2. 上海海洋大学 水域环境生态上海高校工程研究中心, 上海 201306;
3. 上海海洋大学 水产动物遗传育种中心上海市协同创新中心, 上海 201306;
4. 农业部淡水水产种质资源重点实验室, 上海 201306
浮萍科植物过度繁殖与生长不仅会对水生生态系统造成诸多负面影响,同时造成航运障碍,水处理负荷加重,影响景观[1-4],因此研究有效防治浮萍暴发的技术正日益得到高度重视。目前浮萍暴发的控制以物理打捞和化学除草剂为主[1-2, 5]。通过人工或机械打捞浮萍,是快速、直接、无污染的方式之一,但只是对浮萍暴发的一种后期缓冲途径,浮萍极易扩散的特性使其不能被彻底清除,残留浮萍会因有了更广阔的生存空间,在营养充足、光温理化因子适宜时加速生长繁殖,很快又会再次暴发[1]。化学除草剂虽有一定治理效果[6-8],但化学除草剂具残留毒性,缺乏药效专一性,且长期单一化使用具抗性风险。因此,研发有效抑制浮萍的植物源除草剂具有重要的学术价值和应用价值。
目前有关浮萍生长除草剂的研发主要集中于化学合成物对浮萍的生长抑制及杀灭作用,而对于植物提取液,尤其是中草药提取液对浮萍生长的抑制作用却鲜见报道[2, 9-10]。我国具有丰富的中草药资源,从该宝库中优选新型的杀草剂具有环境友好度高、原料易得、价格低廉等优点。本文拟从环境友好度较高的中草药入手,以浮萍叶片数、鲜重和叶绿素等指标为主要评价标准,优选出安全性高、能有效抑制浮萍暴发式生长的生物源除草剂,为解决或缓解水体浮萍暴发这一环境问题提出新思路、新方法,为现行大量使用化学杀草剂找到适合的替代品具有重要意义。
1 材料与方法 1.1 实验材料实验所用的中草药购自上海市中药店,购回后粉碎、过筛,袋封保存。紫背浮萍属于浮萍科、紫萍属植物,叶状体腹面绿色,为多年生漂浮植物,生栖于静止小水体水面上,是我国本土分布最广泛的浮萍[11]。紫背浮萍采自上海南汇果园河道,去除杂质、洗净后挑选生长良好的植株,实验室条件下驯养一周后用于实验。培养液使用1/4霍格兰培养液(Hoagland media)。实验过程所用稀释水为上海海洋大学校内湖水,过0.45 μm膜后备用。培养条件为:光照3 000 lx,温度(25±2) ℃,光暗比为16 h∶8 h。
1.2 实验方法 1.2.1 中草药提取液制备分别称取25 g粉碎(100目)的中草药药粉,装入定制的筛绢袋(200目)后置于烧杯中,按1∶20的固液比(g/mL)添加蒸馏水,水浴微沸2 h,提取液最终浓缩至250 mL,即0.1 g DW/mL的中草药提取液。
1.2.2 分组与设计实验共分8个实验组(甘草、地锦草、金钱草、泽漆、泽泻、黄连、鱼腥草及对照组),每一实验组设3个平行。采用1 000 mL烧杯为实验容器,每个烧杯中加入500 mL培养液和60个浮萍叶状体(选取2片叶片为一株的叶状体,即30株),各实验组中草药提取液的添加量为30 mL,对照组添加30 mL蒸馏水,在与浮萍暂养条件一致的情况下连续培养96 h。培养条件为:光照3 000 lx,温度(25±2) ℃,光暗比为16 h∶8 h。每24 h观察并记录叶片的生长和抑制状况,96 h后测定鲜重和叶绿素。
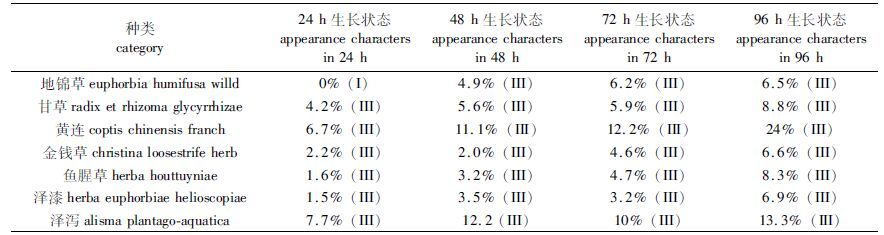
1.2.3 浮萍外观评定观察中草药提取液胁迫期间浮萍的生长状态,记录培养24、48、72、96 h各处理组浮萍的受抑制个体百分比,并按抑制程度不同分为Ⅰ(轻度受损:叶状体颜色变浅、发黄)、Ⅱ(中度受损:叶状体发白、微脱水、叶片变薄)、Ⅲ(重度受损:叶状体枯萎,并由牙囊向周围渐变发黑,植株基本死亡)3个等级。
1.2.4 浮萍鲜重测定用捞网将浮萍从培养水体中捞出,用蒸馏水清洗3遍,然后平铺在滤纸上3 min后称质量。
1.2.5 浮萍叶绿素含量测定浮萍叶绿素测定参照黄帆等 [12]方法测定,浮萍捞出称重后放入研钵内,加入少量CaCO3和10 mL 80%的丙酮,将浮萍快速研磨细碎直至变白后转移至10 mL具塞离心管中,置于4 ℃冰箱中静置12 h,离心10 min (2 000 r/min),取上清液测定。利用Arnon法[13]计算叶绿素含量。
叶绿素a浓度(mg/L):
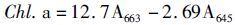 (1)
(1)
叶绿素b浓度(mg/L):
 (2)
(2)
叶绿素总浓度(mg/L):
 (3)
(3)
根据提取液中的叶绿素总浓度,换算成每克鲜叶中叶绿素含量(mg/g鲜重)。
1.3 数据分析与处理数据均以平均值表示,采用SPSS 19.0进行方差分析。
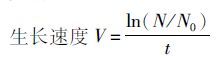 (4)
(4)
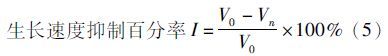 (5)
(5)
式中:N为时间t时的浮萍叶状体数;No为初始时间浮萍叶状体数;Vo为对照组生长速度;Vn为实验组生长速度。
所有实验数据均用平均值±标准误(X±SD)表示,数据采用 Excel 和 SPSS 进行整理和分析,采用单因素方差分析(one-way ANOVA)并应用Duncan氏多重比较对各实验结果进行差异显著性检验和分析,差异显著性水平为 P<0.05。
2 结果与分析 2.1 植物源除草剂对浮萍表观的影响实验期间,对照组紫背浮萍生长状态良好,叶片翠绿,根整齐排列,偶有自然死亡变枯个体,各实验处理组中出现明显受伤症状的个体百分比及受伤害程度见表 1。由表 1可见,不同中草药提取液处理下浮萍表观受伤害程度不同,黄连实验组和泽泻实验组浮萍表观受伤害程度较大,其次是甘草实验组和鱼腥草实验组,地锦草实验组、金钱草实验组和泽漆实验组浮萍表观受伤害程度较小。随着胁迫时间的增加,浮萍受伤个体数增加、受伤程度加深。实验组间比较来看,泽泻实验组起效最快,初期效果最为明显,培养24 h后泽泻实验组即有7.7%的浮萍叶状体出现渐变发黑现象。黄连实验组虽然起效时间不如泽泻实验组短,但随着培养时间的延长,浮萍受损个体的比例却增长最为迅速,重度受损的浮萍比例由24 h的6.7%迅速提升至96 h的24%,对浮萍表观的损伤程度明显大于其他实验组,且黄连实验组对浮萍的持续损伤效果明显。
|
表 1 浮萍受损个体百分比及受损症状程度 Tab.1 Percentage of injured individuals and the symptoms of damage of Soirodela polyrhiza |
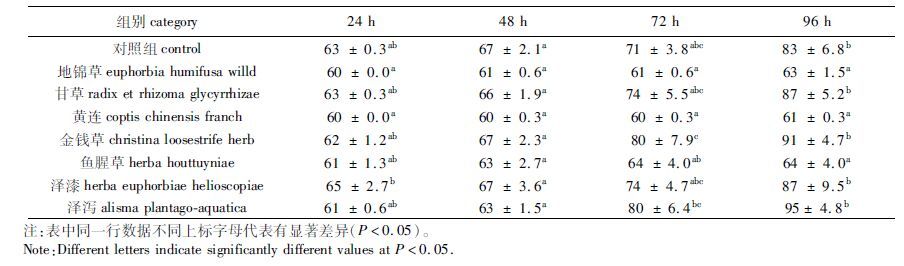
紫背浮萍的增殖方式为无性出芽形式,即浮萍叶状体基部有囊,新叶状体和根由位于囊基部的分生组织形成,断离母体或数代相连。通过观察记录浮萍叶状体数的方式可以表征浮萍的生长情况。实验结果如表 2和3。培养24 h后,地锦草与黄连实验组浮萍叶状体数未见增长,泽漆实验组增加的浮萍叶状体数则大于对照组,其余各实验组浮萍叶状体数虽有不同程度的增加,但均未超过对照组。培养24 h后对照组与实验组间差异不显著,但实验组间有一定差异,如泽漆实验组与地锦草及黄连实验组间有明显差异(P<0.05) ;培养48 h后,各组间浮萍叶状体数未见明显差异,增长较慢的实验组有地锦草实验组及黄连实验组,其次是鱼腥草实验组和泽泻实验组,其余各组叶状体的增长速度与对照组相当;培养72 h后,实验组间叶状体数增长程度分化明显,如地锦草及黄连实验组与金钱草及泽泻实验组有明显差异(P<0.05) ,但各组与对照组间仍未见明显差异;培养96 h后,对照组与部分实验组间差异性凸显,对照组与地锦草实验组、黄连实验组及鱼腥草实验组均出现明显差异(P<0.05) ,见表 2。可见,与化学合成除草剂相比,植物源除草剂存在起效慢这一瓶颈问题。
|
表 2 中草药提取液对紫背浮萍叶状体数的影响 Tab.2 Effect of Chinese herb extracts on frond number (FN) of Soirodela polyrhiza |
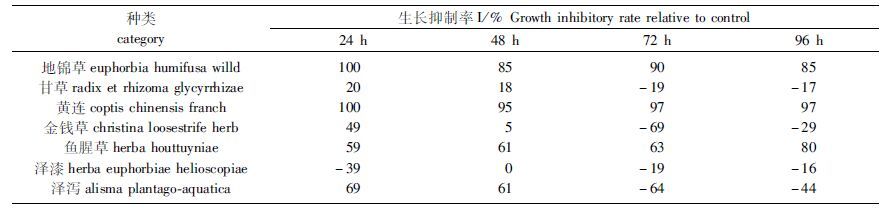
从表 3可以看出,培养期间地锦草实验组、黄连实验组及鱼腥草实验组对浮萍的生长表现出较好的抑制作用。培养96 h后,3个实验组对浮萍生长的抑制率均在80%以上。其中黄连实验组作用效果最为明显,对浮萍的生长抑制率始终保持在95%以上,持续抑制作用明显;而鱼腥草实验组则随着作用时间的延长,对浮萍生长的抑制作用也随之增强,由24 h后的59%增至96 h后的80%。泽泻实验组在培养前期(48 h内)对浮萍生长有较好的抑制作用,抑制率高达60%以上,但随着时间的延长,在培养后期泽泻实验组反而出现促进浮萍生长的现象。金钱草与甘草实验组虽在培养前期对浮萍生长有不同程度的抑制作用,但后期也均出现促进浮萍生长的现象。抑制效果最差的是泽漆实验组,培养期间对浮萍的生长一直呈现出促进作用。
|
表 3 中草药提取液对紫背浮萍生长的抑制作用(基于叶状体数) Tab.3 Inhibition of Chinese herb extracts on Soirodela polyrhiza FN |
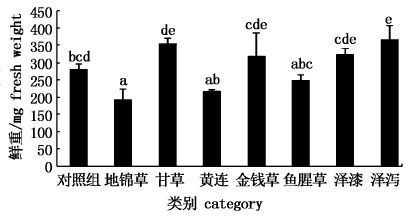
本研究以浮萍鲜重为指标反映培养期间浮萍的生物量变化情况。由图 1可以看出,培养96 h后,实验组浮萍鲜重的变化规律与浮萍叶状体生长的变化规律较为一致,均为地锦草、黄连、鱼腥草3个实验组中浮萍的鲜重低于对照组,而甘草、金钱草、泽漆、泽泻4个实验组中浮萍的鲜重则要高于对照组。对照组与抑制效果最佳的地锦草实验组之间存在显著差异(P<0.05) 。相比对照组,地锦草实验组对浮萍鲜重的抑制率达31%。黄连及鱼腥草实验组与对照组间差异不显著,但黄连实验组和鱼腥草实验组对浮萍鲜重的抑制率分别达到了22%和10%。此外,对照组与泽泻实验组之间同样存在显著差异(P<0.05) 。图 1结果表明泽泻提取液可显著提高浮萍鲜重。
|
图 1 中草药提取液对紫背浮萍鲜重的影响
Fig. 1 Effect of Chinese herb extracts on fresh weight of Soirodela polyrhiza
图中不同上标字母代表有显著差异(P<0.05) 。 The different superscripts of the same column values are significantly different (P<0.05) |
通过比较地锦草、黄连及鱼腥草实验组对浮萍叶状体数及鲜重的抑制率可以看出(表 3及图 1) ,3个实验组对浮萍鲜重的抑制率远没有对浮萍叶状体分蘖的抑制率大,即植物源除草剂对前者的影响要明显小于后者。可见,以浮萍鲜重作为指标来表示植物源除草剂对浮萍生长的影响并不如以叶状体数的变化为指标更明显。这与ELAKOVICH等得出的研究结果是一致的[10]。
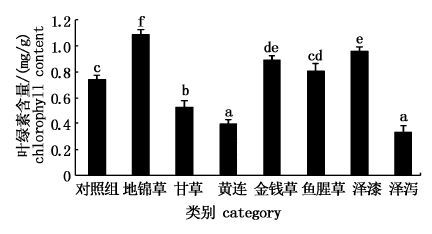
2.4 植物源除草剂对浮萍叶绿素的影响叶绿素含量水平是反映植物生长情况的直观指标。由图 2可以看出,培养96 h后,甘草、黄连、泽泻3个实验组中浮萍的叶绿素含量明显低于对照组(P<0.05) ,叶绿素含量分别下降至对照组的71%、54%和45%,表明3种中草药提取液对紫背浮萍的光合系统产生了强烈影响,杀青效果明显。地锦草、金钱草、泽漆3个实验组中浮萍的叶绿素含量则要显著高于对照组(P<0.05) 。鱼腥草实验组虽然浮萍叶绿素含量高于对照组,但差异不大。各实验组叶绿素测定结果与表 1得出的浮萍表观受损症状程度结果基本一致,表明根据测定的浮萍叶绿素含量可以从一定程度上反映浮萍表观受损情况。
|
图 2 中草药提取液对紫背浮萍叶绿素的影响
Fig. 2 Effect of Chinese herb extracts on chlorophyll of Soirodela polyrhiza
图中不同上标字母代表有显著差异(P<0.05) 。 The different superscripts of the same column values are significantly different (P<0.05) . |
本研究结果表明部分中草药提取液能有效抑制浮萍的生长,如黄连提取液、地锦草提取液和泽泻提取液可分别导致浮萍叶状体数目下降、鲜重减少、叶绿素含量降低,有效抑制了浮萍的生长,且均与对照组存在显著差异(P<0.05) 。因此,浮萍的暴发式生长可以用环境友好度高的生物法来进行控制,即中草药提取液可以作为控制水体浮萍暴发式生长的有效途径之一,从而减轻对化学除草剂的依赖程度。本研究同时表明,以浮萍叶状体数目、浮萍鲜重及浮萍叶绿素含量为指标均能在一定层面上反映中草药提取液对浮萍生长的影响。其中最为敏感的指标为浮萍叶状体数目,培养期间黄莲、地锦草、鱼腥草3个实验组对浮萍叶状体分蘖的抑制率在80%以上。其次是浮萍叶绿素指标,杀青效果最好的泽泻实验组对浮萍叶绿素的抑制率达55%。最不明显的指标是浮萍鲜重的变化,效果最好的地锦草实验组对浮萍鲜重的抑制率仅为30%左右。因此,建议在植物源除草剂的筛选中对于敏感程度不同的指标可以采用不同的权重。
3.1 针对浮萍的植物源除草剂研发的必要性和可行性随着人们生活质量的提高和对生态环境的关注,对无公害产品的需求与日俱增。植物源除草剂的研制是无公害产品的重要保障。我国中草药资源丰富,从中草药宝库中筛选植物源除草剂具有得天独厚的条件。植物源除草剂具有环境友好度高、对非靶标生物安全、不易产生抗药性等特点。近年来,植物源除草剂的研制受到了广泛的关注,对其深入研究已成为越来越热点的课题。我国每年因浮萍治理及其造成的经济损失高达百亿元以上,因此针对浮萍的植物源除草剂的研制正逐渐成为国内外市场的迫切需要。
针对浮萍的植物源除草剂研发虽然鲜见,但在20世纪80年代,国外有研究表明睡莲、粉绿狐尾藻、水盾草、莼菜萃取物能抑制浮萍的生长[10]。国内张乐婷等通过研究认为泽漆浸提液对浮萍有抑制作用,且在低浓度情况下就能使浮萍部分抗氧化酶系统遭受破坏[9]。本研究选用的药材均为常见品种,自然资源丰富、材料易得,价格低廉。实验结果表明,从中草药宝库中寻找抑制浮萍暴发的生物源除草剂是完全可行的。新型植物源除草剂有望取代或部分替代现行大量使用的化学杀草剂,为生态环保型社会的构建做出贡献。
3.2 新型植物源除草剂的杀草机理浅析中草药提取液对浮萍生长的抑制作用存在多种可能性,如化感作用、植物毒性、改变渗透压及pH等。根据本研究结果并结合前人观点[14-16],认为新型植物源除草剂的杀草机理更可能从两方面来解释:(1) 中草药提取液中含有植物毒素。以中草药黄连为例:黄连的主要活性成分为生物碱,其在黄连中的含量往往超过5%,有研究表明多种生物碱物质对植物体表现出植物毒性。因此,浮萍吸收此类物质后,就会出现生长抑制甚至死亡现象。(2) 中草药提取液中含有化感活性物质。化感物质对植物的生长调控作用已得到学界的广泛认同,化感物质的存在会影响植物的光合系统、呼吸系统及酶系统等[17]。本研究结果显示新型植物源除草剂更倾向于调控去除物种的个体发育及种群发展,从而对有害物种的种群繁衍产生深远的影响,而并不是直接杀灭这单一方式。表 1及表 2中的相关结果可以作为该观点的辅证,以鱼腥草实验组为例,96 h后仅有8.3%的浮萍叶状体出现重度损伤现象,但鱼腥草提取液对浮萍生长的抑制率却达到80%以上。可见,植物源除草剂对浮萍的杀草效果主要是从控制其个体生长、分蘖这一方式为主,而不是以直接杀灭为主。
3.3 植物源除草剂的研究展望自然界中生物的问题,主要还是依靠生物方法和技术来解决。因此,针对浮萍暴发式生长而造成的环境问题也应该由生物的方法来处理。今后,针对浮萍的植物源除草剂的研发思路可以从以下几方面考虑:扩大植物源除草剂资源筛选范围,不要仅局限在中草药范围,可以考虑农业废弃物、入侵植物等;弘扬中医的综合诊治理论,防治结合;借鉴中草药的合理配伍理论,研究全面抑制浮萍过度繁殖的复方,同时保障水生态系统的健康。在长远、和谐的理念指导下,新型除草剂的创制策略在于:环境和谐优先,安全、有效并重,方便、经济为辅。
| [1] | 张饮江, 张乐婷, 张曼曼, 等.浮萍暴发控制技术与机理的研究与展望[J]. 广东农业科学, 2014, 41(1): 155–160. ZHANG Y J, ZHANG L T, ZHANG M M, et al.Review on control and mechanism of duckweed overgrowth[J]. Guangdong Agricultural Sciences, 2014, 41(1): 155–160. |
| [2] | PĘCZUŁA W, SUCHORA M.The influence of barley straw extract addition on the growth of duckweed (Lemna valdiviana Phil.) under laboratory conditions[J]. Knowledge and Management of Aquatic Ecosystems, 2014, 415(1): 7. |
| [3] | JANSE J H, VAN PUIJENBROEK P J T M.Effects of eutrophication in drainage ditches[J]. Environmental Pollution, 1998, 102(s1): 547–552. |
| [4] | KILLGORE K J, HOOVER J J.Effects of hypoxia on fish assemblages in a vegetated waterbody[J]. Journal of Aquatic Plant Management, 2001, 39(4): 40–44. |
| [5] | COOKE G D, WELCH E B, PETERSON S, et al.Restoration and management of lakes and reservoirs[M].3rd ed. Boca Raton: CRC Press, 2005. |
| [6] | LANGELAND K A, HILL O N, KOSCHNICK T J, et al.Evaluation of a new formulation of Reward Landscape and aquatic herbicide for control of duckweed, waterhyacinth, waterlettuce, and hydrilla[J]. Journal of Aquatic Plant Management, 2002, 40(1): 51–53. |
| [7] | CHESHIER J C, WERSAL R M, MADSEN J D.The susceptibility of duckweed (Lemna minor L.) to fluridone and penoxsulam[J]. Journal of Aquatic Plant Management, 2011, 49(1): 50–52. |
| [8] | WERSAL R M, MADSEN J D.Combinations of diquat and a methylated seed oil surfactant for control of common duckweed and watermeal[J]. Journal of Aquatic Plant Management, 2009, 47: 59–62. |
| [9] | 张乐婷, 张饮江, 张曼曼, 等.泽漆水浸液及茶皂素浸提液对浮萍的抑制效果[J]. 上海海洋大学学报, 2014, 23(6): 890–896. ZHANG L T, ZHANG Y J, ZHANG M M, et al.Study on the inhibitory effect of Euphorbia helioscopia L. aqueous extract with and without tea saponin on Lemna minor L[J]. Journal of Shanghai Ocean University, 2014, 23(6): 890–896. |
| [10] | ELAKOVICH S D, WOOFEN J W.Allelopathic potential of sixteen aquatic and wetland plants[J]. Journal of Aquatic Plant Management, 1989, 27: 78–84. |
| [11] | 田延辉, 姜辉, 黄继光, 等.两种除草剂对紫背浮萍的生长抑制活性研究[J]. 农药科学与管理, 2015, 36(3): 61–65. TIAN Y H, JIANG H, HUANG J G, et al.Growth inhibition of two herbicides on Spirodela polyrrhiza[J]. Pesticide Science and Administration, 2015, 36(3): 61–65. |
| [12] | 黄帆, 郭正元, 徐珍.测定浮萍叶绿素含量的方法研究[J]. 实验技术与管理, 2007, 24(5): 29–31. HUANG F, GUO Z Y, XU Z.Determined methods of chlorophyll from lemma paucicostata[J]. Experimental Technology and Management, 2007, 24(5): 29–31. |
| [13] | 汪志国, 王静, 李国刚.双波长分光光度法同时测定叶绿素a、b[J]. 中国环境监测, 1999, 15(5): 21–22. WANG Z G, WANG J, LI G G.Preliminary study on simultaneous determination of chlorophyll a, b by double-wavelength spectrophotometric method[J]. Environmental Monitoring in China, 1999, 15(5): 21–22. |
| [14] | 张兴, 马志卿, 冯俊涛, 等.植物源农药研究进展[J]. 中国生物防治学报, 2015, 31(5): 685–698. ZHANG X, MA Z Q, FENG J T, et al.Review on research and development of botanical pesticides[J]. Chinese Journal of Biological Control, 2015, 31(5): 685–698. |
| [15] | TANG Y Z, GOBLER C J.The green macroalga, Ulva lactuca, inhibits the growth of seven common harmful algal bloom species via allelopathy[J]. Harmful Algae, 2011, 10(5): 480–488. |
| [16] | JAIN R, SINGH M, DEZMAN D J.Qualitative and quantitative characterization of phenolic compounds from lantana (Lantana camara) leaves[J]. Weed Science, 1989, 37(3): 302–307. |
| [17] | 鲜啟鸣, 陈海东, 邹惠仙, 等.淡水水生植物化感作用研究进展[J]. 生态学杂志, 2005, 24(6): 664–669. XIAN Q M, CHEN H D, ZOU H X, et al.Research advances in allelopathy of aquatic macrophytes[J]. Chinese Journal of Ecology, 2005, 24(6): 664–669. |
2. Engineering Research Center for Water Environment Ecology in Shanghai, Shanghai Ocean University, Shanghai 201306, China;
3. Shanghai Collaborative Innovation Center for Aquatic Animal Genetics and Breeding, Shanghai Ocean University, Shanghai 201306, China;
4. Key laboratory of Germplasm Resources of the Ministry of Agriculture Freshwater Aquaculture, Shanghai 201306, China
 2016,
Vol. 25
2016,
Vol. 25


