牛磺酸的化学名为2-氨基乙磺酸,是鱼类生长发育必不可少的营养物质,可作为鱼类诱食剂和营养强化剂,具有提高鱼类繁殖性能和增强鱼类耐缺氧能力的作用[1]。研究表明适量的牛磺酸能显著提高大菱鲆 (Scophthalmus maximus L.)[2]、真鲷 (Pagrus major)[3]和牙鲆 (Paralichthys olivaceus)[4]等鱼类的生长性能,但过量的牛磺酸会降低饲料的适口性反而影响鱼类生长[5-7]。不同鱼类对牛磺酸的需求量不同,MARTINEZ等[8]的研究表明海鲈 (Dicentrarchus labrax) 饲料中牛磺酸的最适需求量为0.2%,明显低于牙鲆的最适需求量。另一方面,同种鱼类在不同的生长阶段对牛磺酸的需求量也存在差别,一般幼鱼期鱼类对牛磺酸的需求量较大,随着其不断生长,需求量逐渐下降,这主要和鱼体自身的牛磺酸合成能力有关[4, 9]。
花鳗鲡 (Anguilla marmorata) 隶属鳗鲡目 (Anguilliformes)、鳗鲡科 (Anguillidae)、鳗鲡属 (Anguilla),是我国珍贵的食用鱼,经济价值高,且营养丰富,现已被列为国家二级保护动物[10]。我国的鳗鲡主要养殖品种是日本鳗 (Anguilla japonica) 和欧洲鳗鲡 (Anguilla anguilla),由于其天然鳗苗资源的不断萎缩,近年来鳗鲡养殖行业的发展受到限制[11],为开发新的鳗鲡养殖品种,国内开始陆续开展花鳗鲡的人工养殖。相比于日本鳗鲡和欧洲鳗鲡,花鳗鲡前期生长速度较慢,但后期生长迅速且体型较大,具有较好的发展前景。在花鳗鲡的营养需求研究方面,现阶段还没有相关的报道。本试验以花鳗鲡幼鳗作为试验对象,探索不同牛磺酸水平对其生长和消化酶活力的影响,确定花鳗鲡幼鳗对牛磺酸的适宜需求量,旨在为花鳗鲡配合饲料的研制提供部分理论依据。
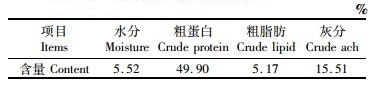
1 材料与方法 1.1 试验设计和饲料试验分为5个处理组,每组3个平行,每个平行100尾85.59 g左右的花鳗鲡幼鳗。基础料采用福建高农饲料有限公司生产的鳗鱼配合饲料 (幼鳗用),常规成分见表 1,测定其牛磺酸含量为0.708%。试验所用牛磺酸购自西安裕华生物科技有限公司 (食品级,纯度为99%)。在基础料中分别添加0%、0.20%、0.40%、0.60%、0.80%的牛磺酸,通过逐级扩大过筛混匀后制成牛磺酸含量分别为0.708%、0.908%、1.108%、1.308%、1.508%的5组试验饲料,分别记为D1、D2、D3、D4和D5,阴凉干燥保存备用。
|
表 1 基础饲料常规成分 Tab.1 Approximate composition of diet |
养殖试验在上海市农业部团头鲂遗传育种中心进行。试验用的1 900尾花鳗鲡购自福建吉祥花鳗渔业有限公司,驯养半月后进行分组,选取中间段规格、健康、体质量为85.95 g左右的花鳗鲡1 500尾分别养于15个2 m×5 m的室内水泥池中进行14周的养殖试验,水深控制在80 cm左右。所有养殖池统一安装过滤系统和1/2面积遮阳网。每周换水1/3左右并清洗滤材。养殖试验期间溶解氧保持在5 mg/L以上,水温在24.0~29.1 ℃之间,pH为6.5~8.0,亚硝酸氮 < 0.5 mg/L,氨氮 < 1.0 mg/L。
每天投喂两次,总投喂量为鳗鲡体质量的3%左右,投喂时间为每天7:00和19:00,晚上投喂量一般占每天投喂总量的60%~70%。将饲料与1.2倍质量的水混合,揉成面团状粘性饵料团进行投喂。根据鱼的摄食情况随时调整投喂量。投喂后30 min清理残饵,称重并记录。
1.3 样品采集与计算试验结束后,对试验鱼进行饥饿24 h处理后称量各池鱼的总重和随机15条鱼的体长及体质量。每个平行随机选取3条鱼,用MS-222麻醉后测量体长体质量,解剖取背部肌肉并分离内脏团,测量内脏团、肝脏重量,并记录。取胃、前肠和肝脏,用0.86%冷冻生理盐水冲洗内容物并剔除表面膜系和脂肪,用滤纸轻轻吸干水分后-80 ℃保存, 用于消化酶活力测定,所有操作均在冰盘上进行。
 (1)
(1)
式中:WGR为增重率;Wf为均未体质量 (g);Wi为均初体质量 (g)。
 (2)
(2)
式中:SGR为特定生长率,t为实验天数 (d)。
 (3)
(3)
式中:HIS为肝体比;WH为肝脏质量 (g);WB为体质量 (g)。
 (4)
(4)
式中:VSI为脏体比;WV为内脏团重量 (g)。
 (5)
(5)
式中:CF为肥满度;LB为体长 (cm)。
 (6)
(6)
式中:SR为存活率;Ns为存活尾数;Ne为实验鱼尾数。
 (7)
(7)
式中:FCR为饵料系数;F为摄食量。
1.4 样品测定 1.4.1 基础饲料牛磺酸测定以常规酸水解法获得饲料中牛磺酸并采用Sykam443D氨基酸自动分析仪 (德国赛卡姆Sykam公司) 进行测定。采用加拿大TRC公司生产的牛磺酸作为标准品。色谱条件如下:色谱柱:LCA K06/Na;监测波长:570 nm;流动相:柠檬酸钠A=0.12 N,pH 3.45;B=0.2 N,pH 10.85;温度:58~74 ℃梯度控温;流速:洗脱泵0.45 mL/min+衍生泵0.25 mL/min;压力:3~4 MPa。
1.4.2 常规成分测定分别采用105 ℃烘干恒重法、凯氏定氮法、氯仿甲醇提取法和马弗炉 (550 ℃) 灼烧法测定饲料和肌肉中水分、粗蛋白、粗脂肪和粗灰分的含量。肌肉中粗蛋白、粗脂肪和粗灰分的含量采用-50 ℃冷冻干燥后的肌肉样品进行测定。
1.4.3. 消化酶活力测定取0.3 g左右胃、前肠和肝脏组织,加入一定比例的预冷0.86%生理盐水后剪碎,用昂尼AD300S-P型匀浆机冰浴匀浆 (7 000 r/min),10秒/次,间隙30 s,连续3次。然后冷冻离心 (0 ℃,3 000 r/min,10 min),取上清液用于各酶活力的测定。测定各组织脂肪酶活力时冷冻离心速率提升到6 000 r/min。
淀粉酶和脂肪酶活力均采用南京建成生物工程研究所生产的试剂盒进行测定。淀粉酶活力单位定义为:组织中每毫克蛋白在37 ℃与底物作用30 min,水解10 mg淀粉定义为1个淀粉酶活力单位 (U/mg)。脂肪酶活力单位定义为:在37 ℃条件下,每克组织蛋白与底物反应1 min,每消耗1 μmol底物为一个酶活力单位 (U/g)。
中性蛋白酶活力采用福林-酚试剂法进行测定:以1%干酪素溶液作为底物。1 mL酶液与2 mL底物溶液混合后,于40 ℃水浴中反应10 min,加入2 mL三氯乙酸终止反应。反应液静置10 min,过滤沉淀后取1 mL滤液,加入5 mL的Na2CO3(0.4 mol/L) 和1 mL福林酚试剂,并在40 ℃显色20 min后在680 nm波长进行比色。以酪氨酸溶液作为标准。蛋白酶活力定义为:在40 ℃(pH=7.5) 条件下,每毫克蛋白在1 min内水解酪素产生1 μg酪氨酸为一个酶活力单位 (U/mg)
组织匀浆液蛋白浓度以考马斯亮蓝染色法进行测定,采用南京建成生物工程研究所生产的总蛋白 (TP) 测定试剂盒,并严格按照试剂盒的要求操作。
1.5 数据统计数据用“平均值±标准差”表示, 采用SPSS 12.0统计软件中One-Way ANOVA过程进行方差分析,并进行Duncan氏多重比较,显著性水平为0.05。
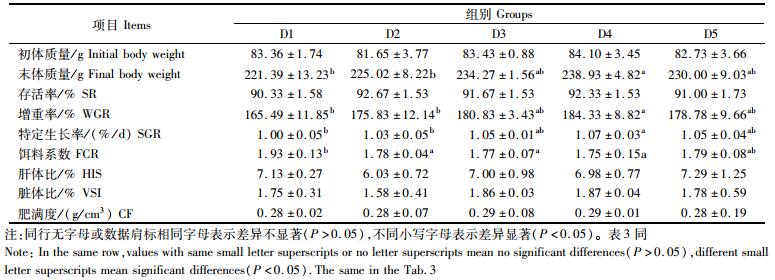
2 结果与分析 2.1 牛磺酸对花鳗鲡生长性能和形体指标的影响由表 2可知,随着牛磺酸含量的增加,花鳗鲡的末体质量、增重率和特定生长率都呈先上升后下降的趋势,并在D4组达到最高值,且D4组显著大于D1和D2组 (P < 0.05)。饵料系数则呈现先下降后上升的趋势,并在D4组达到最低值,其中D2、D3、D4组的饵料系数均显著小于D1组 (P < 0.05)。牛磺酸对花鳗鲡的存活率、肝体比、脏体比和肥满度没有显著性影响。
|
表 2 饲料牛磺酸水平对花鳗鲡生长性能和形体指标的影响 Tab.2 Effect of taurine on growth performance and figure indices of Anguilla marmorata |
|
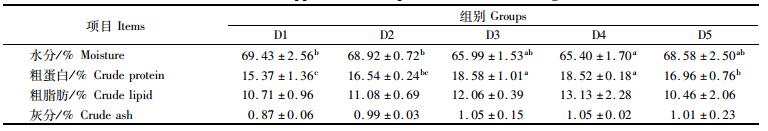
表 3 饲料牛磺酸水平对花鳗鲡肌肉常规成分的影响 Tab.3 Effect of taurine on approximate composition in muscle of Anguilla marmorata |
由表 3可知,随着牛磺酸含量的增加,花鳗鲡肌肉水分含量呈现先下降后上升的趋势,其中D4组的水分含量达到最低,其中D4组显著小于D1和D2组 (P < 0.05)。粗蛋白和粗脂肪含量总体呈现先上升后下降的趋势,其中D3和D4组的粗蛋白含量显著大于D1和D5组 (P < 0.05),而粗脂肪之间没有显著性差别。相比于D1组,其他各组的灰分含量都有所提高,但差异性不明显。
2.3 牛磺酸对花鳗鲡消化道酶活力的影响随着牛磺酸含量的增加,花鳗鲡胃和肝脏中的淀粉酶活力先上升后下降,其中D2和D4组的胃淀粉酶活力显著大于D1和D5组 (P < 0.05),D4组的肝脏淀粉酶活力显著大于D1、D2和D5组 (P < 0.05), 见图 1。肠道淀粉酶活力有所下降,但各组间没有显著性差别。

|
图 1 牛磺酸对花鳗鲡淀粉酶活力的影响
Fig. 1 Effect of taurine on amylase activity in Anguilla marmorata
标有不同小写字母者表示组间有显著性差异 (P<0.05),标有相同小写字母者表示组间无显著性差异 (P>0.05),图 2-3同 The means with different letters are significant differences at the 0.05 probability level, and the means with the same letters are not significant differences, the same in Fig. 2-3 |

|
图 2 牛磺酸对花鳗鲡蛋白酶活力的影响
Fig. 2 Effect of taurine on protease activity in Anguilla marmorata
|
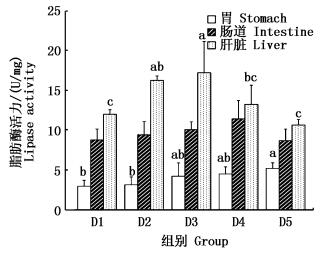
|
图 3 牛磺酸对花鳗鲡脂肪酶活力的影响
Fig. 3 Effect of taurine on lipase activity in Anguilla marmorata
|
随着牛磺酸含量的增加,肠道和胃蛋白酶活力总体上呈现先上升后下降的趋势,其中D4组的肠道蛋白酶活力显著大于D5组,胃蛋白酶活力显著大于D1和D5组。D4组肝脏蛋白酶活力显著大于D2组 (图 2)。
随着牛磺酸含量的增加,肠道和肝脏脂肪酶活力呈现先上升后下降的趋势,而胃脂肪酶活力则不断上升。其中肝脏脂肪酶活力在D3组达到最大值,且显著大于D1、D4和D5组,肠道脂肪酶也在D4组达到最大值,但和其他组之间没有显著性差别。D5组的胃脂肪酶活力显著大于D1和D2组 (图 3)。
3 讨论 3.1 牛磺酸对花鳗鲡生长的影响牛磺酸作为一种非蛋白含硫氨基酸,能作用于鱼类的嗅觉器官,从而起到诱食剂的作用[1],研究表明饲料中0.4%的牛磺酸添加量对鲤鱼 (Cyprinus carpio)[12]有显著的诱食效果。而饲料中缺乏牛磺酸会抑制虹鳟 (Oncorhynchus mykiss)[13]和军曹鱼 (Rachycentron canadum)[14]的生长,五条鰤(Seriola quinqueradiata)[15]甚至会出现绿胆综合症等营养性疾病。关于牛磺酸对鱼类生长的影响已有很多报道,QI等[16]的研究表明,1.15%牛磺酸含量能显著促进体质量为6.3 g的大菱鲆的生长,当体质量为166 g时,牛磺酸最适含量降为0.64%。TAKAGI等[15]发现250~579 g的五条对牛磺酸的需求量高达3.4%,且能有效预防绿胆综合症的发生。本试验的研究表明,随着牛磺酸含量的增加,花鳗鲡的体质量呈现先上升后下降的趋势,这与在大菱鲆[16]和尼罗罗非鱼 (Oreochromis niloticus)[17]上的研究相似。同时可以看出,与0.708%牛磺酸含量组 (D1) 相比,1.308%牛磺酸含量组 (D4) 花鳗鲡的末体质量、增重率和特定生长率均显著增大,说明体质量为85.95 g左右的花鳗鲡饲料中牛磺酸的最适含量为1.308%。这一结果高于海鲈 (0.2%)[8]对牛磺酸的需求量,低于牙鲆 (1.5%~2.0%),这可能与不同鱼类自身的牛磺酸合成能力不同有关。TAKAOKA等[18]认为牛磺酸呈微酸性,过量的牛磺酸添加量会影响饲料的适口性,这可能是本试验中1.508%牛磺酸含量组花鳗鲡的生长效果不如1.308%含量组的原因。
本试验发现随着牛磺酸含量的增加,花鳗鲡的存活率和肥满度都有所提高,但都没有显著性差别,这与在草鱼 (Ctenopharymgodon idellus)[19]和尼罗罗非鱼[17]上的研究相似。TAKAGI等[15]的研究发现牛磺酸能显著提高五条的存活率,本试验中显著性不明显的原因可能和牛磺酸浓度梯度太低有关。D4组的增重率、特定生长率显著大于其他组,且饵料系数最低,说明饲料中1.308%的牛磺酸含量促花鳗鲡生长效果最好。
3.2 牛磺酸对花鳗鲡鱼体常规成分和消化酶活力的影响鱼类的消化酶活性是反映鱼类消化生理机能的一项重要指标,对于研制鱼类的配合饵料和阐明其消化吸收机理具有重要意义[20]。牛磺酸的营养生理功能主要包括参与糖、蛋白质和脂肪代谢,研究表明适量的牛磺酸能显著提高鱼类的消化酶活力[21]。本试验发现适量牛磺酸含量能提高花鳗鲡胃和肝脏中的淀粉酶活力。这主要是因为牛磺酸能刺激胰岛素释放,降低血糖浓度[22],从而间接刺激鱼体分泌淀粉酶产生葡萄糖。其具体作用机理有待进一步深入研究。
牛磺酸虽然不参与鱼体蛋白质的合成,但适量的牛磺酸能提高饲料蛋白质的消化吸收率,从而间接促进鱼类的生长发育。研究表明牛磺酸能通过增加细胞内Ca2+浓度而作用于γ-氨基丁酸A型受体来诱导大鼠胃酸分泌[23],这或许有利于蛋白质的消化。PARK等[9]在牙鲆的饲料中添加1.4%的牛磺酸,发现能显著促进其生长,并提高蛋白质效率比。赵小峰等[24]在鲫鱼 (Crucian carp) 上也得到相似的结论。本试验研究结果显示1.308%牛磺酸含量的饲料能较好的提升花鳗鲡胃、肠道和肝脏中的蛋白酶活力,这与罗莉等[25]和高春生等[26]在草鱼和黄河鲤 (Cyprinus carpio) 上的研究结论是一致的。说明适量的牛磺酸能刺激鱼体的蛋白酶分泌,从而促进蛋白质的消化和吸收。同时,增加外源性牛磺酸的摄入可以相应减少鱼体内含硫氨基酸作为原料合成牛磺酸,从而使更多的含硫氨基酸参与到蛋白质的合成。这也可能是本试验中花鳗鲡肌肉中粗蛋白含量提高的原因。另一方面,本试验结果中花鳗鲡前肠中的蛋白酶活力远大于胃组织中的蛋白酶活力,这主要与蛋白酶活力的测定方法有关。鱼类胃蛋白酶活力均在强酸性条件下最高,一般pH在2.0~3.0。付新华[27]发现大菱鲆胃蛋白酶活力的最适pH为2.0;杨婳等[28]发现黄金鲈 (Perca flavescens) 胃蛋白酶活力的最适pH为2.5。而本实验中测定的组织蛋白酶活力均为中性蛋白酶活力,而一般鱼类肠道蛋白酶活力的最适pH为6.5~9.5[29],从而导致前肠中蛋白酶活力远大于胃组织中的蛋白酶活力。
在鱼类肝脏中,牛磺酸与胆酸、鹅脱氧胆酸等游离胆酸形成牛磺胆酸、牛磺鹅脱氧胆酸等结合胆汁酸,从而促进脂肪的消化吸收[30]。研究表明牛磺酸能显著提高草鱼和黄河鲤肠道和肝胰脏中的脂肪酶活力[20, 26],并能增加大菱鲆[31]和军曹鱼 (Pachycentron canadum)[32]肌肉中的粗脂肪含量。但也有研究认为牛磺酸能促进脂肪酸氧化和减少脂肪合成的作用。ESPE等[33]发现牛磺酸降低了大西洋鲑 (Salmo salar) 肌肉中的脂肪含量。本试验发现不同牛磺酸含量对花鳗鲡不同消化器官脂肪酶活力的促进作用是不一样的,胃、肠道和肝脏中脂肪酶活力的最高值分别对应牛磺酸的添加量为1.508%、1.308%和1.108%。总体上来说,1.108%的牛磺酸含量能较好的促进花鳗鲡消化道的脂肪酶活力。
综上所述,1.308%的牛磺酸含量能显著提高花鳗鲡的增重率、特定生长率,降低饵料系数,有效提高花鳗鲡胃和肝脏中的淀粉酶、蛋白酶活力以及肝脏中的脂肪酶活力 (P < 0.05),故我们建议花鳗鲡幼鳗 (85.95 g左右) 的饲料牛磺酸含量应控制在1.308%左右。
| [1] |
王和伟, 叶继丹, 陈建春. 牛磺酸在鱼类营养中的作用及其在鱼类饲料中的应用[J].
动物营养学报, 2013, 25(7): 1418–1428.
WANG H W, YE J D, CHEN J C. Taurine:effect in fish nutrition and application in fish feed[J]. Chinese Journal of Animal Nutrition, 2013, 25(7): 1418–1428. |
| [2] | YUN B, AI Q H, MAI K S, et al. Aquaculture[M]. , 2012: 85-91. |
| [3] | MATSUNARI H, FURUITA H, YAMAMOTO T, et al. Effect of dietary taurine and cystine on growth performance of juvenile red sea bream Pagrus major[J]. Aquaculture, 2008, 274(1): 142–147. DOI:10.1016/j.aquaculture.2007.11.002 |
| [4] | KIM S K, MATSUNARI H, TAKEUCHI T, et al. Effect of different dietary taurine levels on the conjugated bile acid composition and growth performance of juvenile and fingerling Japanese flounder Paralichthys olivaceus[J]. Aquaculture, 2007, 273(4): 595–601. DOI:10.1016/j.aquaculture.2007.10.031 |
| [5] | TAKAGI S, MURATA H, GOTO T, et al. Efficacy of taurine supplementation for preventing green liver syndrome and improving growth performance in yearling red sea bream Pagrus major fed low-fishmeal diet[J]. Fisheries Science, 2006, 72(6): 1191–1199. DOI:10.1111/fis.2006.72.issue-6 |
| [6] |
高雁, 徐奇友, 许红, 等. 牛磺酸对哲罗鱼仔鱼生长性能的影响研究[J].
饲料工业, 2010, 31(22): 22–24.
GAO Y, XU Q Y, XU H, et al. Effects of taurine on the growth performance of hucho taimen juvenile[J]. Feed Industry, 2010, 31(22): 22–24. |
| [7] |
王和伟. 饲料牛磺酸水平对吉富罗非鱼和斜带石斑鱼生长的影响[D]. 厦门: 集美大学, 2013.
WANG H W. Effect of dietary taurine level on the growth performance of GIFT tilapia Oreochromis nilotictus and grouper Epinephelus coioides[D]. Xiamen:Jimei University, 2013. |
| [8] | MARTINEZ J B, CHATZIFOTIS S, DIVANACH P, et al. Effect of dietary taurine supplementation on growth performance and feed selection of seabass Dicentrarchus labrax fry fed with demand-feeders[J]. Fisheries Science, 2004, 70(1): 74–79. DOI:10.1111/fis.2004.70.issue-1 |
| [9] | PARK G S, TAKEUCHI T, YOKOYAMA M, et al. Optimal dietary taurine level for growth of juvenile Japanese flounder Paralichthys olivaceus[J]. Fisheries Science, 2002, 68(4): 824–829. DOI:10.1046/j.1444-2906.2002.00498.x |
| [10] |
陈锤. 花鳗鲡的生态学特征与开发利用[J].
北京水产, 2005: 54.
CHEN C. The ecological characteristics and exploitation of Anguilla marmorata[J]. Journal of Beijing Fisheries, 2005: 54. |
| [11] |
樊海平. 鳗鲡产业发展存在的问题及对策建议[J].
科学养鱼, 2008: 3–5.
FAN H P. The problems and suggestions of eel industry[J]. Scientific Fish Farming, 2008: 3–5. |
| [12] |
邱小琮, 赵红雪, 魏智清. 牛磺酸对鲤鱼诱食活性的初步研究[J].
河北渔业, 2006: 10–11.
QIU X C, ZHAO H X, WEI Z Q. The feeding attractant activity of taurine to common carp[J]. Hebei Fisheries, 2006: 10–11. |
| [13] | GAYLORD T G, BARROWS F T, TEAGUE A M, et al. Supplementation of taurine and methionine to all-plant protein diets for rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 2007, 269(1/4): 514–524. |
| [14] | LUNGER A N, MCLEAN E, GAYLORD T G, et al. Taurine supplementation to alternative dietary proteins used in fish meal replacement enhances growth of juvenile cobia (Rachycentron canadum)[J]. Aquaculture, 2007, 271(1/4): 401–410. |
| [15] | TAKAGI S, MURATA H, GOTO T, et al. Hemolytic suppression roles of taurine in yellow tail Seriola quinqueradiata fed non-fishmeal diet based on soybean protein[J]. Fisheries Science, 2006, 72(3): 546–555. DOI:10.1111/fis.2006.72.issue-3 |
| [16] | QI G S, AI Q H, MAI K S, et al. Effects of dietary taurine supplementation to a casein-based diet on growth performance and taurine distribution in two sizes of juvenile turbot (Scophthalmus maximus L.)[J]. Aquaculture, 2012, 358-359: 122–128. DOI:10.1016/j.aquaculture.2012.06.018 |
| [17] |
周铭文, 王和伟, 叶继丹. 饲料牛磺酸对尼罗罗非鱼生长、体成分及组织游离氨基酸含量的影响[J].
水产学报, 2015, 39(2): 213–223.
ZHOU M W, WANG H W, YE J D. Effects of taurine supplementation on the growth, body composition and tissue free amino acid concentrations in Nile tilapia (Oreochromis niloticus)[J]. Journal of Fisheries of China, 2015, 39(2): 213–223. |
| [18] | TAKAOKA O, TAKII K, NAKAMURA M, et al. Identification of feeding stimulants for marbled rockfish[J]. Nippon Suisan Gakkaishi, 1990, 56(2): 345–351. DOI:10.2331/suisan.56.345 |
| [19] |
王清滨. 牛磺酸对投喂高脂饲料草鱼幼鱼生长、抗氧化能力及脂质代谢的影响[D]. 长春: 吉林农业大学, 2014.
WANG Q B. Effects of taurine on growth performance, antioxidant capacity and lipid metabolism of juvenile grass carp (Ctenopharyngodon idella) fed high-fat diets[D]. Changchun:Jilin Agricultural University, 2014. |
| [20] |
刘敏, 张辉. 鱼类消化酶的研究进展[J].
渔业经济研究, 2008: 6–10.
LIU M, ZHANG H. Research progress on the digestive enzyme of the fish[J]. Fisheries Economy Research, 2008: 6–10. |
| [21] |
冯幼, 许合金, 刘定, 等. 牛磺酸在水产动物生产中的应用[J].
饲料博览, 2014: 48–51.
FENG Y, XU H J, LIU D, et al. Application of taurine in aquatic animal production[J]. Feed Review, 2014: 48–51. |
| [22] | L'AMOREAUX W J, CUTTITTA C, SANTORA A, et al. Taurine regulates insulin release from pancreatic beta cell lines[J]. Journal of Biomedical Science, 2010, 17(S1): S11. |
| [23] | HUANG K H, CHANG C C, HO J D, et al. Role of taurine on acid secretion in the rat stomach[J]. Journal of Biomedical Science, 2011, 18(1): 11. DOI:10.1186/1423-0127-18-11 |
| [24] |
赵小峰, 贾丽, 周剑平. 牛磺酸对鲫鱼蛋白质消化吸收的影响[J].
水产养殖, 2006, 27(5): 5–6.
ZHAO X F, JIA L, ZHOU J P. Effect of taurine on protein digestibility of crucian carp[J]. Journal of Aquaculture, 2006, 27(5): 5–6. |
| [25] |
罗莉, 文华, 王琳, 等. 牛磺酸对草鱼生长、品质、消化酶和代谢酶活性的影响[J].
动物营养学报, 2006, 18(3): 166–171.
LUO L, WEN H, WANG L, et al. Effects of taurine on growth performance, quality, digestive and metabolic enzyme activity of grass carp (Ctenopharymgodon idellus)[J]. Chinese Journal of Animal Nutrition, 2006, 18(3): 166–171. |
| [26] |
高春生, 范光丽, 王艳玲. 牛磺酸对黄河鲤鱼生长性能和消化酶活性的影响[J].
中国农学通报, 2007, 23(6): 645–647.
GAO C S, FAN G L, WANG Y L. Effects of taurine on growth performance and digestive enzyme activity of carp[J]. Chinese Agricultural Science Bulletin, 2007, 23(6): 645–647. |
| [27] |
付新华. 大菱鲆消化酶的性质研究[D]. 青岛: 中国海洋大学, 2004.
FU X H. Studies on the characters of digestive enzymes in Scophthalmus maximus[D]. Qingdao:Ocean University of China, 2004. |
| [28] |
杨婳, 邢秀苹, 黄权, 等. 温度和pH对黄金鲈消化酶活力的影响[J].
西北农林科技大学学报 (自然科学版), 2014, 42(10): 1–6.
YANG H, XING X P, HUANG Q, et al. Effects of temperature and pH on activities of digestive enzymes in Perca flavescens[J]. Journal of Northwest A & F University (Natural Science), 2014, 42(10): 1–6. |
| [29] |
周景祥, 陈勇, 黄权, 等. 鱼类消化酶的活性及环境条件的影响[J].
北华大学学报 (自然科学版), 2001, 2(1): 70–73.
ZHOU J X, CHEN Y, HUANG Q, et al. On activity of digestive ferment of fish and its change affected by the circumstances[J]. Journal of Beihua University (Natural Science), 2001, 2(1): 70–73. |
| [30] | VESSEY D A, BENFATTO A M, ZERWECK E, et al. Purification and characterization of the enzymes of bile acid conjugation from fish liver[J]. Comparative Biochemistry and Physiology Part B:Comparative Biochemistry, 1990, 95(4): 647–652. DOI:10.1016/0305-0491(90)90299-9 |
| [31] |
陈超, 陈京华. 牛磺酸、晶体氨基酸对大菱鲆摄食、生长和饲料利用率的影响[J].
中国农学通报, 2012, 28(23): 108–112.
CHEN C, CHEN J H. Effects of taurine and compound crystalline amino acid on feed intake, growth and feed utilization of turbot (Scophthalmus maximus L.)[J]. Chinese Agricultural Science Bulletin, 2012, 28(23): 108–112. |
| [32] |
骆艺文, 艾庆辉, 麦康森, 等. 饲料中添加牛磺酸和胆固醇对军曹鱼生长、体组成和血液指标的影响[J].
中国海洋大学学报, 2013, 43(8): 31–36.
LUO Y W, AI Q H, MAI K S, et al. Effects of dietary taurine and cholesterol on growth performance, body composition and plasma metabolites in diets of cobia (Rachycentron canadum L.)[J]. Periodical of Ocean University of China, 2013, 43(8): 31–36. |
| [33] | ESPE M, RUOHONEN K, EL-MOWAFI A, et al. Effect of taurine supplementation on the metabolism and body lipid-to-protein ratio in juvenile Atlantic salmon (Salmo salar)[J]. Aquaculture Research, 2012, 43(3): 349–360. DOI:10.1111/are.2012.43.issue-3 |
 2017,
Vol. 26
2017,
Vol. 26


