2. 上海市水产养殖工程技术研究中心, 上海 201306;
3. 水产动物遗传育种中心上海市协同创新中心, 上海 201306
微藻作为水域初级生产者的主要组成部分,具有分布广泛、种类繁多、生长快速和营养丰富等优点,是水体中有机物和能量的主要提供者[1]。在水产养殖中,硅藻门(Bacillariophyta)种类通常被视为虾、蟹、贝类等无脊椎动物幼体的优质开口饵料,因硅藻细胞通常含有高水平二十碳五烯酸(20:5n-3,eicosapentaenoic acid,EPA)等高不饱和脂肪酸[2],这些高不饱和脂肪酸是海洋动物发育和存活的必需脂肪酸。研究表明,海洋动物中的高不饱和脂肪酸主要由微藻合成并通过食物链向高营养级进行传递[3]。
小环藻(Cyclotella sp.)隶属于硅藻门(Bacillariophyta)、中心纲(Centriae)、圆筛藻目(Coscinodiscales)、圆筛藻科(Coscinodiscus)、小环藻属(Cyclotella),在淡水、半咸水及海水中通常是季节性的优势种,且在中华绒螯蟹(Eriocheir sinensis)蚤状幼体[4]、罗氏沼虾(Macrobrachium rosenbergii)[5]和大型蚤(Daphnia magna)[6]的培养中具有很好的应用效果。小环藻Cyclotella sp. SHOU-B108是一株从河口地区半咸水池塘中分离得到的硅藻,其细胞富含EPA和花生四烯酸(20:4n-6,arachidonic acid,ARA)等高不饱和脂肪酸[7],具有较高的潜在开发价值。有关环境因子对小环藻生长的影响已有报道。如曾蓓蓓等[7]采用单因子实验方法,获得小环藻SHOU-B108的最适宜生长温度、盐度和光照强度分别为20.6 ℃、6.1和40.2 μmol/(m2·s)。曾艳艺和黄翔鹄[8]的研究结果表明温度和光照对小环藻生长有极显著影响。王珺等[9]筛选出微小小环藻(Cyclotella caspia)的最适温度、最适光照、最适盐度、最适pH和氮、磷、铁、硅等营养液配方。覃宝利等[10]发现梅尼小环藻(Cyclotella meneghiniana)在恒温条件下的生长显著优于波动温度下的生长。环境因子对小环藻细胞组成的影响研究仅见温度和光照对小环藻细胞叶绿素及温度变化对细胞多糖的影响[8, 10]。微藻脂肪酸组成是影响其饵料价值的重要因素。微藻的脂肪含量和脂肪酸组成也可随环境因子(如营养盐组成、生长因子、温度和pH等)改变而变化[11]。然而,关于环境因子对小环藻细胞高不饱和脂肪酸的影响研究较少,本研究采用正交实验法,研究盐度、光照强度和温度3因素组合对小环藻SHOU-B108生长及ARA和EPA含量的影响,以期优化小环藻SHOU-B108培养条件,为更合理地开发应用小环藻SHOU-B108积累基础数据。
1 材料与方法 1.1 藻种来源及培养实验用小环藻(Cyclotella sp.) SHOU-B108来自于上海海洋大学生物饵料藻种室。采用f/2配方培养液[12]进行逐级扩大培养。培养的温度、光照强度和盐度条件分别为20.6 ℃、40.2 μmol/(m2·s)和6.1。
1.2 正交实验设计设计盐度(3、6、9)、光照强度[20、40、60 μmol/(m2·s)]和温度(10、20、30 ℃)3因素3水平的正交实验(表 1),实验共9组(简述为组1,组2,组3,组4,组5,组6,组7,组8,组9),每组设置3个平行。将扩大培养后的藻液接种于1 000 mL三角烧瓶中培养,用海水晶调节不同盐度并采用f/2培养液培养,初始接种密度为1.0×106 cells/mL,置于光照培养箱内培养。培养周期为10 d,每天定时摇瓶3次。

|
表 1 正交实验设计表 Tab.1 L9(34) orthogonal test used for the study |
培养过程中隔天(第2、4、6、8和10天)取藻液30 mL经0.45 μm滤膜(半岛,上海)抽滤,滤膜经恒温鼓风干燥箱(DHG9240A,上海)烘干后称量恒重测定其生物量干重。
细胞脂肪酸组成的测定参照GRIFFITHS等[13]的方法,移取一定量藻液经冷冻离心(5 000 r/min,3min)后依次加入甲醇钠(NaOMe,0.5 mol/L)和BF3-甲醇溶液(14%)进行两步甲酯化,提取出含有脂肪酸甲酯的正己烷-甲苯混合物,转移至进样瓶。然后采用气-质联用仪(Agilent 7890A/5975C)分析脂肪酸甲酯,毛细管柱为Supelco Omegawax320 (30.0 m ×0.32 mm×0.25 μm)。根据脂肪酸标准品(Sigma,美国)的分析图谱和保留时间对样品脂肪酸进行定性分析,利用峰面积归一化法计算各脂肪酸的相对百分含量[14],每组样品平行测量3次。
1.4 数据分析和处理结果以平均值±标准差表示,采用PASW Statistics 18.0软件进行单因素和多因素方差分析和Duncan氏多重比较,并对3因素不同水平均值求算估计边际均值和两两比较分析,以P<0.05表示差异显著。
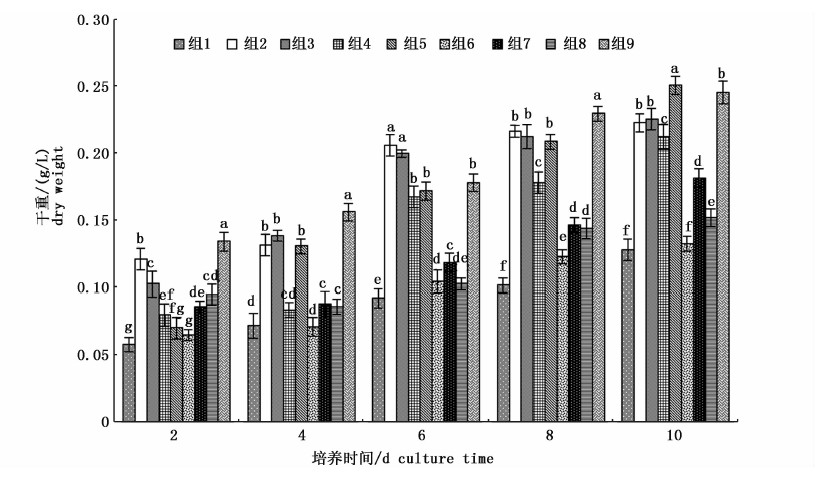
2 结果与分析 2.1 盐度-光照强度-温度对小环藻SHOU-B108生物量干重的影响不同盐度-光照强度-温度对小环藻生物量干重有显著影响(P<0.05),纵观实验期间,组2[3,40 μmol/(m2·s),20 ℃]、组3[3,60 μmol/(m2·s),30 ℃]、组5[6,40 μmol/(m2·s),30 ℃]和组9[9,60 μmol/(m2·s),20 ℃]的生物量干重一直较高(图 1)。但不同培养阶段,最大生物量出现在不同的实验组。组9在培养第2、4和8天收获的生物量干重均显著高于其他组(P<0.05);培养第6天,组2收获的生物量干重最大;培养结束时(第10天),组5收获的生物量干重最大(0.250 9 g/L),显著高于其他组(P<0.05),其次为组9、组3和组2(图 1)。
|
图 1 不同培养时间下盐度-光照强度-温度对小环藻SHOU-B108生物量干重的影响
Fig. 1 Effect of salinity-light intensity-temperature on the dry weight of Cyclotella sp. SHOU-B108 at different culture time
上标不同小写字母表示同一时刻不同实验组之间存在显著差异(P<0.05)。
The column super-marked with different letters means significant difference among the treatments at the same time (P<0.05). |
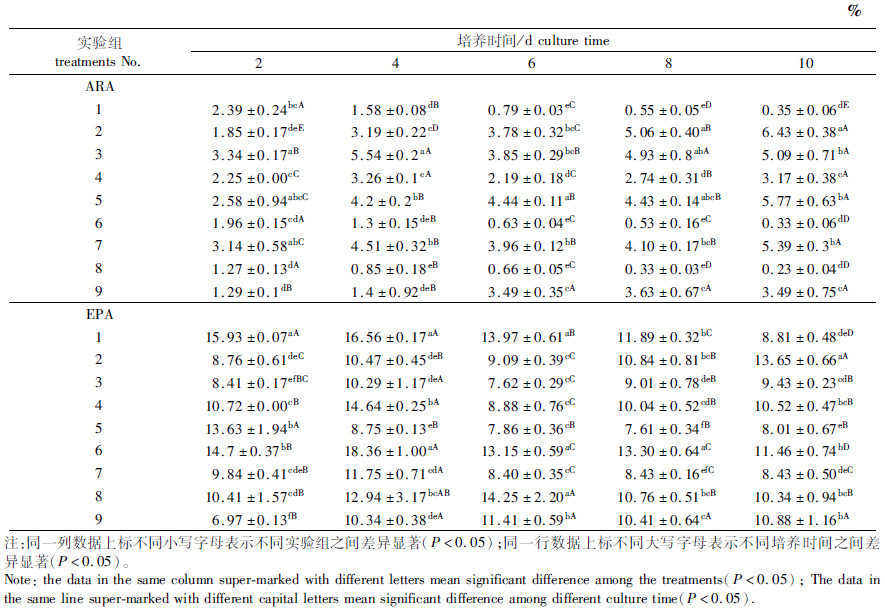
不同盐度-光照强度-温度组合条件下小环藻的ARA含量有显著变化。培养至第4天时,组3的ARA含量显著高于其他组(P<0.05);培养至第6天时,组5的ARA含量显著高于其他组(P<0.05);培养第8天和第10天时,组2的ARA含量最高(表 2)。不同培养条件下藻细胞ARA含量随着培养时间的延长呈现不同的变化,组2、组5随培养时间的延长其细胞ARA含量逐渐增加,组1、组6和组8则出现相反的趋势。ARA含量最大值出现在培养10 d的组2(6.43%±0.38%),见表 2。
|
表 2 不同培养时间下盐度-光强-温度对小环藻SHOU-B108的ARA和EPA含量的影响 Tab.2 Effects of salinity-light intensity-temperature on ARA and EPA contents in Cyclotella sp. SHOU-B108 at different culture time |
小环藻的EPA含量受盐度、光照强度和温度3因素影响显著。培养第4天,组1[3,20 μmol/(m2·s),10 ℃]和组6[6,60 μmol/(m2·s),10 ℃]的EPA含量显著高于其他组(P<0.05);培养第6天,组1、组6和组8[9,40 μmol/(m2·s),10 ℃]的EPA含量均显著高于其他组(P<0.05);培养第8天,组6的EPA含量显著高于其他组(P<0.05);培养第10天,组2的EPA含量达到最高,且显著高于同期的其他组(P<0.05)。不同培养条件下藻细胞EPA含量随着培养时间的延长呈现不同的变化,实验期间,细胞EPA含量的最大值出现在第4天的组6,占总脂肪酸的18.36%(表 2)。
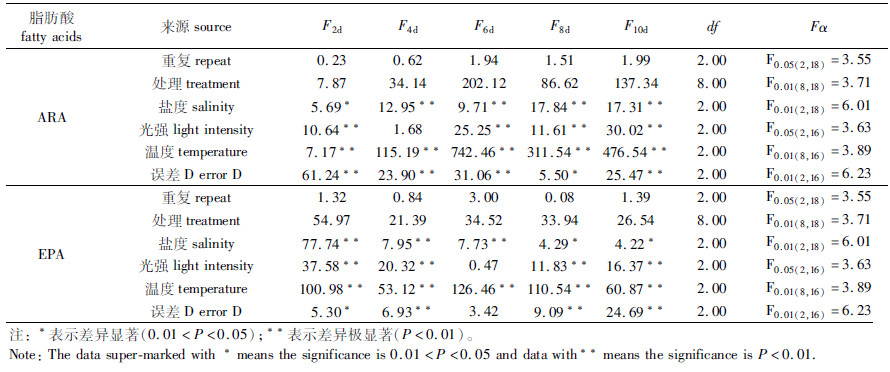
根据3因素水平下小环藻ARA含量的方差分析,不同培养阶段盐度、光照强度和温度对小环藻的ARA含量均有显著或极显著的交互作用。各培养阶段温度始终对小环藻的ARA含量有极显著的影响(P<0.01)。第2天时,光照强度是影响细胞ARA含量的最主要因素;第4、6、8和10天时,温度是影响细胞ARA含量的最主要因素(表 3)。
|
表 3 不同培养时间下3因素对小环藻SHOU-B108的 ARA和EPA含量影响的方差分析 Tab.3 Analysis of variance for the effect of three factors(salinity-light intensity-temperature) on ARA and EPA contents in Cyclotella sp. SHOU-B108 at different culture time |
对3因素水平下小环藻的EPA含量进行方差分析,结果表明,第4、8和10天盐度、光照强度和温度对EPA含量的影响有极显著的交互作用。培养温度始终对小环藻的EPA含量有极显著的影响(P<0.01),且是影响细胞EPA含量的主要因素。培养液盐度仅在培养前期(第2、4和6天)对小环藻的EPA含量有极显著影响(表 3)。
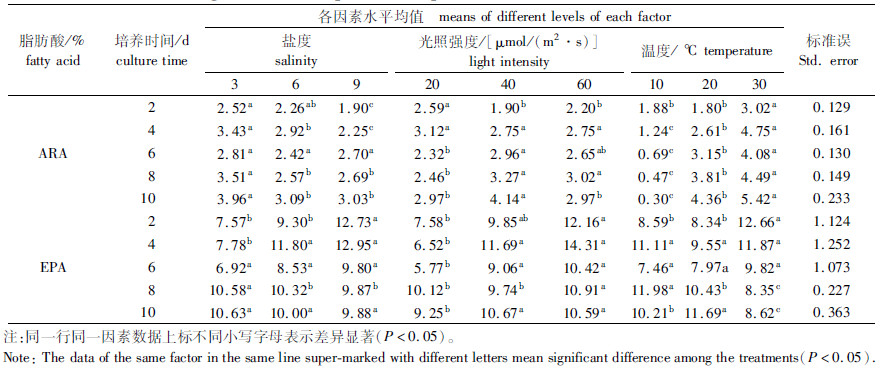
根据3因素不同水平的估计边际均值和两两比较分析,在培养第2和4天时小环藻积累ARA含量的最佳盐度-光照强度-温度组合是[3,20 μmol/(m2·s),30 ℃];在培养6、8和10 d时积累ARA含量的最佳盐度-光照强度-温度组合是[3,40 μmol/(m2·s),30 ℃],见表 4。此结果表明低的盐度和高的温度始终有利于小环藻细胞积累ARA。小环藻积累EPA的最适培养盐度-光照强度-温度也随培养时间不同而有所差异,在培养第2 、4和6天时小环藻积累EPA含量的最佳盐度-光照强度-温度组合是[9,60 μmol/(m2·s),30 ℃];在培养第8天时小环藻积累EPA含量的最佳盐度-光照强度-温度组合是[3,60 μmol/(m2·s),10 ℃];在培养第10天时小环藻积累EPA含量的最佳盐度-光照强度-温度组合是[9,60 μmol/(m2·s),20 ℃],见表 4。
|
表 4 3因素不同水平均值的估计边际均值和两两比较分析 Tab.4 Estimated marginal means and pairwise comparisons of means of different levels of the three factors |
温度、盐度和光照条件等环境因素可影响微藻细胞的生长和生化组成,而不同藻种的最适生长温度、盐度和光照条件存在一定差异[12]。光照是影响微藻生长繁殖的重要生态因子之一,光照强度直接影响微藻的光合作用速率。藻类对光照强度有一个饱和点,低于饱和点,随着光照强度增加,微藻光合速率加快;超过饱和点会产生光抑制作用,导致生物量降低[15]。光照也是微藻细胞内重要的信号源,影响微藻对环境的适应行为[16]。FIGUEROA等[17]证实温度和光照强度会同时影响微藻光合作用相关酶的活性和光合作用的过程,进而影响营养物质的吸收利用效率及藻细胞分裂周期等。在大多数藻细胞中,光合作用、硅酸盐的利用速度、细胞内酸碱平衡的调节及氨基酸的合成均需要钠离子的参与,因此,盐度的变化会引起微藻细胞渗透压的变化并且影响微藻细胞光合作用中电子转移,从而影响微藻细胞的生长[18-19]。曾蓓蓓等[7]采用单因子试验方法,获得小环藻SHOU-B108的最适宜生长温度、盐度和光照强度分别为20.6 ℃、6.1和40.2 μmol/(m2·s)。本实验中,采用正交实验法,培养至第10天小环藻在盐度6、光照强度40 μmol/(m2·s)和温度30 ℃组收获生物量干重最高(0.250 9 g/L)。单因子试验和正交试验得到的结果并不完全一致,表明影响藻类生长的温度、盐度和光照强度等因子之间存在交互作用。类似的结果在其他藻类,如鼠尾藻(Sargassum thunbergii) [20]、旋链角毛藻(Chaetoceros curvisetus) [21]和两栖盖丝藻(Geitlerinema amphibium) [22]中也得到了证实。
3.2 盐度-光照强度-温度对小环藻SHOU-B108的ARA和EPA含量的影响微藻的油脂积累及脂肪酸组成与环境因子(温度、光照强度、盐度等)有密切关系,且环境因子对微藻合成高不饱和脂肪酸的影响具有种间差异性。温度对不同种类微藻脂肪酸组成的影响相对有较高的共性,通常高温会引起微藻细胞饱和脂肪酸(SFA)含量的增加,多不饱和脂肪酸(PUFA)含量的下降,低温会诱导藻细胞大量合成不饱和脂肪酸以维持膜流动性和正常生理功能[23-24],而高温时SFA含量的增加被认为是维持细胞膜完整性的一种策略[23, 25]。RENAUD等[26]对角毛藻(Chaetoceros sp.)、红胞藻(Rhodomonas sp.)和隐藻(Cryptomonas sp.)的研究发现,在较高的生长温度下,5种微藻的EPA占总脂肪酸的比例都较低。李文权等[27]的研究结果表明,随着培养温度上升,球等鞭金藻(Isochrysis galbana)和三角褐指藻(Phaeodactylum tricomutum)的不饱和脂肪酸百分含量下降。本研究中,各培养阶段温度始终对小环藻的ARA和EPA含量有极显著的影响,是影响藻细胞ARA和EPA含量的主要因素。总体上高温有利于小环藻细胞积累更多的ARA。培养前期(第1~6天)藻细胞EPA含量在高温组较高,在培养后期(第8-10天)表现为高温组EPA含量较低,与上述研究结果相似。表明温度对小环藻细胞EPA含量的影响还与培养阶段有关。高温有利于细胞蓄积更多的ARA的现象或许与ARA有助于细胞增加抗高温胁迫的生理作用有关。研究表明,生活于热带的海洋生物通常比温带的海洋生物含有更高的ARA水平。AZACHI等[28]认为盐度的变化能够影响微藻细胞的β-酮脂酰-CoA合成酶(β-ketoacyl-coenzyme A (CoA) synthases (Kcs))和脂肪酸去饱和酶的合成。盐度还会影响微藻的光合作用和呼吸作用的电子传递系统,从而影响细胞脂肪酸的合成。研究表明,低盐度条件有利于绿色巴夫藻(Pavlava viridid)合成PUFA(n-3)及EPA[29]。4株海水小球藻的EPA含量均在低盐度(16)时达到最大值[30]。本研究中ARA含量的变化也具有相似的结果,即低盐度有助于小环藻细胞ARA含量的增加。然而从细胞EPA含量看,培养前期在高盐度(9)条件下更有利细胞EPA的蓄积,到了培养末期,低盐度(3)下小环藻细胞的EPA含量较高。表明盐度对小环藻EPA的影响与培养阶段有关。而TESHIMA 等[31]报道了一种海水小球藻(C. saccharophial)在盐度4~30之间变化时并未引起脂肪酸组成的变化。微绿球藻(Nannochloropsis oculata)EPA含量在盐度处于14.5~33.5之间无显著变化[32]。而事实上海水小球藻(Cyclotella sp.)和眼点拟微球藻(Nannochloropsis sp.)对盐度的适应范围都很广。因此,上述研究结果表明盐度对微藻细胞脂肪酸的影响具有种间差异性,影响规律也与培养条件的选择有关。
光照可调节藻细胞代谢,因此藻细胞的脂肪酸组成也受光照条件的影响而产生变化。光照通过一系列铁氧还原蛋白和硫氧还原蛋白参与的信号转导,激活质体中的乙酰辅酶A羧化酶(ACCase),诱导ACCase酶调节脂肪酸的合成。低光照强度可以促进极性脂合成,尤其是与叶绿体连接的极性膜脂,而高光照强度会增加中性脂含量[33]。此外,尽管光照强度过高很容易导致多不饱和脂肪酸的氧化损伤,但是会促进SFA和单不饱和脂肪酸(MUFA)的合成[34]。THOMPSON等[35]认为大多数海水微藻在低光照强度下合成高水平EPA,而DHA含量通常会随着光照强度升高而增加[36]。曹春晖等[37]也发现2株小球藻(Chlorella sp.)的EPA含量随光照强度增加而明显降低,4株绿藻的ARA含量和PUFA总量均随光照强度的增加而降低。蒋霞敏[38]报道在1 000~7 000 lx光照范围内微绿球藻EPA含量随光照强度升高而降低。本实验中光照强度对小环藻细胞ARA和EPA含量存在不同的诱导效果,高的光照强度[60 μmol/(m2·s)]始终有利于细胞积累EPA;较低的光照强度则有利于细胞积累ARA,而且在培养前期效果更明显。上述研究结果也再次表明,环境因子对微藻细胞脂肪酸组成的影响具有种间差异性和脂肪酸差异性,推测这种差异性与微藻对环境的适应能力及实验参数的选择有关。
综上所述,有利于小环藻生物量生长的盐度-光照强度-温度组合条件与有利于藻细胞积累ARA或EPA含量的组合条件并不完全一致。小环藻在盐度6,光照强度40 μmol/(m2·s) 和温度30℃组收获生物量干重最高;但低的盐度(3)和高的温度(30℃)始终有利于小环藻SHOU-B108细胞积累ARA,而高的光照强度[60 μmol/(m2·s)]则始终有利于细胞积累EPA。通过选择特定的培养条件,可以按需获得特定营养物质含量高的小环藻细胞。
| [1] | 李荷芳, 周汉秋.海洋微藻脂肪酸组成的比较研究[J]. 海洋与湖沼, 1999, 30(1): 34–40. LI H F, ZHOU H Q.Comparative studies on fatty acid composition of marine microalgae[J]. Oceanologia et Limnologia Sinica, 1999, 30(1): 34–40. |
| [2] | YONGMANITCHAI W, WARD O P.Screening of algae for potential alternative sources of eicosapentaenoic acid[J]. Phytochemistry, 1991, 30(9): 2963–2967. |
| [3] | DALSGAARD J, JOHN M S, KATTNER G, et al.Fatty acid trophic markers in the pelagic marine environment[J]. Advances in Marine Biology, 2003, 46: 225–340. |
| [4] | 尹绍武, 王德安.饵料对河蟹溞状幼体变态发育的影响[J]. 生态学报, 2003, 23(4): 725–730. YIN S W, WANG D A.The effects of different diet on metamorphosis and development of Eriocheirsinensis zoeae larvae[J]. Acta Ecologica Sinica, 2003, 23(4): 725–730. |
| [5] | 黄光华, 江林源, 卢小花, 等.小环藻在罗氏沼虾人工育苗中的应用研究[J]. 安徽农业科学, 2011, 39(13): 7849–7850,7853. HUANG G H, JIANG L Y, LU X H, et al.Study on the application of Cyclotella sp. in the artificial breeding of Macrobrachium rosenbergii[J]. Journal of Anhui Agricultural Sciences, 2011, 39(13): 7849–7850,7853. |
| [6] | 史文, 刘其根, 吴晶, 等.不同藻类对大型溞存活和生殖的影响[J]. 生态学杂志, 2009, 28(6): 1128–1133. SHI W, LIUQ G, WU J, et al.Effects of different algae on the survival and reproduction of Daphnia magna[J]. Chinese Journal of Ecology, 2009, 28(6): 1128–1133. |
| [7] | 曾蓓蓓, 黄旭雄, 危立坤, 等.3种半咸水硅藻的适宜培养条件及其细胞生化成分[J]. 海洋渔业, 2014, 36(4): 320–328. ZENG B B, HUANG X X, WEI L K, et al.Suitable culture conditions and cellular biochemical composition of three diatoms from brackish water[J]. Marine Fisheries, 2014, 36(4): 320–328. |
| [8] | 曾艳艺, 黄翔鹄.温度、光照对小环藻生长和叶绿素a含量的影响[J]. 广东海洋大学学报, 2007, 27(6): 36–40. ZENG Y Y, HUANG X H.Effects of temperature and illumination on growth and chlorophyll-a of Cyclotella sp.[J]. Journal of Guangdong Ocean University, 2007, 27(6): 36–40. |
| [9] | 王珺, 赖秋明, 姚发壮, 等.人工培养条件下环境因子对微小小环藻生长的影响[J]. 海洋渔业, 2013, 35(2): 195–201. WANG J, LAI Q M, YAO F Z, et al.Effects of ecological factors on the growth of Cyclotellacaspia under cultivated conditions[J]. Marine Fisheries, 2013, 35(2): 195–201. |
| [10] | 覃宝利, 杨州, 张民.温度波动对浮游藻类生长及多糖组成的影响[J]. 湖泊科学, 2014, 26(3): 432–440. QIN B L, YANG Z, ZHANG M.The effect of temperature fluctuation on the growth and polysaccharide composition of phytoplankton[J]. Journal of Lake Sciences, 2014, 26(3): 432–440. |
| [11] | YONGMANITCHAI W, WARD O P.Growth of and omega-3 fatty acid production by Phaeodactylum tricornutum under different culture conditions[J]. Applied and Environmental Microbiology, 1991, 57(2): 419–425. |
| [12] | CHENG Y X.Live food cultivatology 2nd ed[M].Beijing: Chinese Agricultural Press, 2005. |
| [13] | GRIFFITHS M J, VAN HILLE R P, HARRISON S T L.Selection of direct transesterification as the preferred method for assay of fatty acid content of microalgae[J]. Lipids, 2010, 45(11): 1053–1060. |
| [14] | WEI L K, HUANG X X, HUANG Z Z, et al.Orthogonal test design for optimization of lipid accumulation and lipid property in Nannochloropsis oculata for biodiesel production[J]. Bioresource Technology, 2013, 147: 534–538. |
| [15] | 欧阳峥嵘, 温小斌, 耿亚红, 等.光照强度、温度、pH、盐度对小球藻(Chlorella)光合作用的影响[J]. 武汉植物学研究, 2010, 28(1): 49–55. OUYANG Z R, WEN X B, GENG Y H, et al.The effects of light intensities, temperatures, pH and salinities on photosynthesis of Chlorella[J]. Journal of Wuhan Botanical Research, 2010, 28(1): 49–55. |
| [16] | LEPETIT B, DIETZEL L.Light signaling in photosynthetic eukaryotes with ‘green’ and ‘red’ chloroplasts[J]. Environmental and Experimental Botany, 2015, 114: 30–47. |
| [17] | FIGUEROA FL, JIMÉNEZ C, LUBIÁN LM, et al.Effects of high irradiance and temperature on photosynthesis and photoinhibition in Nannochloropsis gaditana Lubián (Eustigmatophyceae)[J]. Journal of Plant Physiology, 1997, 151(1): 6–15. |
| [18] | MOHAN S V, DEVI M P.Salinity stress induced lipid synthesis to harness biodiesel during dual mode cultivation of mixotrophic microalgae[J]. Bioresource Technology, 2014, 165: 288–294. |
| [19] | KHATOON H, RAHMAN N A, BANERJEE S, et al.Effects of different salinities and pH on the growth and proximate composition of Nannochloropsis sp. and Tetraselmis sp. isolated from South China Sea cultured under control and natural condition[J]. International Biodeterioration & Biodegradation, 2014, 95: 11–18. |
| [20] | 姜宏波, 田相利, 董双林, 等.温度和光照强度对鼠尾藻生长和生化组成的影响[J]. 应用生态学报, 2009, 20(1): 185–189. JIANG H B, TIAN X L, DONG S L, et al.Effects of temperature and light intensity on the growth and biochemical composition of Sargassum thunbergii[J]. Chinese Journal of Applied Ecology, 2009, 20(1): 185–189. |
| [21] | 茅华, 许海, 刘兆普.温度、光照、盐度及pH对旋链角毛藻生长的影响[J]. 生态科学, 2007, 26(5): 432–436. MAO H, XU H, LIU Z P.Effects of water temperature, illumination, salinity and pH on the growth of Chaetoceros curvisetus[J]. Ecological Science, 2007, 26(5): 432–436. |
| [22] | JODŁOWSKA S, LATAŁA A.Combined effects of light and temperature on growth, photosynthesis, and pigment content in the mat-forming cyanobacterium Geitlerinemaamphibium[J]. Photosynthetica, 2013, 51(2): 202–214. |
| [23] | JIANG Y, CHEN F.Effects of temperature and temperature shift on docosahexaenoic acid production by the marine microalge Crypthecodinium cohnii[J]. Journal of the American Oil Chemists' Society, 2000, 77(6): 613–617. |
| [24] | LOS D A, MURATA N.Membrane fluidity and its roles in the perception of environmental signals[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 2004, 1666(1/2): 142–157. |
| [25] | CHEN G Q, JIANG Y, CHEN F.Variation of lipid class composition in Nitzschia laevis as a response to growth temperature change[J]. Food Chemistry, 2008, 109(1): 88–94. |
| [26] | RENAUD S M, THINH L V, LAMBRINIDIS G, et al.Effect of temperature on growth, chemical composition and fatty acid composition of tropical Australian microalgae grown in batch cultures[J]. Aquaculture, 2002, 211(1/4): 195–214. |
| [27] | 李文权, 李芊, 廖启斌, 等.温度对四种海洋微藻脂肪酸组成的影响[J]. 台湾海峡, 2003, 22(1): 9–13. LI W Q, LI Q, LIAO Q B, et al.Effect of temperature on fatty acid composition of four species of marine microalgae[J]. Journal of Oceanography in Taiwan Strait, 2003, 22(1): 9–13. |
| [28] | AZACHI M, SADKA A, FISHER M, et al.Salt induction of fatty acid elongase and membrane lipid modifications in the extreme halotolerant alga Dunaliella salina[J]. Plant Physiology, 2002, 129(3): 1320–1329. |
| [29] | 蒋霞敏, 柳敏海, 邢晨光.不同生态条件对绿色巴夫藻生长与脂肪酸组成的影响[J]. 水生生物学报, 2007, 31(1): 88–93. JIANG X M, LIU M H, XING C G.Effect of different ecological conditions on the growth and fatty acid composition of Pavlavviridis[J]. Acta Hydrobiologica Sinica, 2007, 31(1): 88–93. |
| [30] | 冯雷, 郭永恩.盐度对四株海洋绿藻总脂含量和脂肪酸组成的影响[J]. 天津科技大学学报, 2009, 24(4): 22–24. FENG L, GUO Y E.Effects of salinity on the total lipids contents and fatty acids composition of 4 strains of marine green algae[J]. Journal of Tianjin University of Science&Technology, 2009, 24(4): 22–24. |
| [31] | TESHIMA S, YAMASAKI S, KANAZAWA A, et al.Effect of water temperature and salinity on eicosapentaenoic acid level of marine Chlorella[J]. Bulletin of the Japanese Society of Scientific Fisheries, 1983, 49(5): 805–807. |
| [32] | 吴瑞珊, 魏东.盐度及其调节方式对眼点拟微球藻的生长和EPA积累的影响[J]. 现代食品科技, 2007, 23(12): 5–8. WU R S, WEI D.Effects of salinity and its regulation ways on growth and EPA accumulation of Nannochloropsis oculata[J]. Modern Food Science and Technology, 2007, 23(12): 5–8. |
| [33] | KOZAKI A, KAMADA K, NAGANO Y, et al.Recombinant carboxyltransferase responsive to redox of pea plastidic acetyl-CoA carboxylase[J]. The Journal of Biological Chemistry, 2000, 275(14): 10702–10708. |
| [34] | GUSCHINA I A, HARWOOD J L. Algal lipids and effect of the environment on their biochemistry[M]//KAINZ M, BRETT M T, ARTS M T. Lipids in Aquatic Ecosystems.New York:Springer, 2009:1-24. |
| [35] | THOMPSON P A, HARRISON P J, WHYTE J N C.Influence of irradiance on the fatty acid composition of phytoplankton[J]. Journal of Phycology, 1990, 26(2): 278–288. |
| [36] | SUKENIK A, CARMELI Y, BERNER T.Regulation of fatty acid composition by irradiance level in the eustigmatophyte Nannochloropsis sp.[J]. Journal of Phycology, 1989, 25(4): 686–692. |
| [37] | 曹春晖, 孙世春, 麦康森, 等.光照强度对四株海洋绿藻总脂含量和脂肪酸组成的影响[J]. 生态学报, 2010, 30(9): 2347–2353. CAO C H, SUN S C, MAI K S, et al.Effect of light intensity on the total lipid contents and fatty acid composition in 4 strains of marine green algae[J]. Acta Ecologica Sinica, 2010, 30(9): 2347–2353. |
| [38] | 蒋霞敏.温度、光照、氮含量对微绿球藻生长及脂肪酸组成的影响[J]. 海洋科学, 2002, 26(8): 9–13. JIANG M X.Effects of temperatures, light intensities and nitrogen concentrations on the growth and fatty acid compositions of Nannochloropsis oculata[J]. Marine Sciences, 2002, 26(8): 9–13. |
2. Shanghai Engineering Research Center of Aquaculture, Shanghai 201306, China;
3. Aquatic Animal Genetic Breeding Center Collaborative Innovation Center in Shanghai, Shanghai 201306, China
 2016,
Vol. 25
2016,
Vol. 25


