2. 上海海洋大学 水产动物遗传育种上海市协同创新中心, 上海 201306;
3. 上海市水产研究所, 上海 200433
雌激素相关受体(estrogen related receptor,ERR)属于核受体超家族成员,是与雌激素受体(estrogen receptor,ER)密切相关的孤儿核受体,参与调控动物能量代谢、细胞增殖分化和性腺发育等多种生理过程,在人类、小鼠、斑马鱼和果蝇等动物中已经发现多种ERR,其具体调控机制也在逐步被解析[1-4]。众多研究表明参与雌激素信号通路调控是ERR重要的调控路径之一[5-6],有关其准确的调控路径和基因功能尚不清楚。尽管ERR在动物生长发育过程中具有重要的生物学功能,但有关甲壳动物ERR的研究极少,目前NCBI中仅见三疣梭子蟹(Portunus trituberculatus)、拟穴青蟹(Scylla paramamosain)、飞马哲水蚤(Calanus finmarchicus)、水蚤(Daphnia pulex)和虎斑猛水蚤(Tigriopus japonicus)5个物种ERR的cDNA序列,尚未见甲壳动物体内该基因表达模式及其与生长发育关系的研究报道。
甲壳动物通过蜕皮实现生长,蜕皮是一个高度耗能的生理过程,涉及到细胞增殖、凋亡分化和能量代谢等[7-10],由于ERR基因参与了昆虫的生长发育和能量代谢等过程[4, 11],因此,推测ERR在甲壳动物蜕皮过程中也具有非常重要的作用。三疣梭子蟹是我国重要经济蟹类之一,2013年全国养殖总产量达11万吨左右[12]。三疣梭子蟹养殖过程中的蜕皮死亡综合征(molting death syndrome,MDS)是该养殖产业面临的重要问题之一,其形成原因非常复杂[13-14],深入探讨三疣梭子蟹的蜕皮机制,可以为其MDS控制提供理论参考和实践依据。迄今为止,有关三疣梭子蟹蜕皮的分子机制所知甚少,主要集中在蜕皮相关基因的筛选、克隆和不同蜕皮阶段相关基因表达水平分析等方面[15-18]。本研究在已获得三疣梭子蟹雌激素相关受体基因(PtERR,KM189915)cDNA全长等相关工作的基础上,通过荧光定量PCR技术研究了PtERR基因在不同组织和不同蜕皮阶段的表达情况,初步了解该基因的表达部位、调控位点及其与蜕壳过程的关系,为进一步研究PtERR基因参与三疣梭子蟹生长蜕壳的调控机制提供基础资料。
1 材料与方法 1.1 实验蟹来源与养殖管理实验用三疣梭子蟹幼蟹取自上海市水产研究所启东科研基地,初始体质量为50~90 g,甲壳宽为7~9 cm。精心挑选肢体健全、活力较好、处于蜕壳间期的雌体60只,活体运输到上海海洋大学甲壳动物营养繁殖研究室,于室内循环水系统中暂养一周,暂养水族箱体积为832 L(长×宽×高=130 cm×60 cm×40 cm,水深25 cm),箱底部放置无毒PVC管(直径15 cm,长15 cm)作为隐蔽物,每箱放10只幼蟹,暂养期间每日下午19:00按照蟹体质量的3%~5%投喂梭子蟹配合饲料(浙江欣欣饲料有限公司生产,粒径2.5 mm,蛋白含量38%,脂肪含量11%),次日上午10点清理残饵和粪便。实验用蟹暂养一周后,挑选40只肢体健全、活体较好、处于蜕壳期的个体用于实验。由于三疣梭子蟹极易自相残杀导致成活率偏低,因此正式实验期间每只幼蟹均单独饲养于梭子蟹单养框(长×宽×高=33 cm×27.5 cm×35 cm,水深25 cm)中。实验期间自然光照,水体盐度为24,水温24~26 ℃,pH 7.0~9.0,溶氧>5 mg/L; 氨氮<0.5 mg/L,亚硝酸盐<0.15 mg/L。投喂和日常管理与暂养期间基本一致,每日检查每只蟹所处的蜕壳阶段,并记录。
1.2 样品采集根据沈洁等[19]形态学方法,三疣梭子蟹蜕皮周期可分为蜕皮期(E 期)、蜕皮后期(AB 期)、蜕皮间期(C 期)和蜕皮前期(D 期),每日检查并记录每只蟹所处的蜕皮阶段。解剖特定蜕皮时期的三疣梭子蟹,采集其肌肉、肝胰腺、心脏、胃、肠、鳃、Y 器官、大颚器、眼柄、胸神经节、三角膜组织。每个蜕皮期采集5~8 只个体,所有组织样品放在冻存管中,液氮速冻后保存于-80 ℃冰箱用于总RNA提取。D期分为D0、D1、D2、D3 和D4 5个不同的亚期[19],由于D 期每个亚期持续时间较短,因此本实验中D 期样品均来自较为典型的D2 亚期。
1.3 RNA提取和实时荧光定量PCR取冻存的三疣梭子蟹各种组织,采用总RNA提取试剂盒(TaKaRa,Cat.D9108A)进行总RNA提取,分别采用1%琼脂糖凝胶电泳和紫外分光光度计法检测RNA的完整度和纯度。各取100 ng总RNA 为反转录模板,采用反转录试剂盒(TaKaRa,Cat.D2639A)进行第一链cDNA合成。根据三疣梭子蟹ERR cDNA全长序列,使用Primer Premier 5.0软件设计PtERR基因qRT-PCR特异性引物ERR-F4/R4,根据YANG等[20]的报道合成内参基因18S的引物,引物序列见表 1。所有引物均委托上海生工生物工程有限公司合成。

|
表 1 荧光定量PCR的引物序列 Tab.1 Primers and their sequences used in this experiment |
按照TaKaRa荧光定量PCR(qRT-PCR)试剂盒(TaKaRa,Cat.DRR420A)说明书,将模板cDNA梯度稀释后进行标准曲线扩增。当无非特异性扩增、目标基因和内参基因的扩增效率为95%~105%、标准曲线R2大于0.99时,确定qRT-PCR反应体系与条件。qRT-PCR的反应体系见表 2,反应条件为:95 ℃预变性30 s,95 ℃变性 5 s ,61 ℃退火 30 s ,共进行40个循环。qRT-PCR反应体系与条件确定后,对组织样品进行相关基因的表达水平分析。

|
表 2 目标基因和内参基因定量PCR反应体系的试剂添加量 Tab.2 The volume of each reagent added to the PCR mixture used for qRT-PCR of PtERR and 18S |
采用18S rRNA作为内参基因,计算ΔCt,通过公式ΔΔCt=ΔCt样品-ΔCt对照计算ΔΔCt,2-ΔΔCt 法计算PtERR-mRNA 的相对表达水平。采用SPSS 17.0软件对qRT-PCR 数据进行统计分析,所有数据均以平均值±标准差(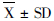
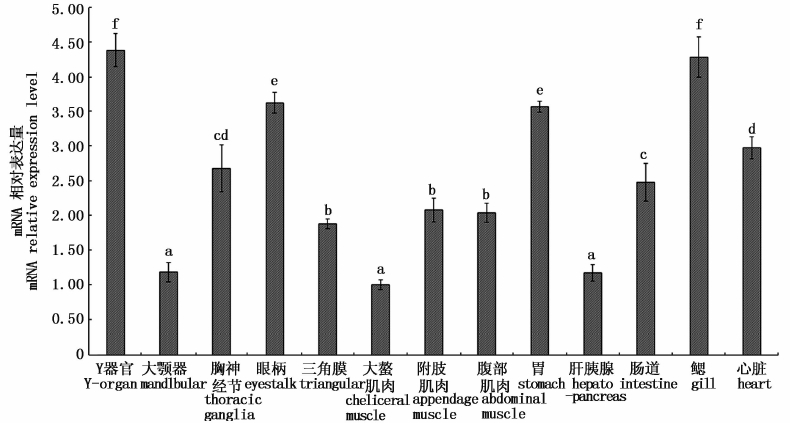
荧光定量PCR结果显示,PtERR在三疣梭子蟹蜕皮C期的Y器官、大颚器、胸神经节、眼柄、三角膜、大螯肌肉、附肢肌肉、腹部肌肉、胃、肝胰腺、肠道、鳃、心脏组织中均有表达,且部分组织中PtERR-mRNA表达水平差异显著(P<0.05,图 1)。Y器官和鳃中的表达量最高,其余依次为眼柄>胃>心脏>胸神经节>肠道>附肢肌肉>腹部肌肉>三角膜>大颚器>肝胰腺>大螯肌肉,其中大颚器、大螯肌肉和肝胰腺中的PtERR-mRNA表达水平最低,且三者间无显著差异。整体上,PtERR-mRNA在4种内分泌器官(Y器官、大颚器、胸神经节和眼柄)和消化器官(胃、肝胰腺和肠道)中表达水平差异显著,在3种肌肉组织和三角膜中表达水平相对较低,除大螯肌肉显著最低外,其余三者间无显著差异。
|
图 1 三疣梭子蟹蜕皮间期各组织中PtERR-mRNA的表达水平比较
Fig. 1 Analysis of expression levels of PtERR-mRNA in various tissues at the intermolt period of P. trituberculatus
柱顶部含有不同字母代表不同组织中的PtERR-mRNA表达量差异显著(P<0.05)。
Different letters at the top of the columns indicate the expression levels of PtERR-mRNA in different tissues were significantly different(P<0.05). |
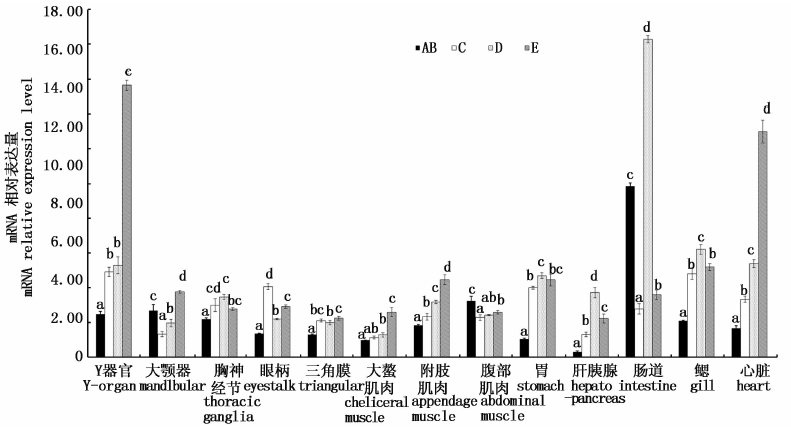
图 2为PtERR-mRNA在三疣梭子蟹不同蜕皮阶段的表达水平变化情况,在整个蜕壳周期,13种组织中PtERR-mRNA表达水平均变化显著(P<0.05),但不同组织中的变化趋势有所不同。就内分泌器官而言,Y器官中PtERR-mRNA表达水平从AB期至E期呈显著上升趋势,特别是D期至E期上升幅度最大,PtERR-mRNA的相对表达水平提升了近2倍(P<0.05),但C期和D期差异不显著(P>0.05);蜕壳周期中胸神经节和眼柄中的PtERR-mRNA变化模式基本相同,均为先上升后下降趋势;大颚器中的PtERR-mRNA表达水平变化趋势为先下降后上升,其中E期最高,C期最低。就消化代谢器官而言,胃、肝胰腺和鳃中PtERR-mRNA的表达模式在整个蜕皮周期中基本相同,为先升高后降低的趋势,均在D期达最高值;肠道中PtERR-mRNA相对表达量在D期最高,AB期次之,C期和E期较低,其中D期的相对表达水平为C期的6.6倍;从AB期至E期,心脏中PtERR-mRNA表达水平一直显著增加,每期增加1倍左右(图 2)。就肌肉组织和三角膜而言,蜕皮周期中大螯肌肉、附肢肌肉和三角膜中的PtERR-mRNA表达水平变化模式基本一致,呈显著升高趋势;腹部肌肉中PtERR-mRNA在AB期表达水平最高,C期显著降低,C期至E期呈递增趋势。
|
图 2 三疣梭子蟹不同蜕皮阶段各组织中PtERR-mRNA表达水平变化
Fig. 2 Analysis of expression difference of PtERR-mRNA in thirteen tissues of P. trituberculatus at different molting stages
AB. 蜕壳后期; C. 蜕壳间期; D. 蜕壳前期; E. 蜕壳期; 柱顶部含有不同字母代表同一组织中不同蜕壳阶段PtERR-mRNA表达水平差异显著(P<0.05)。
AB. postmolt; C. intermolt; D. premolt; E. molt; Different letters at the top of the columns indicate the expression level of PtERR-mRNA was significantly different at different molting stages in the same tissue(P<0.05). |
本研究结果表明PtERR-mRNA在Y器官、大颚器、胸神经节、眼柄、三角膜、大螯肌肉、附肢肌肉、腹部肌肉、胃、肝胰腺、肠道、鳃、心脏组织中均有表达,但其在不同组织中表达水平差异较大,暗示三疣梭子蟹ERR基因可能与哺乳动物的ERR一样,在不同组织中广泛表达,但在不同组织中的生理功能可能具有一定的差异。Y器官中PtERR-mRNA表达水平高,可能是由于三疣梭子蟹在蜕皮过程中体内蜕皮激素浓度显著升高[15],Y器官主要分泌蜕皮激素[21],结合HE等[11]实验猜想:ERR可能参与或合作参与到蜕皮激素信号传导过程,本研究猜测PtERR在蜕皮激素信号通路下游是一个重要调控基因。三疣梭子蟹鳃、心脏、胃和肠道中PtERR-mRNA含量处于中高等水平,可能因为这些器官是三疣梭子蟹的能量代谢和消化吸收器官,能量代谢旺盛。对哺乳动物的研究表明,ERR通常参与节肢动物和哺乳动物的能量代谢过程[4, 22],在褐色脂肪组织、肾脏、心脏和肠道等组织中优势表达,如ERRα突变小鼠的体质量和周边脂肪沉积量显著下降[2, 23]。三疣梭子蟹眼柄和胸神经节中也有中等水平的PtERR-mRNA表达,这可能与视觉、嗅觉和行为等有一定的关系。先前对拟黑多刺蚁(Polyrhachis vicina)的研究表明,PtERR-mRNA在脑神经和视觉神经系统中表达水平较高,推测其与昆虫的嗅觉辨别、视觉学习、记忆功能和行为等关系密切[24]。PtERR-mRNA在三疣梭子蟹的大颚器、肌肉组织和肝胰腺中表达水平较低,可能与这些组织在蜕皮间期细胞增殖较少[10, 25],PtERR在此阶段所起作用较小有关[3]。
3.2 PtERR-mRNA在蜕皮过程中的表达变化原因及其可能的生理功能本研究结果表明PtERR在所测的三疣梭子蟹13种组织中均有表达,且随着蜕皮阶段的变化而显著变化,推测PtERR基因在三疣梭子蟹生长蜕壳过程中起着重要的调控作用。不同蜕皮阶段,同一组织中的PtERR-mRNA表达水平有所不同,其原因可能与PtERR基因的生理功能有关。
三疣梭子蟹的蜕皮过程主要由Y器官分泌的蜕皮激素进行正调控,同时受到眼柄分泌的蜕皮抑制激素(molting-inhibiting hormone,MIH)负调控[15, 26-27]。三疣梭子蟹血淋巴中Y器官分泌的蜕皮激素浓度从AB期至D期显著增加,且在D3期达最高值[15],本研究中Y器官中PtERR-mRNA表达水平在E期达最高值,这说明PtERR-mRNA表达峰值滞后于蜕皮激素浓度,暗示蜕皮激素可以诱导该基因的表达调控,该基因可能是蜕皮激素信号通路下游的一个重要基因[11]。眼柄中PtERR-mRNA在C期表达水平最高,这和蜕皮过程中MIH基因的表达模式基本一致[15],这暗示三疣梭子蟹眼柄中PtERR-mRNA的表达与蜕皮过程呈负相关。大颚器是三疣梭子蟹的另一个重要内分泌器官,其主要功能是分泌甲基法尼酯(Methyl Farnesoate,MF)参与蜕皮、形态发生和性腺发育的调控[28-29],本研究中三疣梭子蟹大颚器中的PtERR-mRNA在AB期和E期相对较高,在C期最低,这说明大颚器中的PtERR在蜕皮过程和蜕皮后起着较重要的作用。
在哺乳动物和昆虫中,ERR基因还参与能量代谢调控过程[2, 4, 23]。当动物机体受到外界环境刺激时,ERRα基因表达上调能使机体作出能量产生与利用的反馈,并达到最佳的适应状态[5]。本研究显示,从AB期至E期,心脏中PtERR-mRNA水平一直显著上升,蜕壳期(E期)表达水平最高,这可能是因为三疣梭子蟹在蜕皮过程中挣脱旧外壳的束缚需要大量耗能[9, 19],因此心跳速度加快,导致供能增加和PtERR-mRNA表达水平升高。胃、肝胰腺和鳃中的PtERR-mRNA表达模式均为先升高后降低趋势,D期最高,这可能与这些器官中的细胞增殖有关,对哺乳动物的研究表明ERR基因还具有参与调控细胞的增殖分化的功能[1-3, 30]。甲壳动物中鳃除了具有排泄和渗透调节作用外,还主要行使呼吸和能量代谢功能[31],在蜕皮C-E期鳃中PtERR-mRNA表达水平较高,暗示该基因可能参与调控三疣梭子蟹呼吸过程的氧化代谢等。在三角膜和肌肉组织中,PtERR-mRNA的表达整体上也呈上升趋势,但是变化幅度没有Y器官、肝胰腺、胃和心脏等器官显著,这暗示PtERR在肌肉组织生长过程中也起到一定的调节作用,但是肌肉组织可能不是该基因在蜕皮调控中的主要靶器官。
综上,PtERR在三疣梭子蟹多种组织中广泛表达,不同蜕皮阶段,PtERR-mRNA在Y器官、大颚器、眼柄、鳃、肝胰腺和心脏等组织中表达水平相差较大,推测PtERR在三疣梭子蟹蜕皮过程和能量代谢中起着重要的调控作用,其具体生理功能和调控机制有待进一步深入研究。
| [1] | PETTERSSON K, SVENSSON K, MATTSSON R, et al.Expression of a novel member of estrogen response element-binding nuclear receptors is restricted to the early stages of chorion formation during mouse embryogenesis[J]. Mechanisms of Development, 1996, 54(2): 211–223. |
| [2] | LUO J M, SLADEK R, CARRIER J, et al.Reduced fat mass in mice lacking orphan nuclear receptor estrogen-related receptor α[J]. Molecular and Cellular Biology, 2003, 23(22): 7947–7956. |
| [3] | FUJIMOTO J, NAKAGAWA Y, TOYOKI H, et al.Estrogen-related receptor expression in placenta throughout gestation[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2005, 94(1/3): 67–69. |
| [4] | TENNESSEN J M, BAKER K D, LAM G, et al.The Drosophila estrogen-related receptor directs a metabolic switch that supports developmental growth[J]. Cell Metabolism, 2011, 13(2): 139–148. |
| [5] | 陆蕴红, 李群益, 施孝金.雌激素相关受体α(ERRα)与肿瘤疾病的研究进展[J]. 复旦学报(医学版), 2014, 41(1): 126–132. LU Y H, LI Q Y, SHI X J.Research progress on estrogen-related receptorα (ERRα) and tumor diseases[J]. Fudan University Journal of Medical Sciences, 2014, 41(1): 126–132. |
| [6] | 刘英华, 何宁, 姜淑卿, 等.雌激素相关受体α与雌激素受体α通路相关性研究[J]. 中华肿瘤防治杂志, 2013, 20(17): 1306–1309. LIU Y H, HE N, JIANG S Q, et al.Correlation between estrogen receptor-related receptor α and estrogen receptor α pathway[J]. Chinese Journal of Cancer Prevention and Treatment, 2013, 20(17): 1306–1309. |
| [7] | 蔡生力.甲壳动物内分泌学研究与展望[J]. 水产学报, 1998, 22(2): 154–161. CAI S L.A review of crustacean endocrinology[J]. Journal of Fisheries of China, 1998, 22(2): 154–161. |
| [8] | 姚俊杰, 赵云龙.甲壳动物蜕皮的调节机制研究进展[J]. 水利渔业, 2006, 26(6): 8–10. YAO J L, ZHAO Y L.Regulation mechanisms of molting in crustaceans[J]. Reservoir Fisheries, 2006, 26(6): 8–10. |
| [9] | CHANG E S, MYKLES D L.Regulation of crustacean molting:a review and our perspectives[J]. General and Comparative Endocrinology, 2011, 172(3): 323–330. |
| [10] | MYKLES D L.Ecdysteroid metabolism in crustaceans[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2011, 127(3/5): 196–203. |
| [11] | HE H, XI G S, LU X.Molecular cloning, characterization, and expression analysis of an estrogen receptor-related receptor homologue in the cricket, Teleogryllus emma[J]. Journal of Insect Science, 2010, 10: 188. |
| [12] | 农业部渔业渔政管理局.2014中国渔业年鉴[M].北京: 中国农业出版社, 2014. Fisheries Bureau and Fishery adiministration of Ministry of Agriculture of China.China Fishery Yearbook 2014[M].Beijing: China Agriculture Press, 2014. |
| [13] | TAKEUCHI T, SATOH N, SEKIYA S, et al.The effect of dietary EPA and DHA on the molting rate of larval swimming crab Portunus trituberculatus[J]. Nippon Suisan Gakkaishi, 1999, 65(6): 998–1004. |
| [14] | 路允良, 王芳, 赵卓英, 等.盐度对三疣梭子蟹生长、蜕壳及能量利用的影响[J]. 中国水产科学, 2012, 19(2): 237–245. LU Y L, WANG F, ZHAO Z Y, et al.Effects of salinity on growth, molt and energy utilization of juvenile swimming crab Portunus trituberculatus[J]. Journal of Fishery Sciences of China, 2012, 19(2): 237–245. |
| [15] | 汪春建, 朱冬发, 亓一舟, 等.三疣梭子蟹蜕皮周期中MIH基因mRNA水平与蜕皮激素浓度变化[J]. 水生生物学报, 2013, 37(1): 22–28. WANG C J, ZHU D F, QI Y Z, et al.Molt-inhibiting hormone levels and ecdysteroid titer during a molt cycle of Portunus trituberculatus[J]. Acta Hydrobiologica Sinica, 2013, 37(1): 22–28. |
| [16] | 王伟, 吴旭干, 楼宝, 等.三疣梭子蟹(Portunus trituberculatus) RXR基因克隆及其在蜕皮过程中的表达分析[J]. 海洋与湖沼, 2014, 45(5): 1105–1114. WANG W, WU X G, LOU B, et al.Cloning of retinoid X receptor (RXR) and its expression analysis during molting in Portunus trituberculatus[J]. Oceanologia et Limnologia Sinica, 2014, 45(5): 1105–1114. |
| [17] | 邱锡尔, 朱冬发, 崔晓雨, 等.三疣梭子蟹HMGR基因的克隆及其在蜕皮中的表达分析[J]. 海洋与湖沼, 2014, 45(6): 1192–1201. QIU X E, ZHU D F, CUI X Y, et al.Cloning and expression of HMGR gene in Portunus trituberculatus during molting[J]. Oceanologia Et Limnologia Sinica, 2014, 45(6): 1192–1201. |
| [18] | WANG W, WU X G, LIU Z J, et al.Insights into hepatopancreatic functions for nutrition metabolism and ovarian development in the crab Portunus trituberculatus: gene discovery in the comparative transcriptome of different hepatopancreas stages[J]. PLoS One, 2014, 9(1). |
| [19] | 沈洁, 朱冬发, 胡则辉, 等.三疣梭子蟹蜕皮周期的分期[J]. 水产学报, 2011, 35(10): 1481–1487. SHEN J, ZHU D F, HU Z H, et al.Molt staging in the swimming crab Portunus trituberculatus[J]. Journal of Fisheries of China, 2011, 35(10): 1481–1487. |
| [20] | YANG F, XU H T, DAI Z M, et al.Molecular characterization and expression analysis of vitellogenin in the marine crab Portunus trituberculatus[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2005, 142(4): 456–464. |
| [21] | FANJUL-MOLES M L.Biochemical and functional aspects of crustacean hyperglycemic hormone in decapod crustaceans:review and update[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2006, 142(3/4): 390–400. |
| [22] | TENG C T, LI Y, STOCKTON P, et al.Fasting induces the expression of PGC-1α and ERR isoforms in the outer stripe of the outer medulla (OSOM) of the mouse kidney[J]. PLoS One, 2011, 6(11). |
| [23] | SCHREIBER S N, KNUTTI D, BROGLI K, et al.The transcriptional coactivator PGC-1 regulates the expression and activity of the orphan nuclear receptor estrogen-related receptor α (ERRα)[J]. The Journal of Biological Chemistry, 2003, 278(11): 9013–9018. |
| [24] | 欧阳霞辉, 李春鸣, 魏锁成, 等.不同品级拟黑多刺蚁(Polyrhachis vicina)脑部雌激素相关受体基因的表达[J]. 陕西师范大学学报(自然科学版), 2012, 40(3): 62–66. OUYANG X H, LI C M, WEI S C, et al.Expression of estrogen related gene in the brain of different caste of Polyrhachis vicina[J]. Journal of Shaanxi Normal University (Natural Science Edition), 2012, 40(3): 62–66. |
| [25] | BUCHHOLZ F, BUCHHOLZ C.Growth and moulting in northern krill (Meganyctiphanes norvegica Sars)[J]. Advances in Marine Biology, 2010, 57: 173–197. |
| [26] | WATSON R D, SPAZIANI E, BOLLENBACHER W E. Regulation of ecdysone biosynthesis in insects and crustaceans:a comparison[M]//KOOLMAN J. Ecdysone, from chemistry to mode of action. Stuttgart:Georg Thieme Verlag, 1989:188-203. |
| [27] | BALDAIA L, PORCHERON P, COIMBRA J, et al.Ecdysteroids in the shrimp Palaemon serratus: relations with molt cycle[J]. General and Comparative Endocrinology, 1984, 55(3): 437–443. |
| [28] | NAGARAJU G P C.Is methyl farnesoate a crustacean hormone?[J]. Aquaculture, 2007, 272(1/4): 39–54. |
| [29] | 谢熙, 朱冬发, 崔晓雨, 等.三疣梭子蟹FAMeT基因克隆及其在蜕皮周期中的表达水平[J]. 水产学报, 2013, 37(7): 994–1001. XIE X, ZHU D F, CUI X Y, et al.Cloning and expression analysis of farnesoic acid O-methyl transferase (FAMeT) gene during molting in Portunus trituberculatus[J]. Journal of Fisheries of China, 2013, 37(7): 994–1001. |
| [30] | FENG W J, RIBEIRO R C J, WAGNER R L, et al.Hormone-dependent coactivator binding to a hydrophobic cleft on nuclear receptors[J]. Science, 1998, 280(5370): 1747–1749. |
| [31] | 卢俊, 庄平, 冯广朋, 等.中华绒螯蟹亲蟹渗透压调节和抗氧化系统对盐度的响应[J]. 海洋渔业, 2011, 33(1): 39–45. LU J, ZHUANG P, FENG G P, et al.Response of osmoregulation and antioxidation system to water salinity in Parent Chinese mitten crab(Eriocheir sinensis)[J]. Marine Fisheries, 2011, 33(1): 39–45. |
2. Aquatic Animal Breeding Center of Shanghai University Knowledge Service Platform, Shanghai Ocean University, Shanghai 201306, China;
3. Shanghai Fisheries Research Institute, Shanghai 200433, China
 2016,
Vol. 25
2016,
Vol. 25


