中华鳑鲏(Rhodeus sinensis)属鲤形目(Cypriniformes)鲤科(Cyprinidae)鲏亚科(Acheibgnathinae),是鳑鲏属(Rhodeus)的一种小型底栖性鱼类,此种鳑鲏广泛分布于除中国黑龙江水系以外的其他各淡水流域[1]。中华鳑鲏体型优美、色彩艳丽,繁殖时需要将卵产于河蚌[2],生理特征独特,深受广大观赏鱼养殖爱好者的喜爱[3],其也是纯天然的野杂鱼类,肉味鲜美,自然资源较丰富,容易捕捞,是人们喜食的一些小型鱼类,有一定的经济价值[4]。近年来由于里下河地区水体环境恶化导致了中华鳑鲏野生鱼种资源不断萎缩,所以研究其生理生活习性,对保护土著鱼类资源有很大的生态意义。
鳑鲏鱼类不耐捕捞和运输,在里下河流域有“出水死”鱼的说法,关于鳑鲏鱼类耗氧、氨氮代谢等研究报道较少,仅山元宪一等1955年时报道过高体鳑鲏浮头和缺氧死亡的溶解氧水平[5]。耗氧和排氨情况是反映体内新陈代谢活动的主要标志[6],本文通过对中华鳑鲏成熟个体在溶氧逐渐胁迫下其呼吸和氮代谢水平的研究,为探讨中华鳑鲏在养殖和运输过程中的供氧条件、密度等方面提供理论参考。
1 材料与方法 1.1 实验材料中华鳑鲏实验鱼为2013年取自江苏里下河水域河道的野生鱼类繁殖的同批子三代性成熟个体,体质量为(1.07±0.068) g,饲养于实验室内120 cm×50 cm×30 cm的水族箱中。实验所用器皿为40 cm×30 cm×30 cm的玻璃鱼缸。实验用水为经过3 d充分曝气的自来水,pH为7.8,硬度以CaCO3计为120 mg/L。
1.2 实验方法实验采用静水呼吸测定的方式,参照文献[6, 7, 8, 9]略有改进,在呼吸室内加满充分曝气的自来水,再放入带止水夹的橡皮管便于虹吸抽取水样,加满水后立即用干净超薄的保鲜膜封盖液面将实验水与外界隔开,呼吸室水体积36 L。实验共分饱食组、饥饿组和空白对照组,第1、2组为饱食组,第3、4组为饥饿组,第5组为对照组。实验开始前饱食组正常投喂至半小时后缸内无饵料剩余;饥饿组停食24 h后用于实验。实验前各组持续曝气,实验开始前10 min停止曝气,测定初始溶氧为(6.5±0.4) mg/L,实验期间水温为(23.2±0.2) ℃。每组放养40尾鱼,体质量分别为:第1组(1.07±0.075) g;第2组(1.06±0.068) g;第3组(1.09±0.064) g;第4组(1.07±0.065) g,第5组不放鱼。实验从下午18:00开始,每4小时采集300 mL水样测定溶解氧、氨氮、亚硝酸氮含量,其中实验第0~12 h为夜间(18:00~6:00),12~24 h(6:00~18:00)为白天。水体中的溶解氧采用碘量法测定,氨氮采用奈氏试剂法测定[10],亚硝酸氮采用磺胺-盐酸萘乙二胺法测定[11]。
1.3 数据处理耗氧率(oxygen consumption rate)的计算方法参照文献[6]略有改进:ROC=(B1-B2-B0)×V/(W·t),式中B1为实验前水体中的溶解氧(mg/L),B2为实验后的溶解氧(mg/L),B0为对照组溶氧差(mg/L),V为实验水体实际体积(L),用上次采样结束时水体积减去采样体积表示,W为实验鱼重量(g),t为时间(h)。
排氨率(ammonia extraction rate)的计算方法参照文献[6]略有改进:RAE=(A1-A2-A0)×V/(W·t),式中A1为实验前氨氮(μg/L),A2为实验后水体中的氨氮(μg/L),A0为对照组氨氮差(μg/L),V为实验水体实际体积(L),用上次采样结束时水体积减去采样体积表示,W为实验鱼重量(g),t为时间(h)。
本实验中所有数据均采用EXCEL 2007进行统计,求取平均值。数据采用SPSS 19.0软件进行显著性检验,ANOVA 和Duncan’s 多重比较进行各组之间平均值的差异显著性检验,P>0.05为无显著性差异,P<0.05为显著性差异。
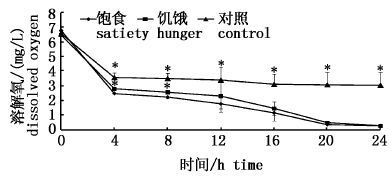
2 结果与分析 2.1 饱食和饥饿状态下溶解氧的变饱食和饥饿状态中华鳑鲏饲养水体溶解氧的变化见图1。各组在前4 h内溶氧急剧下降,对照组从6.57 mg/L下降到3.58 mg/L,饱食组从6.79 mg/L下降到2.50 mg/L,饥饿组从6.48 mg/L下降到2.81 mg/L,其中饱食组溶氧显著低于饥饿组和对照组(P<0.05)。第4~12小时,溶氧缓慢下降,其中第8小时饱食组溶氧显著低于饥饿组和对照组(P<0.05)。从12 h开始饱食组和饥饿组溶氧快速下降,到24 h降到0.3 mg/L左右,为对照组的10%,显著低于对照组(P<0.05),但饱食组和饥饿组差异不显著(P>0.05)。
|
图1
饱食和饥饿状态中华 饲养水体溶氧变化
*表示显著性差异,图2,3,4同此。 * mean significant difference(P<0.05 ),same as Fig.2,3,4. Fig.1 Variation of dissolved oxygen in feeding water of Rhodeus sinensis with satiety and hunger |
实验中观察到第16小时开始中华鳑鲏出现浮头。中华鳑鲏在溶氧6 mg/L以上环境中鳃盖张合频率为(110±27)次/min,16 h时实验组溶氧均下降到1.5 mg/L以下,饥饿组鳃盖张合频率为(224±19)次/min,饱食组为(287±19)次/min,低溶氧时呼吸频率较高溶氧时显著加快(P<0.05),饱食组较饥饿组显著加快(P<0.05)。第20小时溶氧降到0.31 mg/L以下,鱼开始出现死亡,饱食组第24小时死亡率达到17.5%,饥饿组死亡率达7.5%。
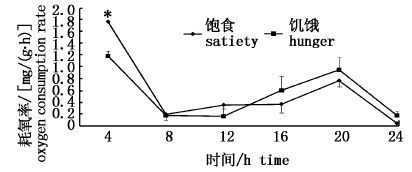
2.2 饱食和饥饿状态下耗氧率的变通过计算得出饱食和饥饿状态中华鳑鲏在不同时间段的耗氧率见图2。在12 h内饱食组耗氧率高于饥饿组,其中4 h内的耗氧率为0.441 mg/(g·h),饥饿组为0.297 mg/(g·h),饱食组显著高于饥饿组(P<0.05),但其他时间差异不显著(P>0.05)。第16~24小时饥饿组耗氧率略高于饱食组,但差异不显著(P>0.05)。
|
图2 饱食和饥饿状态中华鳑鲏耗氧率变化 Fig.2 Variation of oxygen consumption rate (OCR) of Rhodeus sinensis with satiety and hunger |
从各时间段的耗氧率来看,各组第4小时内耗氧率显著高于其他时间段(P<0.05),第8小时段耗氧率急剧下降,第8~20小时内耗氧率有逐渐上升的趋势,其中饱食组第8~16小时(即夜间22点至第2天10点时间段)差异不显著(P>0.05),第20小时段显著升高(P<0.05);饥饿组第8小时和第12小时段差异不显著(即夜间22点至第2天6点时间段)(P>0.05),第16小时和第20小时段显著升高(即上午6点至下午14点时间段)(P<0.05)。两组第24小时段耗氧率均急剧下降,显著低于第4小时段和第20小时段。结果显示夜间耗氧率相对较低,白天耗氧率升高;高溶氧环境下耗氧率较高,低溶氧环境下耗氧率下降。
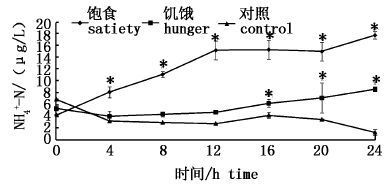
2.3 饱食和饥饿状态下氨氮变化饱食和饥饿状态下中华鳑鲏饲养水体氨氮的变化见图3。实验期间,饱食组氨氮显著高于饥饿组和对照组(P<0.05),并呈逐渐上升的趋势。第12小时内,氨氮浓度逐渐升高,各时间段的氨氮浓度差异显著(P<0.05)。第12~24小时内氨氮浓度差异不显著(P>0.05)。
|
图3 饱食和饥饿状态中华鳑鲏饲养水体氨氮水平 Fig.3 Variation of ammonia in feeding water of Rhodeus sinensis with satiety and hunger |
饥饿组第4小时段和第8小时段与对照组差异不显著(P>0.05),第12~24小时内与对照组差异显著(P<0.05)。试验期间饥饿组氨氮浓度有逐渐增大的趋势,但差异不显著(P>0.05)。对照组在实验期间氨氮浓度差异不显著(P>0.05)。
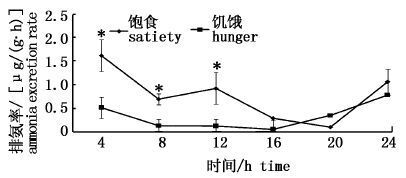
2.4 饱食和饥饿状态下排氨率的变通过计算得出饱食和饥饿状态中华鳑鲏在不同时间段的排氨率见图4。饥饿组和饱食组排氨率在16 h内均呈现逐渐下降的趋势,第16~24小时呈逐渐上升的趋势。在12 h内饱食组排氨率高于饥饿组,其中4 h内的排氨率为1.6 μg/(g·h),饥饿组为0.5 μg/(g·h),第4、8、12 h段饱食组显著高于饥饿组(P<0.05),第16~24 h饥饿组和饱食组差异不显著(P>0.05)。
|
图4 饱食和饥饿状态中华鳑鲏排氨率 Fig.4 Variation of ammonia excretion rate(AER) of Rhodeus sinensis with satiety and hunger |
采用实验所得的耗氧率和排氨率计算第4小时段的O/N,饱食和饥饿时分别为280和600。
3 讨论 3.1 溶解氧胁迫下中华鳑鲏的呼吸作用本实验结果得出23℃水温环境下,中华鳑鲏(1.07±0.68)g在溶氧充足时饱食状态耗氧率为0.441 mg/(g·h),饥饿状态为0.297 mg/(g·h),和底层鱼类相比,耗氧率高于鲫鱼、黄颡鱼及瓦氏黄颡鱼等(表1);和中上层鱼类相比耗氧率低于俄罗斯鲟、美洲鲥鱼、草鱼、白鲢及鳙鱼苗;和麦穗鱼等小型鱼类相比耗氧率低于麦穗鱼苗;和蚌类底栖动物相比高于紫黑翼蚌、三角帆蚌。
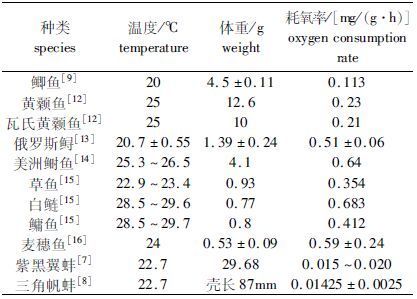
|
表1 不同种类水生动物的耗氧率比较 Tab.1 The OCR of aquatic animals |
中华鳑鲏生活于水体中下层,对低氧有一定的耐受能力,实验发现23 ℃时溶氧低于1.5 mg/L时开始出现浮头现象,0.3 mg/L时开始出现死亡。中层鱼类草鱼、中下层鱼类鲫鱼和底层鱼类鲤鱼发生浮头时的溶氧均低于中华鳑鲏。和同属的高体鳑鲏相比,开始浮头的溶氧比高体鳑鲏略高,发生死亡时的溶氧比高体鳑鲏略低。从浮头和开始死亡的溶氧差来看,底层鱼类鲤最小,鲫次之,中层鱼类草鱼略高,但均低于鳑鲏鱼,而中华鳑鲏大于高体鳑鲏。和青虾相比,日本沼虾窒息点为2.8 mg/L,“太湖1号”青虾为1.96~3.08 mg/L[18],高于中华鳑鲏。
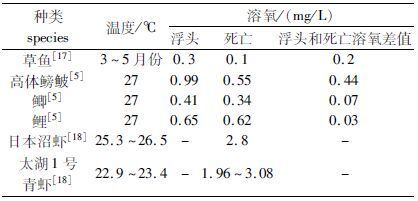
|
表2 不同种类水生动物低氧耐受力比较 Tab.2 The hypoxia tolerance of aquatic animals |
鳑鲏鱼类在捕捞运输过程中死亡率较高,在里下河当地有“出水死”鱼类的说法。从本实验结果看,中华鳑鲏的耗氧率低于花、白鲢等鱼类,所以其死亡可能不是缺氧直接造成,可能与应激等其他因素有关。许多学者认为鱼类正常生长的溶氧在3 mg/L以上,低于2 mg/L将会导致大多数鱼类死亡[17, 19],而且发生浮头和泛塘的溶氧差较小,说明在极度缺氧状态下存活时间较短,所以生产中经常出现不能准确判断缺氧程度而导致严重死亡。在低溶氧环境下中华鳑鲏容易浮头,呈现缺氧状态,鱼体处于亚健康状态,容易感染疾病,出现死亡。所以在草鱼、鲤、鲫、虾蟹等水产品养殖池塘中如果有一定的鳑鲏鱼,如中华鳑鲏、高体鳑鲏等存在时,可作为生物指示,显示养殖池塘的环境压力状态。当进入低氧状态时,出现浮头,指示溶氧较低,养殖鱼类处于亚健康状态;如果持续出现生病死亡可能预示着即将出现泛塘或大规模疾病暴发,从而减少不必要的损失,但这种设想还需要大量实验进行验证。
实验过程中,第4小时内各组包括对照组溶氧有较大降幅,一方面是鳑鲏耗氧率较高,另一方面实验水体为曝气3 d的自来水,可能其中自然菌群耗氧较多,所以在计算耗氧率时计算公式均在唐贤明[6]等的基础上扣除对照组的溶氧变化。实验结果显示水体溶氧对中华鳑鲏呼吸作用有一定的影响,水体溶氧降低后中华鳑鲏呼吸频率增大,但耗氧率有降低的趋势,说明低溶氧胁迫影响了中华鳑鲏的呼吸作用,降低了呼吸效率。耗氧率虽然受到水体溶氧的影响但实验12 h内的夜间时间段相对较低,随后的白天时段逐渐升高,出现一定的昼夜节律性特点,这和中华鳑鲏的活动规律相符,其一般白天活动较多而夜间活动较少。
3.2 溶氧胁迫下中华鳑鲏的氮代谢鱼类氮代谢后的排泄物主要是氨、尿素及尿酸。氨是淡水鱼类最主要的排泄物,主要以 NH3或 NH4+ 2种形态从鳃部排出,而且该过程和呼吸过程密切相关。
本实验测得在溶氧充足的环境中饱食组排氨率为1.6 μg/(g·h),饥饿组为0.5 μg/(g·h),饱食会显著增加氨氮的排泄量。刘建忠等报道0.36 g的河川沙塘鳢在22 ℃环境下排氨率为17 μg/(g·h)[20],其排氨率远高于中华鳑鲏。杨贵强等报道26~30 g的哲罗鱼在17.5℃环境下排氨率为1.95~2.82 μg/(g·h)[21],和中华鳑鲏相近。于宏等报道8 g的黄金鲫在30 ℃环境下排氨率为0.131 μg/(g·h)[22],低于中华鳑鲏。排氨率反映蛋白质的代谢情况,水产动物主要靠蛋白质的代谢提供能量,食物中的蛋白质一部分用于代谢消耗,另一部分用于合成自身蛋白质,以上结果说明中华鳑鲏对蛋白质的利用高于沙塘鳢等鱼,低于黄金鲫,和哲罗鱼较接近。
O/N是反映动物呼吸底物的参数,表示生物体内蛋白质与脂肪和糖类分解代谢的比率,是动物代谢的一个重要生理指标。一些学者认为若O/N为7则几乎完全以蛋白质提供能量[23];O/N为24则是以蛋白质和脂肪氧化共同提供能量[24];O/N较大甚至无穷大则机体主要由脂肪或糖类供能[25]。第4 h时饱食和饥饿状态O/N分别为280和600,说明中华鳑鲏主要以脂肪和糖类供能。中华鳑鲏体重1 g左右即达到性成熟[2],性成熟后生长速度较慢,对饲料蛋白质含量要求不高,解剖成熟个体发现其肠系膜附近有大量脂肪组织,因此本实验得出的结论和其解剖观察到的特征及前期养殖经验观察的结果相符。
环境胁迫对许多水产动物氮排泄有一定影响[6, 20]。结果显示随着实验的进行,溶氧逐渐降低,各实验组氨氮呈逐渐上升的趋势,但氮排泄率在溶氧胁迫下显著下降,说明溶氧水平不仅影响了鱼体呼吸作用还进一步影响了鱼体的代谢水平。实验中,亚硝酸盐含量会随着实验的进行逐渐升高,所以在养殖和高密度运输过程中,尤其是溶氧下降的环境中,氨氮会逐渐累积,转化成亚硝酸等有害物质并逐渐升高,水质逐渐恶化,将影响中华鳑鲏的呼吸作用和氮代谢。在养殖和运输中华鳑鲏时,溶氧水平需要始终保持在1.5 mg/L以上,在进行运输时需要停食,保持饥饿状态会有利于降低低氧胁迫对鳑鲏的影响。
| [1] | 陈校辉, 倪勇, 伍汉霖. 江苏省鳑鲏属(Rhodeus)鱼类的研究[J]. 海洋渔业, 2005, 27(2): 89-97. CHEN X H, NI Y, WU H L. Fishes of genus Rhodeus Agassiz in Jiangsu Province, China[J]. MarineFisheries, 2005, 27(2): 89-97. |
| [2] | 王权, 王建国, 黄爱军, 等. 中华鳑鲏产卵时对河蚌大小的选择研究[J]. 上海海洋大学学报, 2013, 22(4): 559-562. WANG Q, WANG J G, HUANG A J, et al. The choice of mussel size for Chinese bitterling (Rhodeus sinensis) spawning[J]. Journal of Shanghai Ocean University, 2013, 22(4): 559-562. |
| [3] | 赵朝阳, 姜彦钟, 方秀珍, 等. 鳑鲏的生物学特性及观赏价值[J]. 生物学通报, 2010, 45(4): 7-9. ZHAO C Y, JIANG Y Z, FANG X Z, et al. The biological characteristics and ornamental value of Bitterling[J]. Bulletin of Biology, 2010, 45(4): 7-9. |
| [4] | 伍献文. 中国鲤科鱼类志(上卷)[M]. 上海: 上海科学技术出版社, 1982: 199-220. WU X W. China fishes of cyprinidae (Volume 1)[M]. Shanghai: Shanghai Scientific and Technical Publishers, 1982: 199-220. |
| [5] | 山元宪一, 祖岫杰. 11种淡水鱼在低氧条件下的浮头与窒息死亡[J]. 国外水产, 1989, (3): 21-23. SHAN Y X Y, ZHU Y J. Hypoxia and suffocation death of 11 kinds of freshwater fish[J]. Foreign Fisheries, 1989, (3): 21-23. |
| [6] | 唐贤明, 隋曌, 田景波, 等. 盐度对大菱鲆幼鱼耗氧率和排氨率的影响[J]. 南方水产, 2006, 2(4): 54-58. TANG X M, SUI Z, TIAN J B, et al. Effects of salinity on metabolic rate of juvenile turbot (Scophamus maxmius)[J]. South China Fisheries Science, 2006, 2(4): 54-58. |
| [7] | 马学艳, 闻海波, 杜兴伟, 等. 温度对紫黑翼蚌耗氧率和排氨率及其昼夜变化的影响[J]. 上海海洋大学学报, 2015, 24(2): 242-248. MA X Y, WEN H B, DU X W, et al. Effects of temperature on the oxygen consumption rate, ammonia excretion rate and their diurnal variations of Potamilus alatus[J]. Journal of Shanghai Ocean University, 2015, 24(2): 242-248. |
| [8] | 郑侠飞, 王岩. 三角帆蚌耗氧率测定方法的比较[J]. 浙江大学学报(农业与生命科学版), 2013, 39(4): 467-472. ZHENG X F, WANG Y. Comparison of methods for measuring oxygen consumption rate of Hyriopsis cumingii[J]. Journal of Zhejiang University (Agriculture & Life Sciences), 2013, 39(4): 467-472. |
| [9] | 江敏, 黄宗群, 彭自然, 等. 异育银鲫氨氮排泄与耗氧的研究[J]. 上海水产大学学报, 2007, 16(1): 28-32. JIANG M, HUANG Z Q, PENG Z R, et al. Research on ammonia excretion and oxygen consumption in allogynogenetic sliver crucian carp[J]. Journal of Shanghai Fisheries University, 2007, 16(1): 28-32. |
| [10] | 国家环境保护局.中华人民共和国国家标准. GB 7479-87, 水质-铵的测定-纳氏试剂光度法[S]. 北京:中国标准出版社,1987. The Standard of the People's Republic of China. GB 7479-87, Water quality-Determination of ammonium-Nessler's reagent colorimetric method[S]. Beijing:Standards Press of China, 1987. |
| [11] | 国家环境保护局.中华人民共和国国家标准. GB 7493-87, 水质-亚硝酸盐氮的测定-分光光度法[S]. 北京:中国标准出版社,1987. The Standard of the People's Republic of China. GB 7493-87, Water quality-Determination of nitrogen (nitrite)-Spectrophotometric method[S]. Beijing:Standards Press of China, 1987. |
| [12] | 万松良, 葛雷, 张扬, 等. 瓦氏黄颡鱼与黄颡鱼的耗氧率及窒息点[J]. 动物学杂志, 2005, 40(6): 91-95. WAN S L, GE L, ZHANG Y, et al. Oxygen consumption rate and suffocated concentration of Pelteobagrus vachelli and P.fulvidraco[J]. Chinese Journal of Zoology, 2005, 40(6): 91-95. |
| [13] | 刘立志, 赵文, 石振广. 体重和时间节律对俄罗斯鲟(Acipenser gueldenstaedti Brandt)幼鱼耗氧率和窒息点的影响[J]. 生物学杂志, 2013, 30(3): 51-53, 67. LIU L Z, ZHAO W, SHI Z G. The effects of body weight and time rhythm to the oxygen consumption rate and suffocation point of juvenile Acipenser gueldenstaedti Brandt[J]. Journal of Biology, 2013, 30(3): 51-53, 67. |
| [14] | 洪孝友, 潘德博, 朱新平, 等. 温度对美洲鲥耗氧率的影响[J]. 广东农业科技, 2012, 39(10): 159-161. HONG X Y, PAN D B, ZHU X P, et al. Effects of temperature on oxygen consumption rate of the American shad, Alosa sapidissima[J]. Guangdong Agricultural Sciences, 2012, 39(10): 159-161. |
| [15] | 陈寗生, 施瑔芳. 草鱼、白鲢和花鲢的耗氧率[J]. 动物学报, 1955, 7(1): 43-58. CHEN N S, SHI Q F. Oxygen consumption of Ctenopharyngodon idellus, Hypophthalmichthys molitrix and Aristichthys nobilis[J]. Acta Zoologica Sinica, 1955, 7(1): 43-58. |
| [16] | 杨坤, 祝东梅, 王卫民. 麦穗鱼耗氧率和窒息点的测定[J]. 水产科学, 2013, 32(5): 256-260. YANG K, ZHU D M, WANG W M. Oxygen consumption rate and asphyxia point in topmouth gudgeon, Pseudorasbora parva[J]. Fisheries Science, 2013, 32(5): 256-260. |
| [17] | 汤阳, 刘可群, 刘敏, 等. 春季江汉平原草鱼浮头泛塘指标及成因初探[J]. 中国农学通报, 2013, 29(29): 69-74. TANG Y, LIU K Q, LIU M, et al. CDO for Grass carp in Jianghan Plain in spring and elementary analysis of cause[J]. Chinese Agricultural Science Bulletin, 2013, 29(29): 69-74. |
| [18] | 张磊磊, 张倩, 沈建明, 等. 杂交青虾“太湖1号”与日本沼虾耗氧率与窒息点比较[J]. 水产养殖, 2014, 35(4): 49-52. ZhANG L L, ZhANG Q, SHEN J M, et al. Comparison of oxygen consumption rate and critical stifling point between hybrid oriental river prawn “Taihu No. 1” and Macrobrachium nipponense[J]. Journal of Aquaculture, 2014, 35(4): 49-52. |
| [19] | TOOBY T E, LUCEY J, STOTT B. The tolerance of grass carp, Ctenopharyngodon idella Val., to aquatic herbicides[J]. Journal of Fish Biology, 2006, 16(5): 591-597. |
| [20] | 刘建忠, 施永海, 邓平平, 等. 温度对河川沙塘鳢幼鱼耗氧率和排氨率的影响[J]. 大连海洋大学学报, 2013, 28(3): 273-276. LIU J Z, SHI Y H, DENG P P, et al. Effect of temperature on oxygen consumption and ammonia excretion of sleeper Odontobutis potamophila juveniles[J]. Journal of Dalian Ocean University, 2013, 28(3): 273-276. |
| [21] | 杨贵强, 张永旺, 徐绍刚, 等. 不同摄食水平哲罗幼鱼排氨率的研究[J]. 中国农学通报, 2014, 30(35): 112-115. YANG G Q, ZHANG Y W, XU S G, et al. Study on the ammonia excretion rate of the young Taimen with different meal sizes[J]. Chinese Agricultural Science Bulletin, 2014, 30(35): 112-115. |
| [22] | 于宏, 孙学亮, 程民杰, 等. 不同规格黄金鲫耗氧率及排氨率研究[J]. 水产养殖, 2015, 36(1): 10-14. YU H, SUN X L, CHENG M J, et al. Research of oxygen consumption rate and ammonia excretion rate of golden carp in different specifications[J]. Journal of Aquaculture, 2015, 36(1): 10-14. |
| [23] | MAYZAND P. Respiration and nitrogen excretion of zooplankton. Ⅳ. The Influence of starvation on the metabolism and the biochemical composition of some species[J]. Marine Biology, 1976, 37(1): 47-58. |
| [24] | IKEDA T. Nutritional ecology of marine zooplankton[J]. Memoirs of the Faculty of Fisheries Hokkaido University, 1974, 22(1): 1-97. |
| [25] | CONOVER R J, CORNER E D S. Respiration and nitrogen excretion by some marine zooplankton in relation to their life cycles[J]. Journal of the Marine Biological Association of the United Kingdom, 1968, 48(1): 49-75. |
 2016, Vol. 25
2016, Vol. 25


