2. 江苏省淡水水产研究所, 江苏南京 210017;
3. 农业部渔业产品质量监督检验测试中心, 江苏南京 210017;
4. 中国农业科学院农产品加工研究所, 北京 100193
扑草净(Prometryn)是一种三氮类除草剂 (即三嗪类),作为预防农田杂草生长的高效除草剂在世界范围内广泛使用[1],水产养殖中主要用于清除鱼、虾、蟹、贝、海参等养殖水体中的丝状藻类(青苔)、大型草类及有害藻类。由于其水溶性较低,化学性质稳定,施药后残效期长,大量使用致其在养殖池塘中广泛分布,长期积累导致最终产品中药物残留超标[2]。早在2006年,日本在中国出口的紫菜产品中检测出扑草净残留的事件引起两国较大贸易争端[3]。近年,日本等国加强了对我国出口水产品质量的检查,要求出口贝类及相关产品均需接受农残扑草净检测方可销售,限量为10 μg/kg[4]。欧洲和美国等发达地区和国家也相继通过农药限量对中国相关水产品实施贸易技术壁垒,类似事件已引起国内外对水产品中扑草净残留的广泛关注。因此,针对种类繁多且基质成分复杂的水产品,建立扑草净残留快速、灵敏的定量定性检测方法,不仅可以保护消费者的健康安全,同时对促进水产品的出口和推动我国水产业的可持续发展意义重大。
目前针对扑草净残留常用检测方法包括:气相色谱法(GC)[5]、高效液相色谱法HPLC)[1, 6, 7, 8, 9, 10] 、气质联用法(GC-MS)[3, 11, 12, 13, 14, 15]、液-质联用法[2, 4, 16, 17, 18, 19]及其他方法[20, 21],主要涉及水体[1, 6, 8, 10, 14, 15, 20, 21]、土壤[5, 6, 10, 16]、农作物[10, 12, 13, 16, 17]、畜产品[7, 12, 18]、紫菜[3, 9, 11]和贝类[2, 4, 19]等,但上述方法大多针对一种基质展开,且部分方法的检出限接近于国家对食品中农药残留的最大限量。而在水产品痕量扑草净残留的检测中,品种繁多,基质多样性如色素、脂肪、蛋白质等的干扰给实际样品检测带来诸多困难,二级质谱技术可以有效去除样品复杂背景的干扰,具有高选择性、高灵敏度。因此,本文选择鳕鱼、草鱼、斑点叉尾鮰、克氏螯虾、紫菜等5种典型水产品种作为实验对象,采用固相萃取净化、气相色谱-串联质谱(GC-MS/MS)联用技术,对不同基质水产品中扑草净农药残留的检测方法进行了探索,以此建立适用于不同类型水产品的定量定性方法,为不同水产品中扑草净的残留检测提供依据。
1 实验材料与方法 1.1 仪器与设备主要仪器:TSQ-45000 Quantum气相色谱-串联质谱仪(美国ThermoFisher公司);AllegraTM 21R台式高速冷冻离心机(美国Beckman公司);XW-80A微型涡旋混合仪(上海沪西分析仪器厂);AE200电子天平,感量0.0001 g(瑞士梅特乐-托利多公司),JY5002电子天平,感量0.01 g(上海精天电子仪器厂),N-EVAPTM111氮吹仪(美国Organomation公司),DOA-P504-BN固相萃取仪(美国Supelco公司),KQ250B超声波清洗器(昆山市超声仪器有限公司),Turbovap Ⅱ全自动浓缩工作站(英国Caliper公司),Envi-Carb固相萃取柱3 mL、1 g(美国Supelco公司),LC-NH2 固相萃取柱3 mL、1 g(美国Supelco公司)。
1.2 药品与试剂扑草净标准品:100 μg/mL(农业部环境保护科研监测所,Lot:1201);内标d14-扑草净标准品(加拿大CDNisotopes公司,Lot:Z206P5);正己烷、乙酸乙酯、乙腈、丙酮、二氯甲烷、甲醇,色谱纯(美国Tedia公司);氨水,分析纯(南京化学试剂有限公司);硫酸钠,分析纯(南京化学试剂有限公司)。
1.3 实验方法 1.3.1 样品的提取与净化样品制备 实验选用鳕鱼、草鱼、斑点叉尾鮰、克氏螯虾和紫菜这5种具有代表性及重点监测品种样品,鳕鱼、草鱼、斑点叉尾鮰,取肌肉部分,克氏螯虾去壳,取肉,用高速万能试样粉碎机打成匀浆,置于-20 ℃冰箱中冷冻贮存,测定前将其室温解冻供前处理用,紫菜样品粉碎成粉末,室温存放。
样品前处理 准确称取2.00 g混合均匀的样品于离心管中,d14-扑草净添加浓度为10.0 μg/kg,加入20 mL乙腈(紫菜样品加入50 mL),使用超声波清洗仪超声30 min,8 000 r/min离心10 min,转移提取液至60 mL浓缩玻璃瓶中。重复提取一次,合并提取液,45 ℃水浴氮气吹干,用3 mL正己烷溶解备用;使用Envi-Carb和LC-NH2 SPE小柱净化,用柱接头将活性炭小柱和氨基小柱按照从上到下的顺序接好,依次用3 mL丙酮和3 mL正己烷活化,转移备好的样品溶液至柱子中,再用3 mL正己烷清洗瓶子过柱子,过完后抽干,最后用5 mLV正己烷∶V丙酮=6∶4)混合液分两次洗脱,收集全部洗脱液至10 mL小试管中,45 ℃水浴氮气吹干,用1 mL正己烷定容,供气相色谱-串联质谱仪分析。
1.3.2 仪器分析条件色谱条件 色谱柱:TR-5MS(30 m×0.25 mm×0.25 μm);进样口温度:280 ℃;接口温度:280 ℃;柱温:采用程序升温,初温:150 ℃(0.50 min),升温速率:30 ℃/min,升温至213 ℃(0 min),再以3 ℃/min的升温速率升温至230 ℃(0 min),再以30 ℃/min的速率升温,终温:280 ℃(2 min);载气:99.999%高纯N2,流速:1.0 mL/min;进样方式:不分流进样;进样量:1 μL。
串联质谱条件 离子源:电子轰击离子源(EI源);离子源温度:220 ℃;溶剂延迟:5.0 min;灯丝电流:50 μA;多反应离子监测(SRM)。取1.0 mg/L扑草净标准溶液和d14-扑草净标准溶液在色谱条件下,用全扫描方式进行分析,根据扑草净离子和d14-扑草净离子强度大小,选定检测母离子(m/z)分别为241.2、255.2;设置3个水平的碰撞能量(5 V、10 V、15 V、)对选定的母离子进行轰击,并以子离子全扫描(Product Scan)模式监测,选择2个响应值高、质核比大的特征子离子碎片,其中响应值高的子离子确定为SRM模式下的定量离子,另一个为定性离子。
1.3.3 定量分析方法溶剂标准曲线 精确称取0.010 g d14-扑草净标准品,用正己烷定容至100 mL容量瓶中,配制成100 μg/mL 的标准储备液,4 ℃冰箱冷藏保存。使用时用正己烷稀释100 μg/mL扑草净与d14-扑草净标准溶液,配制成分别含扑草净5、10、20、50、100 ng/mL、d14-扑草净20 ng/mL的标准溶剂工作液。
基质标准曲线 分别称取5个2 g不同基质(鳕鱼、草鱼、斑点叉尾鮰、克氏螯虾、紫菜)的样品,加入5、10、20、50、100 ng的扑草净,均加入20 ng d14-扑草净,以下按“样品前处理”操作样品,制备基质标准工作液。
精密度、回收率与最低检测限 在2.00 g空白鳕鱼、草鱼、斑点叉尾鮰、克氏螯虾、紫菜样品中分别添加100、200和500 μL浓度为100 ng/mL 的扑草净标准液(添加水平分别相当于扑草净5、10、25 μg/kg),d14-扑草净添加浓度均为10.0 μg/kg,每个添加水平作6个平行,按照“方法”中进行样品前处理和色谱、质谱条件测定,溶剂标准曲线内标法定量,最后计算出扑草净的平均回收率及相对标准偏差,以分别考察方法的回收率和精密度。当样品中添加水平为5 μg/kg,按照3倍信噪比计算最低检测限,其中信噪比为扑草净定性离子中响应最低离子的信噪比。
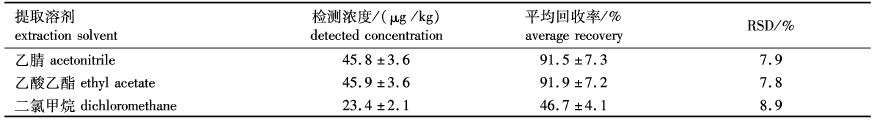
2 结果与分析 2.1 提取溶剂和提取溶剂用量的选择以鳕鱼为实验样本,扑草净添加浓度为50 μg/kg时,通过溶剂标准曲线外标法定量,比较不同提取剂的提取效率。由表1可知,乙腈、乙酸乙酯和二氯甲烷等3种溶剂对鳕鱼中扑草净提取的平均回收率为46.7%~91.9 %,乙腈、乙酸乙酯提取效果佳,因乙腈共提杂质少,故选择乙腈作为提取剂。
|
表1 提取溶剂对回收率的影响(n=3) Tab. 1 Effect of extraction solvents on recoveries (n=3) |
实验以乙腈为提取剂,通过溶剂标准曲线外标法定量,进一步考察提取剂用量对回收率的影响。由表2可知,3个体积梯度试剂用量无显著差异( P>0.05 ),所有回收率均大于90 %,乙腈20 mL萃取2次已经可以满足检测要求,因此,为减少有机溶剂的使用,本实验选择乙腈用量为20 mL×2。

|
表2 提取溶剂用量对回收率的影响 (n=3) Tab. 2 Effect of extraction solvent quantity on recoveries (n=3) |
以鳕鱼为实验样本,扑草净添加浓度为50 μg/kg时,通过溶剂标准曲线外标法定量,比较不同固相萃取柱对回收率的影响。由表3可知,固相萃取柱Envi-Carb与LC-NH2联用的平均回收率为101.3 %,Envi-Carb与LC-SCX联用的平均回收率为49.4 %,LC-NH2与Envi-Carb联用对样品中扑草净的回收率显著高于LC-SCX与Envi-Carb联用( P<0.05 )。

|
表3 固相萃取柱对回收率的影响(n=3) Tab. 3 Effect of different SPE columns on recoveries (n=3) |
为消除样品基质效应,可采用样品基质标准曲线定量。实验比较了溶剂标准曲线和各基质(紫菜、草鱼、斑点叉尾鮰、克氏螯虾、鳕鱼)标准曲线。由表4可知,扑草净在5~100 ng/mL范围内线性关系均良好(表5),相关系数

|
表4 基质和溶剂扑草净标准曲线回归方程的比较 Tab. 4 Comparisons of the standard curves of prometryn in 5 kinds of aquatic products and solvent |
根据串联质谱条件实验得出,扑草净(m/z)质谱条件为母离子241.1、子离子184.3 、199.3,定量离子184.3,碰撞能量为10 V;内标d14-扑草净(m/z)质谱条件为母离子255.2、子离子192.3、237.5,定量离子192.3,碰撞能量为15 V。
2.5 质谱图标准溶液、鳕鱼样品空白及样品加标SRM图如图1所示。从质谱图中可以看出本检测方法能有效地分离目标物和内标物,且在目标物和内标物出峰处无杂质干扰。

|
图1 标准溶液(a)、鳕鱼空白样品(b)和加标样品(c)的SRM谱图 Fig.1 GC-MS/MS chromatograms of prometryn and d14- prometryn standards(a) ,blank cod sample (b) and cod sample with addition of standards(c) under SRM mode |
用正己烷稀释配制含扑草净5~100 μg/L以及内标d14-扑草净20 μg/L系列质量浓度的标准溶液,以标样与内标的定量目标离子峰面积比(y)对标样浓度(x)做标准曲线,得到线性回归方程y=0.060x -0.011,相关系数r2=0.999。结果显示,扑草净在5~100 ng/mL范围内线性关系良好。当样品中添加扑草净水平为5.0 μg/kg时,以3倍信噪比确定扑草净的检出限为0.5 μg/kg,与2014 年8 月公布的国家标准[22]相比,检出限均低于食品中农药的最大残留限量,说明此方法已达到了国家限量检出要求。且与文献报道[23, 24]值相比,也具有较低的检出限。
2.7 回收率和精密度挑选阴性的水产品作为空白样品基质,分别在5.0、10.0及25.0 μg /kg共3 个水平进行扑草净加标实验,每个水平设置6个加标平行样,结果如表1所示。分析各组的添加回收率和相对偏差(RSD)可知,内标法测定的扑草净的平均回收率在82.0%~111.2 %之间,精密度RSD在1.2%~6.0 %之间。说明该方法具有较好重复性; 同时,针对不同基质具有方法简单、快速的优点,回收率和精密度均能满足水产品中扑草净残留快速检测的要求。内标法定量避免了外标法对前处理的操作过程要求严格,回收率和RSD值变化范围增大的现象,进一步增强了检测的稳定性。

|
表5 回收率与精密度(n=6) Tab. 5 Average recovery and precisions of prometryn(n=6) |
本研究以紫菜为例,对江苏沿海的紫菜进行了抽样检测,通过对21个紫菜样品进行测定,扑草净检出率为14.3%,含量在4.7~7.6 μg /kg之间。
3 讨论 3.1 提取溶剂和提取溶剂用量的选择本文考察了乙腈、乙酸乙酯和二氯甲烷等三种溶剂对鳕鱼中扑草净的提取效率,溶剂标准曲线外标法定量的结果表明(表1),乙腈和乙酸乙酯的提取效果较好,在添加浓度为50 μg/kg时,回收率均在90 %以上。但基质空白实验发现,乙酸乙酯萃取出的样品中油脂类杂质较多,而乙腈对脂肪和色素的溶解性较差,共提杂质少,通过固相萃取柱后能基本上消除基质干扰,减少对仪器与色谱柱的污染,效果理想。同时,实验考察了乙腈提取紫菜、草鱼、斑点叉尾鮰、克氏螯虾中扑草净残留的效果,回收率在88.5%~95.6 %。因此在保证目标物提取效率的前提下采用乙腈作为提取剂,这与其他文献的报道结果一致[3, 4, 11, 12, 13]。
通过比较,实验选择40 mL乙腈作为提取剂。但对于干紫菜样品,由于其密度小,药物提取步骤与鱼虾略有不同,一是在溶剂量使用上,2 g紫菜体积明显比鱼虾类样品体积大,为了使溶剂将样品浸没,达到良好的提取效果,实验选择用50 mL的乙腈溶剂两次超声提取;二是在转移提取液时,应采用过滤或吸管滴入的方式,防止紫菜样混入浓缩瓶中。
3.2 净化柱的选择水产品中含有较多的杂质,如脂肪、蛋白质、色素和其他营养成分等,如紫菜样品中含有较多色素和其他诸如胡萝卜素、蛋白质、糖等有机营养成分以及其他大量杂质[3],斑点叉尾鮰、草鱼等样品中含有大量脂肪、蛋白质和有机酸类物质,部分鱼虾品种粘度大、含大量色素,这些物质如果在上机前没有得到有效去除,就会对仪器造成污染,且难以定性和定量。固相萃取净化是常用的方法,操作简便,效果好。本文比较了Envi-Carb与LC-NH2联用和Envi-Carb与LC-SCX联用的净化效果以及对扑草净回收率的影响,在鳕鱼样品提取液中添加50 μg/kg浓度的扑草净,实验数据(表3)表明,LC-NH2与Envi-Carb联用对样品中扑草净的回收率显著高于LC-SCX与Envi-Carb联用( P<0.05 ),同时进一步试验表明采用Envi-Card串联LC-NH2 固相萃取小柱对不同种类的水产样品均有良好的净化效果。Envi-Card小柱具有极强吸附性,可从非极性溶液中吸附各种色素,LC-NH2小柱是不规则硅胶粒,当用非极性溶剂进行处理时,它能与带有-OH、-NH或-SH官能团的分子形成氢键,而扑草净在分子结构上含有一个1,3,5三嗪和两个-NH基团,因此,LC-NH2不仅能有效去除较多蛋白质、脂类及有机酸等杂质,又不会造成目标物损失,且与Envi-Carb+LC-SCX固相萃取柱比较,操作简便易行,中间损失少。因此本文选择Envi-Card串联LC-NH2固相萃取柱作为样品净化柱。
| [1] | 李竺,陈玲,郜洪文,等.固相萃取-高效液相色谱法测定环境水样中的三嗪类化合物[J].色谱, 2006, 24(3):267-270.LI Z, CHEN L, GAO H W, et al. Determination of triazines in surface water using solid phase extraction-high performance liquid chromatography[J]. Chinese Journal of Chromatography, 2006, 24(3):267-270. |
| [2] | 宗万里,刘新才,宋业萍.液相色谱-串联质谱法测定花色蛤中扑草净残留量[J].农产品质量与安全, 2014, (4):52-55.ZONG W L, LIU X C, SONG Y P. HPLC-MS/MS determination of prometryne residue in color clam[J]. Quality and Safety of Agro-Products, 2014, (4):52-55. |
| [3] | 沈伟健,杨雯筌,赵增运,等.气相色谱-质谱联用法测定紫菜中扑草净的残留量[J].分析试验室, 2008, 27(2):84-87.SHEN W J, YANG W Q, ZHAO Z Y, et al. Determination of prometryne in seaweed by gas chromatography-mass spectrometry[J]. Chinese Journal of Analysis Laboratory, 2008, 27(2):84-87. |
| [4] | 刘栋,李蓉娟,陈晓东,等. GPC-HPLC-MS/MS法检测贝类中扑草净残留[J].食品研究与开发, 2013, 34(24):205-208.LIU D, LI R J, CHEN X D, et al. Determination of prometryn residues in shellfish by gel permeation chromatography purification-high performance liquid chromatography-tandem mass spectrometry[J]. Food Research and Development, 2013, 34(24):205-208. |
| [5] | 李卫建,聂志强,蔡彦明,等.气相色谱法同时测定土壤中13中三嗪类除草剂残留量的方法研究[J].农业环境科学学报, 2009, 28(1):211-215.LI W J, NIE Z Q, CAI Y M, et al. Simultaneous determination of residues of 13 varieties of triazine herbicide in soil by gas chromatography[J]. Journal of Agro-Environment Science, 2009, 28(1):211-215. |
| [6] | ZHOU J H, CHEN J D, CHENG Y H, et al. Determination of Prometryne in water and soil by HPLC-UV using cloud-point extraction[J]. Talanta, 2009, 79(2):189-193. |
| [7] | CHENG J H, LIU M, ZHANG X Y, et al. Determination of triazine herbicides in sheep liver by microwave-assisted extraction and high performance liquid chromatography[J]. Analytica Chimica Acta, 2007, 590(1):34-39. |
| [8] | SEE H H, SANAGI M M, IBRAHIM W A W, et al. Determination of triazine herbicides using membrane-protected carbon nanotubes solid phase membrane tip extraction prior to micro-liquid chromatography[J]. Journal of Chromatography A, 2010, 1217(11):1767-1772. |
| [9] | 伊纪峰,胡传明,李海波,等.紫菜中扑草净残留的快速检测方法[J].江苏农业科学, 2009, (1):291-292.YI J F, HU C M, LI H B, et al. Rapid determination of prometryne in seaweed[J]. Jiangsu Agricultural Sciences, 2009, (1):291-292. |
| [10] | 曹军,尹小乐,布文安,等.环境中除草剂扑草净残留分析方法的研究[J].分析科学学报, 2007, 23(4):397-400.CAO J, YIN X L, BU W A, et al. Study on the determination of prometryne residues in environment[J]. Journal of Analytical Science, 2007, 23(4):397-400. |
| [11] | 周明莹,曲克明,陈碧鹃,等.紫菜中六六六、滴滴涕和扑草净的检测[J].渔业科学进展, 2014, 35(6):128-132.ZHOU M Y, QU K M, CHEN B J, et al. Residual determination method of HCHS, DDTS and prometryn in porphyra[J]. Progress in Fishery Sciences, 2014, 35(6):128-132. |
| [12] | 李淑娟,陈冬东,李晓娟,等.气相色谱-质谱法测定食品中扑草净的残留量.中国卫生检验杂志, 2007, 17(12):2138-2140.LI S J, CHEN D D, LI X J, et al. Determination of prometryne residue in foods by GC-MS[J]. Chinese Journal of Health Laboratory Technology, 2007, 17(12):2138-2140. |
| [13] | 曾正宏,陈勇,杨瑞章,等.分散固相萃取-气相色谱-质谱法测定水果和蔬菜中扑草净和禾草丹残留量[J].理化检验(化学分册), 2010, 46(9):1046-1048.ZENG Z H, CHEN Y, YANG R Z, et al. GC-MS determination of residual amounts of prometryne and thioencarb in fruits and vegetables with dispersive solid phase extraction[J]. Physical Testing and Chemical Analysis Part B:Chemical Analysis, 2010, 46(9):1046-1048. |
| [14] | BAGHERI H, KHALILIAN F. Immersed solvent microextraction and gas chromatography-mass spectrometric detection of s-triazine herbicides in aquatic media[J]. Analytica Chimica Acta, 2005, 537(1/2):81-87. |
| [15] | NAGARAJU D, HUANG S D. Determination of triazine herbicides in aqueous samples by dispersive liquid-liquid microextraction with gas chromatography-ion trap mass spectrometry[J]. Journal of Chromatography A, 2007, 1161(1/2):89-97. |
| [16] | 刘峰,金海涛,马文琼,等. UPLC-MS/MS法检测稻米及土壤中扑草净除草剂的残留量[J].农药科学与管理, 2014, 35(4):49-52.LIU F, JIN H T, MA W Q, et al. Determination of prometryn residues in rice and soil by UPLC-MS/MS[J]. Pesticide Science and Administration, 2014, 35(4):49-52. |
| [17] | 李育左,张睿,王海涛,等.高效液相色谱串联质谱法对大米中26种三嗪类除草剂多残留的检测[J].分析测试学报, 2009, 28(3):315-318.LI Y Z, ZHANG R, WANG H T, et al. Determination of multi-residues of triazine herbicides residues in rice by HPLC-tandem MS/MS[J]. Journal of Instrumental Analysis, 2009, 28(3):315-318. |
| [18] | 冯蕾,胡晓芳,许书军,等. SPE-UPLC-MS法同时检测乳制品中11种三嗪类除草剂的残留[J].上海交通大学学报(农业科学版), 2011, 29(2):88-94.FENG L, HU X F, XU S J, et al. Multiresidue determination of 11 triazine herbicides in milk by SPE-UPLC-MS[J]. Journal of Shanghai Jiaotong University (Agricultural Science), 2011, 29(2):88-94. |
| [19] | BICHON E, DUPUIS M, BIZEC B L, et al. LC-ESI-MS/MS determination of phenylurea and triazine herbicides and their dealkylated degradation products in oysters[J]. Journal of Chromatography B, 2006, 838(2):96-106. |
| [20] | 李伶伶,张琳,那宇,等.除草剂扑草净胶体金免疫层析检测试纸条的研制[J].现代食品科技, 2012, 28(4):424-426, 390.LI L L, ZHANG L, NA Y, et al. Development of a colloidal gold immunochromatographic strip for rapid detection of herbicide prometryn[J]. Modern Food Science and Technology, 2012, 28(4):424-426, 390. |
| [21] | 蒋银土,朱岩,郭莹莹,等.离子色谱法测定三嗪类除草剂[J].浙江大学学报(理学报), 2001, 28(5):533-536.JIANG Y T, ZHU Y, GUO Y Y, et al. Determination of triazine herbicides by ion chromatography with UV detection[J]. Journal of Zhejiang University (Science Edition), 2001, 28(5):533-536. |
| [22] | GB 2763-2014,食品安全国家标准食品中农药最大残留限[S]. 2014.GB 2763-2014, National food safety standard-Maximum residue limits for pesticides in food[S]. 2014. |
| [23] | 孙晓杰,郭萌萌,王苏玥,等.分散固相萃取-在线凝胶色谱-气相色谱-质谱联用法快速检测紫菜中的农药多残留[J].色谱, 2014, 32(10):1124-1130.SUN X J, GUO M M, WANG S Y, et al. Rapid determination of pesticide multiresidues in porphyra by dispersive solid-phase extraction coupled with online gel permeation chromatography-gas chromatography-mass spectrometry[J]. Chinese Journal of Chromatography, 2014, 32(10):1124-1130. |
| [24] | 张华威,刘慧慧,田秀慧,等.凝胶色谱-固相萃取-气相色谱-串联质谱法测定水产品中9种三嗪类除草剂[J].质谱学报, 2015, 36(2):177-184.ZHANG H W, LIU H H, TIAN X H, et al. Determinatioan of 9 triazine herbicides in aquatic products by GPC-SPE-GC-MS/MS[J]. Journal of Chinese Mass Spectrometry Society, 2015, 36(2):177-184. |
2. Freshwater Fishery Research Institute of Jiangsu Province, Nanjing 210017, Jiangsu, China;
3. Fishery Products Quality Supervision and Testing Center(Nanjing), Ministry of Agriculture, Nanjing 210017, Jiangsu, China;
4. Institute of Food Science and Technology, Chinese Academy of Agricultural Sciences, Beijing 100193, China
 2015, Vol. 24
2015, Vol. 24


