海藻(Sargassum)和昆布(Laminaria thallus)是一对药食两用的传统中药药对,来源丰富,历史悠久,疗效明确。海藻性味苦、咸、寒,具有清热消痰,化溜利水之效,为治疗瘿瘤瘰疬常用之药。昆布性味咸、寒,其软坚散结清热化痰之力较海藻为强,常用于噎膈、水肿、带下等治疗。两药均归肝、胃、肾经,配伍合用,消痰散结、化瘤之力将增强,临床上主治瘰疬痰核,瘿瘤肿块等症[1]。
研究发现海藻/昆布的水溶性多糖能提高机体免疫力,具有抗肿瘤、抗病毒、抗血栓和降血脂等多种生理功效[2, 3]。但大剂量给药海藻/昆布水溶性多糖的毒副作用以及肝微粒体药物代谢酶(简称肝药酶)关联的药物-药物相互作用研究相对较少。为此,本研究从海藻/昆布药对传统临床应用的角度出发,以海藻/昆布药对水溶性粗多糖(简称海藻/昆布粗多糖)为对象,在优化海藻/昆布药对配方下的粗多糖提取条件的基础上,评价了海藻/昆布粗多糖在大鼠体内的经口亚急性毒性,考察了海藻/昆布粗多糖对大鼠体内3种肝药酶活性的影响,为临床安全合理用药提供参考。
1 材料与方法 1.1 实验仪器仪器主要有:高效液相色谱系统(Dionex U300,美国Dionex公司);生物组织包埋机(KD-BM,浙江省金华市科迪仪器设备有限公司);脱水机(JJ-12J,武汉俊杰电子有限公司);冻台(JB-L5,武汉俊杰电子有限公司);生物组织切片机(RM2016,上海徕卡仪器有限公司);摊片机(KD-P,浙江省金华市科迪仪器设备有限公司);烘箱(DGX-9003B,上海福玛实验设备有限公司);电热恒温水浴锅(DK-S22,上海精宏实验设备有限公司);台式高速冷冻离心机(JOUAN CR3i,美国Thermo Fisher公司);三目生物显微镜数码成像系统(CX31-TR-K10,日本奥林巴斯)。
1.2 试剂与药品主要试剂与药品:海藻、昆布中药饮片(福建产地,批号:131001,执行标准:中国药典2010版)购自上海雷允上药房;甲醛(分析纯)、无水乙醇(分析纯)、磷酸二氢钠(分析纯)、磷酸氢二钠(分析纯)、二甲苯(分析纯) 、切片石蜡(熔点56~58 ℃) 、中性树胶购自国药集团化学试剂有限公司;Mayer's苏木素染液和伊红染液购自北京诺博莱德科技有限公司;标准品非娜西丁、对乙酰氨基酚、咪达唑仑、1-羟基咪达唑仑、氯唑沙宗、6-羟基氯唑沙宗购自西格玛奥德里奇(上海)贸易有限公司。
1.3 动物SD 大鼠,清洁级,雌雄各半,5~6周龄,体质量160~180 g,购自上海斯莱克实验动物有限责任公司,合格证号2007000565992。
1.4 试验方法 1.4.1 海藻/昆布粗多糖制备称取海藻和昆布中药饮片适量,按1∶1比例粉碎混匀后加入12倍比重的去离子水浸泡过夜,待其充分溶胀后,于90 ℃水浴回流提取两次,每次提取1 h,二次提取时加入10比重去离子水。提取后合并滤液经减压浓缩至原体积1/10,离心取上清后缓慢加入5倍体积95%乙醇,静置醇沉过夜,抽滤沉淀于50 ℃鼓风干燥得海藻/昆布粗多糖制品[4, 5]。
1.4.2 实验设计选取清洁级SD大鼠18只,雌雄兼顾,适应饲养环境1周后,随机分为3组,即粗多糖低剂量组、高剂量组和空白对照组。低剂量组经口灌胃染毒[10.8 g/(kg·d)]的粗多糖制品;高剂量组经口灌胃染毒[86.4 g/(kg·d)]的粗多糖制品;空白对照组经口灌胃染毒同等剂量的生理盐水。
受试动物连续经口染毒2周,染毒期间定期观察动物的体重、饮食、行为、外观、排泄物等情况是否有异常,末次染毒48 h后测定凝血时间并麻醉处死,之后迅速剪开腹腔,采集主要脏器心、肝、脾、肺、肾浸没于4%多聚甲醛中,固定24 h后常规石蜡包埋切片,切片经二甲苯、梯度乙醇脱腊、HE染色封片[6],光镜下观察组织显微结构的病理变化。
1.4.3 肝药酶活性测定给药结束后麻醉处死动物,收集部分肝脏以钙离子沉淀法制备肝微粒体[7]。建立肝微粒体体外温孵体系:在200 μL的孵化体系中分别加入肝微粒体蛋白0.5 mg/mL,NADPH 1.0 mmol/L,MgCl2 10.0 mmol/L,KCl 10.0 mmol/L,探针底物(非那西丁10.0 μg/mL或氯唑沙宗5 μg/mL或咪达唑仑5 μg/mL)。反应体系于37 ℃水浴5 min,加入NADPH启动反应,继续温孵30 min后加入200 μL冰甲醇终止反应,加入20 μL内标溶液和1.8 mL乙酸乙酯进行液液萃取,萃取液于30 ℃水浴下氮气流吹干,200 μL流动相复溶,13 000 r/min离心10 min,取上清液20 μL进样HPLC-UV分析,峰面积内标法定量[8]。
1.4.4 色谱条件色谱柱为Diamonsil TMC18柱(150 mm×4.6 mm,5 μm);非娜西丁&对乙酰氨基酚样品色谱条件:流动相为甲醇(0.1%甲酸)(A)-水(0.1%甲酸)(C),梯度洗脱(0~5 min:18% A,5~10 min:18%~60%A,10~15 min:60% A);流速 1.0 mL/min;检测波长247 nm,柱温30 ℃;氯唑沙宗&6羟基氯唑沙宗样品色谱条件:流动相为甲醇(A)-水(B),梯度洗脱(0~10 min:37%~75% A),流速1.0 mL/min;检测波长287 nm,柱温25 ℃;咪达唑仑&1羟基咪达唑仑样品色谱条件:流动相为甲醇(A)-水(0.05%甲酸)(B)梯度洗脱(0~11 min:40%~60% A),流速1.0 mL/min;检测波长223 nm,柱温30 ℃。在该条件下,各探针底物及其代谢产物分离度>1.5,样品内源性基质不干扰出峰。
1.5 统计学分析
所有数据以均数±标准差(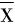 ±SD)表示,通过SPSS 19.0 软件进行独立样本t检验统计学分析,P<0.05表示具有统计学意义的显著差异,P<0.01表示具有统计学意义的极显著差异。
±SD)表示,通过SPSS 19.0 软件进行独立样本t检验统计学分析,P<0.05表示具有统计学意义的显著差异,P<0.01表示具有统计学意义的极显著差异。
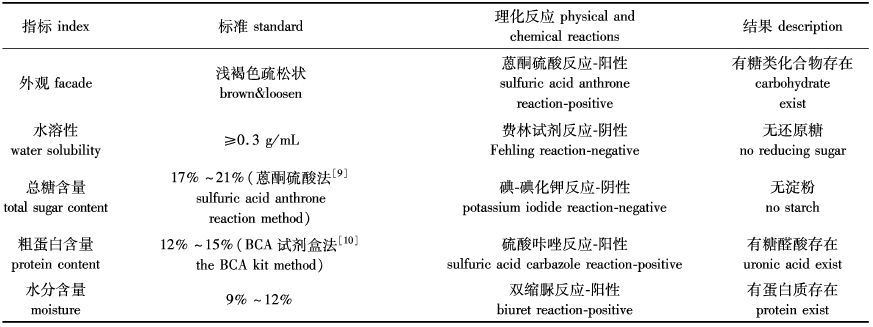
通过初步理化性质检查,将本实验条件下提取的海藻/昆布粗多糖的质量情况录入表1。
|
表1 海藻/昆布药对粗多糖的质量标准 Tab. 1 Quality standard of crude polysaccharides extracted from Sargassum&Laminaria thallus |
由表1可知,按1.4.1 项下的制备工艺所得的海藻/昆布粗多糖质地疏松,水溶性较好,以葡萄糖为标准品标定的总糖含量在20%左右,并混有糖醛酸和少量蛋白杂质。
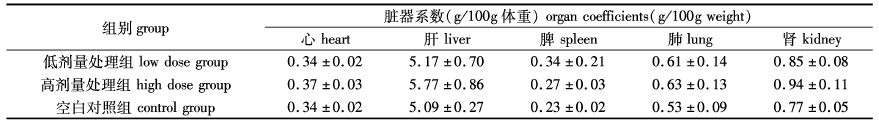
2.2 经口亚急性毒性特征通过对大鼠连续染毒期间的行为学特征及生理指标的观察和检测,我们发现多糖在经口条件下并未对大鼠的行为、外观、饮食、排泄及体重变化产生具有统计学意义的显著差异,尸检观察也未发现异常组织病变现象,各组脏器系数比较现实无显著差异(表2)。
|
表2 各组大鼠脏器系数比较(n=6) Tab. 2 Comparison of organ coefficients between all groups(n = 6) |
由表2可知,连续经口给药2周后,低剂量处理组及高剂量处理组大鼠心脏系数、肝脏系数、脾脏系数、肺脏系数、肾脏系数与空白对照组相比均无显著差异(P>0.05),可知海藻/昆布粗多糖在大剂量连续经口给药条件下对大鼠脏器系数不造成显著影响。
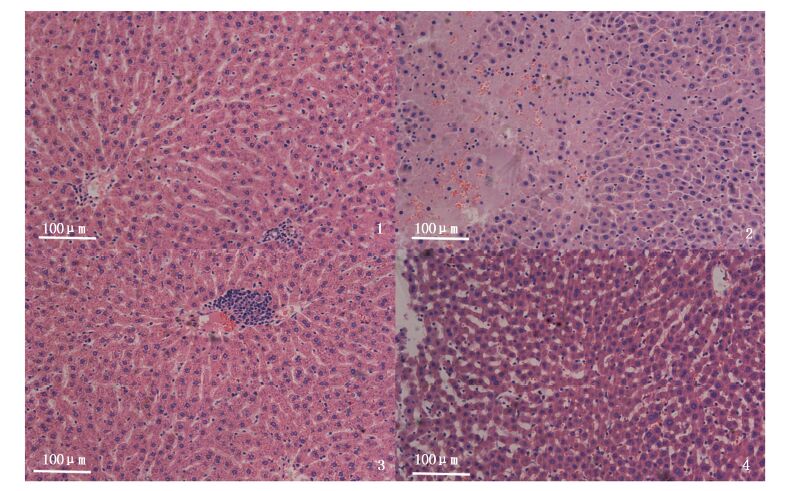
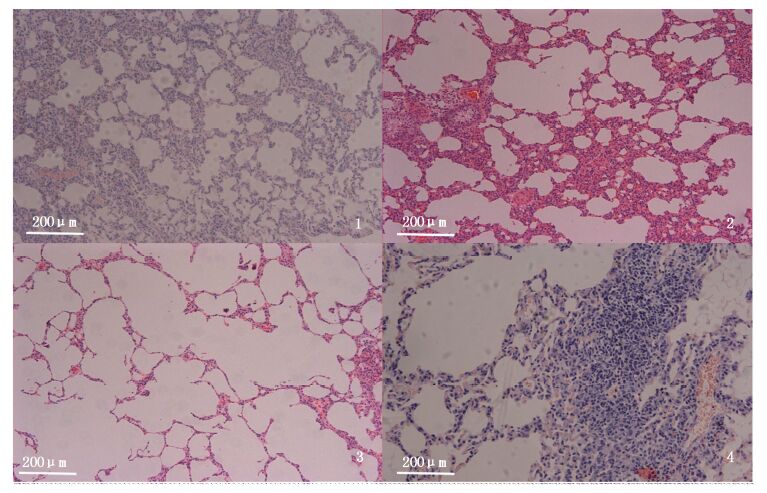
进一步镜下观察发现,染毒组大鼠的肝脏和肺脏出现了明显的形态学变化,其他脏器未见异常。低剂量处理组大鼠均出现了肝窦轻微扩张、偶见轻度水肿。高剂量处理组大鼠均出现了严重的肝脏水肿且肝窦扩张明显,并伴随有脂肪变(图版Ⅰ)。低剂量处理组大鼠均有肺泡轻度气肿,偶见间质性炎细胞浸润。高剂处理组大鼠均出现了肺泡过度膨胀(肺气肿)、支气管扩张、肺泡隔增宽、肺间质有炎细胞浸润(以淋巴细胞及中性粒细胞为主)、气管血管周围肺小叶有间质性炎症(图版Ⅱ)。
|
图版Ⅰ
肝脏组织病变光镜图(HE×200) 1.空白对照组大鼠肝脏组织切片,肝实质细胞呈多边形,体积较大,界限清晰; 2.高剂量处理组大鼠肝脏组织切片,左侧大片水肿; 3.高剂量处理组大鼠肝脏组织切片,汇管区有炎细胞浸润; 4.高剂量处理组大鼠肝脏组织切片,肝窦扩张并伴随脂肪变。 PlateⅠ Comparisons of vessel fishing status derived from the records between Beidou and GPS 1. Liver section from control group,normal volume and clear boundaries; 2. Liver section from High dose group,obvious cellular edema in the left side; 3. Liver section from High dose group,portal area with inflammatory cells infiltration; 4. Liver section from High dose group,obvious fatty changes. |
|
图版Ⅱ
肺脏组织病变光镜图(HE×100) 1.空白对照组大鼠肺脏组织切片; 2.低剂量处理组大鼠肺脏组织切片,可见肺泡隔有轻微增宽; 3.高剂量处理组大鼠肺组织切片,可见肺泡急剧膨胀(肺气肿); 4.高剂量处理组大鼠肺组织切片,可见肺泡隔增宽,间质有大量炎细胞浸润(以淋巴细胞及中性粒细胞为主)。 PlateⅡ Lesions diagram of lung sections (HE staining) 1. Lung section form control group; 2. Lung section form low dose group,the alveolar septa was in width; 3. Lung section form high dose group,obvious pulmonary emphysema; 4. Lung section form high dose group,inflammatory cell infiltration and interstitial pneumonia. |
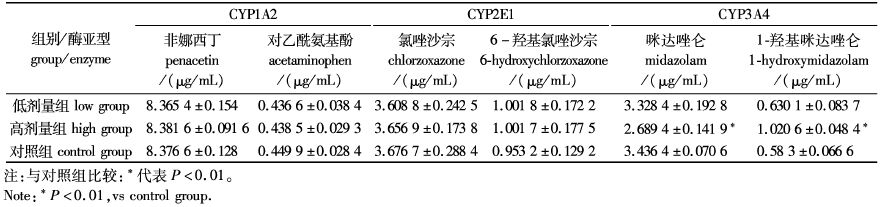
通过建立肝微粒体体外温孵体系,对所制备的大鼠肝微粒CYP450酶在该体系下对CYP1A2、CYP2E1和CYP3A4 3种特异性探针底物的代谢情况进行研究,具体液体分析结果见表3。
|
表3 SD大鼠肝微粒体各代谢酶亚型活性数据比较(n=6) Tab. 3 Subtype activity of hepatic microsomal drug-metabolizing enzymes in SD rats (n = 6) |
由表3可知,在低剂量经口给药条件下,肝微粒体代谢酶亚型CYP1A2、CYP2E1 和CYP3A4 各探针药物降解剩余量和生成的代谢产物量与对照组相比差异无统计学意义;在高剂量经口给药条件下,肝微粒体代谢酶亚型CYP1A2 和CYP2E1 各探针药物降解剩余量和生成的代谢产物量与对照组相比无显著差异,但CYP3A4 探针药物降解剩余量和生成的代谢产物量与对照组相比差异有极显著(P<0.01),提示高剂量下大鼠肝微粒体代谢酶CYP3A4活性被显著提升,推测海藻/昆布粗多糖对肝药酶CYP3A4具有潜在诱导性。
3 讨论本研究结合海藻/昆布药对的古方用量及中国药典中一般人体的推荐剂量,最终选择海藻/昆布药对的最大古方剂量为低剂量,其8倍剂量为高剂量(分别约合中国药典剂量的7倍和56倍),按体表面积换算法[11]折算,得到大鼠的等效剂量[10.8 g/(kg·d)]和[86.4 g/(kg·d)](相对原生药材量)。该给药方案较好的模拟了临床上可能的高剂量使用情况,符合亚急性毒性考察的标准。
试验结果表明,各组大鼠在给药后2周内未见死亡病例或明显的中毒症状,各受试组动物的体重和摄食变化不显著,各受试组动物的外观、行为和生理体征正常,但是肝脏组织和肺脏组织的显微结构形态均发生了改变。
肝脏是机体内最大的腺体,肝细胞富含线粒体、溶酶体和过氧化物酶体、以及糖原、脂滴、色素等内含物,其对不同化学物质损伤的敏感性往往各不相同[12]。研究结果表明随着给药剂量的增大,高剂量处理组肝组织有严重的水肿和脂肪变,这可能与药物引起细胞液体和离子内稳态变化的损伤以及改变肝细胞质内脂肪酸含量的分布有关。于此同时,随着给药剂量的增大,高剂量多糖的摄入还引发了大鼠肺组织的气肿和间质性炎症,这可能与肺脏组织疏松、纤薄、血流丰富、物质交换频繁有关。多糖吸收代谢过程中产生的氧自由基,以及大分子片段诱发的肺部变态反应均可能是诱发肺部慢性炎症的原因。若此类慢性炎症反复长期发作可进一步诱发肺组织胶原蛋白的合成而引起纤维化。因此,临床用药时需密切关注由于过量使用多糖而产生的肝脏、肺脏蓄积毒性。
肝药酶的诱导或抑制是临床用药时产生药物-药物相互作用的主要因素之一[13]。本研究结果表明海藻/昆布粗多糖可能是CYP3A4酶的潜在诱导剂,在高剂量经口给药下可能会引起有临床意义的CYP3A4酶诱导现象发生并阻碍经由该亚型酶特异性代谢药物的治疗效果。由于CYP3A4亚型酶参与介导了50%~60%临床常用治疗药物的代谢,这就意味着在与中药海藻和昆布联合用药时(特别是高剂量下)需密切关注其潜在的药物相互作用影响。
| [1] | ZHA X Q, LU C Q, CUI S H, et al. Structural identification and immunostimulating activity of a Laminaria japonica polysaccharide[J]. International Journal of Biological Macromolecules, 2015, 78:429-438. |
| [2] | KALIMUTHU S, KIM S K. Anticancer effects of fucoidan[J]. Advances in Food and Nutrition Research, 2014, 72:195-213. |
| [3] | ALEKSEYENKO T V, ZHANAYEVA S Y, VENEDIKTOVA A A, et al. Antitumor and antimetastatic activity of fucoidan, a sulfated polysaccharide isolated from the Okhotsk Sea Fucus evanescens brown alga[J]. Bulletin of Experimental Biology and Medicine, 2007, 143(6):730-732. |
| [4] | 张喆迩,刘雪莲,许剑锋,等.羊栖菜硫酸多糖的提取工艺与最佳提取条件[J].食品工业科技, 2008, 29(11):192-194.ZHANG Z E, LIU X L, XU J F, et al. Optimizing extraction conditions for sulfated polysaccharides from Hizikia fusiforme[J]. Science and Technology of Food Industry, 2008, 29(11):192-194. |
| [5] | FLEITA D, EL-SAYED M, RIFAAT D. Evaluation of the antioxidant activity of enzymatically-hydrolyzed sulfated polysaccharides extracted from red algae; Pterocladia capillacea[J]. LWT-Food Science and Technology, 2015, 63(2):1236-1244. |
| [6] | LUO J X, ZHANG Y, HU X Y, et al. The effects of modified sini decoction on liver injury and regeneration in acute liver failure induced by D-galactosamine in rats[J]. Journal of Ethnopharmacology, 2015, 161:53-59. |
| [7] | 礼嵩,唐原君,何菁宇,等.注射用盐酸头孢他美对大鼠肝微粒体CYP1A2、CYP3A4和CYP2E1活性的影响[J].第二军医大学学报, 2013, 34(11):1231-1236.LI S, TANG Y J, HE J Y, et al. Effects of cefetamet hydrochloride injection on activity of CYP1A2, CYP3A4 and CYP2E1 in liver microsomes of rats[J]. Academic Journal of Second Military Medical University, 2013, 34(11):1231-1236. |
| [8] | LIN W S, ZHANG J M, LING X M, et al. Evaluation of the effect of TM208 on the activity of five cytochrome P450 enzymes using on-line solid-phase extraction HPLC-DAD:A cocktail approach[J]. Journal of Chromatography B, 2013, 923-924:29-36. |
| [9] | GRANDY A S, ERICH M S, PORTER G A. Suitability of the anthrone-sulfuric acid reagent for determining water soluble carbohydrates in soil water extracts[J]. Soil Biology and Biochemistry, 2000, 32(5):725-727. |
| [10] | 李海玲,彭书明,李凛,等. 4种常用蛋白浓度测定方法的比较[J].中国生化药物杂志, 2008, 29(4):277-278, 282.LI H L, PENG S M, LI L, et al. Studies on four conventional methods for protein determination[J]. Chinese Journal of Biochemical Pharmaceutics, 2008, 29(4):277-278, 282. |
| [11] | CAO Y, DUAN J A, GUO J M, et al. Pharmacokinetic properties of arsenic species after oral administration of Sargassum pallidum extract in rats using an HPLC-HG-AFS method[J]. Journal of Pharmaceutical and Biomedical Analysis, 2014, 96:213-219. |
| [12] | HAN S R, HAN H Y, LEE B S, et al. Toxicity assessment of Leonuri Herba aqueous extract orally administered to rats for 13 consecutive weeks[J]. Journal of Ethnopharmacology, 2013, 149(1):371-376. |
| [13] | LUO G, GUENTHNER T, GAN L S, et al. CYP3A4 induction by xenobiotics:biochemistry, experimental methods and impact on drug discovery and development[J]. Current Drug Metabolism, 2004, 5(6):483-505. |
 2015, Vol. 24
2015, Vol. 24


