日本鳗鲡(Anguilla japonica)是一种典型的降海洄游性鱼类,广泛分布于东亚各国,是国际市场上十分畅销的水产品之一[1]。过度捕捞导致鳗鲡资源不断减少,且日趋严重[2]。因此需要对其进行更深入地了解和保护。但日本鳗鲡的产卵场位于西马里亚纳海岭附近,生活史复杂,很难对整个生活阶段进行跟踪调查[3]。因此,通过分析生长规律,能掌握它的生长特性,从而进行有效的管护。
有关鱼类生长规律的研究,大多数是通过von Bertalanffy生长方程[4]来拟合的,从而确定最适捕捞时间,评估鱼类资源变化情况。然而有关日本鳗鲡生长的研究大多是通过von Bertalanffy生长方程描述体长与年龄的关系,仅谢正丽等[5]对长江口日本银鳗的生长特性进行了较为深入地分析。为了研究长江中日本鳗鲡近几年的生长变化情况,我们再次对长江口降海洄游日本鳗鲡的生长特性进行分析,以期能够为长江中日本鳗鲡的资源评估和渔业管理提供有效的信息。
1 材料与方法 1.1 材料2012年10月,朔月期,气温突然下降,并伴随降雨、刮风、气压下降,日本鳗鲡开始洄游[6],在距长江入海口约162 km的靖江段(31°55′ N,120°12′ E),用张网(全长20~25 m,宽10~11 m,高4.5 m)捕捞降海洄游日本鳗鲡。
1.2 方法 1.2.1 测量及性别判断将捕获的样本活体运回实验室,用100 mg/L的丁香油酚溶液麻醉后进行形态学测量,包括体长(LT,mm)、体质量(MT,g)。然后解剖取部分性腺于Bouin’S液(饱和苦味酸水溶液 ∶30%~40%甲醛液 ∶冰醋酸 = 15 ∶5 ∶1)中固定12~24 h,制作石蜡切片并判断性别。
1.2.2年龄鉴定
取出矢耳石,用75%乙醇清洗干净后晾干,环氧树脂(奥斯邦,美国特拉华州)包埋。待完全凝固后用切割机(Dremel,美国威斯康星州)沿矢耳石横断面方向切掉多余树脂。用由粗到细的砂纸(400、1500、3000目,MATADOR,德国)进行打磨,至接近耳石核心(P)。抛光液(株式会社,日本东京)抛光后,于显微镜下拍照并鉴定年龄(T)。在照片上可以清晰地看到耳石核心及同心圆排列、明暗相间的轮纹。一条明带(颜色较浅)和一条暗带(颜色较深)组成一个生长组,即为一个年轮标志。
1.2.3 生长速度利用体长和年龄计算年平均生长速度,并计算体长和体质量关系以及von Bertalanffy生长方程[7]。
平均生长速度(Growth rate,Gr):

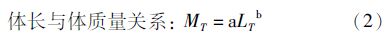
von Bertalanffy生长方程:
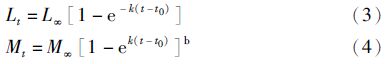
用软件Excel 2013和SPSS 22.0对相关结果进行分析,并用OriginPr分析绘图。用Mann-Whitney U-test [9]进行显著性检验。
2 结果 2.1 性比与年龄在捕获的121尾样本中,雌鳗78尾(64.5%),雄鳗43尾(35.5%)。从耳石照片上可以看到,由核心(P)向外依次为变形轮(由柳叶鳗变为玻璃鳗,MC)、幼鳗轮(当幼鳗到达河口时,EC)和年轮[10](图1)。

|
图1 日本鳗鲡矢耳石横断面结构 Fig.1 Description of structure and annuli on sagitta transverse plane of A.japonica 1 、2为年轮; P为核心; MC为变形轮; EC为幼鳗轮。 1,2 represent annulus; P represents primordium; MC represents metamorphosis check; EC represents elver check. |
经鉴定,雌鳗(3~9龄)主要集中在5、6龄,雄鳗(3~8龄)主要集中在4、5龄。通过比较,雌鳗平均年龄(5.50±1.18)显著大于雄鳗(5.05±1.23,P< 0.05)。
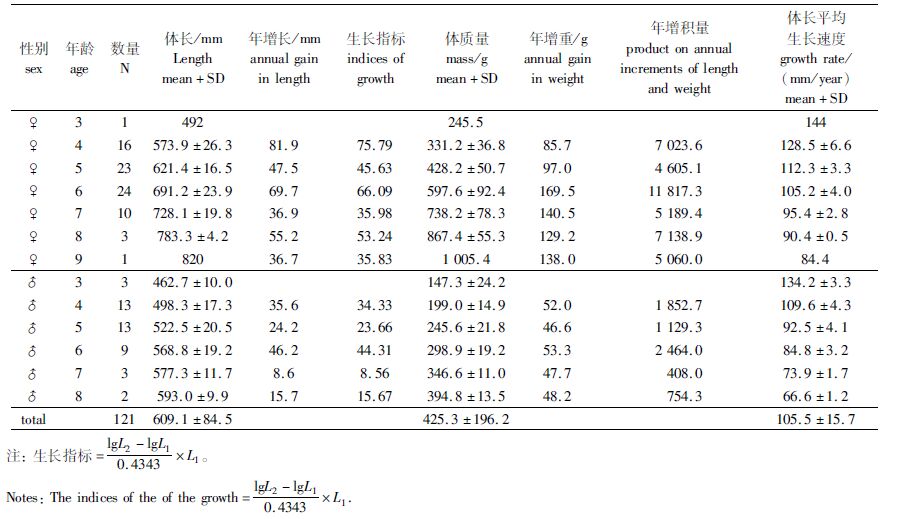
2.2 生长指标与年增积量对不同年龄鳗鲡体长、体质量进行统计发现,随着年龄的增长,体长和体质量也在生长,而平均生长速度显著下降(P< 0.05)。雌鳗平均生长速度[(110.48±12.76) mm/a]显著大于雄鳗[(96.46±16.75) mm/a]。雌鳗最大年增长和生长指标均出现在4龄,最大年增重和年増积量出现在6龄;雄鳗则均在6龄达到最大(表1)。
|
表1 长江口不同年龄降海洄游日本鳗鲡的生长特征 Tab. 1 Growth characteristics of catadromous Japanese eels collected in the Yangtze River Estuary |
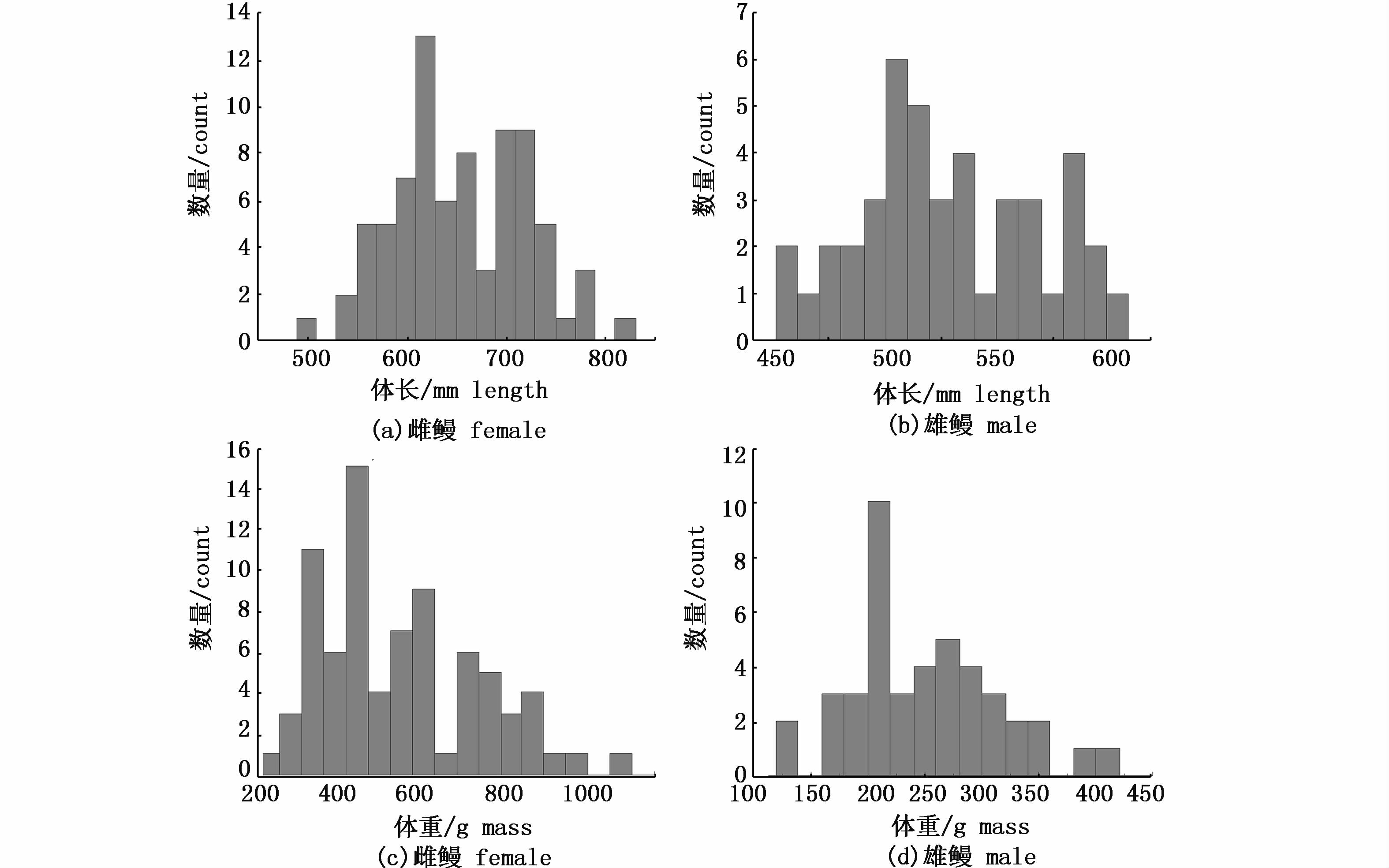
通过分析发现此批洄游鳗鲡中,雌鳗的平均体长为(653.9±67.6) mm(492~820 mm),平均体质量为(522.1±176.2) g(245.5~1 005.4 g)。与雌鳗相比,雄鳗体型显著偏小(P< 0.05),平均体长、体质量分别为(527.8±40.1) mm (455~600 mm)、(249.8±63.7) g(131.3~404.3 g)。雌鳗体长主要分布于550~750 mm,体质量集中于300~800 g。而雄鳗体长主要分布于490~580 mm,体质量集中于160~320 g(图2)。
|
图2 降海洄游日本鳗鲡体长分布(a:雌,b:雄)和体质量分布(c:雌,d,雄) Fig.2 Length (a: female,b: male) and mass (c: female,d: male) distribution of catadromous Japanese eels collected from Yangtze River Estuary |
将根据方程(2)拟合出的参数代入方程得到体长与体质量关系式:
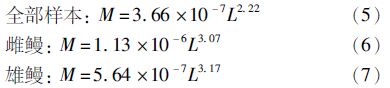
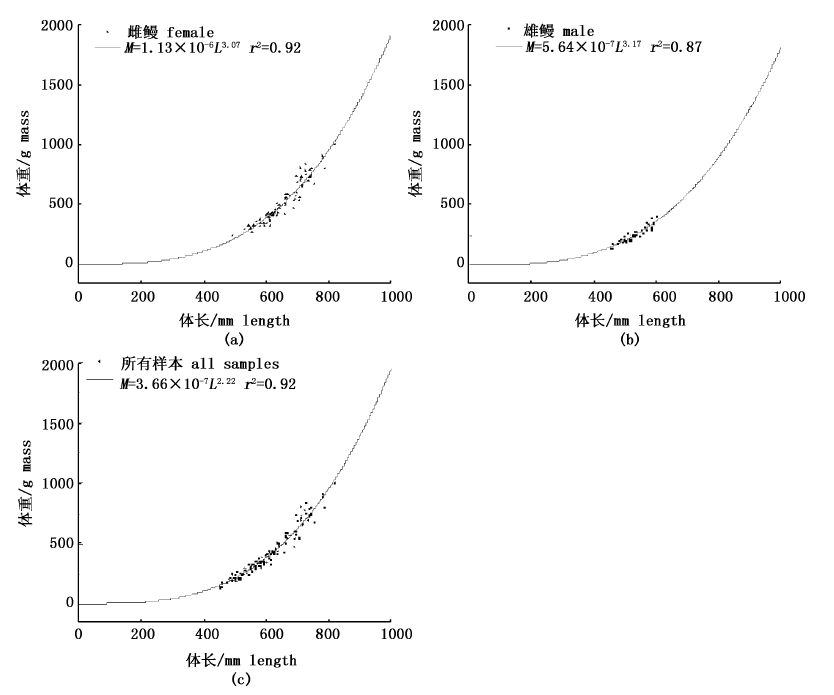
用Pauly的t检验法[11]检验体长与体质量回归方程的幂指数b与3之间的差异,雌性和雄性的t值均小于t 0.05 = 1.96,为等速生长。而总群体则有明显的差异(t = 5.541 >t0.05),为异速生长。体长体质量关系曲线见图3。
|
图3 鳗鲡体长和体质量关系曲线(a)雌鳗;(b)雄鳗;(c)所有样本 Fig.3 The relation curves between length and mass of eels (a) female,(b) male and (c) all samples |
由于雌鳗和雄鳗均为等速生长,因此可以用von Bertalanffy生长方程对其体长和年龄关系进行描述。发现雌鳗渐近体长和体质量明显大于雄鳗,得到方程结果如下:
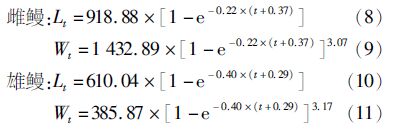
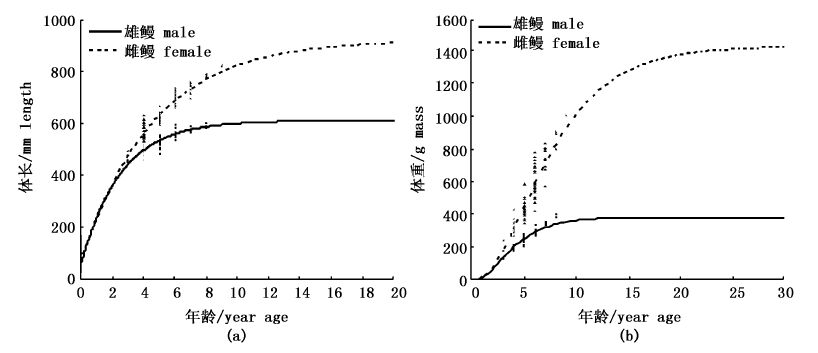
根据以上生长方程绘制出体长和体质量生长曲线,可以明显地看到随着年龄的增长,体长和体质量的增加速度逐渐减小,并趋向渐近体长和体质量。雌鳗体长、体质量要大于雄鳗,且随着年龄的增加其差异程度越来越大(图4a,b)。
|
图4 体长(a)和体质量(b)von Bertalanffy生长曲线图 Fig.4 The von Bertalanffy growth curves,length (a) and mass (b) |
用生长方程对t求一阶二阶导数,得到的生长速度和加速度方程如下,
雌鳗:

雄鳗:
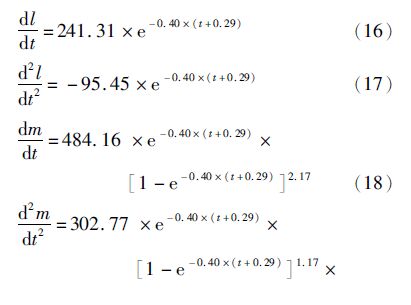
根据上述方程绘制曲线图,从图5中可以发现体长生长速度和加速度曲线平滑,不存在拐点(图5)。早期雄鳗体长生长速度比雌鳗大,在年龄为0.87时相等,此后雌鳗大于雄鳗,且雌鳗生长速度接近0时的年龄要远大于雄鳗(图5a)。雌、雄鳗鲡体长生长加速度开始都小于0,随着年龄的增大,逐渐趋于0,且在4.26龄时达到相等,在此之前雄鳗要小于雌鳗(图5b)。
|
图5 雌、雄鳗鲡体长生长速度(a)与加速度(b) Fig.5 Growth rates (a) and growth accelerations (b) of length |
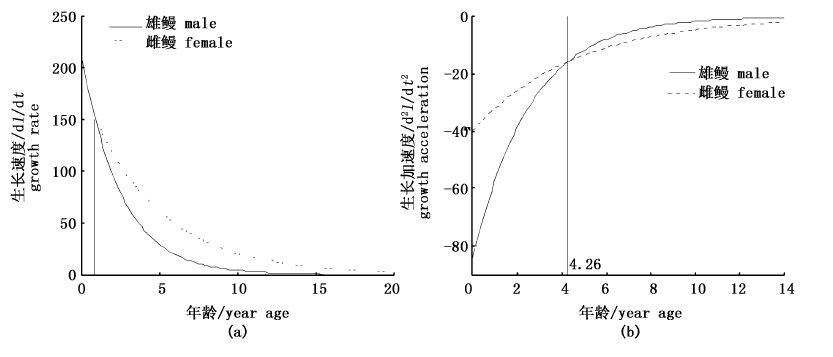
然而体质量生长速度和加速度在雌雄鳗鲡中都存在拐点,最开始生长速度和加速度都增大,然后下降。雌鳗体质量生长速度拐点出现在4.80龄,此时生长加速度减小到0,体长为624.24 mm,体质量为427.46 g;而雄鳗出现在2.63龄,此时体长为420.32 mm,体质量为115.86 g。雌、雄鳗鲡体质量生长速度最后都趋于0,而生长加速度下降到0时会继续下降,然后再上升趋向0(图6)。
|
图6 雌雄鳗鲡体质量生长速度(a)与加速度(b) Fig.6 Growth rates (a)and growth accelerations (b) of mass |
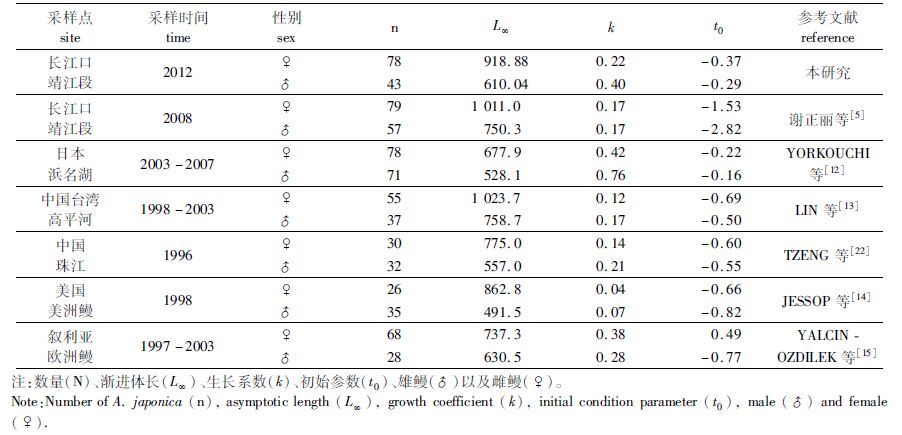
通过对比雌、雄鳗鲡生长参数,发现雌鳗渐进体长和体质量都大于雄鳗,但生长系数(k)却相反。这与其他地区降海洄游日本鳗鲡以及其他种类鳗鲡相似(表2)。然而同是长江口样本,本研究中的渐近体长却明显小于谢正丽等的研究结果[5],这可能是她在拟合von Bertalanffy生长方程时没有考虑玻璃鳗的体长。
|
表2 不同地点日本鳗鲡以及其它2种鳗鲡von Bertalanffy生长方程参数 Tab. 2 Comparison of von Bertalanffy growth parameters for A. japonica and other eels collected in different regions |
从体长和体质量生长速度曲线图可以发现,雌鳗生长速度趋于0时的年龄明显大于雄鳗,表明雌鳗比雄鳗要花更多的时间来进行生长,这同样符合HELFMAN等提出的假设[18],假设认为雄鳗会利用“时间最短化策略”尽可能早地进行繁殖洄游,而雌鳗则会利用“时间最长化策略”,以至于在产卵洄游时能获得最佳的体型大小。另外雌鳗体质量生长速度拐点年龄(4.80)要大于雄鳗(2.63)也证实了这种假设。
3.2 雌雄降海洄游的“二态现象”通过对长江口降海洄游日本鳗鲡的年龄、体长、体质量以及生长模式的综合分析,雄鳗与雌鳗相比,在较小的年龄和体型尺寸时开始洄游繁殖。这种二态性现象在鳗鲡属中普遍存在[16, 17]。为了解释二态性现象,HELFMAN等提出了一个相关的假设[18],假设认为雄鳗会利用“时间最短化策略”尽可能早地进行繁殖洄游;而雌鳗则会利用“时间最长化策略”,以至在产卵洄游时,能获得最佳的体型。利用不同生长策略是为了满足雌、雄鳗鲡在性腺发育过程中对能量的不同需求:由于精子发育所需能量相对较少,较小的体型就能满足洄游时能量的消耗;相反,雌鳗要提高繁殖力(即产卵量),就需要使其体型最大化[19]。
本研究与2008年谢正丽等对长江口降海洄游日本鳗鲡(银鳗)生长的研究结果差异不大[5],这可能是缘于两次研究时间间隔短,生活水域变化较小。与其他地区降海洄游日本鳗鲡相比,大体上本研究样本的年龄结构偏小,而体型偏大,这表明长江水域可能更适合日本鳗鲡的生长(表3)。
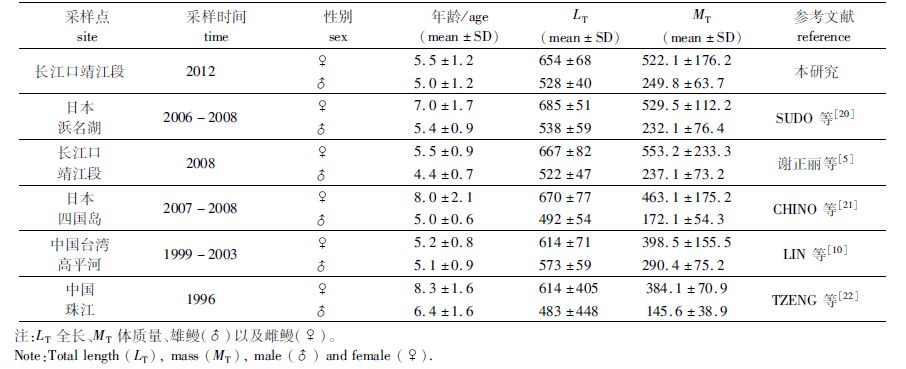
|
表3 不同地区降海洄游日本鳗鲡的性别、年龄、体长和体质量 Tab. 3 Migration age and body size of A.japonica at different areas |
从体长生长速度曲线(图4a)可以发现,鳗鲡的理论生长速度随着年龄的增大逐渐减小,这与平均生长速度(Gr)的变化相似。这种变化趋势也存在于其他的研究中,包括其他地区日本鳗鲡和鳗鲡属的其他物种[23, 24, 25]。同时可以看到,雌、雄鳗鲡的生长速度存在很大的差异,这种现象在鳗鲡中普遍存在[22, 23, 24, 25, 26, 27]。本研究中,通过von Bertalanffy生长速度方程曲线可以发现,当年龄小于0.87时,雄鳗的生长速度要大于雌鳗;0.87龄以后,雌鳗则要大于雄鳗。对于这种现象,有研究[26,28]认为生长速度快的幼鳗将发育成雄鳗,生长速度慢的将会发育成雌鳗。本研究显示当雌性和雄性幼鳗的理论体长生长速度相等时(即幼鳗到达河口时),雌雄鳗鲡的理论体长分别为219.36 mm和226.44 mm,正好是幼鳗性别分化时的体长[29, 30],表明早期生长速度快慢对鳗鲡性别的决定具有重要作用[26, 27]。
综上所述,日本鳗鲡的生长过程非常复杂,雌、雄鳗鲡的生长式型存在着很大差异。因此通过对日本鳗鲡降海洄游阶段的生长规律进行研究,分析其生长特性,能够为人们对其整个生活史的了解提供帮助,这也为日本鳗鲡的保护、人工养殖以及渔业管理提供了理论基础。
| [1] | 娄甜甜, 齐兴柱, 尹绍武, 等. 鳗鲡种质资源的研究进展[J]. 水产科学, 2007, 26(6): 366-369. LOU T T, QI X Z, YIN S W, et al. Recent research on germplasm resources in eels (Genus Anguilla)[J]. Fisheries Science, 2007, 26(6): 366-369. |
| [2] | 刘凯, 段金荣, 徐东坡, 等. 长江口日本鳗鲡苗汛特征及捕捞量时空变动[J]. 上海海洋大学学报, 2010, 19(6): 814-821. LIU K, DUAN J R, XU D P, et al. Studies on distribution characteristics and catching indexes fluctuation in fishing season of elvers of Japanese eel in the Yangtze River Estuary[J]. Journal of Shanghai Ocean University, 2010, 19(6): 814-821. |
| [3] | AOYAMA J, WATANABE S, MILLER M J, et al. Spawning sites of the Japanese eel in relation to oceanographic structure and the West Mariana ridge[J]. PloS One, 2014, 9(2): e88759. |
| [4] | VON BERTALANFFY L. A quantitative theory of organic growth (inquiries on growth laws. II)[J]. Human Biology, 1938, 10(2): 181-213. |
| [5] | 谢正丽, 郭弘艺, 唐文乔, 等. 长江口降海洄游鳗鲡的年龄结构与生长特征[J]. 水产学报, 2010, 34(2): 245-254. XIE Z L, GUO H Y, TANG W Q, et al. Age structure and growth characteristics at seaward migrating periods of Anguilla japonica in the Yangtze River Estuary[J]. Journal of Fisheries of China, 2010, 34(2): 245-254. |
| [6] | OKAMURA A, YAMADA Y, TANAKA S, et al. Atmospheric depression as the final trigger for the seaward migration of the Japanese eel Anguilla japonica[J]. Marine Ecology Progress Series, 2002, 234: 281-288. |
| [7] | VON BERTALANFFY L. Quantitative laws in metabolism and growth[J]. The Quarterly Review of Biology, 1957, 32(3): 217-231. |
| [8] | TSUKAMOTO K, OTAKE T, MOCHIOKA N, et al. Seamounts, new moon and eel spawning: The search for the spawning site of the Japanese eel[J]. Environmental Biology of Fishes, 2003, 66(3): 221-229. |
| [9] | SOKAL R R, ROHLF F J. Biometry[M]. 3rd ed. New York: WH Freman and Company, 1995. |
| [10] | LIN Y J, TZENG W N. Validation of annulus in otolith and estimation of growth rate for Japanese eel Anguilla japonica in tropical southern Taiwan[J]. Environmental Biology of Fishes, 2009, 84(1): 79-87. |
| [11] | PAULY D. Fish population dynamics in tropical waters: A manual for use with programmable calculators[M]. Manila, Philippines: International Center for Living Aquatic Resources Management, 1984. |
| [12] | YOKOUCHI K, SUDO R, KAIFU K, et al. Biological characteristics of silver-phase Japanese eels, Anguilla japonica, collected from Hamana Lake, Japan[J]. Coastal Marine Science, 2009, 33: 54-63. |
| [13] | LIN Y J, TZENG W N. Modelling the growth of Japanese eel Anguilla japonica in the lower reach of the Kao-Ping River, southern Taiwan: An information theory approach[J]. Journal of Fish Biology, 2009, 75(1): 100-112. |
| [14] | JESSOP B M, SHIAO J C, LIZUKA Y, et al. Variation in the annual growth, by sex and migration history, of silver American eels Anguilla rostrata[J]. Marine Ecology Progress Series, 2004, 272: 231-244. |
| [15] | YALCIN-OZDILEK S, GUMUS A, DEKKER W. Growth of European eel in a Turkish river at the south-eastern limit of its distribution[J]. The Bulletin of the European Ichthyological Society, 2006, 2: 55-64. |
| [16] | TODD P R. Size and age of migrating New Zealand freshwater eels (Anguilla spp.)[J]. New Zealand Journal of Marine and Freshwater Research, 1980, 14(3): 283-293. |
| [17] | LAFFAILLE P, ACOU A, GUILLOUËT J, et al. Patterns of silver eel (Anguilla anguilla L.) sex ratio in a catchment[J]. Ecology of Freshwater Fish, 2006, 15(4): 583-588. |
| [18] | HELFMAN G S, FACEY D E, HALES L S JR, et al. Reproductive ecology of the American eel[M]// DADSWELL M J, KLAUDA R L, MOFFITT C M, et al, eds. Common Strategies of Anadromous and Catadromous Fishes. Maryland: American Fisheries Society Symposium 1, 1987. |
| [19] | GROSS M R. Sunfish, salmon, and the evolution of alternative reproductive strategies and tactics in fishes[M]//POTTS G W, WOOTTON R J, eds. Fish Reproduction: Strategies and tactics. London; Academic Press, 1984: 55-75. |
| [20] | SUDO R, FUKUDA N, AOYAMA J, et al. Age and body size of Japanese eels, Anguilla japonica, at the silver-stage in the Hamana Lake system, Japan[J]. Coastal Marine Science, 2013, 36(1): 13-18. |
| [21] | CHINO N, ARAI T. Relative contribution of migratory type on the reproduction of migrating silver eels, Anguilla japonica, collected off Shikoku Island, Japan[J]. Marine Biology, 2009, 156(4): 661-668. |
| [22] | TZENG W N, LIN H R, WANG C H, et al. Differences in size and growth rates of male and female migrating Japanese eels in Pearl River, China[J]. Journal of Fish Biology, 2000, 57(5): 1245-1253. |
| [23] | POOLE W R, REYNOLDS J D. Growth rate and age at migration of Anguilla anguilla[J]. Journal of Fish Biology, 1996, 48(4): 633-642. |
| [24] | HOLMGREN K, WICKSTRÖM H, CLEVESTAM P. Sex-related growth of European eel, Anguilla anguilla, with focus on median silver eel age[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1997, 54(12): 2775-2781. |
| [25] | KOTAKE A, ARAI T, OKAMURA A, et al. Ecological aspects of the Japanese eel, Anguilla japonica, collected from coastal areas of Japan[J]. Zoological Science, 2007, 24(12): 1213-1221. |
| [26] | HOLMGREN K, MOSEGAARD H. Implications of individual growth status on the future sex of the European eel[J]. Journal of Fish Biology, 1996, 49(5): 910-925. |
| [27] | YOSHIKAWA M. Sex differences in growth rates of early life stage Japanese eels Anguilla japonica under experimental conditions[J]. Journal of Fish Biology, 2013, 83(3): 588-597. |
| [28] | DAVEY A J, JELLYMAN D J. Sex determination in freshwater eels and management options for manipulation of sex[J]. Reviews in Fish Biology and Fisheries, 2005, 15(1/2): 37-52. |
| [29] | MATSUI I. Unagigaku: Eel biology[M]. Tokyo: Kosei-sha Kosei-Kaku Press, 1972. |
| [30] | COLOMBO G, GRANDIDR G. Histological study of the development and sex differentiation of the gonad in the European eel[J]. Journal of Fish Biology, 1996, 48(3): 493-512. |
 2016, Vol. 25
2016, Vol. 25


