2. 上海海洋大学 农业部水产种质资源与利用开放实验室, 上海 201306
除了细胞种类的恢复外,真正的再生还需要新生组织的大小、模式和细胞间联系的恢复。如肌肉是重要的运动器官,其结构和功能的维持依赖于完整的神经支配[1]。新生肌肉必须与神经形成神经肌肉接头来建立运动传导通路才能实现肌肉的功能性重建[2]。
大量研究证明神经在组织器官再生过程中发挥着重要作用。蝾螈肢再生的早期,神经可影响芽基细胞的形成、增殖和维持[3]。去神经的蝾螈肢剪切后无法正常再生[4]。另外在发育和再生过程中,肌肉的成熟也需要神经的存在[5,6]。区别于四肢肌肉来源于中胚层,下颌肌肉的形成有神经嵴的参与。作为与四肢发育来源不同的下颌,其剪切后肌肉的再生是否需要神经却鲜有研究。
下颌是脊椎动物进化的重要标志,不同的下颌肌肉由不同的头部肌节起源[7],且由多种组织组成,是研究复杂结构再生的理想模型。已有研究表明斑马鱼下颌剪除前1/3可再生出完整的下颌[8]。但再生下颌的神经-肌肉是否恢复原有组织结构,神经是否参与下颌的再生尚不清楚。本实验以斑马鱼下颌为研究对象,通过组织学切片及免疫荧光技术展示了斑马鱼下颌中神经和肌肉的再生,推断神经可能参与下颌再生的调控。
1 材料与方法 1.1 实验材料本实验所用斑马鱼均为AB品系斑马鱼,养殖环境温度控制在28 ℃左右,按14 h/10 h的光暗周期,每天早上和晚上各喂一次适量的卤虫。实验选取约1龄,体长3.5~4.0 cm的成年雄性斑马鱼作为实验材料。剪去斑马鱼下颌前端约1/3处(齿骨联合处下方附近,图版Ⅰ-1),然后放回养殖系统内继续饲养,待其下颌再生。在剪切后的不同时间点取出斑马鱼,剪取再生过程中的整个斑马鱼下颌用于后续实验。对照组为未经剪切的正常斑马鱼下颌。

|
图版Ⅰ
剪切面周围的神经肌肉类型及排布
Ms. 齿骨联合;INTM-A. 颌间前肌;PR-H-V. 腹舌展肌;PR-H-D. 背舌展肌;e. 表皮;ct. 结缔组织;d. 齿骨;mc. 麦氏软骨;L虚线,参与再生的位置。1,3,5由背面到腹面的水平切,图中上端代表下颌前端;2,4,6对参与下颌再生的部位由前到后横切,图中上端代表下颌的背侧。水平切面肌肉排布的示意图,上端代表下颌前端,虚线是被遮的地方,与右侧对称的左侧背、腹舌展肌未画出。标尺是100 μm。 Ms. mandibular symphysis; INTM-A. intermandibularis Anterior muscle; PR-H-V. ventral sections of protractor hyoide muscle; PR-H-D. dorsal sections of protractor hyoide muscle; e. epiderm; ct. connective tissue; d. dentery; mc. Meckel’s cartilage; L dotted line indicates the end position of regeneration; 1,3 and 5 indicates the section that cut horizontally and top indicates the anterior of lower jaw; 2,4 and 6 indicates the section that cut transversely and the top is ventral; schematic illustration is dorsal view of the lower jaw muscles, top indicates the anterior of lower jaw ,dotted line is the part covered and the right side of the symmetrical part isn’t displayed; bar in all panels is 100 μm. PlateⅠ The constructionanl pattern of mucle in anterior of lower jaw |
剪取的斑马鱼下颌放入1.5 mL离心管中,用波恩氏液于4 ℃固定过夜,然后用70 %乙醇冲洗下颌,除去下颌上残留的固定液。再经梯度乙醇进行脱水。脱水后的下颌组织经二甲苯透明和浸蜡后,再用石蜡包埋。最后用石蜡切片机(Leica, RM2235)将下颌切成5 μm厚的连续蜡片。切好的蜡片依次粘贴于载玻片上,然后经HE (hematoxylin-eosin)染色和中性树胶封片,最后用显微镜(OLYMPUS, BH-2)观察并拍照。
1.3 冰冻切片与免疫荧光组织化学新剪取的下颌组织放入1.5 mL离心管中,经新配制的4% PFA[4.0 g多聚甲醛粉末于60 ℃加热溶解于100 mL的0.01 mol/L PBS(pH=7.4)中]4 ℃固定30 min,然后用0.01 mol/L PBS(pH=7.4)清洗10 min除去下颌组织上残余的固定液,再经梯度蔗糖充分脱水。脱水后的下颌组织用OCT(SAKURA, 4583)包埋,最后用冰冻切片机(Leica, CM1950)沿下颌水平面切成16 μm厚的连续薄片,依次粘附于载玻片上。最后保存于-80 ℃冰箱中以备后续免疫荧光组织化学实验。
用PBST (0.01 mol/L PBS+0.5 % TritonX-100)洗去OCT,再加10 %羊血清(PBST配置)室温封闭1 h,然后滴加标记轴突的一抗(Monoclonal Anti-Acetylated Tubulin antibody, Sigma, T7451; 稀释比例1∶1000)于4 ℃孵育过夜。过夜的切片室温放置30 min后,用PBST清洗未结合的一抗4次,每次10 min。滴加二抗(Alexa Fluor 568 goat anti-mouse IgG Invitrogen; 稀释比例1∶200)与乙酰胆碱受体标记(α-Bungarotoxin Alexa Fluor 488, Invitrogen, B13422; 稀释比例1∶1000)的混合液室温避光孵育1 h,然后用PBST室温清洗4次,每次10 min。最后用含DAPI的封片剂(Sigma)封片,避光4 ℃保存,用荧光倒置相差显微镜(Carl Zeiss, Axio observer. Z1)观察拍照。
2 结果 2.1 下颌剪切面的肌肉类型及排布
斑马鱼作为研究再生的主要模式生物之一,其下颌具有再生能力,将斑马鱼下颌前1/3(图版Ⅰ中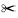 所示位置)横切,切面下的肌肉组织(图版Ⅰ中L线所示位置)作为芽基细胞的来源之一,首先降解再去分化形成芽基细胞[8]。芽基细胞具有多潜能性,能分化成各种类型的细胞结构[9]。通过芽基的增殖和分化,最后再生出下颌失去的组织结构,形成完整的下颌[8]。肌肉作为下颌中的重要组成部分,作用于下颌的提升和下降[10],它的损伤后再生对整个下颌功能的恢复意义重大。
所示位置)横切,切面下的肌肉组织(图版Ⅰ中L线所示位置)作为芽基细胞的来源之一,首先降解再去分化形成芽基细胞[8]。芽基细胞具有多潜能性,能分化成各种类型的细胞结构[9]。通过芽基的增殖和分化,最后再生出下颌失去的组织结构,形成完整的下颌[8]。肌肉作为下颌中的重要组成部分,作用于下颌的提升和下降[10],它的损伤后再生对整个下颌功能的恢复意义重大。
首先利用组织切片和HE染色,分析了斑马鱼下颌剪切后再生过程中所涉及的肌肉组织。切片的结果显示,剪除的下颌肌肉共3块,由背侧到腹侧依次为一块横向排列的颌间前肌 (intermandibularis anterior muscle,INTM-A)见图版Ⅰ-1和两块纵向排列呈对称分布的腹舌展肌(ventral sections of protractor hyoide muscle,PR-H-V),见图版Ⅰ-3。参与裂解去分化形成芽基细胞的肌肉共5块,由背侧到腹侧依次为两块纵向排列呈对称分布的背舌展肌(dorsal sections of protractor hyoidei muscle,PR-H-D),见图版Ⅰ-1,6、一块横向排列的颌间前肌(图版Ⅰ-1~3)和两块纵向排列呈对称分布的腹舌展肌(图版Ⅰ-4,5)。颌间前肌起于下颌一侧齿骨(dentary bone)止于下颌对侧齿骨,作用是连接两侧下颌骨[10]。背舌展肌起于齿骨腹正中表面止于前角舌软骨前端(anterior ceratohyal),主要用于舌骨板(hyoid bars)的提升和下颌骨(mandible)的下降,下颌骨的下降可以使嘴张开[10]。腹舌伸展肌起于齿骨腹正中表面止于角舌软骨前端(anterior ceratohyal)和腹下舌骨(ventral hypohyal),也主要用于舌骨板(hyoid bars)的提升和下颌骨(mandible)的下降[10]。肌肉的排布方式见图版Ⅰ示意图所示。
2.2 下颌肌肉的再生结合组织学切片观察,发现斑马鱼下颌组织再生过程中肌肉再生非常明显。正常下颌中,肌纤维整齐排列在下颌中(图版Ⅱ-1)。剪切后12 h的下颌,截面周围的肌肉组织裂解、肌纤维断裂、肌肉细胞核明显增多并且分布密集(图版Ⅱ-2)。剪切后2 d的下颌,截面周围的肌纤维基本消失(图版Ⅱ-3)。剪切后4 d的下颌,出现大量的成纤维细胞样梭形细胞即芽基细胞(图版Ⅱ-4,箭头所示)。剪切后5 d的下颌,芽基细胞已开始分化形成各种细胞,形成的细胞呈现出极性,按一定的方向排列(图版Ⅱ-5,三角形及箭头所示)。剪切后9 d的下颌,出现新的肌细胞(图版Ⅱ-6,箭头所示),并且肌肉细胞核数量明显减少(图版Ⅱ-6)。剪切后30 d的下颌,形成成熟的肌肉组织(图版Ⅱ-7),与正常下颌肌肉形态一致(图版Ⅱ-1)。

|
图版Ⅱ 肌肉的再生过程 PlateⅡ The regeneration process of muscles in lower jaw |
已知正常下颌前端肌肉由5块肌肉组成(图版Ⅰ-1,3,5),那么再生后的肌肉必须恢复到原来的组成模式才能证明肌肉形态结构能再生。通过对再生60 d的下颌(图版Ⅱ-8~10)观察显示,再生的肌肉由5块肌肉组成:两块纵向排列呈对称分布的背舌展肌(图版Ⅱ-8)、一块横向排列的颌间前肌(图版Ⅱ-9)和两块纵向排列呈对称分布的腹舌展肌(图版Ⅱ-10)。再生的肌肉组成与对照组的正常肌肉组成(图版Ⅰ-1,3,5)一致,表明下颌再生中肌肉组织的形态结构完全恢复。
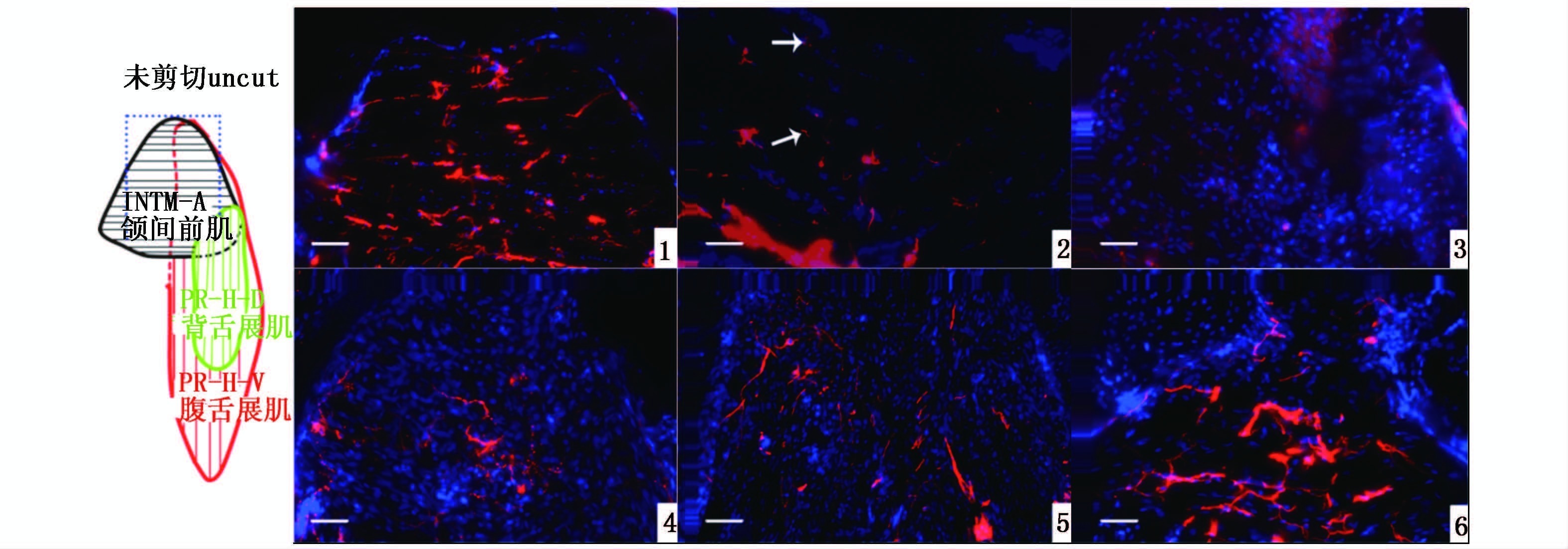
2.3 下颌神经再生的过程在胚胎发育过程中,神经可以促进其支配的肌纤维的成熟。为了展示组织再生过程中神经和肌肉的关系,我们进一步研究了斑马鱼下颌再生过程中神经的再生。免疫荧光实验结果显示正常下颌的肌肉组织上分布着大量的神经纤维,并呈线形排布,其中多数神经纤维的方向与肌纤维的方向平行(图版Ⅲ-1)。剪切后2 h的下颌神经纤维就发生明显降解,由远截面到近截面处降解逐渐严重,依次由线性逐渐降解成短线形、点状、最后完全消失。其中近截面降解最严重,基本上所有神经纤维完全降解消失,仅存在极个别的点状的信号(图版Ⅲ-2)。剪切后2 d的下颌,肌肉溶解部位内的神经纤维几乎完全降解消失(图版Ⅲ-3)。神经纤维的信号在下颌剪切后3 d开始增强,新形成的神经纤维主要出现在远截面处的中间和两侧(图版Ⅲ-4)。剪切后第5天,肌肉溶解部位的神经纤维进一步延长,并布满整个芽基 (图版Ⅲ-5)。下颌剪切后21 d的神经纤维密度明显增多,且排列方向平行于肌纤维方向(图版Ⅲ-6)。
|
图版Ⅲ
下颌神经再生过程
观察部位即示意图蓝色框内所示INTM-A部位;红色表示轴突;蓝色表示 DAPI标记的细胞核;箭表示退化呈点状的轴突;标尺是50 μm。 The observation is INTM-A that is part of the blue box in schematic illustration ; red indicates axons; blue indicates cell nucleus; arrows indicate degraded axons; scal bar is 50 μm. PlateⅢ The regeneration process of nerve in lower jaw |
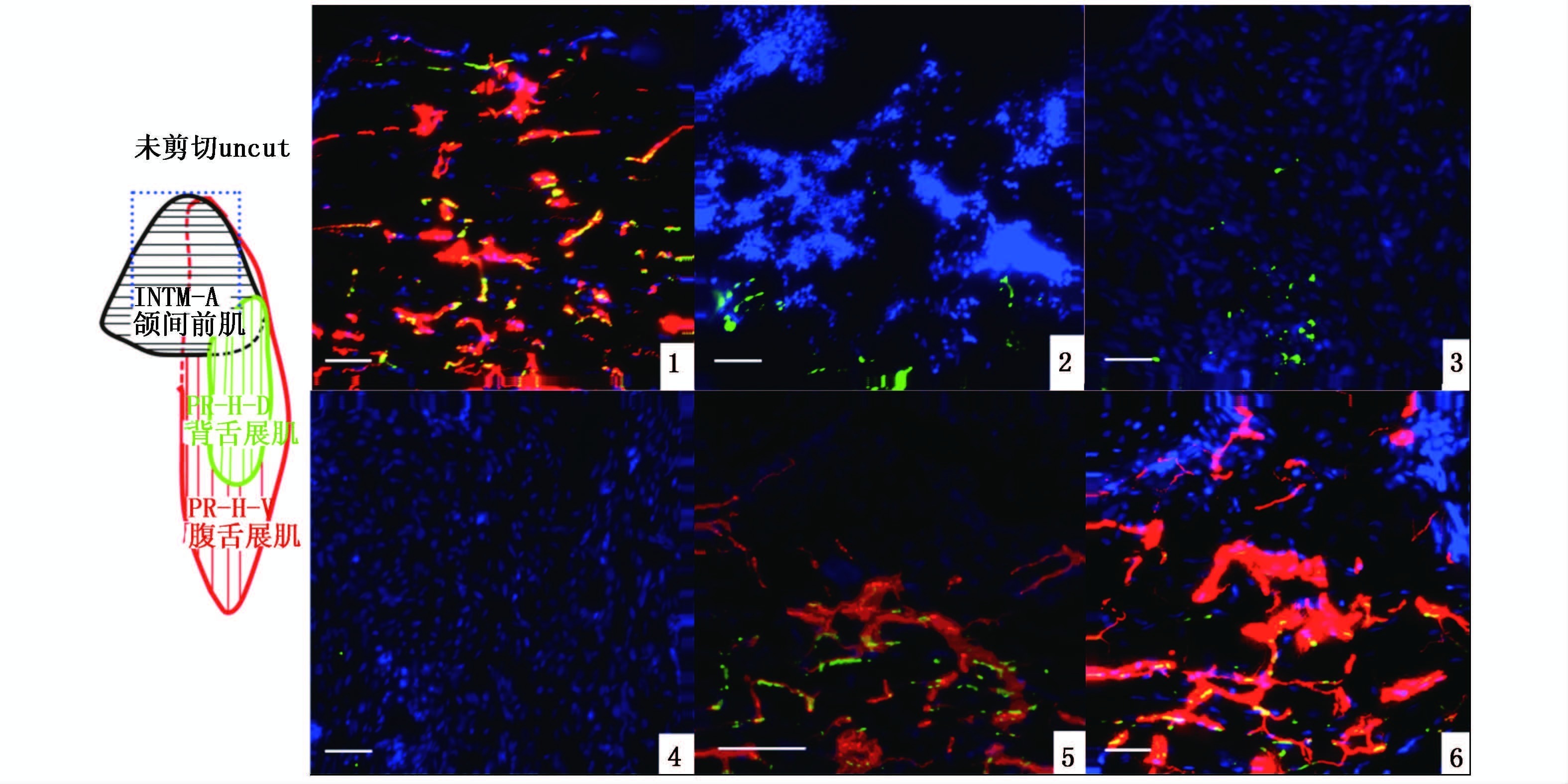
神经的神经纤维和其支配的肌肉形成一种化学突触结构神经肌肉接头。神经肌肉接头的形成是肌肉维持形态结构和发挥功能的结构基础[2]。银环蛇毒素能和乙酰胆碱受体的α亚基结合,可特异性标记乙酰胆碱受体[10]。正常下颌中,肌纤维的表面分布着大量的乙酰胆碱受体,并且乙酰胆碱受体与神经纤维共定位(图版Ⅳ-1)。这表明神经与肌肉存在大量的神经肌肉接头。剪切后5 h的下颌,乙酰胆碱受体含量明显下降,截面处乙酰胆碱受体完全降解消失,仅远截面处残余部分乙酰胆碱受体(图版Ⅳ-2)。剪切后3 d的下颌,远截面处中间残余极少量乙酰胆碱受体 (图版Ⅳ-3)。剪切后5 d的下颌,乙酰胆碱受体完全降解消失(图版Ⅳ-4)。剪切后14 d下颌的远截面处出现新的乙酰胆碱受体,形成的乙酰胆碱受体多数与神经纤维共定位 (图版Ⅳ-5)。剪切后21 d的下颌中,乙酰胆碱受体明显增多,接近对照水平。所有的乙酰胆碱受体与神经纤维共定位(图版Ⅳ-4)。这表明再生的肌纤维与再生的神经纤维间重新建立了神经肌肉接头,实现了肌肉的功能性重建。
|
图版Ⅳ
神经肌肉接头的消失和重建
红色荧光表示轴突;绿色荧光表示乙酰胆碱受体;黄色荧光是红色和绿色荧光重合,表示神经肌肉接头;蓝色荧光表示细胞核;标尺是50 μm。 Red indicates axons; green indicates acetylcholine receptors; yellow results from red and blue overlapping and indicates neuromuscular junction; blue indicates cell nucleus; scale bar is 50 μm. PlateⅣ The loss and reconstruction of neuromuscular junction |
斑马鱼下颌剪切1/3时可以实现原有肌肉模式的再生,超过1/3就不能再生出原有肌肉模式[8],超过1/3不能再生的原因有待进一步研究。发育中,下颌再生中的5块肌肉起源于颌弓和舌弓。其中,颌间前肌来源于颌弓[12]。舌展肌是一块混合肌肉,由颌间后肌后部分肌肉及舌间肌前部分肌肉发生混合而成 [10]。而颌间后肌发育来源于颌弓,舌间肌发育来源于舌弓。所以舌展肌发育来源于颌弓和舌弓[12]。
对再生的肌肉观察显示:再生完全的下颌前端肌肉组成及排列方式从背面到腹面依次是背舌展肌、颌间前肌和腹舌展肌。这与正常未剪切的下颌前端肌肉组成及排列方式完全相同。并且,再生的下颌肌肉与神经形成了神经肌肉接头。标志着肌肉维持形态结构和发挥功能的结构基础完全再生。表明斑马鱼下颌前端肌肉能实现功能性再生。
3.2 神经纤维再生与肌肉再生的关系很多脊椎和无脊椎动物不同组织的再生都需要神经的参与[13]。蝾螈的去神经肢被剪断后无法实现再生[14]。在幼蛙肢的再生过程中,神经对芽基的生长十分必要[3]。之前的研究表明:肌纤维约在剪切后第2天开始去分化,接下来芽基才开始形成[8]。我们发现下颌剪切后3 d,在肌肉溶解部位已经布满大量的再生神经纤维(图版Ⅱ和图版Ⅲ)。这表明神经的形成早于芽基的出现,这与蝾螈再生肢中的芽基形成过程相似。斑马鱼下颌芽基的形成是否也受神经的调控,还有待进一步的证明。
在胚胎发育过程中,神经纤维对肌肉细胞的成熟至关重要,可促进哺乳动物骨骼肌成肌细胞融合[15,16],维持分化肌纤维完整性及影响肌肉生长和成熟[17]的作用。有研究显示再生神经通过影响乙酰胆碱受体的排列方式恢复,进而影响肌肉的再生及功能恢复[18,19]。本实验对下颌再生的研究显示,新生神经在剪切后第3天已大量形成;肌肉的再生过程起始于第5天即芽基形成,第10天出现大量的肌细胞,在第14天左右与神经建立了直接联系形成神经肌肉接头,30 d左右形成了成熟的肌肉组织。是否说明神经参与肌肉前体细胞的再生及成熟肌肉的再生,有待进一步证明。
| [1] | 陈东辉, 王伟, 郑宏良. 失神经骨骼肌再生过程中成肌干细胞的调控[J]. 国际耳鼻咽喉头颈外科杂志, 2010, 34(3): 142-145. CHEN D H, WANG W, ZHENG H L. Muscle stem cell regulation in denervated skeletal muscle regeneration process[J]. International Journal of Otolaryngology Head Neck Surg, 2010, 34(3): 142-145. |
| [2] | 唐休发, 刘宝林, 顾晓明, 等. 骨骼肌失神经后退变与再生的形态学观察[J]. 实用口腔医学杂志, 1999, 15(1): 16-17. TANG X F, LIU B L, GU X M, et al. The morphological feature of the skeletal muscles after denervation[J]. Journal of Practical Stomatology, 1999, 15(1): 16-17. |
| [3] | SUZUKI M, SATOH A, IDE H, et al. Nerve-dependent and-independent events in blastema formation during Xenopus froglet limb regeneration[J]. Developmental Biology, 2005, 286(1): 361-375. |
| [4] | STUDISKY A N, ZHENEVSKAYA R P. Theory and practice of the auto and homotransplantations of muscles[M]. Moscow: Science Publishing House, 1967: 28. |
| [5] | SINGER M. The influence of the nerve in regeneration of the amphibian extremity[J]. The Quarterly Review of Biology, 1952, 27(2): 169-200. |
| [6] | SINGER M. A theory of the trophic nervous control of amphibian limb regeneration, including a re-evaluation of quantitative nerve requirements[M]//KIORTSIS V, TRAMPUSCH H A L. Regeneration in Animals and Related Problems. Amsterdam: North-Holland Publ. Co., 1965: 20-32. |
| [7] | SONG J, BOORD R L. Motor components of the trigeminal nerve and organization of the mandibular arch muscles in vertebrates. Phylogenetically conservative patterns and their ontogenetic basis [J]. Acta Anatomica, 1993, 148: 139-149. |
| [8] | WANG X L, HE H H, TANG W Q, et al. Two origins of blastemal progenitors define blastemal regeneration of zebrafish lower jaw[J]. PLoS One, 2012, 7(9): e45380. |
| [9] | CARLSON B M. Relationship between the tissue and epimorphic regeneration of muscles[J]. American Zoologist, 1970, 10(2): 175-186. |
| [10] | DIOGO R, HINITS Y, HUGHES S M. Development of mandibular, hyoid and hypobranchial muscles in the zebrafish: homologies and evolution of these muscles within bony fishes and tetrapods[J]. BMC Developmental Biology, 2008, 8: 24. |
| [11] | BORODINSKY L N, SPITZER N C. Activity-dependent neurotransmitter-receptor matching at the neuromuscular junction[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(1): 335-340. |
| [12] | SCHILLING T F, KIMMEL C B. Musculoskeletal patterning in the pharyngeal segments of the zebrafish embryo[J]. Development, 1997, 124(15): 2945-2960. |
| [13] | KUMAR A, BROCKES J P. Nerve dependence in tissue, organ, and appendage regeneration[J]. Trends in Neurosciences, 2012, 35(11): 691-699. |
| [14] | KUMAR A, GODWIN J W, GATES P B, et al. Molecular basis for the nerve dependence of limb regeneration in an adult vertebrate[J]. Science, 2007, 318(5851): 772-777. |
| [15] | STUDISKY A N. Dynamics of the development of myogenic tissue under conditions of explantation and transplantation[M]//ROSE G G, ed. Cinemicrography in Cell Biology. New York: Academic Press, 1963: 171-200. |
| [16] | STUDISKY A N, ZHENEVSKAYA R P, RUMYANTSEVA O. The role of neurotrophic influences upon the restitution of structure and function of regenerating muscles[M]//GUTMANN E, HNIK P, eds. The Effect of Use and Disuse in Neuromuscular Functions. Prague: Publ. House Czech. Acad. Sci, 1963: 71-81. |
| [17] | HSU L. The role of nerves in the regeneration of minced skeletal muscle in adult anurans[J]. The Anatomical Record, 1974, 179(1): 119-135. |
| [18] | 周重建, 施杞, 王拥军, 等. 大鼠腰神经根损伤后乙酰胆碱斑的实验研究[J]. 安徽医科大学学报, 2001, 36(3): 178-181. ZHOU C J, SHI Q, WANG Y J, et al. An experiment study on neuromuscular junction in the injuried lumbar nerve root of rat[J]. Acta Universitatis Medicinalis Anhui, 2001, 36(3): 178-181. |
| [19] | 郑宏良, 周水淼, 颜永碧, 等. 周围神经再生时乙酰胆碱受体免疫电镜与肌功能观察[J]. 中华显微外科杂志, 2000, 23(1): 42-45. ZHENG H L, ZHOU S M, YAN Y B, et al. Effect of neuromuscular junctional acetylcholine receptor on muscular function in peripheral nerve regeneration[J]. Chinese Journal of Microsurgery, 2000, 23(1): 42-45. |
2. Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources, Ministry of Education, Shanghai Ocean University, Shanghai 201306, China
 2016, Vol. 25
2016, Vol. 25


