2. 上海申漕特种水产开发公司, 上海 201516
罗氏沼虾(Macrobrachium rosenbergii),又名马来西亚大虾,大型淡水虾之一。我国于1976年从日本引种后,因其个体大、生长快、食性广、易养殖,养殖规模逐渐扩大,尤其是在人工育苗技术突破后,养殖业获得迅速发展,目前已成为我国最重要的养殖虾类之一[1]。但长期的近亲繁殖和小群体间近交,导致生产出的虾苗抗逆性差、成活率低,虾苗质量缺乏保证,优良苗种的供应已经成为制约罗氏沼虾养殖发展的首要因素[2-3]。影响苗种品质的因素有多种,如种质、亲本质量、产卵次数、育苗工艺、药物等[4-5]。罗氏沼虾为多次产卵虾类,产卵后的雌体,卵巢在30~40 d内再次成熟,接着又蜕壳,经交配后再次产卵,一般一年可产卵3~4次[6]。据记录,同一尾虾一年产卵7次,广东水产研究所报道,一尾雌虾在85 d中最多能产卵4次[7],生产上也是利用罗氏沼虾多次产卵特性生产虾苗,以提高亲虾利用率。目前国内外在此方面的研究多是关于繁殖期内虾类多次产卵对怀卵量、卵质量、幼体质量的影响[8-10]。而多次产卵对子代间的生长及遗传结构是否存在差异的研究尚未见报道,这对改进罗氏沼虾种苗人工繁殖工艺具有重要意义,也将对罗氏沼虾的遗传育种提供一定的理论基础和实践指导。
本实验通过孵化同一雌虾的5批次卵,开展不同产卵批次的仔虾生长对比实验,并利用微卫星标记技术对罗氏沼虾5个产卵批次子代的遗传结构进行分析,探讨多次产卵对罗氏沼虾生长及遗传结构的影响,以期为改进罗氏沼虾种苗繁殖工艺和培育罗氏沼虾优良品种提供一定的理论基础和技术指导。
1 材料与方法 1.1 实验用虾从上海申漕特种水产开发公司的上海罗氏沼虾养殖群体中挑选30尾体格健壮、未交配产卵的雌虾[L=(7.566±0.498) cm,W=(12.34±2.19) g]与30尾体格健壮的雄虾[L=(9.178±1.112) cm,W=(23.58±2.38) g]两两配对饲养,从中挑选10尾首次抱卵时间接近的雌虾以及相应配对雄虾作为实验用亲虾。
待抱卵雌虾卵块呈灰色,将其分别放入连接有水循环过滤系统的孵化桶(0.3m3)中孵化,孵化24 h后统计幼体数量并将亲虾捞回继续营养强化。待雌虾第二次交配抱卵后,重复以上过程,直至第五次。各产卵批次孵化桶出现仔虾4 d后结束育苗,淡化2 d至盐度小于1并统计仔虾数量。这5个产卵批次的仔虾记为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ,即为实验用虾。
1.2 实验水槽单因素随机生长性能比较实验以水泥池(1.6 m×1.6 m×0.8 m)为实验水槽,位于上海申漕特种水产开发公司卤虫孵化室。实验用水为经沉淀过滤、杀菌消毒的河水。
1.3 生长比较实验测量记录5个产卵批次仔虾的初始体质量,分别从中随机捞取100尾(设3个平行)放入水槽饲养60 d,每天投喂配合饲料、螺蛳肉和鱼肉(7:00,13:00,21:00),连续散气石充气,锅炉加热控温T=(28±1)℃,每周排污一次。实验期末,统计各池中虾的数量,测量每尾虾的体质量,并辨别雌雄。
1.4 微卫星分析实验 1.4.1 DNA提取DNA提取方法参照STRAUSS[11],取肌肉组织0.1 g,剪碎并烘干,用蛋白酶 K 消化,经酚-氯仿法提取、纯化,无水乙醇沉淀,加入适量TE缓冲液溶解后置于4℃保存备用。
1.4.2 微卫星引物实验用8对微卫星引物,其中2对(编号为SUGbp8-103b、SUGbp8-137)为本实验室自主开发而来,另外6对从外文文献[12-14]筛选而来。引物由上海生工生物工程有限公司合成,引物信息见表 1。
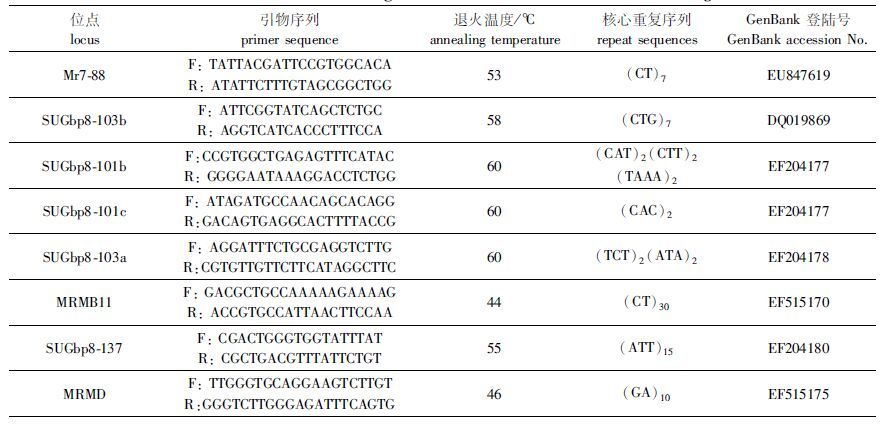
|
表 1 罗氏沼虾8对微卫星位点的特征 Tab.1 Characterization of eight microsatellite loci of tested M. rosenbergii |
PCR反应程序参考戴习林等[15],采用Eppendorf公司PCR仪(22331HAMBURG),对罗氏沼虾5个产卵批次子代的 DNA 进行PCR扩增,8%非变性聚丙烯酰胺对PCR产物进行凝胶电泳,硝酸银染色后拍照。
1.5 数据处理与分析幼体数量的统计方法参照王克行[16],生长指标参数计算公式如下:
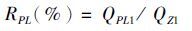 (1)
(1)
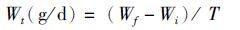 (2)
(2)
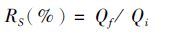 (3)
(3)
式中:RPL 为出苗率;Wt为体质量日均增重量;RS 为成活率; QPL1为Ⅰ期仔虾数量(尾); QZ1为Ⅰ期溞状幼体数量(尾); Qf为实验期末沼虾尾数(尾); Qi为实验初始放养尾数(尾); Wf为实验期末虾体均重(g);Wi为实验初始虾体均重(g);T为养殖天数(d)。
用Excel 2003统计处理数据,SPSS 17.0对处理后数据进行单因素方差分析,LSD法多重比较,差异显著性设为P< 0.05。
采用Gel-Pro Analyzer 4.5[17]对银染后的电泳谱带进行统计分析。利用PopGene 3.2[18]计算微卫星基因座上的等位基因数(NA)、有效等位基因数(NE)、观测杂合度(HO)、期望杂合度(HE)、和Nei’s遗传距离(D)。根据BOTSTEIN等[19]公式计算多态信息含量(CPI):
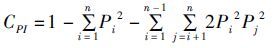 (4)
(4)
式中:n为某位点上等位基因数; Pi、Pj分别为第i和第j个等位基因在群体中的频率,j = i+1。
用MEGA 4.0软件采用非加权配对算数平均法(unweighted pair groupmethod using arithmetic average,UPGMA)构建聚类图。
2 结果 2.1 生长比较 2.1.1 不同产卵批次的幼体和仔虾数量如表 2所示,幼体及仔虾的绝对数量随产卵次数增加而增加,而亲本单位质量产幼体数与仔虾数在不同批次间基本相同(P>0.05)。前三批次的仔虾出苗率高于后两批次,其中Ⅱ批次最高,为12.15%,Ⅴ批次最低,为8.11%。
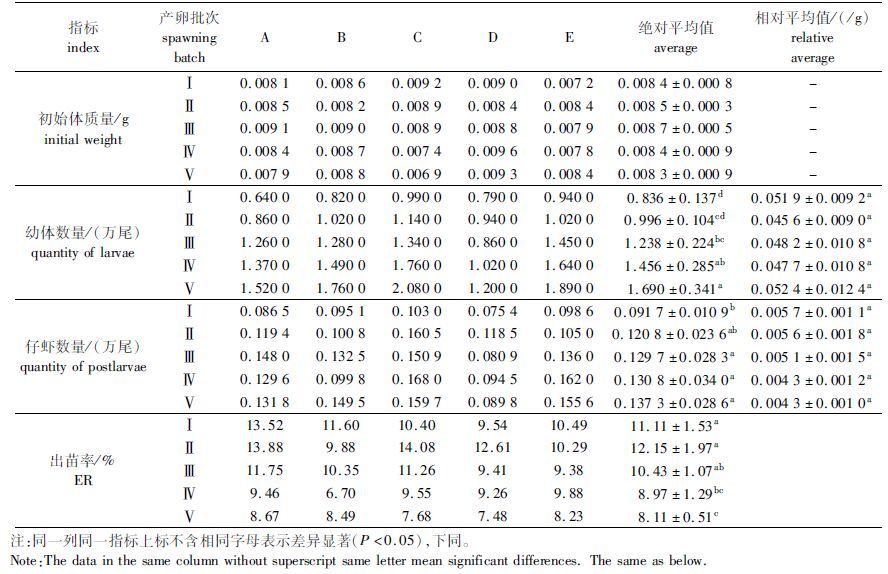
|
表 2 不同产卵批次的幼体和仔虾数量及出苗率 Tab.2 The number of larvae,juveniles and seedling emergence rate of different spawning batches |
表 3数据表明养殖60 d后,各产卵批次子代绝对增重率大小顺序为Ⅲ>Ⅱ>Ⅴ>Ⅳ>Ⅰ,Ⅱ和Ⅲ批次子代的日均增重量达到0.032 g/d,Ⅳ和Ⅴ批次子代的日均增重量较小,约为0.026 g/d,而Ⅰ批次子代的日均增重量最小为0.022 g/d,差异均显著(P< 0.05)。Ⅰ批次子代的平均成活率为88.3%,显著高于后四批次(P<0.05),后四批次子代成活率有降低趋势,但差异不显著(P>0.05)。
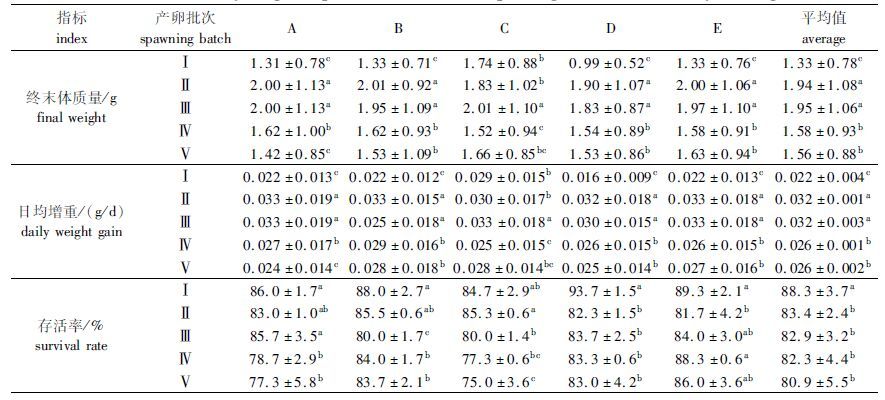
|
表 3 不同产卵批次的仔虾60 d内体质量变化情况 Tab.3 The body weight of postlarvae at different spawning batches after 60 days feeding |
从表 4可以看出,前三批次子代体质量的平均变异系数小于后两批次,表明前三批次子代的养成规格更为整齐。
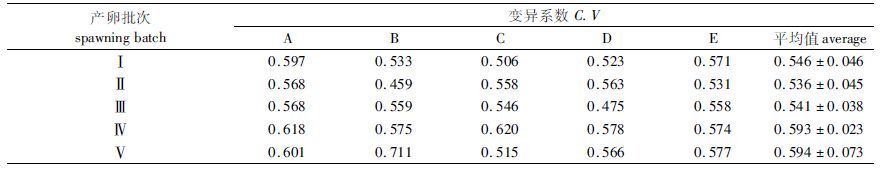
|
表 4 不同产卵批次的仔虾养殖60 d后体质量的变异系数 Tab.4 The C.V of body length and weight at different spawning batches after 60 days feeding |
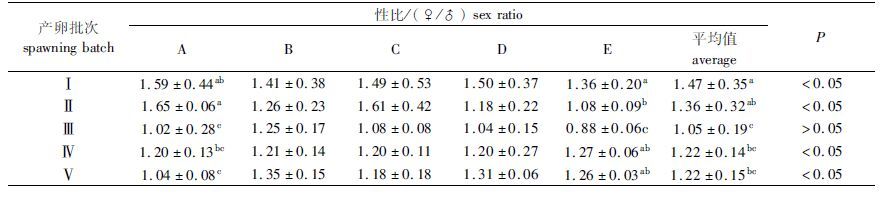
如表 5所示,养殖60 d后,绝大多数养成池中的雌虾数量多于雄虾,Ⅰ、Ⅱ、Ⅳ、Ⅴ批次子代的雌性比例较高,经χ2检验,P<0.05,其性比均不符合1∶1的理论比例,而Ⅲ批次子代的雌雄比接近1,经χ2检验,P>0.05,其性比符合1∶1的理论比例。
|
表 5 不同产卵批次的仔虾养殖60 d后的性比 Tab.5 The ratio of female to male of postlarvae at different spawning batches after 60 days feeding |
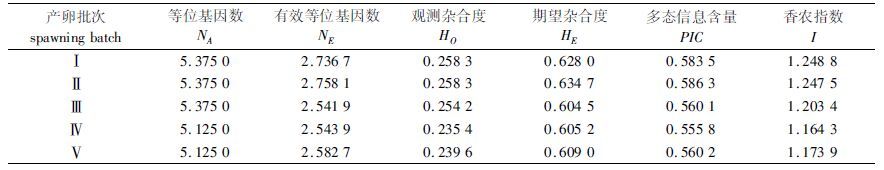
由表 6可以看出,罗氏沼虾5个产卵批次子代的等位基因数(Na)为5.125~5.375,有效等位基因数(Ne)为2.541 9~2.758 1,杂合度观测值(Ho)为0.235 4~0.258 3,杂合度期望值(He)为0.604 5~0.634 7。多态信息含量(PIC)大小顺序为:Ⅱ(0.586 3)>Ⅰ(0.583 5)>Ⅴ(0.560 2)>Ⅲ(0.560 1)>Ⅳ(0.555 8),均为高度多态。
|
表 6 罗氏沼虾5个产卵批次在8个微卫星座位上的遗传参数 Tab.6 Genetic parameters at 8 microsatellite loci of 5 spawning batches of M. rosenbergii |
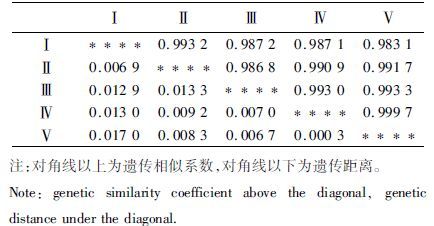
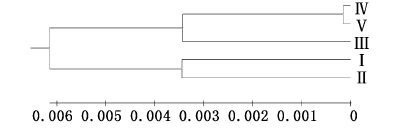
如表 7所示,Ⅰ批次与Ⅴ批次间的遗传距离最大为0.017 0,遗传相似系数最小为0.983 1;Ⅳ批次与Ⅴ批次间的遗传距离最小为0.000 3,遗传相似系数最大为0.999 7。根据各批次子代间遗传距离,用UPGMA法进行聚类分析。从图 1中可以看出,Ⅳ批次先与Ⅴ批次首先聚在一起,再与Ⅲ批次聚为一支;Ⅰ、Ⅱ批次聚为另一支。
|
表 7 5个罗氏沼虾产卵批次的Nei’s遗传距离及遗传相似系数 Tab.7 Nei’s genetic distance and genetic identity in 5 spawning batches of M. rosenbergii |
|
图 1 根据遗传距离用UPGMA法构建罗氏沼虾5个产卵批次群体的系统进化树
Fig. 1 Phylogenetic tree based on genetic distance of 5 spawning batches of M. rosenbergii by UPGMA methods
|
有研究表明,罗氏沼虾怀卵量因个体大小、营养水平而异,由几千到数万粒不等[16]。另有学者通过对凡纳滨对虾的研究认为,同一批亲虾随着生长和时间的推移不仅产卵量会增加,其孵化率也会增加,这可能与亲虾体型与成熟度有关[20]。ARCOS等[21]的研究结果也证实,不同产卵批次幼体至仔虾Ⅰ期(PL1)的应激耐受力及幼体存活率均无差异。因此笔者认为前5批次幼体数量逐次增加主要因为随生长和时间的推移,亲虾个体增大、绝对产卵量增加,而与产卵批次无关。实验中,仔虾数量也随着产卵批次增加而增加,增幅明显小于幼体数量,因此笔者认为仔虾数量不仅与亲虾产卵量和幼体数量相关,且与幼体的变态率有关。在罗氏沼虾育苗生产上,往往前期育苗比较容易,后期则一次比一次难育,仔虾出苗率也逐渐降低,表明产卵批次对幼体变态具有一定影响,猜测Ⅳ、Ⅴ批次幼体出苗率较低可能与亲虾在集约条件下长时间持续促熟导致的生殖疲劳有关。
3.1.2 多次产卵对罗氏沼虾生长存活的影响目前,亲虾性腺发育次数对卵子、幼体质量影响的研究较多,主要有两种说法。
多数学者认为有影响,即生产中通常所说的无节幼体质量是“头好尾差”。有学者认为每尾雌对虾所产的第一批卵最好,随后卵子质量会有所下降[22-23]。黄、渤海对虾前两次所产卵子质量较好,第三、四次所产卵子膜径、卵黄径明显减小,育出幼体质量较差,抵抗力弱[24]。同时,先后有学者分别以GSI、肝胰腺中TG、卵巢蛋白质、产卵力、受精率、孵化率等参数为评判指标,研究了虾类在集约促熟条件下连续多次产卵导致生殖疲劳的结果[10]。然而,ARCOS等[9]提出卵子质量和雌虾的生理状态不受连续产卵的影响,具有多次产卵能力的雌虾可获得较大的生殖性能。PALACIOS等[25]研究表明可通过食物提供能量来满足雌虾性腺再成熟的需要。
在本实验中,Ⅱ和Ⅲ批次子代表现出明显的生长优势,Ⅰ批次子代成活率显著高于后四批次,前三批次子代养成规格更加整齐。实验结果基本与多数学者观点一致,笔者认为亲虾产卵批次可影响子代质量。目前,一些育苗场将育苗临近结束时部分虾苗作为来年的种虾,而实验结果表明这些后期育出的虾苗生长性能较差,这似乎与近几年罗氏沼虾养殖过程中性早熟、生长缓慢、个体小等现象有所关联,但具体原因需要进一步研究。
3.1.3 多次产卵对罗氏沼虾性比的影响目前,甲壳动物的性别决定机制仍处于进化的早期阶段,已报道的虾蟹类性别决定机制中,有遗传决定型、环境决定型以及遗传与环境共同决定型[26]。MALECHA等[27]发现罗氏沼虾的性别由染色体决定,为ZW型,理论上性腺成熟交配产生的后代雌雄各占50%,但自然条件下,罗氏沼虾的雌雄比一般为1.29∶1。各种外部环境因素如食物丰度、盐度和水温等都可能影响甲壳动物的性别 [26-28]。另有研究发现日本沼虾非繁殖期雄虾多于雌虾,而繁殖期雌雄性比逐渐上升,繁殖盛期雌虾多于雄虾[29]。李明云[30]研究表明,脊尾白虾的雌雄比大于1,繁殖期比例更高。由于罗氏沼虾雄虾可与多尾雌虾交配,生产上雌雄比例往往以4~5∶1为宜[31],交配前雌虾进行生殖蜕皮,且交配只能在壳尚未变硬的几小时内进行 [23]。因此笔者认为雌虾数量多于雄虾可能是一种有利于罗氏沼虾种族繁衍的自然选择。而Ⅲ批次虾苗的性比接近1,是否是前期(Ⅰ、Ⅱ)亲虾体型较小、怀卵量较少,而后期(Ⅳ、Ⅴ)亲虾产生生殖疲劳、仔虾出苗率低而引起的现象,这需要进一步观察研究。同时,此现象也可能由其遗传因子决定。目前已在罗氏沼虾体内检测到与性别发育相关的MroSxl和MroDmrt基因[32-33],但性别分化与产卵批次间的关系需要进一步研究。
3.2 罗氏沼虾各产卵批次遗传结构分析维持种内遗传多样性是持续利用种质资源的关键[34]。在人工选育过程中,应尽可能保持选育群体的遗传多样性,以保证选育工作顺利进行。本实验中罗氏沼虾5个产卵批次子代的多态性差异均不明显;其中后三批次子代的多态性较前两批次略微有所降低,这是否与亲虾长时间持续促熟导致的生殖疲劳有关,则需要进一步研究。
遗传距离可以有效地显示群体间的遗传变异,遗传距离越大表示群体间遗传关系越远[35]。本实验中,各产卵批次子代间的遗传距离均比较小,其中Ⅰ批次子代与Ⅴ批次子代间的遗传距离最大仅为0.017 0,Ⅳ批次子代与Ⅴ批次子代间的遗传距离最小为0.000 3,表明各批次子代间遗传关系极近,这和5个产卵批次的子代来源于同一亲虾有关。Ⅰ批次子代与后续批次子代的遗传距离逐批增大,而相邻产卵批次子代间的遗传距离自Ⅱ批次起逐批减小,表明随着产卵次数增加,遗传结构趋于更加稳定[36]。
| [1] | 刘恩生, 万全.罗氏沼虾的养殖现状与发展前景[J]. 安徽农业大学学报, 1997, 24(2): 189–192. LIU E S, WAN Q.Status and prospect of culture of Macrobrachium rosenbergii[J]. Journal of Anhui Agricultural University, 1997, 24(2): 189–192. |
| [2] | 卢小花, 江林源, 黄光华, 等.罗氏沼虾幼体质量对育苗影响的研究[J]. 科学养鱼, 2011: 7. LU X H, JIANG L Y, HUANG G H, et al.Studies on effects of larvae quality on seeding of Macrobrachium rosenbergii[J]. Scientific Fish Farming, 2011: 7. |
| [3] | 史建华, 肖雨, 徐琴英.罗氏沼虾引种复壮技术的研究[J]. 水产科技情报, 2001, 28(2): 64–67. SHI J H, XIAO Y, XU Q Y.Studies on the introductional rejuvenated technique of Macrobrachium rosenbergii[J]. Fisheries Science and Technology Information, 2001, 28(2): 64–67. |
| [4] | 陆春明.影响南美白对虾苗种质量关键因素分析[J]. 上海农业科技, 2011: 76. LU C M.Aanlysis of key factors affecting seed quality of Litopenaeus vannamei[J]. Shanghai Agricultural Science and Technology, 2011: 76. |
| [5] | 江林源, 黄光华, 卢小花, 等.罗氏沼虾健康育苗技术研究[J]. 南方农业学报, 2011, 42(4): 446–449. JIANG L Y, HUANG G H, LU X H, et al.Experiment on healthy shrimp(Macrobrachium rosenbergii) rearing[J]. Journal of Southern Agriculture, 2011, 42(4): 446–449. |
| [6] | 李科社.虾蟹养殖新技术[M].西安: 西北农林科技大学出版社, 2005: 50. LI K S.The new technology of shrimp and crab culture[M].Xi'an: Northwest Agriculture and Forestry University Press, 2005: 50. |
| [7] | 陈宇梁.罗氏沼虾人工育苗技术[J]. 水产养殖, 1992: 2–4. CHEN Y L.The technique of artificial breeding of Macrobrachium rosenbergii[J]. Aquaculture, 1992: 2–4. |
| [8] | 李秀民.中国对虾亲虾多次产卵利用技术[J]. 河北渔业, 2013: 56–58. LI X M.The use of technology on multiple spawning of parent shrimp Fenneropenaeus chinensis[J]. Hebei Fisheries, 2013: 56–58. |
| [9] | ARCOS F G, IBARRA A M, PALACIOS E, et al.Feasible predictive criteria for reproductive performance of white shrimp Litopenaeus vannamei: egg quality and female physiological condition[J]. Aquaculture, 2003, 228(1): 335–349. |
| [10] | PALACIOS E, RACOTTA I S, PAZ A.Spawning frequency analysis of wild and pond-reared shrimp Penaeus vannamei broodstock under large-scale hatchery conditions[J]. Journal of the World Aquaculture Society, 1999, 30(2): 180–191. |
| [11] | STRAUSS W M.Preparation of genomic DNA from mammalian tissue[J]. Current Protocols in Molecular Biology, 1998: 221–223. |
| [12] | BHASSU S, SEE L M, HASSAN R, et al.Isolation and characterization of microsatellite loci in the Malaysian giant freshwater prawn, Macrobrachium rosenbergi[J]. Molecular Ecology Resources, 2008, 8(5): 983–985. |
| [13] | DIVU D, KARUNASAGAR I.Microsatellite DNA markers in the giant freshwater prawn, Macrobrachium rosenbergii: a tool for genetic analysis[J]. Molecular Ecology Resources, 2008, 8(5): 1040–1042. |
| [14] | BHAT S, PATEL A, DAS P, et al.Isolation and characterization of microsatellite loci in giant freshwater prawn, Macrobrachium rosenbergii[J]. Conservation Genetics, 2009, 10(5): 1473–1475. |
| [15] | 戴习林, 邓平平, 施永海, 等.罗氏沼虾SSR标记再开发及其影响因素初探[J]. 生物技术通报, 2012: 142–149. DAI X L, DENG P P, SHI Y H, et al.A preliminary study on re-developing of Macrobrachium rosenbergii microsatellite markers and influence factors[J]. Biotechnology Bulletin, 2012: 142–149. |
| [16] | 王克行.虾类健康养殖原理与技术[M].北京: 科学出版社, 2008: 372. WANG K X.The principle and technology of healthy aquaculture shrimp[M].Beijing: Science Press, 2008: 372. |
| [17] | HAN Z, WANG C, SONG X, et al.Characteristics, development and mapping of Gossypium hirsutum derived EST-SSRs in allotetraploid cotton[J]. Theoretical and Applied Genetics, 2006, 112(3): 430–439. |
| [18] | YEH F C, YANG R C, BOYLE T B, et al.POPGENE, the user-friendly shareware for population genetic analysis[M].Canada: Molecular Biology and Biotechnology Centre, University of Alberta, 1997. |
| [19] | BOTSTEIN D, WHITE R L, SKOLNICK M, et al.Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J]. Am J Hum Genet, 1980, 32: 314–331. |
| [20] | 王克行.虾类健康养殖原理与技术[M].北京: 科学出版社, 2008: 328. WANG K X.The principle and technology of healthy aquaculture shrimp[M].Beijing: Science Press, 2008: 328. |
| [21] | ARCOS F G, IBARRA A M, VAZQUEZ-BOUCARD C, et al.Hemolymph metabolic variables in relation to eyestalk ablation and gonad development of Pacific white shrimp Litopenaeus vannamei[J]. Aquaculture Research, 2003, 34: 749–755. |
| [22] | BROWDY C L, SAMOCHA T M.The effect of eyestalk ablation on spawning, molting and mating of Penaeus semisulcatus de Haan[J]. Aquaculture, 1985, 49(1): 19–29. |
| [23] | HANSFORD S W, MARSDEN G E.Temporal variation in egg and larval productivity of eyestalk ablated spawners of the prawn Penaeus monodon from Cook Bay, Australia[J]. Journal of the World Aquaculture Society, 1995, 26(4): 396–400. |
| [24] | 王克行.虾蟹类增养殖学[M].北京: 中国农业出版社, 2009: 219. WANG K X.Shrimp and crab aquaculture science[M].Beijing: China Agriculture Press, 2009: 219. |
| [25] | PALACIOS E, IBARRA A M, RACOTTA I S.Tissue biochemical composition in relation to multiple spawning in wild and pond-reared Penaeus vannamei broodstock[J]. Aquaculture, 2000, 185(3): 353–371. |
| [26] | 楼允东, 刘艳红, 邱高峰.虾蟹类性别决定研究进展[J]. 上海水产大学学报, 2004, 13(2): 157–163. LOU Y D, LIU Y H, QIU G F.Advances in sex determination of shrimps(Prawns) and crabs[J]. Journal of Shanghai Fisheries University, 2004, 13(2): 157–163. |
| [27] | MALECHA S R, NEVIN P A, HA P, et al.Sex-ratios and sex-determination in progeny from crosses of surgically ex-reversed freshwater prawns, Macrobrachium rosenbergii[J]. Aquaculture, 1992, 105(3): 201–218. |
| [28] | WU C G, XIANG J H.Genetic determination and exogenous influence in sex differentiation in crustacean[J]. Developmental and Reproductive Biology, 2002, 11(2): 88–94. |
| [29] | 何绪刚, 龚世园.日本沼虾(Macrobrachium nipponensis)规模化育苗实验[J]. 内陆水产, 2003, 28(11): 36–38. HE X G, GONG S Y.Macrobrachium nipponensis scale breeding test[J]. Inland Fisheries, 2003, 28(11): 36–38. |
| [30] | 李明云.池养脊尾白虾的繁殖、生长及其最大持续轮捕量的初步探讨[J]. 水产学报, 1994, 18(2): 85–92. LI M Y.An approach to the reproduction and growth of shrimp Exopelaemon Carinicanda cultured in earthen ponds with reference to its maximum sustaining yield on catch rotation[J]. Journal of Fisheries of China, 1994, 18(2): 85–92. |
| [31] | 徐庆登, 董洪学.怎样养殖罗氏沼虾赚钱多[M].南京: 江苏科学技术出版社, 2010: 32. XU Q D, DONG H X.How to make money more breeding Macrobrachium rosenbergii[M].Nanjing: Jiangsu Science and Technology Press, 2010: 32. |
| [32] | 彭巧玲, 蒲友光, 程子华, 等.罗氏沼虾3个Dmrt基因的序列分析[J]. 中国水产科学, 2005, 12(1): 5–9. PENG Q L, PU Y G, CHENG Z H, et al.Sequence analysis of three Dmrt genes in Macrobrachium rosenbergii[J]. Journal of Fishery Sciences of China, 2005, 12(1): 5–9. |
| [33] | 俞炎琴. 罗氏沼虾中性别发育相关基因Sxl和Dmrt基因的分子特征和功能研究[D]. 杭州: 浙江大学, 2013. YU Y Q. The molecular characterization and functional analysis of sexual development related genes Sxl and Dmrt in the prawn, Macrobrachium rosenbergii[D]. Hangzhou: Zhejiang University, 2013. |
| [34] | 池喜峰, 贾智英, 李池陶, 等.鲤易捕性状选育群体不同世代微卫星分析[J]. 上海海洋大学学报, 2010, 19(3): 308–313. CHI X F, JIA Z Y, LI C T, et al.SSR analysis of selected high-harvesting populations of comm on carp(Cyprinus carpio)[J]. Journal of Shanghai Ocean University, 2010, 19(3): 308–313. |
| [35] | 于爱清, 李思发, 蔡完其."新吉富" 罗非鱼选育F10~F13遗传变异微卫星分析[J]. 上海海洋大学学报, 2011, 20(1): 1–7. YU A Q, LI S F, CAI W Q.Genetic variations among the recent selected generations F10~F13 of NEW GIFT strain Nile tilapia(Oreochromis niloticus) by SSR analysis[J]. Journal of Shanghai Ocean University, 2011, 20(1): 1–7. |
| [36] | 张红玉, 何毛贤, 管云雁.马氏珠母贝红色壳家系不同世代遗传变异的SRAP分析[J]. 水产学报, 2009, 33(5): 727–733. ZHANG H Y, HE M X, GUAN Y Y.SRAP analysis on genetic variation of the different generations of a red shell family in pearl oyster, Pinctada martensi Dunker[J]. Journal of Fishery of China, 2009, 33(5): 727–733. |
2. Shanghai Shencao Special Fisheries Development Co., Shanghai 201516, China
 2016,
Vol. 25
2016,
Vol. 25

