2. 中国水产科学研究院淡水渔业研究中心, 江苏 无锡 214081
团头鲂(Megalobrama amblycephala)俗称武昌鱼、鳊鱼。隶属硬骨鱼纲(Osteichthyes),鲤形目(Cypriniformes),鲤科(Cyprinidae),鲌亚科(Culterinae),鲂属(Megalobrama),原产于湖北省武昌县[1],近年来养殖范围逐渐扩大,产量逐年上升,已成为我国重要的大宗淡水养殖鱼类之一。
蛋白质和氨基酸是鱼类生长和发育过程中所必需的重要营养素。鱼类有十种必需氨基酸,饲料中缺乏必需氨基酸会导致饲料利用率低下、鱼体生长缓慢。赖氨酸常被称为第一限制性氨基酸[2],是常用植物性蛋白原料中最易缺乏的必需氨基酸[3],含量过高或不足会导致鱼体氨基酸不平衡,影响鱼类对饲料蛋白源的利用,不利于鱼类生长[4]。
目前,国内外学者已对鲤(Cyprinus carpio)、鲫(Carassius auratus)、草鱼(Ctenopharyngodon idellus)和青鱼(Mylopharyngodon piceus)等多种鱼类的日粮赖氨酸需要量进行了研究,也开展了许多团头鲂基本营养需要量的研究,如蛋白质[5]、碳水化合物[6]、脂肪[7]和精氨酸[8]等。但多数研究仅选取了其中一个生长阶段,不能反映鱼类整个生长过程的营养需求。鱼类在不同生长发育阶段的营养需求存在差异[9-10],而关于相同养殖条件下鱼类不同生长阶段营养需求的比较,国内外均少有报道。廖英杰等[11]报道团头鲂幼鱼的赖氨酸需要量为2.36%,但有关养成期较大规格团头鲂的赖氨酸需要量还未见报道。本实验旨在研究并比较不同赖氨酸水平饲料对不同规格团头鲂生长、血液生化及游离必需氨基酸的影响,确定不同规格团头鲂的最适赖氨酸需要量,为进一步优化团头鲂人工配合饲料提供理论依据。
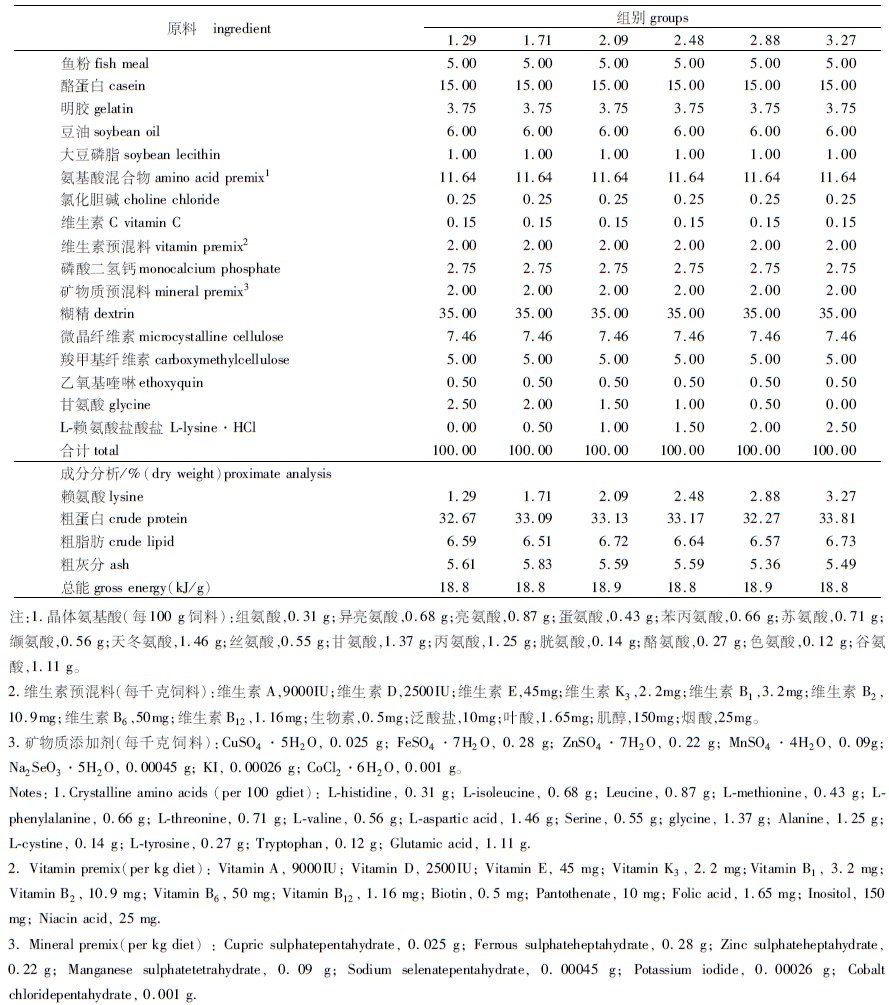
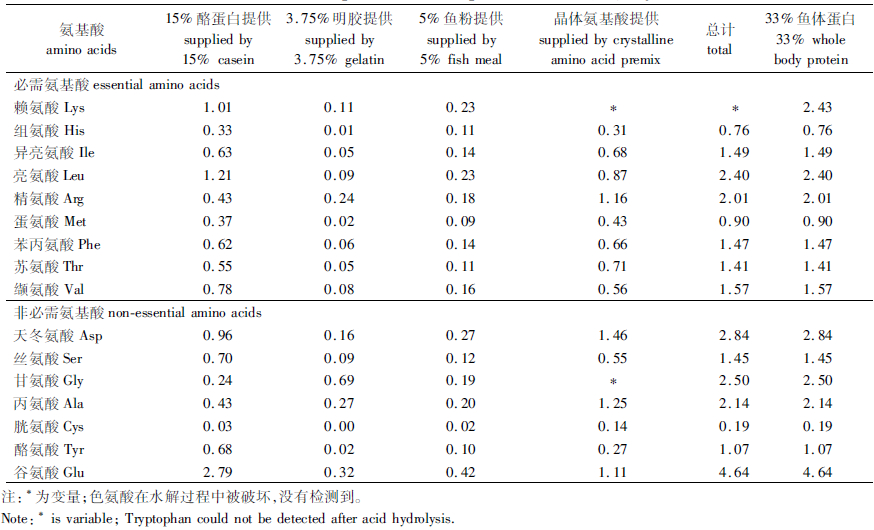
1 材料与方法 1.1 实验饲料本实验采用单因子梯度实验设计,以鱼粉、酪蛋白和明胶为蛋白源,豆油为脂肪源,糊精为糖源配制蛋白为32.67%、脂肪为6.59%的基础饲料。以团头鲂鱼体氨基酸含量为标准,添加相应晶体氨基酸,使除赖氨酸以外各种氨基酸含量均达到鱼体中含量(见表 2)。实验饲料为在基础饲料中添加0、0.5%、1.0%、1.5%、2.0%和2.5%的不同水平晶体赖氨酸,并以甘氨酸为填充剂调整至相同氨基酸比例,以酪蛋白和明胶作为等氮替代物,按表 1所示配方制作6组等氮等能的半精制饲料。实际测得饲料中赖氨酸含量分别为1.29%、1.71%、2.09%、2.48%、2.88%和3.27%。晶体赖氨酸(L-氨基酸盐酸盐,99%)购于上海斐雅科技发展有限公司,各原料粉碎过50目筛,按配比充分混匀后,用小型饲料制粒机(SLP-45型,中国水产科学研究院渔业机械仪器研究所)制成粒径1~2 mm的沉性颗粒饲料,30 ℃烘干后放于-20 ℃冰箱保存备用。
|
表 1 实验饲料配方及营养成分组成(%,干物质基础) Tab.1 Formulation and proximate composition of the experimental diets (%,dry matter) |
|
表 2 饲料中氨基酸组成(%,干物质基础) Tab.2 Amino acid composition of the experimental diets(%, dry matter) |
实验鱼由中国水产科学研究院淡水渔业研究中心南泉基地提供,养殖实验在该基地水泥池塘(规格:60 m×30 m)进行,池塘平均水深2.5 m。不同规格团头鲂分别进行单独实验,用对照组饲料(赖氨酸含量1.29%)投喂驯化7 d后,分别随机选取规格一致、体质健康的团头鲂324尾(规格Ⅰ:52.49±0.18 g/尾,规格Ⅱ:101.85±1.85 g/尾),分别随机分成6组,其中1.29%赖氨酸为对照组,1.71%、2.09%、2.48%、2.88%、3.27%为实验组。每组3个重复,每个重复18尾鱼,分别放养于18个网箱(规格Ⅰ:1 m×1 m×1 m,规格Ⅱ:2 m×1 m×1 m)中。实验期间每天定时定点(8:00,12:00和16:00)投喂至表观饱食,并根据天气、摄食和生长情况适当调整投喂量。实验期间水体温度27~30 ℃,溶氧>5.0 mg/L,氨氮 <0.05 mg/L,pH 7.2~7.8。
1.3 样品采集方法养殖实验结束前,对实验鱼禁食24 h,分别对每个网箱进行计数、称重。每个网箱随机选取3尾实验鱼并单独称重,用MS-222(浓度100 mg/L)快速深度麻醉,2.5 mL医用注射器(肝素钠润湿)尾静脉取血,转移至1.5 mL抗凝管中离心(4 ℃,7 500 r/min,10 min),分离血清并保存于-80 ℃备用。每个网箱另取3尾实验鱼,-20 ℃保存,用于测定全鱼体成分。
1.4 样品测定方法 1.4.1 常规生长指标测定每个规格每个网箱全部称重并计数,依据相应公式计算增重率、特定生长率、饵料系数、摄食量、蛋白质效率和成活率。
1.4.2 全鱼体成分分析干物质、粗蛋白、粗灰分依据AOAC颁布的方法[12]测定,干物质用常压干燥法,粗蛋白(N×6.25)用凯氏定氮法,粗脂肪用索氏抽提法,先将样品在电炉上炭化后用马弗炉560 ℃灼烧法测定灰分。
1.4.3 血液指标及血清游离氨基酸测定谷丙转氨酶(ALT)、谷草转氨酶(AST)、白蛋白(ALB)、总蛋白(TP)、球蛋白(GLB)和尿素(Urea)等血液生化指标用深圳迈瑞BS-400全自动生化分析仪测定,所用试剂均购于深圳迈瑞生物医疗电子股份有限公司。血清游离氨基酸先用三氯乙酸沉淀血清中的蛋白,再用江南大学食品科技学院测试中心安捷伦-1100液相色谱分析仪测定。
1.4.4 饲料氨基酸测定将各赖氨酸水平饲料粉碎,用6 mol/L的HCl在110℃下水解24h,再用江南大学食品科技学院测试中心安捷伦-1100液相色谱分析仪测定其中的氨基酸含量。
1.5 相关指标计算公式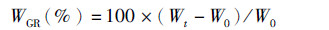 (1)
(1)
式中:WGR为增重率;W0为初始鱼体均重;Wt为终末鱼体均重。
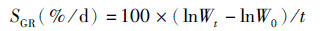 (2)
(2)
式中:SGR为特定生长率;W0为初始鱼体均重;Wt为终末鱼体均重;t为饲喂天数。
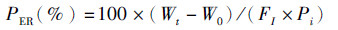 (3)
(3)
式中:PER为蛋白质效率;W0为初始鱼体均重;Wt为终末鱼体均重;FI为每尾鱼平均摄食饲料总量(风干样重);Pi为饲料蛋白含量。
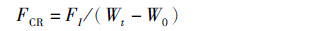 (4)
(4)
式中:FCR为饵料系数;FI为每尾鱼平均摄食饲料总量(风干样重);W0为初始鱼体均重;Wt为终末鱼体均重。
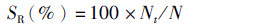 (5)
(5)
式中:SR为成活率;Nt为收获尾数;N为放养尾数。
1.6 数据统计与分析用SPSS 19.0对实验数据进行单因素方差分析(One-way ANOVA),差异显著时再进行多重比较(Duncan’s procedure),P<0.05表示差异显著,所有结果均以平均值±标准误(mean±SE)表示。通过折线模型(Broken-line)回归分析,根据特定生长率与饲料中赖氨酸含量的相关性,得出不同规格团头鲂的最适赖氨酸需要量。
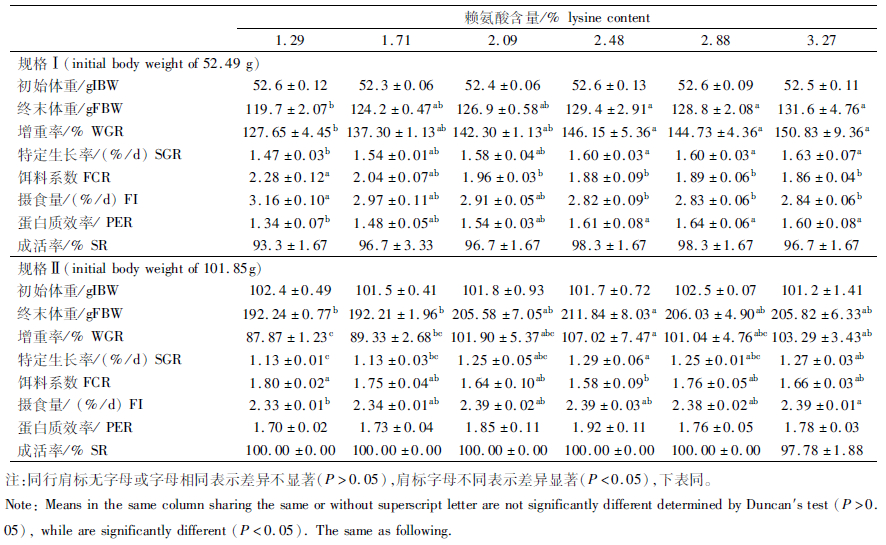
2 结果与分析 2.1 饲料赖氨酸水平对不同规格团头鲂生长性能的影响不同水平赖氨酸对不同规格团头鲂生长性能的影响如表 3所示,随日粮中赖氨酸水平的提高,规格Ⅰ和规格Ⅱ的鱼体末重、增重率、特定生长率和蛋白质效率呈先升高后趋于平缓的趋势,饵料系数呈先降低后趋于平缓的趋势。与对照组相比,2.48%、2.88%和3.27%组显著提高了规格Ⅰ的增重率、特定生长率和蛋白质效率(P<0.05),显著降低了规格Ⅰ的饵料系数和摄食量(P<0.05);2.48%组显著降低了规格Ⅱ的饵料系数(P<0.05),2.48%和3.27%组显著提高了规格Ⅱ的特定生长率和增重率(P<0.05);规格Ⅰ的成活率,规格Ⅱ的蛋白质效率和成活率均无显著差异(P>0.05)。相同赖氨酸添加水平下,规格Ⅰ的增重率和特定生长率均高于规格Ⅱ,而蛋白质效率和成活率均低于规格Ⅱ。
|
表 3 饲料赖氨酸水平对不同规格团头鲂生长性能的影响 Tab.3 Effects of dietary lysine level on growth performance in different growth stages of M. amblycephala |
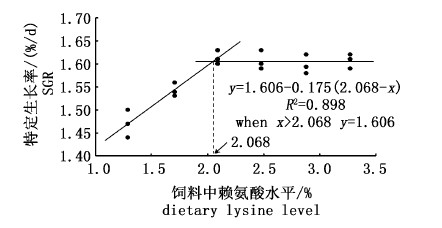
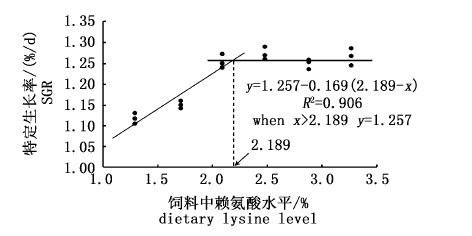
经折线模型回归分析发现规格Ⅰ和规格Ⅱ的特定生长率与赖氨酸添加水平呈非线性关系,如图 1和图 2所示,当赖氨酸添加水平分别为2.068%(饲料粗蛋白含量的6.27%)和2.189%(饲料粗蛋白含量的6.63%)时,规格Ⅰ和规格Ⅱ的特定生长率最大。
|
图 1 饲料赖氨酸水平对规格Ⅰ团头鲂特定生长率的影响
Fig. 1 Effects of dietary lysine level on SGR of
M. amblycephala(initial body weight of 52.49 g)
|
|
图 2 饲料赖氨酸水平对规格Ⅱ团头鲂特定生长率的影响
Fig. 2 Effects of dietary lysine level on SGR of
M. amblycephala(initial body weight of 101.85 g)
|
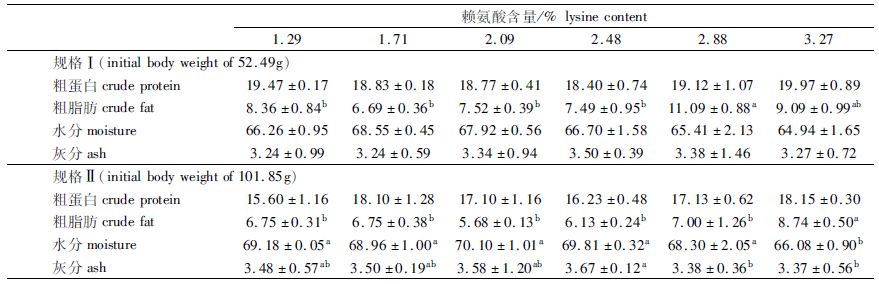
如表 4所示,规格Ⅰ的鱼体粗蛋白、水分和灰分,规格Ⅱ的鱼体粗蛋白均无显著性差异(P>0.05)。与对照组相比,2.88%组显著提高了规格Ⅰ的鱼体粗脂肪含量(P<0.05);3.27%组显著提高了规格Ⅱ的鱼体粗脂肪含量(P<0.05),显著降低了水分含量(P<0.05)。相同赖氨酸水平下,规格Ⅰ的鱼体粗蛋白和粗脂肪含量均高于规格Ⅱ,而水分和灰分含量均低于规格Ⅱ。
|
表 4 饲料赖氨酸水平对不同规格团头鲂体成分的影响(%,干物质基础) Tab.4 Effects of dietary lysine level on body composition in different growth stages of M.amblycephala (%, dry matter) |
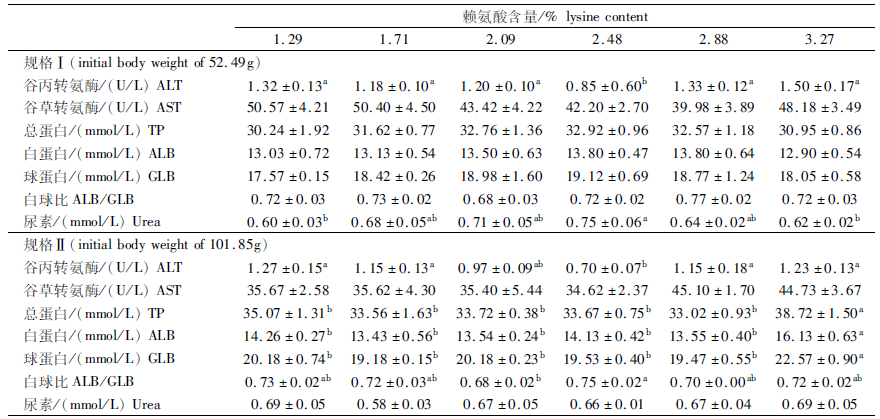
由表 5可知,与对照组相比,2.48%组显著降低了规格Ⅰ和规格Ⅱ的ALT活性(P<0.05),显著降低了规格Ⅰ的Urea含量(P<0.05);3.27%组显著提高了规格Ⅱ的TP、ALB和GLB含量(P<0.05);规格Ⅰ的AST、TP、ALB、GLB、ALB/GLB以及规格Ⅱ的AST、Urea均差异不显著(P>0.05)。
|
表 5 饲料赖氨酸水平对不同规格团头鲂血液生化指标的影响 Tab.5 Effects of dietary lysine level on blood biochemical indices in different growth stages of M. amblycephala |
如表 6所示,随着饲料中赖氨酸水平的提高,规格Ⅰ血清赖氨酸含量呈先升高后降低的趋势,并在添加量为2.88%时达到最高(P<0.05);血清精氨酸含量呈逐渐降低的趋势。规格Ⅱ的血清赖氨酸含量呈逐渐升高趋势,在3.27%时显著高于其他组(P<0.05);血清精氨酸含量先降低后升高,在2.09%时显著低于其他组(P<0.05)。2.88%组规格Ⅰ和规格Ⅱ的血清游离苯丙氨酸含量均显著提高(P<0.05),而血清苏氨酸含量均显著降低(P<0.05);2.48和2.88%组规格Ⅰ的血清游离总必需氨基酸的含量显著升高(P<0.05)。规格Ⅰ的血清游离异亮氨酸、蛋氨酸和规格Ⅱ的血清游离组氨酸、蛋氨酸含量无显著性差异(P>0.05)。
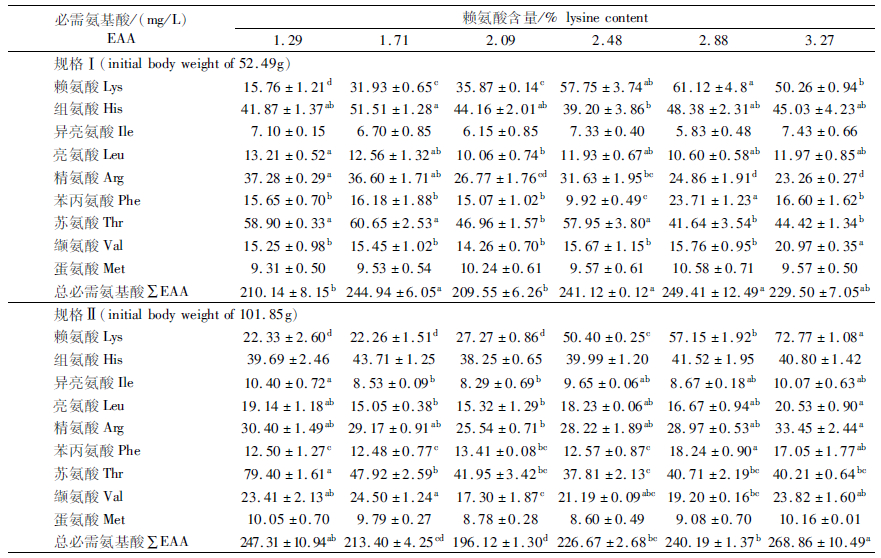
|
表 6 饲料赖氨酸水平对不同规格团头鲂血清必需氨基酸含量的影响 Tab.6 Effects of dietary lysine level on the concentration of serum essential amino acids in different growth stages of M. amblycephala |
赖氨酸是鱼体正常生长所必需的氨基酸,饲料中添加赖氨酸对不同规格团头鲂的生长均有影响。赖氨酸水平为1.27%~2.48%时,规格Ⅰ的特定生长率和蛋白质效率均随赖氨酸水平的增加而升高,而摄食量逐渐降低,说明在一定范围内,规格Ⅰ生长速度的提高可能增加了饲料利用和蛋白转化能力;规格Ⅱ的特定生长率和摄食量随赖氨酸添加量的增加而趋于平缓,蛋白质效率没有显著变化,说明规格Ⅱ的生长速度提高与摄食量的增加有关。这些数据表明饲料中添加赖氨酸对不同规格团头鲂生长影响的因素并不相同,这与牛磺酸对不同规格大菱鲆(Scophthalmus maximus)[13]和真鲷(Pagrus major)[14]生长的影响一致。两种规格团头鲂的生长速度在赖氨酸水平超过2.48%后趋于稳定,这可能是因为过量的赖氨酸导致脱氨基作用加重,能量消耗增加[8],也可能是由于体内赖氨酸与精氨酸的拮抗作用影响了两种氨基酸的吸收、转运及代谢[15],进而影响了生长。
3.2 不同规格团头鲂的赖氨酸需要量比较水产动物必需氨基酸的需要量因动物种类、生长阶段、食性[16, 17]以及统计模型[18]等的不同而不同,不同生长阶段因能量需要不同也存在很大差异。本研究除鱼体规格不同,其他因素均相同,以特定生长率为评价指标,通过折线模型回归分析得到规格Ⅰ和规格Ⅱ的赖氨酸最适需要量分别为饲料干重的2.07和2.19%,低于团头鲂幼鱼(2.36%)[11]的最适需要量,这与其他报道一样,相对较大规格团头鲂(52.49 g)的赖氨酸需要量大于团头鲂幼鱼(3.34 g),但是超过52.49 g后团头鲂的赖氨酸需要量变化不大。
饵料系数是衡量鱼体对配合饲料利用程度的重要指标,饵料系数的高低除与饲料质量有关,也与鱼体对饲料的消化、吸收和代谢相关[19]。本研究中,相同赖氨酸添加水平下规格Ⅰ的饵料系数高于规格Ⅱ,可能原因是规格Ⅰ生长速度较快,代谢也比规格Ⅱ旺盛,消耗的能量相对较多,需要摄取更多的饲料才能满足生长[20],具体原因有待进一步研究。
3.3 饲料赖氨酸水平对不同规格团头鲂体成分影响的比较本试验中赖氨酸对两种规格团头鲂的鱼体粗蛋白含量没有显著影响,与澳洲银鲈(Bidyanus bidyanus)[21]和许氏平鲉(sebastess chlegeli)[22]的研究结果一致,也有研究表明大西洋鳕鱼(Atlantic cod)[23]和军曹鱼(Rachycentron canadum)[2]的鱼体粗蛋白含量随赖氨酸水平的提高呈先增加后趋于平稳的趋势。两种规格团头鲂的鱼体粗脂肪含量随饲料赖氨酸水平的增加先趋于稳定,超过2.48%后呈升高趋势,说明赖氨酸水平超过鱼体最适需要量后,过剩的赖氨酸通过脱氨基作用用于脂肪合成和沉积[24],这与鲶鱼研究结果一致[25]。相同赖氨酸水平下,规格Ⅰ的鱼体粗蛋白和粗脂肪含量均高于规格Ⅱ,灰分均低于规格Ⅱ,可能是因为相同赖氨酸水平下规格Ⅰ的摄食量高于规格Ⅱ,可提供更多的营养,增加了蛋白和脂肪的积累,导致规格Ⅰ的鱼体粗蛋白和粗脂肪高于规格Ⅱ。
3.4 饲料赖氨酸水平对不同规格团头鲂血清生化指标影响的比较鱼体的血液生化指标受机体代谢、营养水平、健康状况及免疫功能的影响[26]。谷丙转氨酶(ALT)和谷草转氨酶(AST)是鱼体肝脏中重要的氨基转移酶[27],正常情况下在血清中活性较低,当发生肝脏损伤或病变时才大量释放到血清中。本研究中,规格Ⅰ和规格Ⅱ的血清ALT呈先降低后升高趋势,与许氏平鮋[22]的研究结果一致,且均在添加量为2.48%时显著低于其他组,这说明日粮赖氨酸不平衡对团头鲂肝脏有一定的影响。相同赖氨酸添加水平下,规格Ⅰ的ALT和AST活性均高于规格Ⅱ,表明随着团头鲂规格的增大,赖氨酸对肝脏的保护作用逐渐增强[28]。
血清总蛋白(TP)包括白蛋白(ALB)和球蛋白(GLB),它们的含量可反映机体蛋白质的吸收、代谢和免疫情况[29]。本研究中规格Ⅰ的TP和ALB没有显著差异,可能是由于规格Ⅰ的生长速度较快,TP和ALB主要用于营养物质的吸收和利用[30];而规格Ⅱ的TP和ALB均在添加量为3.27%时显著高于其他组,可能是因为高剂量组鱼体的蛋白质合成旺盛,吸收到血液中的蛋白质含量较高,进而导致TP和ALB含量显著高于其他组,与赖氨酸对犊牛[31]的影响结果一致。
血清尿素含量是衡量动物体内蛋白质和氨基酸代谢状况的最直观指标[32]。研究发现,当饲料中氨基酸缺乏和不平衡时,鱼体的氨基酸分解代谢增强,血清尿素含量也随之升高[32-33],与本研究中规格Ⅰ的血清尿素含量变化趋势一致。而规格Ⅱ的血清尿素含量没有显著变化,说明在未达到最适赖氨酸需求量时,尿素含量变化不显著,与CHEN等对斑节对虾(Penaeus monodon)的研究结果一致[34]。
3.5 饲料赖氨酸水平对不同规格团头鲂血清中游离必需氨基酸影响的比较鱼体血清中游离氨基酸含量受摄食赖氨酸含量的影响[35],能够反映机体的氨基酸吸收情况。本试验中,规格Ⅰ和规格Ⅱ的血清赖氨酸含量随饲料中赖氨酸水平的提高逐渐升高,在2.88%时达到最高,这与团头鲂幼鱼[11]、五条鰤(Seriolaquin queradiata)[36]等的研究结果一致,超过2.88%后,规格Ⅰ的血清赖氨酸含量显著降低,可能是因为鱼体储存氨基酸能力有限,过量的赖氨酸被排出体外;而规格Ⅱ继续升高,可能是因为规格Ⅱ的蛋白质及脂质合成需要吸收更多的氨基酸才能满足。本研究中,在最适赖氨酸需要量范围内,规格Ⅰ和规格Ⅱ的血清精氨酸与赖氨酸含量呈相反趋势,表明团头鲂对赖氨酸和精氨酸的吸收存在拮抗作用[31],与大西洋鲑(Salmo salar)[37]的结论一致。
| [1] | 柯鸿文.一种优良淡水鱼团头鲂(Megalobrama amblycephala)的繁殖和饲养[J]. 水生生物学集刊, 1975, 5(3): 293–312. KO H W.An excellent fresh-water food fish, Megalobrama amblycephala, and its propagating and culturing[J]. Acta Hydrobiologica Sinica, 1975, 5(3): 293–312. |
| [2] | ZHOU Q C, WU Z H, CHI S Y, et al.Dietary lysine requirement of juvenile cobia (Rachycentron canadum)[J]. Aquaculture, 2007, 273(4): 634–640. |
| [3] | SMALL B C, SOARES J R.Quantitative dietary lysine requirement of juvenile striped bass Morone saxatilis[J]. Aquaculture Nutrition, 2000, 6(4): 207–212. |
| [4] | 周贤君, 解绶启, 谢从新, 等.异育银鲫幼鱼对饲料中赖氨酸的利用及需要量研究[J]. 水生生物学报, 2006, 30(3): 247–255. ZHOU X J, XIE S Q, XIE C X, et al.The utilization and requirement of dietary lysine for juvenile gibel carp[J]. Acta Hydrobiologica Sinica, 2006, 30(3): 247–255. |
| [5] | LI X F, LIU W B, JIANG YY, et al.Effects of dietary protein and lipid levels in practical diets on growth performance and body composition of blunt snout bream (Megalobrama amblycephala) fingerlings[J]. Aquaculture, 2010, 303(1/4): 65–70. |
| [6] | ZHOU C, LIU B, GE X, et al.Effect of dietary carbohydrate on the growth performance, immune response, hepatic antioxidant abilities and heat shock protein 70 expression of Wuchang bream, Megalobrama amblycephala[J]. Journal of Applied Ichthyology, 2013, 29(6): 1348–1356. |
| [7] | 蒋阳阳, 李向飞, 刘文斌, 等.不同蛋白质和脂肪水平对1龄团头鲂生长性能和体组成的影响[J]. 水生生物学报, 2012, 36(5): 826–836. JIANG Y Y, LI X F, LIU W B, et al.Effects of different protein and lipid levels on the growth performance and body composition of blunt snout bream (Megalobrama amblycephala) yearlings[J]. Acta Hydrobiologica Sinica, 2012, 36(5): 826–836. |
| [8] | REN M C, LIAO Y J, XIE J, et al.Dietary arginine requirement of juvenile blunt snout bream, Megalobrama amblycephala[J]. Aquaculture, 2013, 414. |
| [9] | 姚林杰, 叶元土, 蔡春芳, 等.团头鲂两个生长阶段适宜蛋白/脂肪比的需要量[J]. 水产学报, 2014, 38(6): 861–868. YAO L J, YE Y T, CAI C F, et al.Research on the optimal protein to lipid (energy) ratio of blunt snout bream (Megalobrama amblycephala) in two growth stages[J]. Journal of Fisheries of China, 2014, 38(6): 861–868. |
| [10] | 林淑琴. 不同生长阶段大黄鱼的蛋白质和蛋/能比营养研究[D]. 青岛:中国海洋大学, 2013. LIN S Q. Effects of dietary protein levels and its ratio to energy on growth performances and metabolic responses of large yellow croaker at different stages[D]. Qingdao:Ocean University of China, 2013. |
| [11] | 廖英杰, 刘波, 任鸣春, 等.赖氨酸对团头鲂幼鱼生长、血清生化及游离必需氨基酸的影响[J]. 水产学报, 2013, 37(11): 1716–1724. LIAO Y J, LIU B, REN M C, et al.Effects of lysine on growth, physiological and biochemical indexes of blood and essential amino acids of serum in juvenile blunt snout bream (Megalobrama amblycephala)[J]. Journal of Fisheries of China, 2013, 37(11): 1716–1724. |
| [12] | Association of Official Analytical Chemists (AOAC).Official Methods of Analysis 16th ed[M].Washington: Association of Official Analytical Chemists, 1995. |
| [13] | QI G S, AI Q H, MAI K S, et al.Effects of dietary taurine supplementation to a casein-based diet on growth performance and taurine distribution in two sizes of juvenile turbot (Scophthalmus maximus L.)[J]. Aquaculture, 2012: 122–128. |
| [14] | MATSUNARI H, FURUITA H, YAMAMOTO T, et al.Effect of dietary taurine and cystine on growth performance of juvenile red sea bream Pagrus major[J]. Aquaculture, 2008, 274(1): 142–147. |
| [15] | KAUSHIK S J, FAUCONNEAU B.Effects of lysine administration on plasma arginine and on some nitrogenous catabolites in rainbow trout[J]. Comparative Biochemistry and Physiology Part A:Physiology, 1984, 79(3): 459–462. |
| [16] | KIM K, KAYES T B, Amundson C H.Requirements for lysine and arginine by rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 1992, 106(3/4): 333–344. |
| [17] | LUO Z, LIU Y J, MAI K S, et al.Advance in researches on arginine requirement for fish:a review[J]. Journal of fisheries of China, 2004, 28(4): 450–459. |
| [18] | ZHOU F, XIONG W, XIAO J X, et al.Optimum arginine requirement of juvenile black sea bream, Sparus macrocephalus[J]. Aquaculture Research, 2010, 41(10): 418–430. |
| [19] | 李爱杰.水产动物营养与饲料学[M].北京: 中国农业出版社, 1996. LI A J.Aquatic animal nutrition and feed science[M].Beijing: China Agricultural Press, 1996. |
| [20] | 陈义方, 林黑着, 牛津, 等.不同规格南美白对虾蛋白质需要量的研究[J]. 广东农业科学, 2011, 38(13): 118–121. CHEN Y F, LIN H Z, NIU J, et al.Dietary protein requirements for three sizes of pacific white shrimp, Litopenaeus vannamei[J]. Guangdong Agricultural Sciences, 2011, 38(13): 118–121. |
| [21] | YANG S D, LIU F G, LIOU C H.Assessment of dietary lysine requirement for silver perch (Bidyanus bidyanus) juveniles[J]. Aquaculture, 2011, 312(1/4): 102–108. |
| [22] | 严全根, 解绶启, 雷武, 等.许氏平鲉幼鱼的赖氨酸需求量[J]. 水生生物学报, 2006, 30(4): 459–465. YAN Q G, XIE S Q, LEI W, et al.Quantitative dietary lysine requirement for juvenile Sebastes schlegeli[J]. Acta Hydrobiologica Sinica, 2006, 30(4): 459–465. |
| [23] | GRISDALE-HELLAND B, HATLEN B, MUNDHEIM H, et al.Dietary lysine requirement and efficiency of lysine utilization for growth of Atlantic cod[J]. Aquaculture, 2011, 315(3/4): 260–268. |
| [24] | CHATZIFOTIS S, TAKEUCHI T, SEIKAI T.The effect of dietary carnitine supplementation on growth of red sea bream (Pagrus major) fingerlings at two levels of dietary lysine[J]. Aquaculture, 1996, 147(3/4): 235–248. |
| [25] | TANTIKITTI C, CHIMSUNG N.Dietary lysine requirement of freshwater catfish (Mystus nemurus Cuv. & Val.)[J]. Aquaculture Research, 2001, 32(S1): 135–141. |
| [26] | 周玉, 郭文场, 杨振国.鱼类血液学指标研究的进展[J]. 上海水产大学学报, 2001, 10(2): 163–165. ZHOU Y, GUO W C, YANG Z G.Advances in the study of haemotological indices of fish[J]. Journal of Shanghai Fisheries University, 2001, 10(2): 163–165. |
| [27] | FYNN-AIKINS K, HUGHES S G, VANDENBERG G W.Protein retention and liver aminotransferase activities in Atlantic salmon fed diets containing different energy sources[J]. Comparative Biochemistry and Physiology-Part A:Physiology, 1995, 111(1): 163–170. |
| [28] | 刘颖. 饲料蛋白水平及蛋白质量对彭泽鲫养殖全期生长的影响[D]. 北京:中国农业科学院, 2008. LIU Y. Long-term effects of dietary protein levels and protein quality on growth performance on crucian carp (Carassius aruatus, Pengze):two-year study[D]. Beijing:Chinese Academy of Agricultural Sciences, 2008. |
| [29] | AFFONSO E G, DA COSTA SILVA E, TAVARES-DIAS M, et al.Effect of high levels of dietary vitamin C on the blood responses of matrinxã (Brycon amazonicus)[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2007, 147(2): 383–388. |
| [30] | 万金娟, 刘波, 戈贤平, 等.日粮中不同水平维生素C对团头鲂幼鱼免疫力的影响[J]. 水生生物学报, 2014, 38(1): 10–18. WAN J J, LIU B, GE X P, et al.Effects of dietary vitamin C on the non-specific immunity, three HSPs mRNA expression and disease resistance of juvenile Wuchang bream (Megalobrama amblycephala)[J]. Acta Hydrobiologica Sinica, 2014, 38(1): 10–18. |
| [31] | 王建红, 刁其玉, 许先查, 等.赖氨酸、蛋氨酸和苏氨酸对犊牛生长性能和血清生化指标的影响[J]. 动物营养学报, 2011, 23(2): 226–233. WANG J H, DIAO Q Y, XU X C, et al.Effects of lysine, methionine and threonine supplementation on growth performance and serum biochemical parameters of calves[J]. Chinese Journal of Animal Nutrition, 2011, 23(2): 226–233. |
| [32] | BERGE G E, LIED E, SVEIER H.Nutrition of Atlantic Salmon (Salmo salar):The Requirement and Metabolism of Arginine[J]. Comparative Biochemistry and Physiology Part A:Physiology, 1997, 117(4): 501–509. |
| [33] | TANTIKITTI C, CHIMSUNG N.Dietary lysine requirement of freshwater catfish (Mystus nemurus Cuv. & Val.)[[J]. Aquaculture Research, 2001, 32(S1): 135–141. |
| [34] | CHEN H Y, LEU Y T, ROELANTS I.Quantification of arginine requirements of juvenile marine shrimp, Penaeus monodon, using microencapsulated arginine[J]. Marine Biology, 1992, 114(2): 229–233. |
| [35] | MAI K, WAN J L, AI Q H, et al.Dietary methionine requirement of large yellow croaker, Pseudosciaena crocea R[J]. Aquaculture, 2006, 253(1/4): 564–572. |
| [36] | RUCHIMAT T, MASUMOTO T, HOSOKAWA H, et al.Quantitative lysine requirement of yellowtail (Seriola quinqueradiata)[J]. Aquaculture, 1997, 158(3/4): 331–339. |
| [37] | BERGE G E, BAKKE-MCKELLEP A M, LIED E.In vitro uptake and interaction between arginine and lysine in the intestine of Atlantic salmon (Salmo salar)[J]. Aquaculture, 1999, 179(1/4): 181–193. |
2. Freshwater Fisheries Research Center, Chinese Academy of Fisheries Sciences, Wuxi 214081, Jiangsu, China
 2016,
Vol. 25
2016,
Vol. 25


