鲻鱼(Mugil cephalus)隶属鲻形目(Mugiliformes)、鲻科(Mugilidae)、鲻属(Mugil),俗称乌头[1, 2]。在世界各地的热带和亚热带海域都有分布。在我国的渤海、黄海、东海、南海四大海域都有分布,属于广盐性鱼类,适宜在咸淡水的近海生长[3]。鲻鱼以生长快、适应能力强、个体大、饵料要求低等优点被誉为“海洋中的牛羊”,是世界很多国家的重要养殖品种[4]。由于鲻鱼具有良好的养殖效益,养殖户对鲻鱼养殖具有很高的热情,然而苗种的来源一直限制着鲻鱼养殖业的发展。我国自20世纪六十年代开始对鲻鱼的人工繁殖进行探索[5],国家海洋局第三海洋研究所对鲻鱼进行了早期卵子发生、全雌鲻鱼培育的研究[6, 7],中国水产科学研究院南海水产研究所对鲻鱼的人工繁殖和仔鱼发育及营养进行了研究[8],福建海洋研究所研究了鲻鱼精子发生的过程[9],因养殖环境下性腺成熟度参差不齐和雌雄比例失调等问题[10],苗种的规模化生产依然很难实现。本研究报道了鲻鱼的亲鱼催熟、人工催产等人工繁育关键技术,同时观察其胚胎发育特征,旨在为我国开展鲻鱼的人工育苗、规模化养殖和利用提供基础科学依据。
1 材料与方法 1.1 亲鱼实验用亲鱼为珠海市龙胜良种鱼苗培育公司从自然海域捕获并于池塘驯养一年。雌、雄均为2~4龄,平均体质量雌鱼3 kg以上,雄鱼2 kg以上;雌鱼性腺发育良好,腹部膨胀明显,雄鱼体格健壮,体表光滑可挤出精液。将亲鱼从养殖池转到产卵池中暂养,并强化营养,促进性腺成熟。
1.2 产前催熟将体质健壮、性腺发育良好的亲鱼从低盐度池塘中转移到高盐度的圆形产卵池内,产卵池以5 m×6 m×1 m为宜,产卵池盐度保持在27~31。投喂粗蛋白含量40%以上的优质海水鱼饲料,每日投喂两次,投喂量以亲鱼半小时能吃完为宜。每周换水2~3次,保持水质清新。
1.3 催产与受精选择性腺发育成熟的亲鱼进行催产,采用一次背鳍基或胸鳍基注射法。催产激素为HCG(宁波市激素制品厂,鱼用)、LRH-A2(上海丽珠东风生物技术有限公司)两种激素配合使用,雌鱼注射剂量为HCG 1 000 IU / kg+LRH-A2 10 μg / kg,雄鱼减半,每尾鱼的注射剂量控制在2.5 mL以内。催产后的亲鱼按雌雄比例1∶2的比例放入4个不同温度梯度的产卵池中。温度设置为10~13 ℃、14~17 ℃、18~21 ℃、22~25 ℃,增氧泵24 h增氧。注意观察亲鱼活动,亲鱼在水泥池内自然产卵受精,记录亲鱼催产及产卵时间,发现亲鱼交尾产卵后,及时收集鱼卵。将从不同温度的产卵池中收集到的鱼卵分离后,取上层漂浮受精卵用50 mL/m3的聚维酮碘(含有效碘10%)水溶液浸洗后再用清洁的过滤海水清洗后放入相应温度的圆形孵化桶中孵化,记录鱼卵的孵化出膜时间。
1.4 受精卵孵化与胚胎发育观察圆形孵化桶在使用前,彻底清洗消毒,孵化用水盐度为25~32,pH为7.8~8.4,溶解氧5 mg/L以上,氨氮及亚硝酸盐在安全范围内。注意控制充气量,以气泡冲出水面泛起水花为宜。在江南生物显微镜下连续观察胚胎发育的全过程,详细记录各期形态特征并拍照。以半数以上鱼卵所处时期确定为该批次鱼卵达到的发育时期。
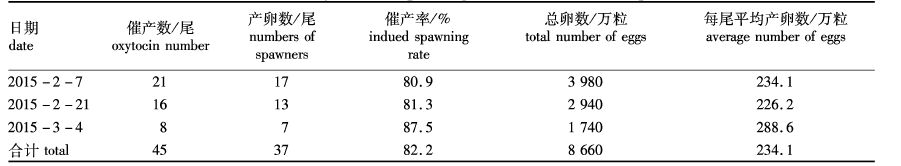
2 结果 2.1 鲻鱼人工催产和产卵情况2015年2月7日至3月4日前后进行3次催产,雌鱼一共催产了45尾,产卵37尾,平均产卵率为82.2%,总产卵量约为8 660万粒,每尾雌鱼平均产卵234.1万粒(表1)。
|
表1 鲻鱼的人工催产情况 Tab. 1 Artifically induced spawning with hormone of M.cephalus |
设置10~13 ℃、14~17 ℃、18~21 ℃、22~25 ℃ 4组温度梯度,每组30条亲鱼,探究水温对鲻鱼催产注射后效应时间和受精卵孵化时间的影响。效应时间是指每组亲鱼中有50%开始产卵的时间,孵化时间是指同时受精的一批卵子中有50%孵化出膜时所用的时间,结果如表2所示:水温为10~13 ℃时,效应时间为60 h,孵化时间为83 h,孵化率为53%;水温为14~17 ℃时,效应时间为51 h,孵化时间为70 h,孵化率为67%;水温为18~21 ℃时,效应时间为43 h,孵化时间为61 h,孵化率为84%;水温为22~25 ℃时,效应时间为36 h,孵化时间为52 h,孵化率为72%。最高温度组与最低温度组效应时间相差24 h,孵化时间相差31 h。表明在温度为10~25 ℃范围内,鲻鱼的效应时间和孵化时间随温度的升高而缩短,孵化率随温度的升高呈先升高后降低趋势,在18~21 ℃时孵化率最高。

|
表2 不同温度对鲻鱼效应时间、孵化时间和孵化率的影响 Tab. 2 The effects of different temperature on response time,incubation time and hatching rate of M.cephalus |
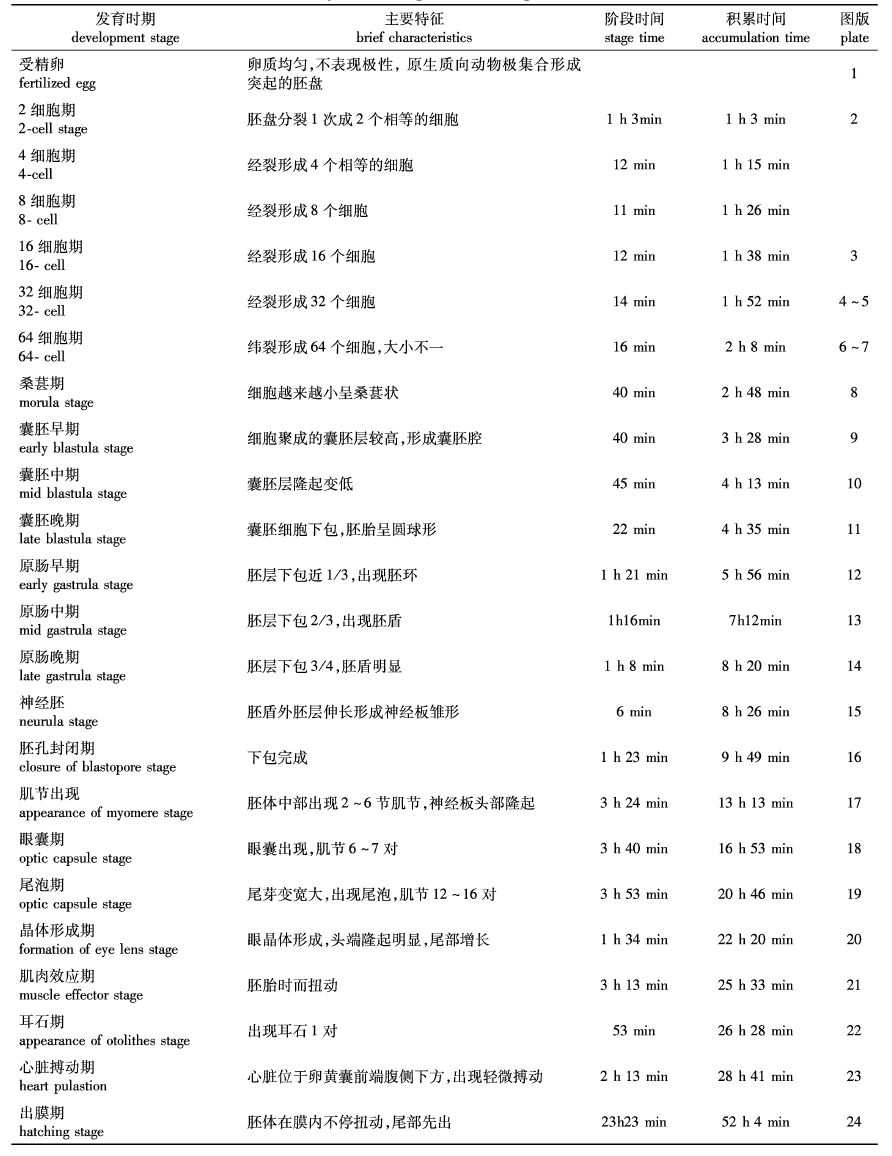
鲻鱼受精卵胚胎发育过程总体可分为7个大的发育时期:胚胎形成期、卵裂期、囊胚期、原肠胚期、神经胚期、器官形成期、出膜期等。整个阶段还可以细分为25个时期,取水温在22~25 ℃的条件下胚胎发育过程进行观察描述(表3)。
|
表3 鲻鱼胚胎发育(22~25 ℃) Tab. 3 Embryonic development of M.cephalus(22~25 ℃) |
鲻鱼成熟卵为圆球形,无色透明,浮性卵,卵遇水吸水膨胀,卵中心有一个大油球,油球直径约占卵直径的50%~60%。吸水膨胀约5 min后达到最大,膨胀后卵膜直径(316.4±6.9) μm,油球直径为(190.8±5.0) μm(图版-1)。受精8~15 min后,受精卵的卵质由原先的均匀分布开始向动物极集中,形成慢慢隆起的胚盘。
2.3.2 卵裂期受精后1 h 3 min,第一次卵裂,为经裂,将胚盘分为相等的2份,12 min后进行第二次卵裂,将胚盘分为相等的4份,第二次卵裂与第一次卵裂沟垂直,为经裂。受精卵前5次卵裂都是经裂,且每次卵裂间相互垂直(图版-2~6)。第6次为纬裂,将胚盘分为相等的64份(图版-7),之后细胞越分越小,细胞聚集成团在动物极隆起,呈桑葚状(图版-8)。
2.3.3 囊胚期受精卵发育2 h 48 min,细胞分裂形成隆起的囊胚层,经40 min达到最高,此时为囊胚早期(图版-9),之后囊胚层慢慢降低,细胞向下转移。受精4 h 35 min,囊胚层明显下包,囊胚层呈平扁状,整个胚胎呈圆形,此时进入囊胚晚期(图版-11)。
2.3.4 原肠胚期受精卵发育5 h 56 min,囊胚层下包整个卵黄约1 / 3,此时胚环出现,进入原肠早期(图版-12)。经历1 h 16 min后,囊胚层下包卵黄约2 / 3,胚盾出现,此时进入原肠中期(图版-13)。囊胚层继续下包达卵黄的3 / 4,卵黄囊呈倒梨状,胚盾明显,进入原肠晚期(图版-14),此时受精卵已发育8 h 20 min。
2.3.5 神经胚期受精卵发育8 h 26 min,此时囊胚层下包至卵黄底部,胚盾外胚层延伸到胚体前段,形成神经板雏形,此时为神经胚期(图版-15)。之后经过1 h 23 min,胚孔逐渐关闭,此时为胚孔关闭期(图版-16)。之后可以观察到有1~3对肌节出现,神经板头部隆起,中间有凹陷,尾部逐渐明显,此时为肌节出现期(图版-17),受精卵已发育13 h 13 min。
2.3.6 器官出现期受精卵发育到14 h 33 min,眼囊在头部出现,进入了眼囊期(图版-18)。再经过2 h 17 min,尾部和卵黄囊分离,可以轻微颤动,肌节7~8对。尾芽和卵黄囊分离时带出一个泡状结构,为尾泡期(图版-19),此时受精卵发育20 h 46 min。再经过1 h 34 min,尾泡逐渐消失,眼晶体慢慢出现,此时为晶体形成期(图版-20)。胚胎发育到25 h 33 min,尾部逐渐增长,胚胎身体开始出现轻微的颤动,此时为肌肉效应期(图版-21)。在其后的55 min里,耳石出现(图版-22)。在28 h 41 min,观察到胚胎头部腹侧下方出现心脏,可以轻微地跳动(图版-23)。在之后的4 h 41 min里,胚胎体内出现血液沿固定路线缓慢流动。
2.3.7 出膜期血液循环出现后,血管数量逐渐增多,血流量逐渐增大。胚胎发育到29 h时,仔鱼在膜内不断扭动,卵膜逐渐软化,尾部首先从卵膜中伸出,整个扭动到出膜过程持续23 h 23 min,之后仔鱼挣脱卵膜(图版-24)。出膜后仔鱼身体是弯曲的,只能随水流移动。初孵仔鱼靠卵黄囊提供营养,两日后卵黄囊消耗殆尽,仔鱼开始开口摄食水中的浮游生物。
3 讨论 3.1 温度与效应时间和胚胎发育时间的关系温度对鱼类的生理活动有直接的影响[11]。鱼类受精卵胚胎发育时间随温度的升高而降低。厚颌鲂在水温19.5 ℃和28.8 ℃条件下,胚胎发育时间分别为68 h 50 min和31 h 40 min[12];条斑星鲽胚胎发育的最适水温为8~10 ℃[13];白斑狗鱼在18 ℃时发育时间最短为117.56 h,但孵化率也偏低为50.25%[14];似刺鳊在水温为20 ℃和24 ℃时,孵化时间分别为95.3 h和73.5 h,孵化率分别为50%和80%[15];宝石鲈在27 ℃孵化率最高为82%,孵化时间为18 h 2 min[16]。研究发现,水温在10~25 ℃范围内,鲻鱼的效应时间和孵化时间随温度的升高而缩短,而孵化率呈先升高后降低的趋势,这同其他鱼类的研究结果是一致的。大多数的鱼类胚胎中都具有促使胚胎发育的孵化酶,由具有起源于外胚层的单细胞孵化腺所分泌。孵化酶的活性受温度影响:在孵化过程中温度降低,可以减缓孵化酶的分泌并降低其活性,导致胚胎发育过程缓慢,并能降低胚胎的孵化率[17, 18]。也有学者认为,鱼类的胚胎发育过程与有效积温有关,变温动物要完成一段生长发育过程,必须从环境中摄取一定的热量。所摄取的总热量为一个常数,即为有效积温[19, 20]。在适宜的范围内,升高温度,鱼类达到有效积温的时间就会缩短。鲻鱼胚胎发育过程符合硬骨鱼胚胎发育的一般特征。
3.2 繁殖特性在自然界,鲻鱼存在雌雄比例严重失调的问题,有研究发现,自然界中捕到的鲻鱼雌雄比例为9∶1[10]。人工养殖繁殖过程中,在选择后备亲鱼时可适当增加雄鱼的比例,从而保证繁殖时雌鱼排出卵子的受精率。
亲鱼性腺的成熟度对鲻鱼人工繁殖和孵化出仔鱼的质量有直接影响。产前催熟是实现鲻鱼大规模人工繁殖的关键步骤,鲻鱼属广盐性鱼类,可以在盐度很低的水中生存,但是要在较高盐度的海水中性腺才能完全发育成熟,自然产卵[18],因此产卵前要将亲鱼转移到高盐度的产卵池里。投喂优质蛋白饲料,强化营养,促进性腺发育成熟。 注射合适剂量的催产激素是鲻鱼人工繁殖成功的另一关键步骤,经过大量对比实验,发现对亲鱼注射1 000 IU/kg HCG+10 μg /kg LRH-A2可以达到较好的催产效果。采用一次催产注射方法,不仅可以达到较好的催产效果,且比两次注射对亲鱼的伤害更小,孵出的鱼苗活力比人工授精得到的鱼苗旺盛,抗逆性强。
感谢珠海龙胜鱼苗培育有限公司汤清亮总经理、广东海洋大学朱春华教授对实验的帮助和指导。
| [1] | 吴文婵.鲻鱼胚胎发育及规模化繁育技术的研究[J].北京农业, 2012(15):137-138.WU W C. Mullet embryonic development and large scale breeding technology research[J]. Beijing Agriculture, 2012(15):137-138. |
| [2] | MARAIS J F K. Aspects of food intake, food selection, and alimentary canal morphology of Mugil cephalus (Linnaeus, 1958), Liza Tricuspidens (Smith, 1935), L. Richardsoni (Smith, 1846), and L. Dumerili (Steindachner, 1869)[J]. Journal of Experimental Marine Biology and Ecology, 1980, 44(2):193-209. |
| [3] | DE SILVA S S, WIJEYARATNE M J S. Studies on the biology of young grey mullet, Mugil cephalus L. Ⅱ. Food and Feeding[J]. Aquaculture, 1977, 12(2):157-167. |
| [4] | LEE C S, TAMARU C S. Advances and future prospects of controlled maturation and spawning of grey mullet (Mugil cephalus L.) in captivity[J]. Aquaculture, 1988, 74(1/2):63-73. |
| [5] | 张寿山.鲻鱼人工育苗技术研究的现状和动向[J].水产科技情报, 1981(1):8-9.ZHANG S S. The present situation and trend of mullet artificial seedling technique[J]. Fisheries Science & Technology Information, 1981(1):8-9. |
| [6] | 方永强,翁幼竹,洪万树,等.鲻鱼早期卵子发生的超微结构研究[J].水生生物学报, 2001, 25(6):583-589.FANG Y Q, WENG Y Z, HONG W S, et al. An ultrastructural study of the early oogenesis in striped mullet, Mugil cephalus[J]. Acta Hydrobiologica Sinica, 2001, 25(6):583-589. |
| [7] | 方永强,翁幼竹,林君卓,等.全雌鲻鱼培育的研究[J].水产学报, 2001, 25(2):131-135.FANG Y Q, WENG Y Z, LIN J Z, et al. Studies on the cultivation of all-female in Mugil cephalus[J]. Journal of Fisheries of China, 2001, 25(2):131-135. |
| [8] | 区又君.鲻鱼人工繁殖技术[J].海洋与渔业, 2008(6):30-31.OU Y J. Artificial propagation of grey mullet (Mugil cephalus)[J]. Ocean and Fishery, 2008(6):30-31. |
| [9] | 林君卓,翁幼竹,方永强,等.鲻鱼精子发生的组织学研究[J].台湾海峡, 2001, 20(1):57-60.LIN J Z, WENG Y Z, FANG Y Q, et al. A histological study on spermatogenesis of grey mullets, Mugil cephalus[J]. Journal of Oceanography in Taiwan Strait, 2001, 20(1):57-60. |
| [10] | 蔡良侯,叶金聪,郑镇安,等.鲻鱼人工繁殖研究[J].台湾海峡, 1997, 16(2):223-228.CAI L H, YE J C, ZHENG Z A, et al. Studies on artificial propagation of grey mullet (Mugil cephalus)[J]. Journal of Oceanography in Taiwan Strait, 1997, 16(2):223-228. |
| [11] | 楼允东.淡水鲻鱼的性腺发育[J].水产科技情报, 1997(1/2):47-49.LOU Y D. The gonad development of freshwater mullet[J]. Fisheries Science & Technology Information, 1997(1/2):47-49. |
| [12] | 王剑伟,谭德清,李文静.厚颌鲂人工繁殖初报及胚胎发育观察[J].水生生物学报, 2005, 29(2):130-136.WANG J W, TAN D Q, LI W J. Preliminary studies on artificial propagation and embryonic development of Megalobrama pellegrini[J]. Acta Hydrobiologica Sinica, 2005, 29(2):130-136. |
| [13] | 王妍妍,柳学周,刘新富,等.温度、盐度对条斑星鲽胚胎发育的影响[J].海洋水产研究, 2008, 29(6):27-32.WANG Y Y, LIU X Z, LIU X F, et al. Effects of temperature and salinity on embryonic development of barfin flounder Verasper moseri[J]. Marine Fisheries Research, 2008, 29(6):27-32. |
| [14] | 齐遵利,张秀文,韩叙,等.温度对白斑狗鱼胚胎发育的影响[J].淡水渔业, 2010, 40(4):76-79.QI Z L, ZHANG X W, HAN X, et al. The effect of temperature on embryonic development of Esox lucius[J]. Freshwater Fisheries, 2010, 40(4):76-79. |
| [15] | 徐钢春,张守领,顾若波,等.温度、盐度对似刺鳊(鱼句)胚胎发育过程的影响[J].淡水渔业, 2012, 42(1):72-75.XU G C, ZHANG S L, GU R B, et al. Effects of temperature and salinity on the embryonic development of Paracanthobrama guichenoti[J]. Freshwater Fisheries, 2012, 42(1):72-75. |
| [16] | 陈昆慈,朱新平,杜合军,等.温度和盐度对宝石鲈胚胎发育的影响[J].中国水产科学, 2007, 14(6):1032-1037.CHEN K C, ZHU X P, DU H J, et al. Effects of temperature and salinity on the embryonic development of jade perch Scortum barcoo[J]. Journal of Fishery Sciences of China, 2007, 14(6):1032-1037. |
| [17] | 樊廷俊,史振平.鱼类孵化酶的研究进展及其应用前景[J].海洋与湖沼通报, 2002(1):48-56.FAN T J, SHI Z P. Advances and prospect in fish hatching enzyme research[J]. Transactions of Oceanology and Limnology, 2002(1):48-56. |
| [18] | 孙儒泳.动物生态学原理[M].北京:北京师范大学出版社, 1986:36-39.SUN R Y. The Principle of Animal Ecology[M]. Beijing:Beijing Normal University Press, 1986:36-39. |
| [19] | 施瑔芳.鱼类生理学[M].北京:农业出版社, 1999:300-319.SHI Q F. Fish Physiology[M]. Beijing:Agricultural Press, 1999:300-319. |
| [20] | WHITFIELD A K, PANFILI J, DURAND J D. A global review of the cosmopolitan flathead mullet Mugil cephalus Linnaeus 1758(Teleostei:Mugilidae), with emphasis on the biology, genetics, ecology and fisheries aspects of this apparent species complex[J]. Reviews in Fish Biology and Fisheries, 2012, 22(3):641-681. |
 2015, Vol. 24
2015, Vol. 24


