2. 大洋渔业资源可持续开发省部共建教育部重点实验室, 上海 201306;
3. 农业部大洋渔业资源环境科学观测试验站, 上海 201306;
4. 国家远洋渔业工程技术研究中心, 上海 201306;
5. 远洋渔业协同创新中心, 上海 201306
热休克蛋白(Heat Shock Proteins,HSPs)是生物体在环境高温、物理、化学、生物应激原等的刺激下诱导生成的一组蛋白质,此外,缺血、寒冷、饥饿、感染、细胞因子等机体内环境的变化也能够诱导HSPs的生成[1, 2]。热休克蛋白是一组分子伴侣蛋白,广泛存在于从原核到真核生物的各种生物体内,在细胞生长、发育和调节过程中发挥着重要的生物学功能。根据分子量的大小,HSPs分为HSP110、90、70、60、47、32等类型[3]。
HSP90是HSPs家族的重要成员之一,在进化过程中高度保守,在多种生物体中都有表达[4]。HSP90可以分为5个亚家族:细胞质HSP90、内质网Grp94、线粒体TRAP1、叶绿体HSP90和细菌HtpG[5]。研究表明,人类的HSP90主要存在5种亚型,其中HSP90α和HSP90β这两种亚型位于胞质内[6]。HSP90参与细胞周期调控、细胞存活、激素等许多信号通路,对于维持细胞的内稳态发挥着关键作用[5]。27.5 ℃热激西伯利亚鲟1 h,其脑、鳃、脾脏的HSP70表达量升高[7]。9℃冷应激处理吉富罗非鱼12 h后,Hsp70 mRNA水平显著升高[8]。在水生动植物中,HSP90参与冷激和热激的耐受、高盐和低盐的耐受、疾病防御等过程。高温处理三疣梭子蟹,其肌肉和肝胰腺中ptHSP90-1积累;低温刺激三疣梭子蟹,其肝胰腺和鳃中的HSP90转录水平升高[9]。条斑紫菜在0℃和10℃的低温胁迫下,HSP90被诱导表达,且温度越低,HSP90表达量越高[10]。
鲈形目的南极鱼亚目鱼类是南大洋动物群的主要部分,南极大陆的分离使南冰洋成为地球上最寒冷、最稳定的一片水域。在适应低温的进化过程中,许多南极鱼的蛋白质家族都发生了功能适应性进化,包括伴侣蛋白[11]、热休克蛋白 [12, 13]、血红素蛋白[14, 15]、微管蛋白[16]和抗冻蛋白[17, 18]等,同时会导致增强耐热性和促进短期环境温度变化的适应性等一些功能的丧失。4 ℃条件下培养21 d后的伯氏肩孔南极鱼(Trematomus bernacchii),鳃、肌肉和脑中的HSP70亚型数量和HSPs水平增加,这可能是诱导型基因的构成性表达,该研究还发现,与温带南极鱼相比,南极的南极鱼具有较少的HSP70亚型[19, 20]。CHEN等对南极犬牙鱼的转录组分析发现,HSP90β和HSP70基因表达显著上调[21]。
独角雪冰鱼(Chionodraco hamatus)隶属于鲈形目、南极鱼亚目,鳄冰鱼科,长期生活在南极深海水域中。HSP90作为一种应激蛋白和分子伴侣,在生物耐受各种逆境胁迫方面发挥重要的生物学功能。本研究从南极独角雪冰鱼中克隆HSP90β基因的CDS区,分析其蛋白质的结构、性质,并研究其在低温胁迫下对大肠杆菌的细胞保护功能,为后续进一步研究HSP90β基因在南极鱼低温适应过程中的功能提供理论基础。
1 材料与方法 1.1 材料独角雪冰鱼(Chionodraco hamatus,CH)由雪龙号科考人员采样于南极埃默里冰架。尼罗罗非鱼(Oreochromis niloticus,ON)采集于上海浦东新区南汇水产养殖场。
1.2 主要试剂Trizol Reagent和抗体购自Life Technologies,反转录试剂盒和PCR相关试剂均为TaKaRa公司产品,pBLUE-T载体购自北京艾德莱生物科技有限公司,质粒小提试剂盒由上海生工生物科技有限公司提供,限制性内切酶EcoR Ⅰ 和 Xho Ⅰ来自NEB。
1.3 方法 1.3.1 总RNA提取和反转录取约100 mg独角雪冰鱼的鳃组织,利用Trizol Reagent(Invitrogen)、饱和酚、氯仿等提取总RNA。1.0%琼脂糖凝胶电泳检测RNA完整性,紫外分光光度计测定RNA浓度及纯度。以2 μg的RNA为模板,Oligo(dT)为反转录引物,反转录得到第一链cDNA。用同样的方法提取罗非鱼鳃的RNA,反转录得到cDNA。
1.3.2 HSP90β ORF克隆根据NCBI上已登录的尖吻鲈的HSP90β的CDS序列设计上下游引物HSP90β_F1(5′- CGGAATTCCAGATGCCTGAAGAAATGCACC-3′),HSP90β_R1(5′-CCGCTCGAGTTAATCGACTTCT TCCATGCG-3′)扩增独角雪冰鱼HSP90β基因的开放阅读框序列。根据NCBI数据库中的尼罗罗非鱼(Oreochromis niloticus)HSP90β的CDS序列设计引物HSP90β_F2(5′- CGGAATTCAT GCCTGAAGAAATGCACCA-3′),HSP90β_R2(5′-CCGCTCGAGTTAATCCAC TTCTTCCATGCG -3′)扩增尼罗罗非鱼HSP90β的开放阅读框全长序列。
以反转录的cDNA为模板,PCR反应体系为Taq酶:0.25 μL,DNA模板1 μL,10×PCR buffer: 2.5 μL,dNTPs: 2 μL,引物:各0.5 μL,ddH2O:至25 μL。PCR反应程序为:95 ℃ 5 min;95 ℃ 30 s,60 ℃ 45 s,72 ℃ 2 min,35个循环;72 ℃ 10 min。以1.0%的琼脂糖凝胶电泳后,胶回收PCR片段,连接pBLUE-T载体,转化E.coli Top10细胞,蓝白斑筛选,挑取单克隆进行菌液PCR,将阳性克隆的菌液送至上海生工生物工程有限公司测序。
1.3.3 氨基酸基本特征和系统进化分析测序所得核苷酸结果在Genbank数据库Blast,进行同源序列搜索比对,用DNASTAR软件找出开放阅读框,同时使用ExPASy分子生物学序列分析工具包括翻译、评估pI/MW和Blast分析推导氨基酸序列,根据SMART软件推测其保守结构域。使用MEGA 6.06构建系统进化树。
1.3.4 原核表达载体构建及重组质粒诱导表达将测序正确的独角雪冰鱼和尼罗罗非鱼的pBLUE-T-HSP90β质粒进行EcoR Ⅰ和Xho Ⅰ双酶切,胶回收HSP90β目的片段,连接EcoR Ⅰ和Xho Ⅰ双酶切后的pET28a(+)载体,转化至E.coli Top10细胞中,用含有卡那霉素抗性的平板筛选,将连接成功的pET28-HSP90β重组质粒转化至大肠杆菌表达菌株DE3(BL21)细胞中培养。挑取含有pET28-HSP90β重组质粒的单克隆于含有卡纳霉素的LB液体培养基中,37 ℃振荡培养至OD600为0.4~0.6,加入IPTG至浓度为0.2 mmol/L,37 ℃继续培养。分别在加入IPTG后的2、4、6、8、10、12 h收集500 μL菌液,4 ℃、11 304 r/min离心1 min后加入60 μL PBS重悬细胞,加入SDS上样缓冲液和β-巯基乙醇煮沸10 min,进行SDS-PAGE电泳,检测重组质粒pET28-HSP90β蛋白表达的变化。取诱导表达12 h的蛋白,Western Blotting验证表达蛋白是否为目的蛋白。
1.3.5 低温胁迫下大肠杆菌生长状况分别挑取含有pET28a(+)空载体质粒、pET28-CH-Hsp90和pET28-ON-Hsp90重组质粒的单菌落于装有20 mL LB液体培养基(含50 μg/mL的卡那霉素)的锥形瓶中,37 ℃培养至OD600=0.4~0.6,加入终浓度为0.2 mmol/L的IPTG,37 ℃继续培养12 h。测定OD600,将实验组和对照组菌液稀释至OD600=1.0后,再将菌液稀释10-5倍,取100 μL涂布到含有卡那霉素的LB平板上,将涂好菌液的平板放到4 ℃冰箱低温处理,分别在处理0、4、8、12 h后取出平板,转移到37 ℃培养箱培养20 h,计数每个平板上长出的单克隆的个数,每个时间点做3个平行,实验重复3次[22]。
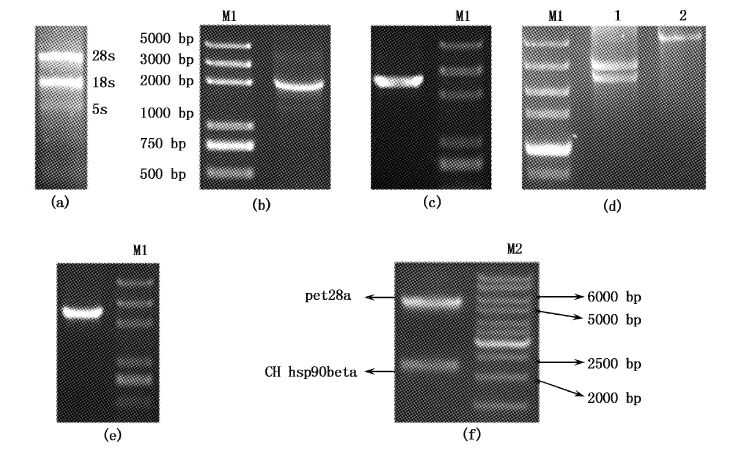
2 结果 2.1 独角雪冰鱼 HSP90β基因的克隆提取独角雪冰鱼鳃组织的RNA,琼脂糖凝胶电泳可见28S和18S rRNA条带明显(图1a),表明提取的RNA可以用于后续实验。反转录得到cDNA,PCR扩增,得到1条约2 200 bp的DNA片段(图1b),回收该片段之后与克隆载体pBLUE-T连接转化至大肠杆菌细胞DH5α,菌液PCR鉴定(图1c),将阳性克隆送至上海生工生物有限公司测序,测序得到的独角雪冰鱼HSP90β基因的开放阅读框全长为2 184 bp,测序结果在NCBI数据库上的比对结果显示,独角雪冰鱼HSP90β全长cDNA序列与鮸鱼(gb:JQ929760)的HSP90β CDS序列相似性为92%,与点带石斑鱼(gb:FJ644278)和鲈鱼(gb:AY395632)的序列相似性为91%。
|
图1
独角雪冰鱼pET28-HSP90β表达载体构建及重组质粒的酶切鉴定
Fig.1
Construction of C. hamatus pET28-HSP90β and screening for recombinant clones
(a).独角雪冰鱼总RNA;(b).HSP90β PCR片段;(c).pBLUE-T-HSP90β阳性菌液PCR验证;(d).pET28a(+)双酶切前后比较:1.pET28a(+)双酶切产物;2.pET28a(+)质粒;(e).pET28-HSP90β阳性菌液PCR验证;(f).pET28-HSP90β重组质粒酶切鉴定(pET28a:5330bp,C.hamatus HSP90β:2200bp);M1. DL5000;M2. SM0331。 (a).Total RNA of C.hamatus;(b).HSP90β PCR segment;(c).Screening for pBLUE-T-HSP90β recombinant clones by PCR;(d).Comparison between pET28a(+) digested and non-digested:1. pET28a(+) digested with EcoRI and XhoI; 2.pET28a(+) vector;(e).Screening for pET28-HSP90β recombinant clones by PCR;(f).pET28-HSP90β digested with EcoRI and XhoI;M1. DL5000;M2. SM0331. |
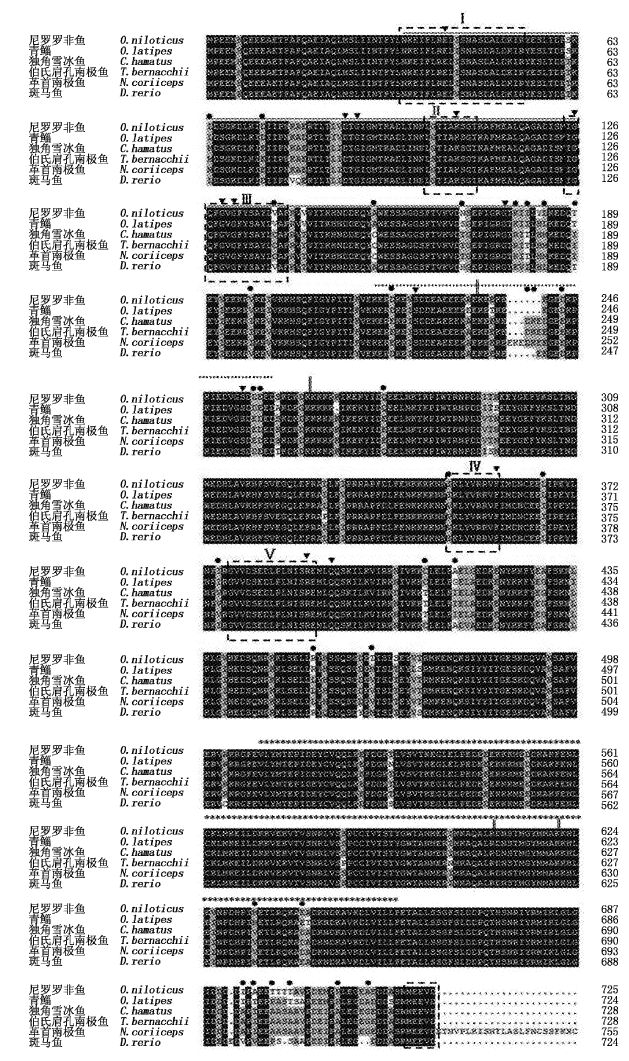
测序得到的独角雪冰鱼HSP90β的开放阅读框全长为2 184 bp,通过ORF软件分析预测得到的蛋白质具有728个氨基酸(图2)。利用http://www.expasy.org/tools/网站对南极冰鱼HSP90β基因编码的氨基酸序列进行分析,得到HSP90β蛋白的分子量约为83.7287 ku;理论等电点pI为4.9;负电荷残基(Asp+G1u)151个,正电荷残基(Arg+Lys)109个;不稳定系数(Instability index)为42.24,表明该蛋白状态不稳定;脂肪系数为79.42。该蛋白质由20种氨基酸组成,其中Glu、Lys、Leu含量最为丰富,Cys和Trp含量最少。
|
图2
HSP90β氨基酸序列多重比对及保守结构域和功能位点分析
Fig.2
Alignment of HSP90β amino acid sequences and analysis of conservative domain structure and functional sites
虚线框表示HSP90家族保守信号区(Ⅰ-Ⅴ),单划线表示HSP90β_HATPase结构域(第34-188个氨基酸残基),*表示螺旋结构,…表示富含谷氨酸区域,黑三角标注非常重要的HSP90β功能位点,黑点标注独角雪冰鱼和尼罗罗非鱼氨基酸位点差异,“||”五个不同的结构域的分界。 Dashed box said conserved signal area,“single line”for the HSP90β_HATPase domain (34-188th amino acid residues),“*” stands for four-helical cytokine,“…” donates Glutamic acid-rich region,“▼” for the functionally important residues experimentally identified,“●”shows differences between Chionodraco hamatus and Oreochromis niloticus,five different regions are separated by“||”. |
根据OBERMANN等[23, 24]的研究,将HSP90蛋白序列分成5个结构域(图2):N-端结构域[NTD(CH HSP90β)1-235]、带电荷结构域1(Charged domain 1,236-267)、中间结构域(MTD,268-613)、带电荷结构域2(Charged domain 2,614-624)和C-端结构域(CTD,625-728)。对独角雪冰鱼和尼罗罗非鱼的HSP90β氨基酸序列进行分析,发现都含有HSP90家族的5个保守信号区(图2,分别标记为Ⅰ-Ⅴ):(NKEIFLREL[I/V]SNASDALDKIR,L[S/G]TIAKSGT,IGQFGVGFYSAYL[V/C]AF,[I/V]KLYVRRVF,GVVDSEDLPLNISRE和C末端保守序列MEEVD)。根据SMART软件推测,第34~188个氨基酸残基处具有HATPase(histidine kinase-like ATPases)活性(图2)。第511~660个氨基酸残基(CH HSP90β)形成4-螺旋细胞因子,第218~261个氨基酸残基区域富含谷氨酸(图2)。
序列比对发现,一些非常重要的HSP90β功能位点的氨基酸残基非常保守,例如E41(ATP水解),D87(ATP结合),E89、 E126、 E129、 E 131、E177(GA、p23结合),K106(GA结合),R393、Q397(ATPase活性),F362(结构域间的相互作用),S225、S256(被酪蛋白激酶Ⅱ磷酸化)(图2)。独角雪冰鱼(CH)和尼罗罗非鱼(ON)的HSP90β蛋白有32处位点差异,其中在ATP结合区有8个氨基酸不同(图2)。
将推导出的氨基酸序列与NCBI上已登录的其他物种的HSP90β序列进行相似性比对发现,南极冰鱼HSP90β与革首南极鱼(Notothenia coriiceps)(ref|XP_010774807)的蛋白同源性高达99%,与斑马鱼(ref|NP_571385)、罗非鱼(ref|XP_005475052)的蛋白相似度为90%,与人类(ref|NP_031381)的蛋白相似度为87%(图2)。
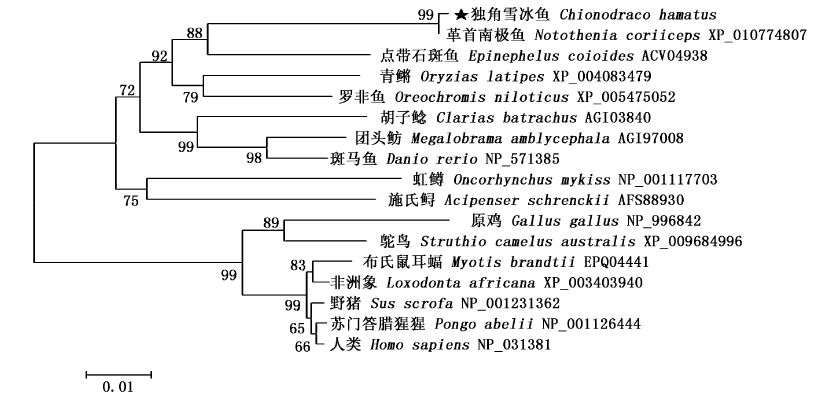
用软件MEGA 6.0对不同物种的HSP90β序列进行分析,构建进化树,比对的物种包括革首南极鱼、青鳉、罗非鱼、斑马鱼、团头鲂、鸡、野猪、人等。其中,独角雪冰鱼与革首南极鱼的遗传距离最近,只有0.001,与人的遗传距离为0.110,与鸡的遗传距离最远,达到0.126。系统进化树形成两个大分支,哺乳类、鸟类聚为一支,鱼类为另一支。在鱼类分支中,独角雪冰鱼与革首南极鱼、点带石斑鱼聚在一起,与虹鳟、斑马鱼相距较远(图3)。
|
图3
HSP90β氨基酸序列构建的NJ树
Fig.3
The neighbor joining(NJ)consensus tree constructed based on HSP90β amino acid sequences
各分支上的数字为自引导值(重复500次)。 Numbers on the branches are the bootstrap values obtained from 500 replicates. |
用EcoRI和XhoI双酶切pBLUE-T-HSP90β质粒,T4 DNA连接酶连接双酶切后的pET28a(+)质粒(图1d),转化DH5α后菌液PCR鉴定(图1e),提取pET28-CH-Hsp90和pET28-ON-Hsp90重组质粒,并转化到表达菌株E.coli DE3(BL21)中,双酶切鉴定(图1f)。在37 ℃条件下,诱导表达空载pET28a(+)质粒、pET28-CH-Hsp90和pET28-ON-Hsp90重组质粒,分别在加入诱导剂后的2,4,6,8,10,12 h 时收集菌体,离心,用PBS重悬细胞,做SDS-PAGE电泳,用考马斯亮蓝染色(图4a)。预测的HSP90β蛋白的分子量是83.7287 ku,pET28a载体的T7启动子起始密码子到EcoRⅠ酶切位点的氨基酸序列分子量为3.84 ku,所以目的蛋白分子量约为87.57 ku。图中过表达的蛋白条带在100 ku与75 ku之间,与预测结果相符。加入IPTG后,随着时间增加,蛋白表达量逐渐增加,实验组独角雪冰鱼和尼罗罗非鱼重组质粒表达量明显多于空载体对照。Western Blotting结果表明表达的蛋白是HSP90β蛋白(图4b)。

|
图4
重组质粒pET28-HSP90β在E.coli BL21(DE3)中的表达
Fig.4
Expression of pET28-HSP90β in E.coli BL21(DE3)
(a).1,4,7,10,13,16分别为加入IPTG后2 h,4 h,6 h,8 h,10 h,12 h的阴性对照(空载pET28a);2,5,8,11,14,17分别为相对应的独角雪冰鱼pET28-HSP90β ;3,6,9,12,15,18分别为不同时间的尼罗罗非鱼pET28-HSP90β。(b). Western blotting,1.pET28a空载体; 2.独角雪冰鱼 pET28-HSP90β; 3.尼罗罗非鱼pET28-HSP90β;M:RM013。 (a).1,4,7,10,13,16:negative control of different time(2h,4 h,6 h,8 h,10 h,12 h,respectively);2,5,8,11,14,17: C. hamatus pET28-HSP90β of different time (2 h,4 h,6 h,8 h,10 h,12 h,respectively); 3,6,9,12,15,18: Oreochromis niloticus pET28-HSP90β of different time (2 h,4 h,6 h,8 h,10 h,12 h,respectively).(b). Western blotting,1.pET28a vector; 2.C. hamatus pET28-HSP90β; 3. O.niloticus pET28-HSP90β M:Protein Marker RM013. |
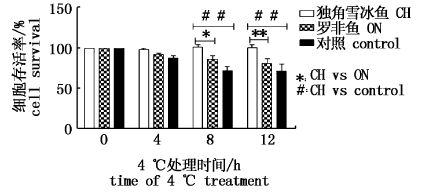
将4 ℃处理0、4、8、12 h的平板转移到37 ℃培养箱培养20 h,计数每个平板上长出的单克隆的个数。低温处理4 h时,三者在数量上没有显著性差异,当低温处理时间延长至8 h和12 h时,C.hamatus-HSP90β组的大肠杆菌细胞存活率高于其余两组,出现了显著性差异。在4 ℃处理8 h条件下,C. hamatus-HSP90β组和O.niloticus-HSP90β组,C.hamatus-HSP90β组和pET28a空载对照组(control)都存在显著性差异,其中C. hamatus-HSP90β组和control组存在极显著差异(P<00.01,图5)。4 ℃处理12 h,C.hamatus-HSP90β组和O.niloticus-HSP90β组,C.hamatus-HSP90β组和pET28a空载对照组(control)均存在极显著性差异(P<0.01,图5)。
|
图5 低温处理大肠杆菌细胞存活率 Fig.5 Viability of E.coli BL21 transformant for pET28-HSP90β subjected to 4 ℃ treatment *P<0.05;**P<0.01。 |
本研究克隆了独角雪冰鱼HSP90β基因的开放阅读框全长,其氨基酸序列与其他鱼类的HSP90具有较高的同源性,说明C. hamatus的HSP90β具有较高的保守性。对C. hamatus的HSP90β的氨基酸序列进行结构域分析发现,其含有HSP90的5个保守信号区,第34~188个氨基酸残基处具有HATPase活性,同时一些负责ATP结合和水解、重要的底物结合、结构域间相互作用和被酪蛋白激酶磷酸化的重要功能位点的氨基酸残基非常保守。
生活在不同环境中的生物,其耐低温的机制不尽相同,当极地生物长期生活在极端寒冷的南极水域,海水温度低于其体液冰点,但这些生物体内不结冰,避免了结冰对组织的损伤,这种耐低温机制称为过冷机制[25]。南极鱼的血清中的糖蛋白能够降低体液的冰点,是一种生物抗冻剂[25]。冬鲽血清中的抗冻多肽含有8种氨基酸,其中60%为丙氨酸[26]。抗冻糖蛋白的组成单元为糖三肽,其中三肽为丙氨酸-丙氨酸-苏氨酸。本研究中,通过六种鱼的氨基酸序列比对发现,南极鱼与非南极鱼的HSP90β蛋白有32个位点差异,其中有5个位点在南极鱼中由丙氨酸取代其他氨基酸,有3个位点由苏氨酸代替其他氨基酸,可以推测南极鱼的HSP90β蛋白通过增加丙氨酸和苏氨酸的数量来增强该蛋白的抗冻能力。床疣杜父鱼(Myoxocephalus verrucosus)血清中的抗冻多肽含有较多的非极性氨基酸[27]。在南极鱼与非南极鱼的HSP90β蛋白差异位点中,有5个位点处的氨基酸由其他氨基酸替换为非极性的异亮氨酸,可以推测南极鱼通过增加非极性氨基酸的数量来提高HSP90β蛋白的抗冻能力。但是在海渡鸦(Hemitripterus ameriicanus)的抗冻多肽分子中却只含有少量的丙氨酸,但含有大量的甘氨酸和芳香族氨基酸。每一类生物的抗低温机制不尽相同,南极鱼HSP90蛋白如何通过氨基酸序列变化和蛋白空间结构的改变来适应南极环境,其低温适应的具体机制还有待于进一步研究。
非胁迫状态下,HSP90约占大多数组织细胞总蛋白的1%~2%,当受到外界不利条件刺激时,在细胞中的表达量上升,约占到细胞蛋白的4%~6%,对细胞起到修复和保护的作用[28]。过量表达番茄叶绿体中的sHSPs,番茄的冷害症状轻于未表达的番茄,提高了植物的抗寒性[29],这说明HSP在提高植物抗冷害方面的重要作用。赵风云[30]用转化含有草鱼HSP90 ATPase的 cDNA质粒的大肠杆菌做4℃低温胁迫实验,发现经过低温处理2~10 d的实验组大肠杆菌细胞存活率高于空载对照组。本研究的实验结果中,4 ℃低温处理大肠杆菌8 h和12 h,相对于空载和罗非鱼对照组,C.hamatus-HSP90β显著提高了低温下大肠杆菌细胞的存活率,表明C. hamatus-HSP90β同样具有低温胁迫下的细胞保护功能。
许多南极物种即使存在一些基因[31]和转录本,但是这些分子却不能够表达,伯氏肩孔南极鱼(Trematomus bernacchii)[12]和窄体南极鱼(Notothenia angustata)[32]经过高温诱导后无热休克反应,HOFMANN等[33]的研究表明其热休克反应的缺失是由于诱导型HSP70的组成型表达,所以南极鱼HSP基因家族的表达模式可能发生了改变以适应这种接近零度的低温环境。本研究中,低温处理4 h条件下,C. hamatus-HSP90β组与O.niloticus-HSP90β和空载pET28a(control)组没有显著性差异;低温处理8 h,C. hamatus-HSP90β组与其他两组都出现显著性差异,其中C. hamatus-HSP90β组与空载pET28a(control)组之间存在极显著性差异(P<0.01);4℃处理12 h,C. hamatus-HSP90β组与O.niloticus-HSP90β和空载pET28a(control)组均存在极显著性差异(P<0.01)。随着低温处理时间的延长,细胞存活率的差异越来越大,且C. hamatus-HSP90β对细胞存活率的影响明显高于O.niloticus-HSP90β,与热温带鱼类相比,C. hamatus-HSP90β可能更加具有低温环境的适应性。
目前,南极鱼HSP的研究大多是高温(+4 ℃)刺激活体样本后,观察其转录组水平HSPs的表达量变化或者表达的HSP亚型数量的变化,以研究其热休克反应缺失的机制和低温适应性进化的分子机制[34, 35]。6 ℃热激真裸南极鱼(Harpagifer antarcticus)2~48 h过程中,HSP70、HSC70和GRP78基因的表达都下调,其中GRP78基因的下调高达100倍,这提示真裸南极鱼可能已丧失了热休克反应能力[36]。本项研究首次克隆了独角雪冰鱼的HSP90β基因的开放阅读框全长,用软件推测其氨基酸序列,并对其氨基酸序列特点和保守结构域进行分析。大肠杆菌的低温胁迫实验以尼罗罗非鱼和空载体为对照,说明C. hamatus-HSP90β可能更加具有低温环境的适应性,这为后续进一步研究HSP90β基因在南极鱼低温适应过程中的功能打下了基础。但是生物低温适应的具体机制不尽相同,HSPs参与低温适应的具体分子机制还有待于进一步研究。
| [1] | 陈主初. 病理生理学[M]. 北京: 人民卫生出版社, 2001: 191-194. CHEN Z C. Pathologic physiology[M]. Beijing: People's Medical Publishing House, 2001:191-194. |
| [2] | 冯冰冰, 牛东红, 钟玉民, 等. 缢蛏ScHsc70 cDNA 的分子特性和表达分析[J]. 中国水产科学, 2012, 19(1): 33-44. FENG B B, NIU D H, ZHONG Y M, et al. Molecular characteristics and expression analysis of ScHsc70 cDNA in agamaki clam(Sinonovacula constricta)[J]. Journal of Fishery Sciences of China, 2012, 19(1): 33-44. |
| [3] | VOS M J, HAGEMAN J, CARRA S, et al. Structural and functional diversities between members of the human HSPB, HSPH, HSPA, and DNAJ chaperone families[J]. Biochemistry, 2008, 47(27): 7001-7011. |
| [4] | REBBE N F, HICKMAN W S, LEY T J, et al. Nucleotide sequence and regulation of a human 90-kDa heat shock protein gene[J]. The Journal of Biological Chemistry, 1989, 264(25): 15006-15011. |
| [5] | JACKSON S E. Hsp90: structure and function [C]. Topics in Current Chemistry, 2013, 328: 155-240. |
| [6] | 李艳光, 曹富民. HSP90的功能及HSP90抑制剂的研究进展[J]. 食管外科电子杂志, 2013, 1(4): 168-172. LI Y G, CAO F M. Research progress on the function of HSP90 and inhibitor of HSP90[J]. Electronic Journal of Esophageal Surgery, 2013,1(4):168-172. |
| [7] | 田照辉, 徐绍刚, 王巍, 等. 急性热应激对西伯利亚鲟HSP70 mRNA 表达、血清皮质醇和非特异性免疫的影响[J]. 水生生物学报, 2013, 37(2): 344-350. TIAN Z H, XU S G, WANG W, et al. Effects of acute thermal stress on hsp70 mrna, physiology and nonspecific immunity in Siberian sturgeon(Acipenser baerii)[J]. Acta Hydrobiologica Sinica, 2013, 37(2): 344-350. |
| [8] | 刘波, 王美垚, 谢骏, 等. 低温应激对吉富罗非鱼血清生化指标及肝脏HSP70基因表达的影响[J]. 生态学报, 2011, 31(17): 4866-4873. LIU B, WANG M Y, XIE J, et al. Effects of acute cold stress onserum biochemical and immune parameters and liver HSP70 gene expression in GIFT strain of Nile tilapia(Oreochromis niloticus)[J]. Acta Ecologica Sinica, 2011, 31(17): 4866-4873. |
| [9] | ZHANG X Y, ZHANG M Z, ZHENG C J, et al. Identification of two hsp90 genes from the marine crab, Portunus trituberculatus and their specific expression prifiles under different environmental conditions [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2009, 150(4): 465-473. |
| [10] | PARKES G. Fishes of the southern ocean [J]. Reviews in Fish Biology and Fisheries, 1992, 2(4): 344-345. |
| [11] | PUCCIARELLI S, PARKER S K, DETRICK III H W, et al. Characterization of the cytoplasmic chaperonin containing TCP-1 from the Antarctic fish Notothenia coriiceps[J]. Extremophiles, 2006, 10(6): 537-549. |
| [12] | HOFMANN G, BUCKLEY B A, AIRAKSINEN S, et al. Heat-shock protein expression is absent in the antarctic fish Trematomus bernacchii(family Nototheniidae) [J]. The Journal of Experimental Biology, 2000, 203(15): 2331-2339. |
| [13] | PLACE S P, ZIPPAY M L, HOFMANN G E. Constitutive roles for inducible genes: evidence for the alteration in expression of the inducible hsp70 gene in Antarctic notothenioid fishes [J]. American Journal of Physiology: Regulatory, Integrative and Comparative Physiology, 2004, 287(2): 429-436. |
| [14] | O'BRIEN K M, SIDELL B D. The interplay among cardiac ultrastructure, metabolism and the expression of oxygen-binding proteins in Antarctic fishes[J]. The Journal of Experimental Biology, 2000, 203(8): 1287-1297. |
| [15] | SIDELL B D, O'BRIEN K M. When bad things happen to good fish: the loss of hemoglobin and myoglobin expression in Antarctic icefishes[J]. The Journal of Experimental Biology, 2006, 209(10): 1791-1802. |
| [16] | DETRICH III H W, PARKER S K, WILLIAMS JR R C, et al. Cold adaptation of microtubule assembly and dynamics-Structural interpretation of primary sequence changes present in the alpha- and beta-tubulins of antarctic fishes[J]. The Journal of Biological Chemistry, 2000, 275(47): 37038-37047. |
| [17] | DEVRIES A L, CHENG C H C. Antifreeze proteins and organismal freezing avoidance in polar fishes[J]. Fish Physiology Series, 2005, 22: 155-201. |
| [18] | CHENG C H C, CZIKO P A, EVAN C W. Nonhepatic origin of notothenioid antifreeze reveals pancreatic synthesis as common mechanism in polar fish freezing avoidance [J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(27): 10491-10496. |
| [19] | FEDER M E, HOFMANN G E. Heat shock proteins, molecular chaperones, and the stress response: evolutionary and ecological physiology[J]. Annual Review of Physiology, 1999, 61: 243-282. |
| [20] | PLACE S P, HOFMANN G E. Temperature interactions of the molecular chaperone Hsc70 from the eurythermal marine goby Gillichthys mirabilis[J]. The Journal of Experimental Biology, 2004, 204: 2675-2682. |
| [21] | CHEN Z Z, CHENG C H C, ZHANG J F, et al. Transcriptomic and genomic evolution under constant cold in Antarctic notothenioid fish[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(35): 12944-12949. |
| [22] | MIOT M, REIDY M, DOYLE S M, et al. Species-specific collaboration of heat shock proteins(Hsp) 70 and 100 in thermotolerance and protein disaggregation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(17): 6915-6920. |
| [23] | OBERMANN W M J, SONDERMANN H, RUSSO A A, et al. In vivo function of Hsp90 is dependent on ATP binding and ATP hydrolysis[J]. The Journal of Cell Biology, 1998, 143(3): 901-910. |
| [24] | CHEN B, ZHONG D B, MONTEIRO A. Comparative genomics and evolution of the HSP90 family of genes across all kingdoms of organisms [J]. BMC Genomics, 2006, 7: 156. |
| [25] | 陶云霞, 袁绍颐. 动物抗低温机制的研究[J]. 生物工程进展, 1990, 15(1): 26-30. TAO Y X, YUAN S Y. Anti low temperature mechanism of animal[J].Progress in Biological Engineering, 1990,15(1):26-30. |
| [26] | FLETCHER G L, IDLER D R, VAISIUS A, et al. Hormonal regulation of antifreeze protein gene expression in winter flounder[J]. Fish Physiology and Biochemistry, 1989, 7(1/6): 387-393. |
| [27] | REISMAN H M, FLETCHER G L, KAO M H, et al. Antifreeze proteins in the grubby sculpin, Myoxocephalus aenaeus and the tomcod, Microgadus tomcod: comparisons of seasonal cycles[J]. Environmental Biology of Fishes, 1987, 18(4): 295-301. |
| [28] | PRATT W B. The hsp90-based chaperone system: involvement in signal transduction from a variety of hormone and growth factor receptors[J]. Proceedings of the Society for Experimental Biology and Medicine, 1998, 217(4): 420-431. |
| [29] | 王丽, 赵春梅, 王义菊, 等. 过量表达叶绿体小分子热激蛋白提高番茄的抗寒性[J]. 植物生理与分子生物学报, WANG L, ZHAO C M, WANG Y J, et al. Overexpression of chloroplast-localized small molecular heat-shock protein enhances chilling tolerance in tomato plant[J]. Journal of Plant Physiology and Molecular Biology, 2005, 31(2): 167-174. |
| [30] | 赵风云. 草鱼(Ctenopharyngodon idella)Hsp90、Wap65基因的克隆、表达特性及功能分析[D]. 南昌: 南昌大学, 2011:1-43. ZHAO F Y. Cloning, expression characteristics and functional analysis of Hsp90 and Wap65 genes from grass carp[D]. Nanchang: Nanchang University, 2011:1-43. |
| [31] | COCCA E, RATNAYAKE-LECAMWASAM M, PARKER S K, et al. Do the hemoglobinless icefishes have globin genes?[J]. Comparative Biochemistry and Physiology Part A: Physiology, 1997, 118(4): 1027-1030. |
| [32] | HOFMANN G E, LUND S G, PLACE S P, et al. Some like it hot, some like it cold: the heat shock response is found in New Zealand but not Antarctic notothenioid fishes[J]. Journal of Experimental Marine Biology and Ecology, 2005, 316(1): 79-89. |
| [33] | PLACE S P, HOFMANN G E. Constitutive expression of a stress-inducible heat shock protein gene, hsp70, in phylogenetically distant Antarctic fish[J]. Polar Biology, 2005, 28(4): 261-267. |
| [34] | BUCKLEY B A, SOMERO G N. cDNA microarray analysis reveals the capacity of the cold-adapted Antarctic fish Trematomus bernacchii to alter gene expression in response to heat stress [J]. Polar Biology, 2009, 32(3): 403-415. |
| [35] | HUTH T J, PLACE S P. De novo assembly and characterization of tissue specific transcriptomes in the emerald notothen, Trematomus bernacchii[J]. BMC Genomics, 2013, 14: 805. |
| [36] | CLARK M S, FRASER K P P, BURNS G, et al. The HSP70 heat shock response in the Antarctic fish Harpagifer antarcticus[J]. Polar Biology, 2008, 31(2): 171-180. |
2. Key Laboratory of Sustainable Exploitation of Ocean Fisheries Resources, Ministry of Education, Shanghai 201306, China;
3. Scientific Observing and Experimental Station of Oceanic Fishery Resources, Ministry of Agriculture, Shanghai 201306, China;
4. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China;
5. Collaborative Innovation Center for Distant-water Fisheries, Shanghai 201306, China
 2015, Vol. 24
2015, Vol. 24


