鳗鲡,学名为日本鳗鲡(Anguilla japonica),是亚洲最重要的洄游性鱼类之一,也是我国重要的经济鱼类。由于特殊而复杂的繁殖习性,人们对鳗鲡在自然孵化场的水质条件以及初孵仔鱼的开口饵料知之甚少,鳗鲡的人工繁殖仍未取得真正意义上的成功[1]。目前认为鳗鲡胚胎发育和受精卵孵化的最适温度为24~26 ℃,盐度为34~35[2, 3]。通过注射外源激素催熟可以持续不断地获得卵子和精子[4],并可获得初孵仔鱼和玻璃鳗[5]。在历经半个世纪的研究后,日本水产综合研究中心于2010年4月发布了在世界上首次实现鳗鲡完全人工繁殖的消息[6],但是受精卵孵化率和仔鱼存活率非常低,大量生产幼苗仍然很困难。目前我国尚未获得在人工条件下发育变态的柳叶鳗[7, 8]。
鳗鲡的自然产卵场位于马里亚纳海沟附近的海山处,海水水质、水温非常稳定[9]。而在鳗鲡人工繁殖过程中,实验用水一般采用近海或人工配置的海水,但近海海水经常受到河流淡水和降雨的影响,从而导致盐度有所变化,海水中的一些主要离子的浓度以及离子比例也会发生变动,这可能会影响到胚胎的正常发育。目前已知水体中Ca2+、Mg2+及其比例对鳗鲡受精卵孵化存在一定的影响,但水体中Na+、K+离子浓度及比例对鳗鲡人工孵化效果的影响未见报道。本文用含不同Na+、K+浓度的海水培育鳗鲡受精卵,观察其胚胎发育以及孵化情况,旨在优化人工海水配方,获得人工条件下鳗鲡胚胎发育的最佳水质条件,为鳗鲡的人工繁殖提供基础数据。
1 材料与方法 1.1 材料来源及分组处理 1.1.1 实验亲鱼2013年10月中旬,将收集的降河入海鳗鲡运到上海海洋大学滨海养殖基地暂养,2014年1月初挑选健康的亲鱼转运到上海海洋大学大洋山生态站养殖,其中雌鳗体质量为650~1 500 g,雄鳗体质量为200~500 g,养殖于水泥池中,最初盐度为22,通过加入海盐(上海昱合化工原料有限公司)逐步调节上升到34~35。养殖水温为16~23 ℃。养殖池均用遮阳网遮光,池中光照强度为10 lx。
1.1.2 催熟及催产称取亲鳗体质量,根据体质量在其背部肌肉注射鲤鱼脑垂体(CPE)和hCG(20 mg CPE+300 IU hCG/kg)进行促熟。雌鳗每周注射1次,催熟5~7次后,视发育情况开始催熟雄鳗,至雌鳗注射11~14次、雄鳗注射6~8次时,雌雄鱼基本达到性成熟。
根据雌鳗体色、腹围和生殖孔状态的变化(体色变深,腹围膨大,生殖孔少许红肿),挑选发育成熟的亲鱼活体取卵,在显微镜下测量卵径及卵内油球直径,当油球直径为40~70 μm,卵径为820~880 μm时,注射启动针;当油球直径为 90~110 μm,卵径为920~960 μm时注射催产针[10]。
挑选上述成熟的亲鳗,在17:00左右注射雌鱼催产的启动针(20 mgCPE+300 IU hCG/kg),24 h后注射催产针17α-羟基孕酮(OHP,10 mg/kg)或者17α,20β-双羟孕酮(DHP,4 mg/kg)。同时挑选发育成熟的雄鳗,注射CPE和hCG(20 mg/kg+800 IU/kg)进行催情;将雌、雄鳗按1∶3比例轻放入产卵池,次日凌晨4点开始,观察雌雄鳗鲡在水体中的追逐情况,4 h后,将未产卵雌鳗捞出,对其进行半干法人工授精,收集受精卵。
1.1.3 孵化用人工海水配制、分组及处理受精卵孵化所用海水是在超纯水的基础上,添加Na、K、Ca、Mg等主要元素对应的分析纯化合物配制成盐度为35的全人工海水[11]。在预实验的基础上,本实验设以下3组实验:第1组是保持Na+含量正常,即浓度为10 760 mg/L,改变K+含量,使Na+/K+(R值)分别为10、20、30、40、50,对应K+浓度分别为:1 076、538、359、269、215 mg/L;第2组实验保持K+含量正常,即浓度为390 mg/L,改变Na+含量,使R值分别为10、20、30、40、50,即Na+浓度分别为:3 900、7 800、11 700、15 600、19 500 mg/L;第3组实验稳定Na+/K+值,即保持R值为28,改变Na+、K+的含量,即Na+/K+分别为:5 600/200、8 400/300、11 200/400、14 000/500、16 800/600,观察鳗鲡胚胎发育和孵化情况。每组实验设置5个梯度,每个梯度设3个平行。
1.2 孵化人工海水水温控制在(24±0.5) ℃,NH4+-N和NO2--N含量分别不超过0.02 mg/L和0.05 mg/L,人工海水中添加青霉素G钾100 000 IU/L,实验之前充分曝气2 h。实验在24孔培养板(costar 3524,COSTAR公司,美国)中进行[12],培养板每孔滴加1 mL对应不同实验组的人工海水,随机挑取同批受精卵,放入培养板中进行孵化。实验在暗环境中进行,孵化期间不换水。
1.3 受精卵孵化率、畸形率和存活率计算在Nikon80i显微镜下观察胚胎发育情况,运用软件Image-pro Plus 5.1 进行图像处理,以第一个幼苗出膜的时间作为出膜时间。以孵化率、畸形率和存活率作为指标,其计算公式如下:
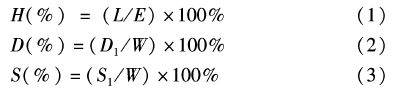
式中:H为孵化率;L为存活幼苗数;E为受精卵数;D为畸形率;D1为畸形幼苗数;W为总幼苗数;S为存活率;S1为幼苗存活数。
1.4 统计分析实验所得数据采用Excel处理,用平均数±标准差(Mean±SD)表示,采用SPSS 17.0软件进行统计分析处理,单因素方差分析(ANOVA)比较各梯度组间的差异,P<0.05为显著差异,P<0.01为极显著差异。
2 结果 2.1 鳗鲡受精卵发育情况判别图版为光学显微镜下观察到的鳗鲡初孵仔鱼以及发育至11 d的仔鱼。其中图版-1为发育至11 d的仔鱼,可以看出仔鱼已长出牙齿,肠管已通,仔鱼发育到开口摄食阶段,但出现下颌畸形。

|
图版
鳗鲡正常仔鱼和畸形仔鱼的形态学观察
Plate
Plate Morphology of normal larvae and larval deformity
1.发育正常的初孵仔鱼; 2.尾部弯曲的初孵仔鱼; 3.开口仔鱼。 1.newly hatched larva; 2. the curved tail larva; 3.the larva with jaw deformity at 11 days post hatching(Photo under microscopy and Photoshop spliced). |
从表1中可以看出,当Na+浓度为10 760 mg/L、K+浓度为538 mg/L时,鳗鲡受精卵的孵化率达到最高值,显著高于其他浓度组(P<0.05);且初孵仔鱼畸形率达最低值,但5个浓度梯度间无显著的统计差异(P>0.05)。

|
表1 不同K+浓度对鳗鲡受精卵孵化及致畸率的影响 Tab. 1 Effects of different K+ concentrations of the artificial seawater on hatching rate and deformity rate of the eggs of Anguilla japonica |
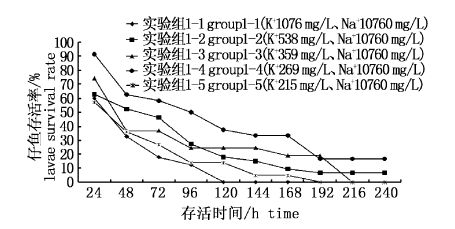
图2显示不同K+浓度对鳗鲡仔鱼存活时间的影响。从图中可以看出,当固定Na+为10 760 mg/L,K+为1 076 mg/L时,鳗鲡仔鱼在第120小时全部死亡;当K+为215 mg/L时,仔鱼在第192小时全部死亡;另外3组即Na+为10 760 mg/L,K+为538、359、269 mg/L时均在第8天时达到了开口阶段,显微镜下可清晰观察到牙齿。K+为269 mg/L时,仔鱼在第8天开口,但第9天全部死亡。而K+为538 mg/L和359 mg/L时,鳗鲡的仔鱼在培养板的存活时间都达到了11 d。
|
图1 人工海水中K+含量对仔鱼存活率的影响 Fig.1 Effects of K+ concentrations of the artificial seawater on survival rate of the larvae at different time |

|
图2 人工海水中Na+含量对仔鱼存活率的影响 Fig.2 Effects of Na+concentrations of the artificial seawater on survival rate of the larvae at different time |
综合表1和图2,当保持Na+浓度稳定,K+浓度为538 mg/L时,鳗鲡受精卵的孵化率最高,畸形率最低,仔鱼的存活时间最长,而其他浓度则对鳗鲡受精卵的孵化以及仔鱼的存活产生明显不利影响。
2.3 Na+含量对鳗鲡受精卵孵化及仔鱼存活的影响统计分析发现,当Na+为19 500 mg/L时,受精卵孵化率显著低于其他组(P<0.05),而畸形率达到100%,显著高于其他组(P<0.05)。其他4个Na+浓度之间,鳗鲡受精卵的孵化率和畸形率无显著的统计差异(P>0.05),见图2。
当Na+浓度为19 500 mg/L时,鳗鲡仔鱼在第1天全部死亡;Na+浓度为15 600 mg/L时,仔鱼在第4天全部死亡;而Na+为3 900、7 800、11 700 mg/L时,存活时间均超过了8 d(图3)。

|
图3 不同Na+,K+浓度组合对鳗鲡仔鱼存活时间的影响(R=28) Fig.3 Effects of different Na+ to K+ ratio of the artificial seawater on life span of the larvae of A. japonica |
综合表2和图3,当Na+浓度超过11 700 mg/L时,鳗鲡受精卵的孵化率明显下降,畸形率增加,仔鱼在4天内相继死亡。

|
表2 不同Na+浓度对鳗鲡受精卵孵化及致畸率的影响 Tab. 2 Effects of different Na+ concentrations of the artificial seawater on hatching rate and deformity rate of the eggs of Anguilla japonica |
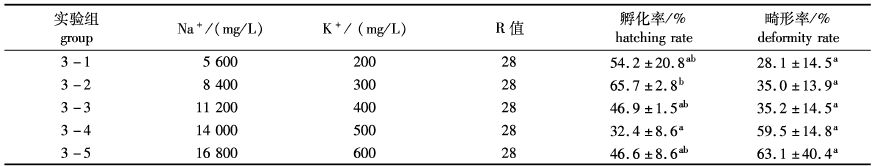
由于鳗鲡自然孵化场天然海水Na+/K+为28(即R=28),因此本实验在R值不变的情况下进行(表3)。从表中可以看出,当保持R值不变,Na+、K+分别为8 400、300 mg/L时,鳗鲡受精卵和孵化率显著高于其他4个浓度组(P<0.05);幼苗畸形率在Na+、K+分别为5 600、200 mg/L组中最低,随着Na+、K+浓度的升高,畸形率逐渐升高。
从图4可以看出,当R值不变,Na+、K+分别为16 800、600 mg/L时,鳗鲡仔鱼在第4天全部死亡;Na+、K+分别为14 000、500 mg/L时,鳗鲡仔鱼在第8天全部死亡,Na+、K+分别为5 600、200 mg/L时,虽已开口长出牙齿,但仔鱼在第9天全部死亡,而其他2组中的鳗鲡仔鱼均存活至11 d。
综合表3和图4,当R值为28,Na+、K+分别为8 400、300 mg/L时,鳗鲡受精卵的孵化率最高,畸形率较低,仔鱼的存活时间最长。
|
表3 不同Na+,K+浓度组合对鳗鲡受精卵孵化的影响(R=28) Tab. 3 Effects of different concentrations of Na+ and K+ of artificial seawater on hatching rate of the eggs of A. japonica |
海洋中Na+和K+含量丰富,海洋鱼类通常直接从海水中摄取钾以满足生命活动需求,而淡水鱼类则通过饲料获取[13],但水产动物机体内没有长期贮存钾的器官,钾易在机体中丧失。而细胞膜对Na+离子的通透性大于K+和Cl-,细胞内外由钠泵控制K+和Na+的浓度,因此,细胞内的Na+必须通过主动运输转运到细胞外,而K+则通过简单扩散进入细胞内[21, 22]。因此,对于鳗鲡来说,机体所需的钾只有通过摄食或从水环境中不断补充,以保持吸收与消耗之间的平衡,维持机体正常生长,海水中Na+和K+浓度及其比例势必影响其生命活动。
钾是水产动物必需矿物元素之一,它同钠、氯等矿物元素一起参与维持体液的渗透压和酸碱平衡、供应消化液中的酸和碱、保持细胞形态[14, 15]。此外,钾还与钙、镁、钠等矿物元素一起作用,参与碳水化合物代谢等过程、维持肌肉和神经的正常敏感性[16, 17]。同时,K+还是许多酶系的激活因子[18],1943年BOYER等[19]首次报道了需要K+来激活丙酮酸激酶的活性,到目前为止,已证实有60多种酶需要K+来活化。一般情况下,K+和Na+、Ca2+、Mg2+共同影响酶的活性。但在有些情况下K+能提高酶的活性,而Na+或Ca2+抑制酶的活性[20]。Na+/K+-ATP酶是水产动物进行渗透调节最重要的蛋白酶,其作用是把动物细胞内的Na+运输出去同时将细胞外的K+运输进细胞内,从而维持机体的Na+、K+平衡,并且可以调节血淋巴渗透压,其活性可随着环境中盐度的变化而变化[23]。目前有文献报道了盐度对鳗鲡Na+/K+-ATP酶活力的影响,认为在美洲鳗鲡(Anguilla rostrata)、鳗鲡(A. japonica)和欧洲鳗鲡(A. anguilla)降海洄游过程中,鳃丝Na+/K+-ATP酶活力均随环境盐度的上升而上升[25, 26]。本文的实验结果显示,海水中主要离子浓度及比例的改变会引起鳗鲡受精卵孵化率和仔鱼存活时间的变化,这是否是通过影响Na+/K+-ATP酶活性,亦或通过影响其渗透压调节而导致的,理清这些机制将有助于鳗鲡人工繁殖的成功。
3.2 海水中主要离子对鳗鲡受精卵孵化的影响Ca2+、Mg2+、Na+和K+作为海水阳离子主要成分,在鳗鲡初孵仔鱼发育变态过程中起着非常重要的作用。王广军研究表明,Mg2+过高或过低对鳗鲡受精卵的孵化率都有一定的影响,Ca2+含量过高或过低时,孵出的仔鱼畸形大多表现为脊柱弯曲变形等不良现象;在R值一定的情况下,Ca2+、Mg2+绝对量对畸形率影响显著[27]。本文实验结果显示,Na+和K+过高也会导致鳗鲡受精卵孵化率迅速下降,存活时间缩短。因此,在进行鳗鲡人工繁殖实验使用近海海水或者配置人工海水时,不仅要注意海水的盐度、pH等,还要注意海水中Ca2+、Mg2+、Na+、K+的含量及比值。
从本实验结果来看,鳗鲡人工繁殖过程中,海水主要离子的R值范围应在20~30之间,K+、Na+的范围分别在360~540 mg/L和7 800~11 700 mg/L之间有利于受精卵的孵化以及仔鱼的存活。TAKUMA等发现,鳗鲡受精卵在盐度24~42下都可以进行孵化;在盐度24~33下存活率没有显著性差异;但在含盐量越高的情况下,成活率会变得越小,因此,考虑到孵化率和存活率,最终得出培育鳗鱼卵和胚胎的最佳盐度应该是24~33[28]。本实验中当Na+浓度为7 800 mg/L时对应的盐度为24,当Na+浓度为11 700 mg/L时对应的盐度为34,这与TAKUMA等[28]的相关研究相符。
| [1] | 蒋天宝,刘利平,高晓阳,等.鲤脑垂体和HCG诱导雌性日本鳗鲡性腺成熟过程中血清生化成分的变化[J].水产学报, 2012, 36(6):893-899.JIANG T B, LIU L P, GAO X Y, et al. The changes of serum biochemical components during carp pituitary extract and HCG induced maturation of the female Japanese eel (Anguilla japonica)[J]. Journal of Fisheries of China, 2012, 36(6):893-899. |
| [2] | AHN H, YAMADA Y, OKAMURA A, et al. Effect of water temperature on embryonic development and hatching time of the Japanese eel Anguilla japonica[J]. Aquaculture, 2012, 330-333:100-105. |
| [3] | OKAMURA A, YAMADA Y, HORIE N, et al. Effects of water temperature on early development of Japanese eel Anguilla japonica[J]. Fisheries Science, 2007, 73(6):1241-1248. |
| [4] | OHTA H, KAGAWA H, TANAKA H, et al. Changes in fertilization and hatching rates with the time after ovulation induced by 17, 20β-dihydroxy-4-pregnen-3-one in the Japanese eel, Anguilla japonica[J]. Aquaculture, 1996, 139(3/4):291-301. |
| [5] | TANAKA H, KAGAWA H, OHTA H, et al. The first production of glass eel in captivity:fish reproductive physiology facilitates great progress in aquaculture[J]. Fish Physiology and Biochemistry, 2003, 28(1):493-497. |
| [6] | 水産総合研究センタ ー.世界初!!ウナギ完全養殖達成-(別紙)[成果の概要] [R].第8回成果発表会, 2010. |
| [7] | 柳凌,张洁明,郭峰,等.人工条件下日本鳗鲡胚胎及早期仔鱼发育的生物学特征[J].水产学报, 2010, 34(12):1800-1811.LIU L, ZHANG J M, GUO F, et al. Biological characteristics of embryo and larval development in Japanese eel under artificial incubation[J]. Journal of Fisheries of China, 2010, 34(12):1800-1811. |
| [8] | MOCHIOKA N, IWAMIZU M, KANDA T. Leptocephalus eel larvae will feed in aquaria[J]. Environmental Biology of Fishes, 1993, 36(4):381-384. |
| [9] | DOU S Z, YAMADA Y, A. OKAMURA A, et al. Observations on the spawning behavior of artificially matured Japanese eels Anguilla japonica in captivity[J]. Aquaculture, 2007, 266(1/4):117-129. |
| [10] | UNUMA T, HASEGAWA N, SAWAGUCHI S, et al. Fusion of lipid droplets in Japanese eel oocytes:Stage classification and its use as a biomarker for induction of final oocyte maturation and ovulation[J]. Aquaculture, 2011, 322-323:142-148. |
| [11] | 李爱英,陈远威.海水的化学组成[J].海水化学, 1983, 1:4-6.LI A Y, CHEN Y W. The chemical composition of seawater[J]. Seawater Chemistry, 1983, 1:4-6. |
| [12] | UNUMA T, KONDO S, TANAKA H, et al. Determination of the rates of fertilization, hatching and larval survival in the Japanese eel, Anguilla japonica, using tissue culture microplates[J]. Aquaculture, 2004, 241(1/4):345-356, |
| [13] | HALVER J E, HARDY R W. Fish Nutrition[M]. New York:Academic Press, 2002:259-308. |
| [14] | EPSTEIN F H, SILVA P, KORMANIK G. Role of Na-K-ATPase in chloride cell function[J]. American Journal of Physiology, 1980, 238(3):R246-R250. |
| [15] | MCDONOUGH A A, THOMPSON C B, YOUN J H. Skeletal muscle regulates extracellular potassium[J]. American Journal of Physiology, 2002, 282(6):F967-F974. |
| [16] | MARSHALL W S, BRYSON S E. Transport mechanisms of seawater teleost chloride cells:an inclusive model of a multifunctional cell[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 1998, 119(1):97-106. |
| [17] | EVANS D H, PIERMARINI P M, CHOE K P. The multifunctional fish gill:dominant site of gas exchange, osmoregulation, acid-base regulation, and excretion of Nitrogenous waste[J]. Physicalogical Reviews, 2005, 85(1):97-177. |
| [18] | BOYER P D, LARDY H A, PHILLIPS P H. The role of potassium in muscle phosphorylations[J]. Joumal of Biological Chemistry, 1942, 146:673-682. |
| [19] | BOYER P D, LARDY H A, PHILLIPS P H. Further studies on the role of potassium and other ions in the phosphorylation of the adenylic system[J]. Journal of Biological Chemistry, 1943, 149:529-541. |
| [20] | CANNON P R, FRAZIER L E, HUGHES R H. Sodium as a toxic ion in potassium deficiency[J]. Metabolism, 1953, 2(4):297-312. |
| [21] | WILDE W. Potassium[M]. New York:Academic Press, 1962:73-107. |
| [22] | WRIGHT F S, STRIEDER N, FOWLER N B, et al. Potassium secretion by distal tubule after potassium adaptation[J]. American Journal of Physiology, 1971, 221(2):437-448. |
| [23] | 潘鲁青,刘泓宇.甲壳动物渗透调节生理学研究进展[J].水产学报, 2005, 29(1):109-114.PAN L Q, LIU H Y. Review on the osmoregulation of crustacean[J]. Journal of Fisheries of China, 2005, 29(1):109-114. |
| [24] | EVANS D H, PIERMARINI P M, CHOE K P. The multifunctional fish gill:dominant site of gas exchange, osmoregulation, acid-base regulation, and excretion of nitrogenous waste[J]. Physiological Reviews, 2005, 85(1):97-177. |
| [25] | THOMSON A J, SARGENT J R. Changes in the levels of chloride cells and (Na++K+)-dependent ATPase in the gills of yellow and silver eels adapting to seawater[J]. Journal of Experimental Zoology, 1977, 200(1):33-40. |
| [26] | FONTAINE Y A, PISAM M, LE MOAL C, et al. Silvering and gill "itochondria-rich" cells in the eel, Anguilla anguilla[J]. Cell and Tissue Research, 1995, 281(3):465-471. |
| [27] | 王广军,谢骏,潘德博.海水中Ca2+, Mg2+的含量及Mg2+/Ca2+对日本鳗鲡受精卵孵化率的影响[J].海洋科学, 2002, 26(2):69-71.WANG G J, XIE J, PAN D B. Effects of Ca2+, Mg2+ oncentration and Ca2+/Mg2+ on hatching rates for the eggs of Anguilla japonica reared in artificial sea water[J]. Marine Sciences, 2002, 26(2):69-71. |
| [28] | OKAMOTO T, KUROKAWA T, GEN K, et al. Influence of salinity on morphological deformities in cultured larvae of Japanese eel, Anguilla japonica, at completion of yolk resorption[J]. Aquaculture, 2009, 293(1/2):113-118. |
 2015, Vol. 24
2015, Vol. 24


