2. 上海海洋大学 海洋科学学院, 上海 201306;
3. 国家海洋局北海环境监测中心, 山东 青岛 266033;
4. 国家海洋局东海监测中心, 上海 200137
绿潮(Green Tide)是一种在世界沿岸国家中普遍发生的有害藻华[1-3],同时也是一种可以造成次生环境危害的生态异常现象[4]。绿潮主要由石莼属(Ulva)、刚毛藻属(Cladophora)、硬毛藻属(Chaetomorpha)等大型定生绿藻脱离固着基后漂浮并不断增殖,而导致生物量迅速扩增形成的藻类灾害,通常发生在河口、泻湖、内湾和城市密集的海岸等富营养化程度相对较高的水域环境中,在70-90年代,美国[5]、法国[6]、南非[2]、菲律宾[7]、日本[8-9]等许多国家沿海均发生过较大规模绿潮,并至今难以防治,成为世界性难题。
自2007年以来,我国黄海近海海域连续8年暴发大规模绿潮,最大影响面积可达60 000 km2,累计覆盖面积可达2 700 km2[10],绿潮面积之大及形成之快堪称世界之最,并且对江苏、山东沿岸海洋生态环境和生态服务功能造成严重破坏,也造成巨大经济损失。近年来,多数研究针对绿潮暴发过程及机制提出一些推断和假设[11-14],然而对绿潮如何在北黄海逐渐消退,即消亡机制研究甚少。
掌握绿潮消亡机制是今后进一步提出绿潮防控方案的关键步骤。针对我国黄海绿潮每年在青岛逐渐消亡的实际情况,本文采用了卫星遥感监测、海上监测和室内实验等手段,对绿潮漂移过程、分布海域、覆盖面积动态变化、生长速率和藻体生理特征等方面进行了系统研究,初步探究了黄海绿潮藻衰亡规律,该研究将为探索我国黄海绿潮防控技术提供一定理论依据。
1 材料与方法 1.1 HJ卫星影像获取与处理本文所用数据为环境1A/1B卫星CCD传感器2级数据(系统几何校正产品,http://www.cresda.com/n16/index.html),环境1A/1B卫星从2008年9月运行至今,准太阳同步圆轨道,包括4个波段,空间分辨率为30 m,并且可以实现2天一景的重复观测,大大提高了卫星的重访观测周期。每年的5-8月为黄海海域绿潮的暴发期,每天搜集下载当天的HJ-1A/1B卫星遥感影像,利用ENVI软件,对遥感影像进行图像配准、几何校正、大气校正、图像裁切与拼接、图像融合等预处理后,采用计算归一化植被指数法(NDVI)来获取绿潮藻分布信息,通过灰度分割得出绿潮图层,再转换成矢量数据,然后运用ArcGIS软件,统计绿潮矢量图斑的总面积[15]。
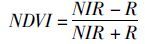 (1)
(1)
式中:NIR和R分别表示近红外波段和红光波段的反射率。
1.2 原位围隔实验2014年7月在青岛海区进行围隔实验,围隔所用装置采用国家实用新型专利(ZL 2014 2 0294420.0) 所描述的装置。放入初始生物量为50 g的漂浮绿藻样品,设置对照组和添加营养盐组,共培养6 d,每三天称重一次:将藻样捞出,用纱布包裹,放入甩干机中甩干1 min,再将藻样放在电子秤上称重,数值精确至小数点后两位。藻体特定生长率(RSG)按照下式计算:
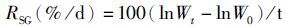
式中:W0为藻体初始湿重(g);Wt为第t天藻体湿重(g);t为培养时间(d)。
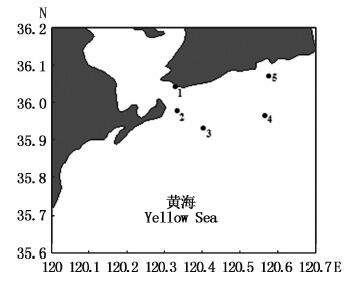
1.3 样品采集2014年7月12日,实验组人员乘坐“向阳红8号”考察船,在山东近岸的青岛海区进行监测过程中,捞取海上漂浮绿潮藻,采样点分布如图 1所示,其中1号采样点为第一海水浴场,所采样品为海滩堆积藻体。现场清理杂藻和附着漂浮物,放入保温箱中,当天带回实验室进行初步处理:将采回的新鲜样品置于自然海水中,用毛笔轻轻洗净藻体表面污泥和附生杂藻后,静置于干净的自然海水中等候实验。
|
图 1 青岛海区绿潮藻漂浮浒苔样品采集站位
Fig. 1 Sampling stations for free-floating Ulva prolifera collecting along the Qingdao coast
|
挑选数根形态不同的藻体,置于白瓷盘中拍取单株形态照片,并且每根藻截取三段,利用Olympus BX61荧光显微镜拍摄藻体显微形态,每段藻体分别截取3个不同画面。
1.5 藻体荧光活性Fv/Fm的测定从所采样品中随机挑选三根藻体,采用Phyto-PAM荧光仪测量叶绿素荧光,测定前样品需经充分暗适应5 min,测量过程由Phytowin软件控制,开启测量光(ML),待光信号稳定后打开饱和脉冲键,记录下Fv/Fm。
1.6 藻体叶绿素含量的测定所用测定方法参见ARNON[16]和林阿朋等[17],用滤纸将藻体表面水分吸干,称取0.5 g藻体,加入液氮研磨至粉碎。叶绿素a的浓度(Ca)、叶绿素b的浓度(Cb)以及总叶绿素浓度CT分别按照以下公式计算:
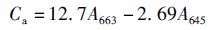 (2)
(2)
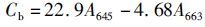 (3)
(3)
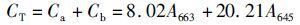 (4)
(4)
式中:Ca为叶绿素a的浓度;Cb为叶绿素b的浓度;CT为总叶绿素浓度;A663为波长663 nm处的光密度值;A645为波长645 nm处的光密度值。
1.7 数据处理应用SPSS 13.0对绿潮藻荧光活性Fv/Fm值进行方差分析及回归分析,以P<0.05作为差异显著性水平,所得数据均以平均值±标准差(X±SD)表示。
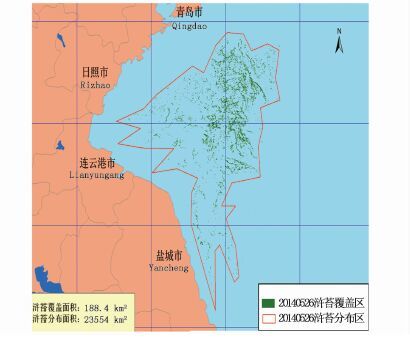
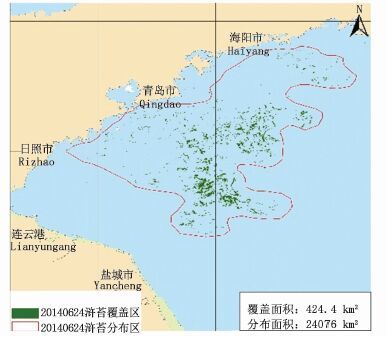
2 结果 2.1 2014年HJ卫星影像解译图图 2-7为2014年HJ卫星影像解译图。结果显示绿潮在风场流的共同作用下,从南黄海逐渐向北漂移,5月底黄海绿潮主要分布在连云港和日照海域,其覆盖面积为188.4 km2;6月至7月中旬,绿潮影响规模不断扩大;6月30日浒苔覆盖面积达到峰值,为574.4 km2;之后,漂浮绿潮继续向东北海域漂移,影响日照、青岛、海阳等海区,其覆盖面积迅速减小;至8月中旬,海上漂浮绿潮藻基本消失。
|
图 2 5月26日绿潮藻分布
Fig. 2 Green tide algal distribution on May 26
|

|
图 3 6月18日绿潮藻分布
Fig. 3 Green tide algal distribution on June 18
|
|
图 4 6月24日绿潮藻分布
Fig. 4 Green tide algal distribution on June 24
|

|
图 5 6月30日绿潮藻分布
Fig. 5 Green tide algal distribution on June 30
|
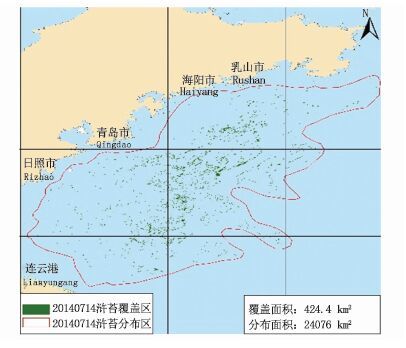
|
图 6 7月14日绿潮藻分布
Fig. 6 Green tide algal distribution on July 14
|
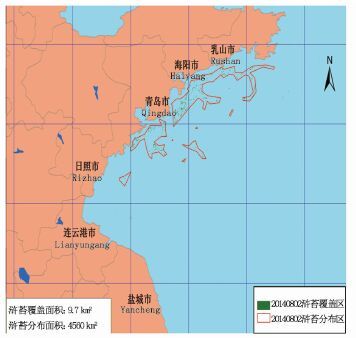
|
图 7 8月2日绿潮藻分布
Fig. 7 Green tide algal distribution on August 2
|
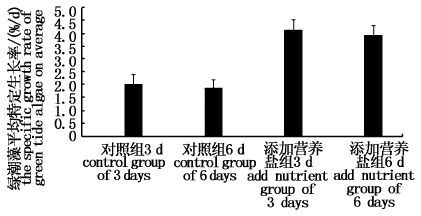
图 8为青岛海区围隔实验中绿潮藻的平均特定生长率。结果显示添加营养盐组和空白对照组围隔中绿潮藻的日生长率均较低,对照组生长率仅为2%/d左右,而添加营养盐组仅为4%/d左右。在实验过程中,晴天状态下漂浮藻体呈发白现象,藻体生物量出现负增长,而阴雨天气,藻体出现下沉现象,生物量逐渐增多。
2.3 青岛海域浒苔形态特征监测过程中发现,青岛近岸出现藻体堆积现象,藻体呈浅绿或黄绿色,部分藻体发白,发白比例约为5%(图 9-a);青岛海域漂浮绿潮呈条带状或斑块状,且多为浅绿或黄绿色,厚度约2~8 cm(图 9-h)。图 9-b、c和9-i、j分别为青岛近岸堆积和海区漂浮藻体形态,藻体多为囊状或管状,呈浅绿或黄绿色,部分发白。图 9-d、e和9-k、l分别为青岛近岸堆积和海区漂浮藻体细胞显微形态,细胞多呈浅绿或黄绿色,细胞间隔增大,内部填充物缺失,部分细胞出现颗粒化,并且少量藻体出现生殖细胞放散等现象。以上现象表明青岛海区的藻体及藻体细胞已处于退化衰亡状态。
|
图 8 青岛海区围隔中绿潮藻生长速率
Fig. 8 The growth rate of green algae in the Mesocosms of Qingdao sea area
|
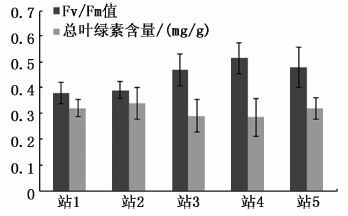
图 10为青岛海域站1-站5漂浮藻体叶绿素荧光参数和叶绿素含量。其中,5个站位绿藻荧光参数Fv/Fm维持在0.38~0.52之间。站位4的Fv/Fm最高,为0.52;站位3、站位5的值其次,在0.4~0.5范围之间;站位1、站位2的Fv/Fm低于0.4。根据曹佳春等[18]藻体状态评价体系,站位1、站位2的藻体属于衰老藻体,站位3-站位5的藻体则属于半健康藻体。此外,5个站位藻体叶绿素含量均较低,约0.3 mg/g左右,光合能力降低,处于衰老状态。总体看来,青岛海区的藻体已处于逐渐衰亡阶段。

|
图 9 藻体形态及细胞显微形态
Fig. 9 The morphology and cell structure of U.prolifera
a为青岛第一海水浴场岸边浒苔堆积; b、c为a处单株藻体形态; d、e为a处藻体细胞显微形态; h为青岛近岸海区漂浮绿潮斑块; i、j为h处单株藻体形态; k、l为h处藻体细胞显微形态。 a. the accumulated green tide at the coast of Qingdao; b and c. algal morphology of a; d and e. the microscopic morphology of a; h. the floating algal patches in Qingdao sea area; i and j. algal morphology of h; k and l. the microscopic morphology of h. |
|
图 10 站1-站5海上漂浮藻体现场光合参数最大光量子产量Fv/Fm值和总叶绿素含量
Fig. 10 The Fv / Fm values and total chlorophyll content of floating algals of 1-5 station sites
|
卫星遥感监测早已成为绿潮业务化监测工作的一项重要手段,其大尺度、多空间分辨率、多光谱等优势为大范围海上绿潮监测提供了可靠的保障。但环境卫星影像并不能覆盖整个黄海海域,抑或是受到云覆盖的影响,另外,影像处理过程中,方法的选用或者阈值的设定也会影响到提取结果。本文结果与中国海洋灾害公报、王宁等、李三妹等[19-21]均不尽相同,辛蕾等[22]也对比分析了MODIS、HJ卫星两种数据的提取结果,从而强调了卫星影像信息提取方法精细化研究的必要性。但这些并不会影响运用卫星影像对海上漂浮绿潮的分布面积、漂移路径等进行定性分析,如若要对绿潮分布面积进行更精确或定量研究,可以利用光学、微波多源遥感影像结合船舶海上监测的手段,为我国黄海绿潮发生、发展提供坚实有力的数据支撑。
3.2 青岛海域绿潮藻形态和生理状态变化本文监测的2014年青岛海区藻体形态多为囊状或管状,与如东海区藻体有显著差异[23]。根据我们目前的研究,黄海绿潮暴发期包括4种形态:丝状、管状、囊状和褶皱状。丝状藻体比其他3种形态的藻体生长快,暴发早期常见,是南黄海绿潮藻的主要形态;管状、囊状藻体多出现在北黄海;褶皱状藻体很少见,一般出现在暴发消亡期末期[24-26]。所以,南、北两个不同黄海海域的藻体形态差异可能是导致北黄海绿潮消失的原因之一。
叶绿素含量和荧光活性是评价大型海藻不同条件下生理状态的重要参数。青岛海区的藻体叶绿素含量明显低于南黄海[10, 18],因此我们可以断定青岛海区的藻体光合能力下降,而这也可以通过其荧光活性反映出来。Y(Ⅱ)和Fv/Fm分别代表PSⅡ实时光合作用效率和潜在光合作用效率,绿藻的Fv/Fm通常在0.70~0.75之间,然而,青岛海区的藻体Fv/Fm低于0.55,明显低于健康藻体,这表明该海区的藻体受胁迫或处于低营养条件,即外界环境条件不足以维持绿潮藻大规模的暴发。
3.3 青岛海域绿潮消亡外部原因:生长环境变化环境条件的变化可以影响绿潮藻的形态和生理状态,进一步导致暴发生物量的动态增长和减少,所以环境因子的变化可能是导致北黄海绿潮衰亡的主要原因。何进等[22]、张晓红等[28]和黄显军等[29]的研究表明:温度对绿藻的生长至关重要。浒苔(Ulva prolifera)作为黄海绿潮的优势种,其生态幅很广,适宜生长的温度范围为10~30 ℃,然而,最近几年北黄海海域7、8月平均海表温为23~28 ℃[19],也适宜绿潮藻的生长,所以,温度可以排除在青岛海区绿潮藻衰亡的限制条件之外。
水华灾害的暴发原因大多归因于水体富营养化,这也是所有沿海国家面临的一个常见问题[30-31]。高嵩等[32]的研究证实了南黄海海区为低盐高营养盐区,为绿潮的暴发提供了一定的物质基础,而绿潮藻的生长速率通常是与它们储存营养物质的能力有关的,大量研究[30-31, 33]表明大型绿藻浒苔具有高比表面,呈现高营养吸收速率,这些快速生长的海藻需要更多的营养,所以浒苔依靠持续高水平的氮来维持暴发。国家海洋局官方监测黄海营养显示[19],南黄海营养水平,特别是沿岸地区,比北黄海高很多,更进一步佐证了北黄海低营养水平不足以支撑绿潮大规模暴发。
多数绿潮藻分布于北黄海的时间为每年7-8月份,是年度中气温最高的时间段,日照时间最长,而北黄海海域透明度显著高于南黄海海域(图 11) 。因而,我们推断绿潮藻漂移至透明度较高的北黄海海域,失去了泥沙等颗粒物的庇荫,长时间暴露在高温高光照的环境中,加之,北黄海低营养水平无法满足大量绿潮藻的营养需求,促使绿潮于北黄海海域迅速消亡。
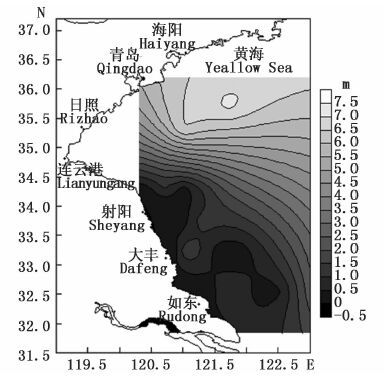
|
图 11 黄海海域透明度
Fig. 11 The transparency of Yellow Sea
|
为了控制离散的大型海藻聚集暴发,着重关注暴发早期发展阶段,通过寻找源头、控制源头灾害无疑是减轻灾害的一个直接有力的方式。然而,绿潮普遍存在于世界各地的海洋和河口栖息地,这些地方温度、盐度、水质等环境参数差异大,也就意味着很难准确定位源头,所以目前很难从源头控制黄海绿潮。本文认为,北黄海的环境条件不再适合大量绿潮藻的生长,高透明度和低营养水平是绿潮暴发的终结者,使得这个海域的生物量下降。而低透明度和富营养化对早期暴发阶段的快速形成起到至关重要的作用。目前最迫在眉睫的是尽可能减少沿海海域的营养物污染,包括人类活动、污水排放等。
| [1] | BLOMSTER J, BÄCK S, FEWER D P, et al.Novel morphology in Enteromorpha (Ulvophyceae) forming green tides[J]. American Journal of Botany, 2002, 89(11): 1756–1763. |
| [2] | ANDERSON D M, GLIBERT P M, BURKHOLDER J M.Harmful algal blooms and eutrophication: nutrient sources, composition and consequences[J]. Estuaries, 2002, 25(4): 704–726. |
| [3] | NELSON T A, LEE D J, SMITH B C.Are "greentide" harmful algal blooms? Toxic properties of water-soluble extracts from two bloom-forming macroalgae, Ulva fenestrata and Ulvaria obscura (Ulvophyceae)[J]. Journal of Phycology, 2003, 39(5): 874–879. |
| [4] | NELSON T A, NELSON A V, TJOELKER M.Seasonal and spatial patterns of "green tides" (Ulvoid algal blooms) and related water quality parameters in the coastal waters of Washington State, USA[J]. Botanica Marina, 2003, 46(3): 263–275. |
| [5] | NELSON T A, HABERLIN K, NELSON A V, et al.Ecological and physiological controls of species composition in green macroalgal blooms[J]. Ecology, 2008, 89(5): 1287–1298. |
| [6] | CHARLIER R H, MORAND P, FINKL C W, et al.Green tides on the Brittany coasts[J]. Environmental Research,Engineering and Management, 2007, 3(41): 52–59. |
| [7] | LARGO D B, SEMBRANO J, HIRAOKA M, et al.Taxonomic and ecological profile of "green tides" species of Ulva (Ulvales, Chlorophyta) in central Philippines[J]. Hydrobiologia, 2004, 512(1/3): 247–253. |
| [8] | HIRAOKA M, DAN A, SHIMADA S, et al.Different life histories of Enteromorpha prolifera (Ulvales, Chlorophyta) from four rivers on Shikoku Island, Japan[J]. Phycologia, 2003, 42(3): 275–284. |
| [9] | YABE T, ISHⅡ Y, AMANO Y, et al.Green tide formed by free-floating Ulva spp. at Yatsu tidal flat, Japan[J]. Limnology, 2009, 10(3): 239–345. |
| [10] | ZHANG J H, HUO Y Z, ZHANG Z L, et al.Variations of morphology and photosynthetic performances of Ulva prolifera during the whole green tide blooming process in the Yellow Sea[J]. Marine Environmental Research, 2013, 92: 35–42. |
| [11] | LIU D Y, KEESING J K, XING Q G, et al.World's largest macroalgal bloom caused by expansion of seaweed aquaculture in China[J]. Marine Pollution Bulletin, 2009, 58(6): 888–895. |
| [12] | HUO Y Z, ZHANG J H, CHEN L P, et al.Green algae blooms caused by Ulva prolifera in the southern Yellow Sea: identification of the original bloom location and evaluation of biological processes occurring during the early northward floating period[J]. Limnology and Oceanography, 2013, 58(6): 2206–2218. |
| [13] | KEESING J K, LIU D Y, FEARNS P, et al.Inter- and intra-annual patterns of Ulva prolifera green tides in the Yellow Sea during 2007-2009, their origin and relationship to the expansion of coastal seaweed aquaculture in China[J]. Marine Pollution Bulletin, 2011, 62(6): 1169–1182. |
| [14] | LIU D Y, KEESING J K, HE P M, et al.The world's largest macroalgal bloom in the Yellow Sea, China: Formation and implications[J]. Estuarine, Coastal and Shelf Science, 2013, 129: 2–10. |
| [15] | 国家海洋局. HY/T 147.7-2013海洋监测技术规程第7部分: 卫星遥感技术方法[S]. 北京: 中国标准出版社, 2013. State Oceanic Administration People's Republic of China. HY/T 147.7-2013 Code of practice for marine monitoring technology-Part 7: satellite remote sensing technical methods[S]. Beijing: China Standard Press, 2013. |
| [16] | ARNON D I.Cooper enzymes in isolated chloroplast polyphenoloxidaese in Brta vulgaris[J]. Plant Physiology, 1949, 24(1): 1–15. |
| [17] | 林阿朋, 王超, 乔洪金, 等.青岛海域漂浮和沉降浒苔的光合作用研究[J]. 科学通报, 2009, 54(3): 294–298. LIN A P, WANG C, QIAO H J, et al.Study on the photosynthetic performances of Enteromorpha prolifera collected from the surface and bottom of the sea of Qingdao sea area[J]. Chinese Science Bulletin, 2009, 54(3): 294–298. |
| [18] | 曹佳春, 吴青, 张建恒, 等.青岛海域漂浮浒苔光合生理特性及藻体状态等级评价研究[J]. 上海海洋大学学报, 2013, 22(6): 922–927. CAO J C, WU Q, ZHANG J H, et al.Studies on photosynthetic physiological characteristics and grade evaluation for free-floating algae (Ulva prolifera) along Qingdao coast[J]. Journal of Shanghai Ocean University, 2013, 22(6): 922–927. |
| [19] | 国家海洋局. 2014年中国海洋灾害公报[EB/OL]. http://www.soa.gov.cn/. State Oceanic Administration People's Republic of China. 2014 China ocean disasters bulletin[EB/OL]. http://www.soa.gov.cn/. |
| [20] | 王宁, 曹丛华, 黄娟, 等.基于遥感监测的黄海绿潮漂移路径及分布面积特征分析[J]. 防灾科技学院学报, 2013, 15(4): 24–29. WANG N, CAO C H, HUANG J, et al.Feature analysis of green tide drift path and distribution area on the yellow sea based on remote sensing monitoring[J]. Journal of Institute of Disaster-Prevention Science and Technology, 2013, 15(4): 24–29. |
| [21] | 李三妹, 李亚君, 董海鹰, 等.浅析卫星遥感在黄海浒苔监测中的应用[J]. 应用气象学报, 2010, 21(1): 76–82. LI S M, LI Y J, DONG H Y, et al.Satellite remote sensing application to Enteromorpha prolifera monitoring in the Yellow Sea[J]. Journal of Applied Meteorological Science, 2010, 21(1): 76–82. |
| [22] | 辛蕾, 王宁, 钟山.浅析绿潮卫星影像信息提取方法精细化研究的必要性[J]. 科技视界, 2013: 127. XIN L, WANG N, ZHONG S.Analyse the necessity of research on the refinement of the method that extracting green tide information from satellite image[J]. Science & Technology Vision, 2013: 127. |
| [23] | 张建恒, 陈丽平, 霍元子, 等.我国江苏如东岸基绿潮藻分布特征[J]. 海洋环境科学, 2013, 32(1): 1–5. ZHANG J H, CHEN L P, HUO Y Z, et al.Distributing characteristics of green tide algae growing on settled sediment in Rudong coastal area[J]. Marine Environmental Science, 2013, 32(1): 1–5. |
| [24] | ZHANG J H, HUO Y Z, YU K F, et al.Growth characteristics and reproductive capability of green tide algae in Rudong coast, China[J]. Journal of Applied Phycology, 2013, 25(3): 795–803. |
| [25] | 张华伟, 马家海, 胡翔, 等.绿潮漂浮浒苔繁殖特性的研究[J]. 上海海洋大学学报, 2011, 20(4): 600–606. ZHANG H W, MA J H, HU X, et al.Reproductive characteristics of the floating algae in green tide[J]. Journal of Shanghai Ocean University, 2011, 20(4): 600–606. |
| [26] | 张惠荣.浒苔生态学研究[M].北京: 海洋出版社, 2009: 10. ZHANG H R.Ulva ecology[M].Beijing: Ocean Press, 2009: 10. |
| [27] | 何进, 石雅君, 王玉珏, 等.不同温度与营养盐条件对浒苔(Ulva prolifera)和肠浒苔(Ulva intestinalis)的生长影响[J]. 海洋通报, 2013, 32(5): 573–579. HE J, SHI Y J, WANG Y J, et al.Impact of temperature and nutrients on the growth of Ulva prolifera and Ulva intestinalis[J]. Marine Science Bulletin, 2013, 32(5): 573–579. |
| [28] | 张晓红, 王宗灵, 李瑞香, 等.不同温度、盐度下浒苔(Entromorphra prolifera)群体增长和生殖的显微观测[J]. 海洋科学进展, 2012, 30(2): 276–283. ZHANG X H, WANG Z L, LI R X, et al.Microscopic observation on population growth and reproduction of Entromorphra prolifera under different temperature and salinity[J]. Advances in Marine Science, 2012, 30(2): 276–283. |
| [29] | 黄显军, 骆其君.光照与低温对3种浒苔存活的影响[J]. 宁波大学学报(理工版), 2012, 25(1): 24–26. HUANG X J, LUO Q J.Effects of light condition and low temperature on survivability in three kinds of Ulva[J]. Journal of Ningbo University (Natural Science and Engineering Edition), 2012, 25(1): 24–26. |
| [30] | PEDERSON M F, BORUM J.Nutrient control of estuarine macroalgae: growth strategy and the balance between nitrogen requirements and uptake[J]. Marine Ecology Progress Series, 1997, 161: 155–163. |
| [31] | 田千桃, 霍元子, 张寒野, 等.浒苔和条浒苔生长及其氨氮吸收动力学特征研究[J]. 上海海洋大学学报, 2010, 19(2): 252–258. Q T, HUO Y Z, ZHANG H Y, et al.Preliminary study on growth and NH4+-N uptake kinetics of Enteromorpha prolifera and Enteromorpha clathrata[J]. Journal of Shanghai Ocean University, 2010, 19(2): 252–258. |
| [32] | 高嵩, 范士亮, 韩秀荣, 等.浒苔绿潮与南黄海近岸海域水质的关系[J]. 中国环境科学, 2014, 34(1): 213–218. GAO S, FAN S L, HAN X R, et al.Relations of Enteromorpha prolifera blooms with temperature, salinity, dissolved oxygen and pH in the Southern Yellow Sea[J]. China Environmental Science, 2014, 34(1): 213–218. |
| [33] | 刘静雯, 董双林, 马甡.温度和盐度对几种大型海藻生长率和NH4-N吸收的影响[J]. 海洋学报, 2001, 23(2): 109–116. LIU J W, DONG S L, MA S.Effects of temperature and salinity on growth of G. tenuisti pitata var. liui, U. pertusa, G. filicina and NH4-N uptake of G. tenuistipitata var. liui[J]. Acta Oceanologica Sinica, 2001, 23(2): 109–116. |
2. College of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China;
3. North Sea Environmental Monitoring Center, State Oceanic Administration, Qingdao 266033, Shandong, China;
4. East China Sea Branch of State Oceanic Administration, Shanghai 200137, China
 2016,
Vol. 25
2016,
Vol. 25


