视蛋白(Opsin),属于G蛋白偶联受体(G protein-coupled receptor)超家族中的一支。它通过一系列反应将光信号放大并通过一系列信号传导途径将信息传至大脑。对于脊椎动物而言,这类蛋白主要由视觉细胞产生,并且根据其是否参与直接感光成像可分为视觉系统视蛋白和非视觉系统视蛋白[1]。脊椎动物视网膜上存在两种感光细胞:视锥细胞和视杆细胞,它们介导视觉光反应。视杆细胞中的视蛋白称为视杆视蛋白或视紫红质(Rhodopsin,RH1),与暗视觉相关;而视锥细胞中则有视锥视蛋白,与明视觉相关。按照吸收光谱的范围可分为长波敏感视蛋白(long-wave sensitive opsin,LWS),中波敏感视蛋白(middle-wave sensitive opsin or Rhodopisn-like pigments,MWS/RH2)和短波敏感视蛋白(short-wave sensitive opsin,SWS)[1]。而对于并不介导视觉光反应的非视觉视蛋白则有很多类,包括pinopsin、VA-opsin(vertebrate ancient opsin)、parapinopsin、exo-rhodopsin、encephalopsin、neuropsin(Opn5)、melanopsin和peropsin[1, 2]。
鱼类拥有多种对不同光波敏感的视锥视蛋白。2003年,CHINEN等最早克隆出斑马鱼(Danio rerio)5种视觉视蛋白基因(RH1、RH2、LWS、SWS1、SWS2),发现这些视蛋白基因主要在视网膜感光细胞层中表达[2]。此后,KAWAMURA在青鳉(Oryzias latipes)中也克隆出视蛋白基因[3]。其他硬骨鱼,比如虹鳟(Oncorhynchus mykiss)、银大麻哈鱼(Oncorhynchus kisutch)、欧洲鳗鲡(Anguilla anguilla)、绿背菱鲽(Rhombosolea tapirina)[4]、大西洋鲱(Clupea harengus)[5] 、河鲈(Perca fluviatilis)[6]等视蛋白基因也相继被克隆[7],并证实这些视蛋白均具有相似的七次跨膜结构[8],序列保守性强[9]。在银大麻哈鱼和欧洲鳗鲡中尚未发现紫外敏感视蛋白基因SWS1[10],前者视觉主要依赖视紫红质的变化[11],而后者则是发生了视蛋白吸收波长的迁移[12]。在香鱼(Plecoglossus altivelis)中则发现两种紫外视蛋白SWS1-1、SWS1-2和两种绿色视蛋白RH2-1、RH2-2基因来适应光线变化,它们和其他视锥视蛋白基因的序列相似性均超过75%[13]。除眼睛外,在大西洋庸鲽(Hippoglossus hippoglossus)胚胎脑部松果体的感光器官中,FORSELL等通过RNA切片原位杂交发现类似RH2和SWS1基因的松果体视蛋白基因表达[14]。在大西洋牙鲆(Pseudopleuronectes americanus)卵黄囊期仔鱼,4种不同的视锥视蛋白基因(LWS、RH2、SWS1、SWS2)开始表达[15]。牙鲆同大部分脊椎动物一样具有5种感光的视觉视蛋白[15],但目前对于牙鲆(Paralichthys olivaceus)仔鱼阶段的视觉视蛋白基因表达情况尚无系统的研究,本研究克隆了牙鲆紫外敏感视蛋白SWS1基因cDNA全长序列,并调查了视觉系统视蛋白基因在仔鱼阶段的表达情况。
1 材料与方法 1.1 实验材料牙鲆受精卵来自山东海阳市黄海水产有限公司,经72 h孵化后仔鱼出膜,仔鱼饲养水温(16±2) ℃[16]。所取样品一部分用液氮速冻后存于-80 ℃备抽提牙鲆总RNA,另一部分用4 %多聚甲醛溶液固定12 h后换成甲醇保存于4 ℃以备RNA整体原位杂交实验用。
1.2 牙鲆总RNA的提取与cDNA第一链的合成采用Trizol法提取总RNA。RNA的浓度及纯度分别采用Nanodrop 2000超微量分光光度计和1 %琼脂糖凝胶电泳检测。OD260/OD280均为1.90~2.05,电泳显示RNA完整性良好。利用M-MLV反转录酶(Promega公司)试剂盒合成牙鲆cDNA第一条链,-20 ℃保存备用。合成的cDNA第一条链,利用SMARTerTM RACE cDNA Amplification Kit(Clontech公司)合成RACE-ready-cDNA。
1.3 短波敏感视蛋白SWS1的全长cDNA的克隆根据GenBank中人(Homo. sapiens,ADQ38361.1)、斑马鱼(D. rerio,NP571394.1)、大西洋庸鲽(H. hippoglossus,AAM17917.1)等SWS1氨基酸序列及牙鲆密码子偏好性,设计上下游引物(表1),引物浓度为10 μmol/L。以牙鲆cDNA为模板,进行常规PCR扩增,反应程序为:95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,35个循环。DNA产物经回收并测序后,得到276 bp的片段序列。
| 表1 PCR扩增所用引物序列及用途 Tab.1 Nucleotide sequences and usage of oligonucleotide primers |
测得的片段序列经NCBI网站比对后,根据此序列设计RACE引物(表1),引物浓度为10 μmol/L。按照SMARTerTM RACE cDNA Amplicafication Kit (Clontech公司)说明书分别以5′/3′-RACE-Ready cDNA为模板,以通用引物UPM和5′/3′特异引物分别进行5′RACE和3′RACE的扩增反应,程序均为:94 ℃ 30 s,72 ℃ 3 min,5个循环;94 ℃ 30 s,70 ℃ 30 s,72 ℃ 3 min,5个循环;94 ℃ 30 s,68 ℃ 30 s,72 ℃ 3 min,25个循环;PCR产物用1 %琼脂糖凝胶电泳分析,DNA凝胶回收试剂盒(Axygen公司)回收正确大小的DNA片段后连接到pGEM-T载体(Promega公司)上,转化至大肠杆菌Top10感受态细胞中,挑选阳性克隆鉴定后送至生物工程(上海)有限公司测序。
1.4 序列分析由测序结果得到SWS1基因的3′和5′末端cDNA序列。使用ContigExprees软件进行序列拼接,获得牙鲆SWS1全长cDNA序列;通过DNAstar软件预测和翻译该序列开放阅读框;利用美国国立生物技术信息中心(NCBI)分析序列的结构域和同源性;运用EXPASY(http://www.expasy.ch)分析牙鲆SWS1氨基酸组成、分子量、等电点和结构域等;采用CLUSTALW(http://www.ebi.ac.uk)进行蛋白序列比对;利用MEGA 6.0中邻接法(Neighbor-Joining,NJ)构建系统进化树,并应用泊松分布验证进化距离。
1.5 实时荧光定量PCR以β-actin作为内参基因(引物见表1),实验设计3个重复。总体系为20 μL:上下游引物各0.5 μL(引物浓度均为10 μmol/L),iQTM SYBR Green Supermix 10 μL,cDNA 1 μL,RNase free H2O 8.5 μL补足至20 μL。RT-qPCR的反应条件如下:95 ℃ 3 min;95 ℃ 10 s,60 ℃ 30 s,72 ℃ 30 s,40个循环;选用CFX-96软件(Bio-Rad公司)进行熔解曲线分析和Ct值分析,相对表达量计算采用2-ΔΔCt法,其数值用平均值±标准误(mean±SE)表示。统计分析使用SPSS 19.0软件,并采用“LSD”单因素方差分析法比较各时期基因表达量差异,当P<0. 05时,表示差异显著。
1.6 视蛋白mRNA探针的制备与整体原位杂交根据NCBI中已知或本研究克隆出的5种牙鲆视蛋白基因序列,设计各自上游和下游引物(表1),分别进行目的基因片段克隆。测序结果比对正确后,将含有此基因片段的质粒抽提并用限制性内切酶NotⅠ和NcoⅠ(Fermentas公司)单酶切线性化,经纯化后分别使用T7和SP6 RNA Polymerase(Promega公司)体外合成含地高辛标记(Roche公司)的正义和反义RNA探针(37 ℃,2 h)。其反应体系如下(20 μL):线性化质粒DNA 1 μg,4 μL 5×Transcription buffer,2 μL DTT(100 mmol/L),0.5 μL Rnase inhibitor(40 U/μL),2 μL 10×DIG Mix,1 μL SP6或T7 RNA Polymerase,用RNase free水补足至20 μL。合成好的RNA探针用1 %琼脂糖凝胶电泳和紫外分光光度计分别进行条带大小和探针浓度的检测及记录后保存于-20 ℃中。
牙鲆仔鱼处理详细步骤参考文献[17]。经甲醇保存的牙鲆仔鱼经梯度复水至PBST(137 mmol/L NaCl,2.7 mmol/L KCl,10 mmol/L Na2HPO4,2 mmol/L KH2PO4,调节pH至7.4,加入0.1 % Tween20)、100 mmol/L甘氨酸漂洗去除醛基、3 %双氧水强光照射脱色后,经盐酸处理后蛋白酶K消化,然后置于4 %多聚甲醛溶液中固定1 h,以保持仔鱼的完整性。PBST漂洗两次后,预杂交4 h以封闭非特异性位点,加入探针(1 ng/μL)后于60 ℃下再杂交16 h。杂交完毕后,用稀释的杂交液梯度清洗,样品在抗体稀释液中37 ℃震荡1 h,然后以1∶2 000加入地高辛抗体(Roche 公司)过夜。用PBST清洗10 h后,在Fast Red(Roche公司)显色液中室温避光显色1~2 h。
1.7 显微观察和图像处理RNA原位杂交处理的仔鱼样品用SMZ 1500体视显微镜(尼康公司)观察和拍摄。然后此样品再被冰冻切片成8 μm厚于载玻片上,在SZX 7显微镜(奥林帕斯公司)下观察和拍照,图片经Adobe Photoshop 6.0软件编辑。
2 结果 2.1 牙鲆SWS1基因cDNA全长序列分析牙鲆SWS1基因全长为1 317 bp,其5′ UTR和3′ UTR分别为109 bp和131 bp,包括1 077 bp的ORF编码358个氨基酸,蛋白分子量约为48.9 ku,等电点为7.45。该蛋白包含一个Rhodopsin_N结构域和一个7tm_1(7 transmembrane receptor)结构域(图1)。

|
图1
牙鲆SWS1基因cDNA全长序列及由此预测的氨基酸序列
Fig.1
Full-length cDNA sequence and putative amino acid sequence of P. olivaceus SWS1 gene
上面为核苷酸序列,下面为氨基酸序列;小写字母表示为5′ UTR和3′ UTR;* 代表终止密码子。Rhodopsin_N结构域用阴影部分表示;7tm_1 结构域用粗线方框表示。 Deduced amino acid sequence for the open reading frame shown in the figure; Both 5′ UTR and 3′ UTR indicated by lower case letter;* indicates termination codon; Rhodopsin_N:Amino terminal of the G-protein receptor rhodopsin;7tm_1:7 transmembrane receptor (rhodopsin family). |
牙鲆SWS1基因序列与条斑星鲽(Verasper moseri)、大菱鲆(Scophthalmus maximus)等鲽形目鱼类基因核苷酸序列相似性分别为98.5 %和96.7 %,表明SWS1基因保守性强。基于氨基酸序列的系统进化分析表明,牙鲆的短波敏感视蛋白SWS1先和条斑星鲽的SWS1聚为一支,两者聚合后再与大菱鲆SWS1聚为一支,然后与所有物种的SWS1聚集一起后,再与牙鲆的长波敏感视蛋白LWS聚集(图2)。
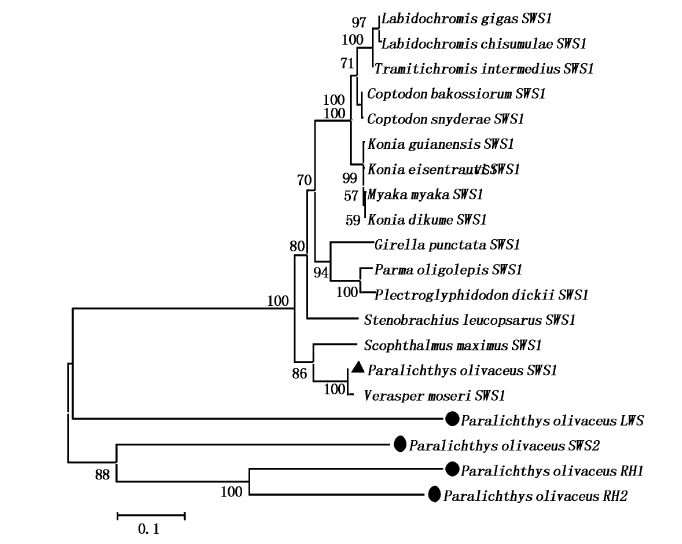
|
图2 牙鲆视锥视蛋白SWS1氨基酸序列系统进化树 Fig.2 A phylogenetic tree constructed by the Neighbour-Joining method for amino acid sequences of SWS1 条斑星鲽Verasper moseri SWS1(BA_O93915.1);大鳞盾豆娘鱼Parma oligolepis SWS1(AE_O00696.1);白身臂灯鱼Stenobrachius leucopsarus SWS1(AC_J72020.1);大菱鲆Scophthalmus maximus SWS1(AA_Q02801.1);瓜子Girella punctata SWS1(BA_D80827.2);慈鲷鱼Coptodon bakossiorum SWS1(AD_K92832.1);黑带椒雀鲷Plectrogly dickii SWS1(AE_O00697.1);迈卡丽鱼Myaka myaka SWS1(AD_K92820.1);喀麦隆康尼丽鱼Konia dikume SWS1(AD_K92821.1);马拉维湖慈鲷Tramitichromis intermedius SWS1(AD_A77667.1);巨镊丽鱼Labidochromis gigas SWS1(AD_J54159.1);希萨镊丽鱼Labidochromis chisumulae SWS1(AD_J54155.1);埃氏康尼丽鱼Konia eisentrauti SWS1(AD_K92822.1);牙鲆Paralichthys olivaceus RH1(AD_Q38361.1);牙鲆Paralichthys olivaceus RH2 (AD_I59659.1);牙鲆Paralichthys olivaceus SWS2(AD_I59658.1);牙鲆Paralichthys olivaceus LWS (AD_I59657.1)。 |
通过qRT-PCR分析牙鲆5种视蛋白基因的总体表达情况(图3),发现RH1和SWS1基因从孵化后第1天到第13天表达量未发生显著性变化(图3-a,d);而RH2和SWS2基因表达量从第1天到13天显著性增强(图3-b,e);LWS基因则从孵化后第1天到第6天相对表达量显著性增强,然后到第9天、第13天显著性降低(图3-c)。
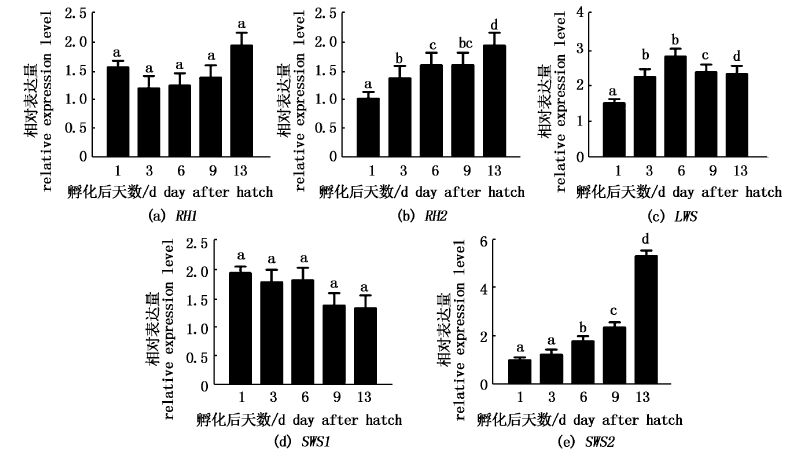
|
图3
牙鲆仔鱼视蛋白基因的相对表达量
Fig.3
Gene expressional level of five opsin genes in larval P. olivaceus by qRT-PCR
字母标注相同的,表示组间没有显著性差异。 The same letters indicate no significant differences between groups. |
牙鲆仔鱼视蛋白基因整体空间表达如图版Ⅰ所示。RH1(图版Ⅰ-A1)和SWS1基因(图版Ⅰ-D1)在牙鲆初孵仔鱼(DAH1)孵出后就有较强表达;RH2、LWS、SWS2基因在卵黄囊与鳍条等处有表达(图版Ⅰ-B1,C1,E1);在卵黄囊开始缩小的DAH3,除SWS2基因外,可见其他视蛋白基因在仔鱼广泛表达(图版Ⅰ-E2);SWS2基因直到DAH6才开始在鳍条处表达(图版Ⅰ-E3)。同为短波敏感视蛋白的SWS1基因始终可见表达(图版Ⅰ-D1~D5)。从DAH9后,5种视蛋白基因在牙鲆仔鱼表达位置主要集中于鳍褶(图版Ⅰ-8)、鳍条(图版Ⅰ-2,7)、鳃(图版Ⅰ-4)、上下颌(图版Ⅰ-10)、冠状幼鳍(图版Ⅰ-12)、肌节(图版Ⅰ-6)、鼻(图版Ⅰ-5)、肠(图版Ⅰ-3)、脊索(图版Ⅰ-11)等处。
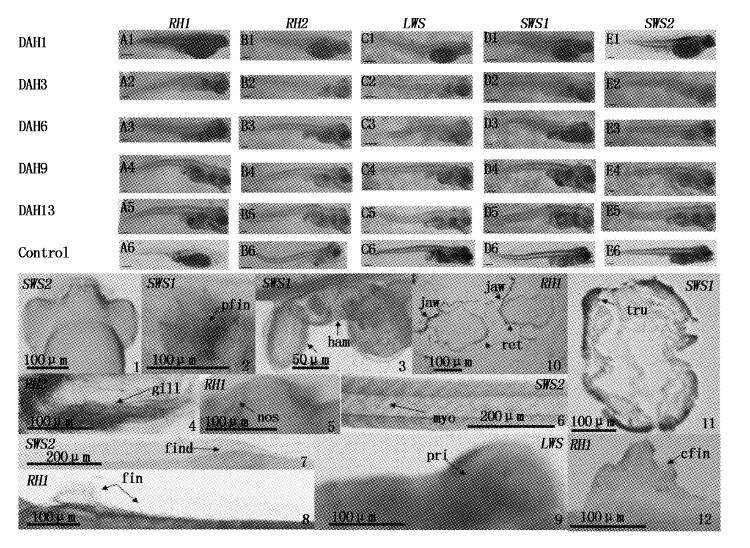
|
图版Ⅰ
牙鲆仔鱼阶段视蛋白基因的整体表达
PlateⅠ
Expressional pattern of opsin genes in larval P. olivaceus
A~E. RH1、RH2、SWS1、WS2、LWS基因在牙鲆仔鱼时期的全身表达模式及阴性对照;红色为基因表达信号,黑色箭头所指为信号较强处。1. SWS2背面观(DAH9); 2. SWS1胸鳍(DAH9); 3. RH2肠道(DAH13); 4. RH2鳃(DAH9); 5. RH1鼻(DAH9); 6. SWS2肌节(DAH3); 7. SWS2鳍褶(DAH1); 8. RH1鳍条(DAH6); 9. LWS冠状幼鳍原基(DAH6); 10. RH1冠状幼鳍(DAH13); 11. RH1眼睛的横切(DAH6); 12. SWS1身体的横切(DAH13); pfin. 胸鳍; ham. 肠;jaw. 颌; ret. 视网膜; tru. 脊索; gill. 鳃; nos. 鼻子; myo. 肌节; find. 鳍褶; fin. 鳍条; pri. 原基; cfin. 冠状幼鳍; 标尺为200 μm。 A-E. Expression patterns and the negative control of RH1,RH2,SWS1,SWS2 and LWS gene in larval P. Olivaceus. Hybridization signals were reflected as red color. Black arrow shows strong signals. 1. Dorsal view of SWS2 gene (DAH9); 2. Expressing pattern of pectoral fin of SWS1 gene (DAH9); 3. Expressing pattern of intestine of RH1 gene (DAH6); 4. Expressing pattern of gill of RH2 gene; 5. Expressing pattern of nose of RH1 gene (DAH9); 6. Expressing pattern of myocomma of SWS2 (DAH3); 7. Expressing pattern of fin fold of SWS2 gene (DAH9); 8. Expressing pattern of fin of RH1 gene; 9. Expressing pattern of the primordium of coronary fin of LWS gene (DAH6); 10. Expressing pattern of coronary fin of RH1 gene (DAH13); 11. Expressing pattern of the crosscut on both eyes of RH1 gene (DAH6); 12. Expressing pattern of the crosscut on body of SWS1gene (DAH13); pfin. pectoral fin;int. intestinal;jaw. jaw;ret. retinal;not. notochord;gill. gill;nos. nose;myo. myocomma;find. fin fold;fin. fin;pri. primordium;cfin. coronary fin. Bars,200 μm. |
视杆视蛋白RH1基因及4种视锥视蛋白(RH2、LWS、SWS1、SWS2)基因在眼睛中的表达见图版Ⅱ。牙鲆孵出后第1天(DAH1),视杆视蛋白RH1(图版Ⅱ-A1-1,A1-2)基因表达时间最早,其表达范围也相对较大;视锥视蛋白基因中,短波敏感视蛋白SWS基因则有着不同的表达情况:其中SWS1基因(图版Ⅱ-C1-1,C1-2)表达明显早于SWS2(图版Ⅱ-D1-1,D1-2);而在中长光谱波段,RH2(图版Ⅱ- B1-1,B1-2)与LWS基因在初孵仔鱼两眼外侧的视网膜感光细胞层表达(图版Ⅱ-E1-1,E1-2;图版Ⅱ-3);此时,除暂未表达的SWS2基因外,其余的视蛋白基因主要集中在眼睛朝向鼻翼侧的视网膜感光细胞层表达(图版Ⅱ-1)。在孵出后第3天仔鱼的眼睛中,仍未见SWS2基因表达(图版Ⅱ-D2-1,D2-2),其他视蛋白基因表达范围扩大,表达强度也逐渐增强。冰冻切片可见SWS1、LWS基因视网膜中视蛋白基因信号表达范围扩大,沿着鼻侧向颞侧发展(图版Ⅱ-5,6,7);SWS2基因在DAH6仔鱼的眼睛中隐约可见(图版Ⅱ-D3-1、D3-2),SWS1基因仍有较强表达(图版Ⅱ-C3-1、C3-2)。到DAH9时,牙鲆仔鱼眼部视蛋白基因环绕仔鱼眼睛周围表达,SWS2基因表达范围也逐渐增大(图版Ⅱ-D4-1、D4-2);5种感光视蛋白基因在DAH13仔鱼的眼睛中均有一定程度的表达,此时冰冻切片显示RH1表达信号环绕整个视网膜感光细胞层(图版Ⅱ-9)。
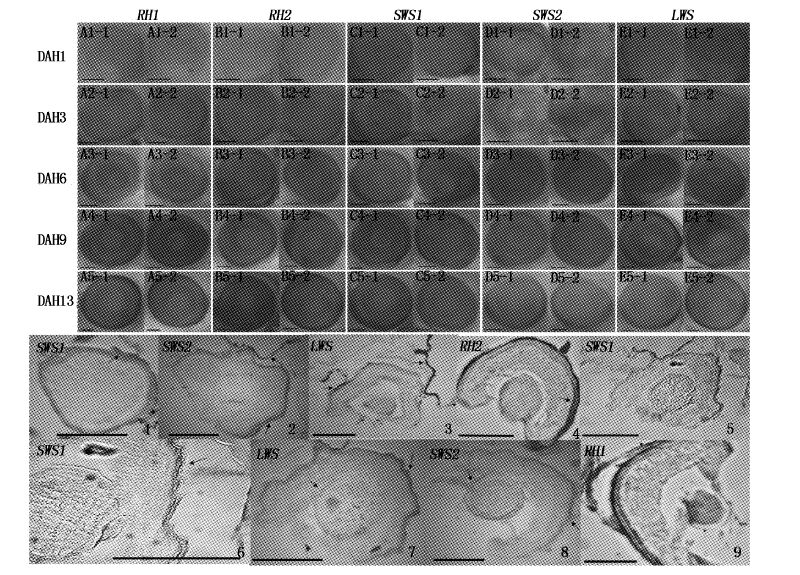
|
图版Ⅱ
牙鲆仔鱼眼睛中视蛋白基因的表达分布
PlateⅡ
Expressional pattern of five opsin genes in eyes of laval P. olivaceus
A~E. RH1、RH2、SWS1、SWS2、LWS基因在牙鲆仔鱼各时期眼睛中的表达情况。红色处为基因表达信号,黑色箭头所指为信号较强处。1. SWS1(DAH1); 2. SWS2(DAH9); 3. LWS(DAH9); 4. RH2(DAH13); 5. SWS1(DAH3); 6. SWS1信号放大图(DAH3); 7. LWS(DAH3); 8. SWS2(DAH13); 9. RH1(DAH13); 所有标尺为100 μm。 A-E. Expression patterns of RH1,RH2,SWS1,SWS2 and LWS gene in eyes of larval P. Olivaceus. Hybridization signals were reflected as red color. Black arrow shows strong signals. 1. SWS1(DAH1); 2. SWS2(DAH9); 3. LWS(DAH9); 4. RH2(DAH13); 5. SWS1(DAH3); 6. Signal amplification of SWS1(DAH3); 7. LWS(DAH3); 8. SWS2(DAH13); 9. RH1(DAH13); All Bars,100 μm. |
本研究首次克隆了牙鲆短波敏感视蛋白SWS1基因全长1 317 bp的cDNA序列,发现其编码的蛋白包含2个视蛋白基因家族特有结构域,分别是Rhodopsin_N(视紫红质N端G蛋白受体)区和一个7tm_1区(七次跨膜受体区)。系统进化分析显示牙鲆先与其他鱼类的SWS1基因聚在一支,然后再跟其他视蛋白基因聚在一起,表明本研究所克隆到的序列为SWS1基因序列。目前,已在斑马鱼[2]、香鱼[13]、大西洋庸鲽[14]等鱼类中发现了该基因。已报道的两栖类和鱼类等已测定的21种脊椎动物的SWS1的λmax均为360 nm左右[18]。在牙鲆中发现SWS1基因,表明牙鲆具有潜在的感受紫外光线的能力。
从孵化后第1天到第13天,RH1基因在眼睛中总体表达较强,该结果与qRT-PCR得到的结果相吻合,表明牙鲆仔鱼RH1基因相对表达量的变化与眼睛中表达的变化趋势一致。随着眼睛的发育,RH1基因在视网膜感光层中的表达范围逐渐扩大,从鼻翼侧逐渐延伸至整个视网膜。RH1在0~10 m水层的鱼类中λmax接近500 nm[19],由于RH1本身λmax为493 nm,所以牙鲆仔鱼视杆视蛋白RH1可直接对此光波长接收[19]。同时,视锥蛋白RH2的感受范围也在510 nm左右,因此牙鲆仔鱼的视锥蛋白RH2与RH1基因表达有相似的表现,这种相似的表现也在金眼鲷目金鳞鱼科中被发现[19]。
LWS主要感受长波的红色光(λmax为560 nm),普遍在有胎盘哺乳动物及两栖类视网膜中表达[20]。SWS1的吸收波长λmax为360 nm左右[18]。在牙鲆初孵仔鱼中感受长波长和短波长的LWS和SWS1基因就有表达,表明一开始牙鲆仔鱼就具有感受长波长和短波长光线的能力,可能有助于尽早地避开紫外线对鱼体的伤害。令人奇怪的是,相比另外4种在第1天就表达的感光视蛋白基因,同样感受短波蓝光的SWS2的基因直到孵化后第6天才开始表达,这点与同为比目鱼的大西洋牙鲆就有一定的差异[15]。除了环境对此造成的原因,究其本质,在调查了其他物种视蛋白基因表达的先后顺序后,我们发现这种情况也在大马哈鱼等视网膜中出现,出现这种情况的原因可能是相对于哺乳类等高等脊椎动物,鱼类的视蛋白基因序列相似性相对较低,并由于长期生活在海洋不同水深,发生“蓝移”、“红移”的概率也大得多[21]。在此之前,仔鱼可能通过SWS1感受蓝光,因为SWS1除了感受紫外以外,也能感受λmax 390~440 nm的蓝光[22],对视蛋白基因序列的比较发现得到感受较早,这点在鱼类中普遍存在。有研究表明,仅仅一个氨基酸的替换就可以使SWS1的敏感性向蓝色转换[19]。
本研究还首次发现了视杆视蛋白和视锥视蛋白基因在牙鲆仔鱼阶段眼睛以外的组织中广泛表达,如鳍条、上下颌、鼻、鳃、肌节、表皮层及肠等组织,尤其在表皮大范围地表达,说明了表皮也具有感光能力。在非视觉系统视蛋白,如体表的黑视蛋白与光行为、褪黑激素的合成、睡眠等密切相关,脑中的松果体视蛋白,可能参与节律的变化及生物钟的调控等[22]。同属视蛋白的牙鲆视杆和视锥视蛋白,可能并不是以往所认为的单一介导视觉的功能,而可能具有多种未知的作用,有待今后进一步地深入调查。
| [1] | YOKOYAMA S. Molecular evolution of vertebrate visual pigments[J]. Progress in Retinal and Eye Research, 2000, 19(4): 385-419. |
| [2] | CHINEN A, HAMAOKA T, YAMADA Y, et al. Gene duplication and spectral diversification of cone visual pigments of zebrafish[J]. Genetics, 2003, 163(2): 663-675. |
| [3] | KAWAMURA S, TAKESHITA K, TSUJIMURA T. Evolutionarily conserved and divergent regulatory sequences in the fish rod opsin promoter[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2005, 141(4): 391-399. |
| [4] | AHLBERT I B. Ontogeny of double cones in the retina of perch fry(Perca fluviatilis, Teleostei)[J]. Acta Zoologica, 1973, 54(4): 241-254. |
| [5] | PANKHURST P M, BUTLER P. Development of the sensory organs in the greenback flounder, Rhombosolea tapirina[J]. Marine and Freshwater Behaviour and Physiology, 1996, 28(1/2): 55-73. |
| [6] | BLAXTER J H S, JONES M P. The development of the retina and retinomotor responses in the herring[J]. Journal of the Marine Biological Association of the United Kingdom, 1967, 47(3): 677-697. |
| [7] | STELL W T, HÁROSI F I. Cone structure and visual pigment content in the retina of the goldfish[J]. Vision Research, 1976, 16(6): 647-657. |
| [8] | DOWNING J E G, DJAMGOZ M B A, BOWMAKER J K. Photoreceptors of a cyprinid fish, the roach: morphological and spectral characteristics[J]. Journal of Comparative Physiology A, 1986, 159(6): 859-868. |
| [9] | BOWMAKER J K, KUNZ Y W. Ultraviolet receptors, tetrachromatic colour vision and retinal mosaics in the brown trout(Salmo trutta): age-dependent changes[J]. Vision Research, 1987, 27(12): 2101-2108. |
| [10] | ALEXANDER G, SWEETING R, MCKEOWN B. The shift in visual pigment dominance in the retinae of juvenile coho salmon(Oncorhynchus kisutch): an indicator of smolt status[J]. The Journal of Experimental Biology, 1994, 195(1): 185-197. |
| [11] | BROWMAN H I, HAWRYSHYN C W. Thyroxine induces a precocial loss of ultraviolet photosensitivity in rainbow trout(Oncorhynchus mykiss, Teleostei)[J]. Vision Research, 1992, 32(12): 2303-2312. |
| [12] | ARCHER S, HOPE A, PARTRIDGE J C. The molecular basis for the green-blue sensitivity shift in the rod visual pigments of the European Eel[J]. Proceedings of the Royal Society of London Series B, 1995, 262(1365): 289-295. |
| [13] | MINAMOTO T, SHIMIZU I. Molecular cloning and characterization of rhodopsin in a teleost(Plecoglossus altivelis, Osmeridae)[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2003, 134(4): 559-570. |
| [14] | FORSELL J, HOLMQVIST B, EKSTRÖM P. Molecular identification and developmental expression of UV and green opsin mRNAs in the pineal organ of the Atlantic halibut[J]. Developmental Brain Research, 2002, 136(1): 51-62. |
| [15] | HELÜIK J V, DRIVENES Ø, HARBOE T, et al. Topography of different photoreceptor cell types in the larval retina of Atlantic halibut(Hippoglossus hippoglossus)[J]. The Journal of Experimental Biology, 2001, 204(14): 2553-2559. |
| [16] | 李慧, 徐义平, 鲍宝龙. 牙鲆胚后发育阶段HDAC1基因的空间表达[J]. 上海海洋大学学报, 2014, 23(5): 642-648. LI H, XU Y P, BAO B L. Different expression pattern of HDAC1 before and during the process of metamorphosis in Paralichthys olivaceus[J]. Journal of Shanghai Ocean University, 2014, 23(5): 642-648. |
| [17] | 李乐康, 鲍宝龙. 牙鲆变态发育过程中epigen基因的空间表达分布[J]. 上海海洋大学学报, 2012, 21(6): 929-934. LI L K, BAO B L. Expressional pattern of epigen gene in metamorphosing Paralichthys olivaceus using whole-mount in situ hybridization[J]. Journal of Shanghai Ocean University, 2012, 21(6): 929-934. |
| [18] | FASICK J I, ROBINSON P R. Mechanism of spectral tuning in the dolphin visual pigments[J]. Biochemistry, 1998, 37(2): 432-438. |
| [19] | YOKOYAMA S, TAKENAKA N. The molecular basis of adaptive evolution of squirrelfish rhodopsins[J]. Molecular Biology and Evolution, 2004, 21(11): 2071-2078. |
| [20] | TREZISE A E, COLLIN S P. Opsins: evolution in waiting[J]. Current Biology, 2005, 15(19): R794-R796. |
| [21] | CHENG C L, GAN K J, FLAMARIQUE I N. The ultraviolet opsin is the first opsin expressed during retinal development of salmonid fishes[J]. Investigative Ophthalmology & Visual Science, 2007, 48(2): 866-873. |
| [22] | SHI Y S, YOKOYAMA S. Molecular analysis of the evolutionary significance of ultraviolet vision in vertebrates[J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(14): 8308-8313. |
 2015, Vol. 24
2015, Vol. 24


