2. 国家海洋局海洋赤潮灾害立体监测技术与应用重点实验室, 上海 200090;
3. 上海海洋大学 海洋科学学院, 上海 201306
随着我国经济的不断发展,沿海港口和航运业发挥着越来越重要的作用,城市规模也在不断地扩大。随之而来的是码头建设、桥梁建设、航道疏浚、围海造地以及城市建设等工程建设,疏浚物大量倾倒入海洋倾倒区。疏浚物的主要成分为粘质土和砂质土,主要为清洁疏浚物,其倾倒入海必然会对疏浚区以及周边的海洋环境造成一定的影响。
疏浚物在海上的倾倒已对海洋生态造成一定程度的危害,国内外的学者都对此进行了研究。疏浚物的倾倒引起水体中悬浮物、浊度的升高,并产生土丘状浮泥[1],改变着原有的底质类型和地形等物理变化;同时改变着水体中pH、COD、营养盐和有毒有害物质等化学环境。如悬浮物浓度的升高会降低藻类的光合作用[2, 3];一定浓度的悬浮物对浮游甲壳类有明显的致毒效应[4],同时影响蟹幼体的变态发育和浮游动物的种群密度[5, 6];疏浚物所产生的高浓度悬浮物还影响鱼类的摄食率等正常的生理功能[7, 8],对仔鱼有致畸作用[9],使鱼类出现回避反应[10];疏浚物的倾倒也可造成有机或重金属污染物二次污染,使其在生物体内积累产生毒性效应[11, 12]。
疏浚物短时间内的大量倾抛,倾倒区及其附近海域原有底质被覆盖,造成的直接结果是原来底质中生存的部分海洋生物随之被掩埋,破坏了底栖生物尤其是底栖贝类的栖息环境,造成大量底栖生物的死亡。疏浚物悬沙对于海洋生物致死效应的影响已经有了比较深入的研究,但是掩埋对于底栖生物研究不多。菲律宾蛤仔(Ruditapes philippinarum)、双齿围沙蚕(Perinereis aibuhitensis)为广分布种[13, 14, 15],同时也是疏浚物海洋倾倒生物学检测技术规程推荐急性毒性试验的受试生物[16],因此,本实验选用这两种受试生物。而不同粒度的清洁疏浚物掩埋对于底栖生物急性毒性效应的研究还没有开展过,为研究不同粒度疏浚物掩埋对于海洋底栖生物的致死效应,本实验采用长江口的疏浚物模拟不同粒度、不同厚度掩埋菲律宾蛤仔以及双齿围沙蚕,从而了解底栖生物在不同粒度、不同厚度掩埋情况下的反应及存活情况。
1 材料与方法 1.1 疏浚物样品的采集疏浚物采自长江口地区各码头、港口以及航道海域底泥(图1)。现场用0.05 m2采泥器采集沉积物样本,用自封袋封口保存。

|
图1 采样位点 Fig.1 The sampling stations |
将疏浚物放入干燥箱中在100 ℃下烘干至恒重,冷却干燥后,对于粘土质的疏浚物进行研磨,而对于砂质的疏浚物来说不用进行研磨,然后用不同孔径大小的筛子过筛,保留粒度大小为63~125 μm、63 μm以下的疏浚物,放置在干燥皿中备用。
对分离后疏浚物中的硫化物、重金属(Cu,Pb,Zn,Cr,Cd,Hg)、As、PCBs、六六六、DDT、有机碳、油类污染物含量及各实验组用水进行了分析。硫化物用甲基兰分光光度法测定;Hg、As采用冷原子荧光光度法测定;Cu、Cr、Cd、Pb采用原子吸收分光光度法测定;有机碳采用重铬酸钾氧化-还原容量法;油类采用紫外分光光度法测定。表1显示,疏浚物各项指标符合国家沉积物质量Ⅰ类标准[17],实验使用的疏浚物属清洁疏浚物。
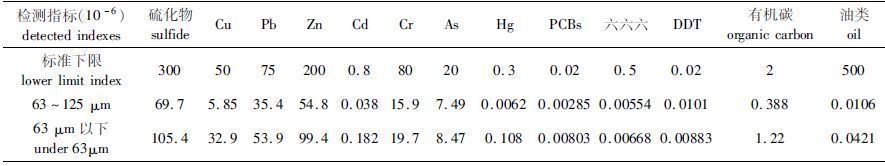
|
表1 疏浚物各项指标 Tab. 1 All detected indexes of dredged materials |
实验开始前将不同粒度大小的疏浚物放置于大的容器内与实验时所用的海水(盐度为23.27,pH 8.34,DO为7.1 mg/L)充分混合。
1.3 实验贝类受试生物菲律宾蛤仔购于上海军工路东方水产品市场。实验贝类取回后,在生物毒性实验室放入水族缸中用实验海水暂养3天进行驯化,暂养期间充气,每天投喂小球藻(Chlorella vulga)两次,并换水一次,以保证贝类的活性。实验时挑选大小均一、健康的个体进行实验。贝类的生物学数据见表2。

|
表2 受试生物菲律宾蛤仔情况 Tab. 2 Biology measure of Ruditapes philippinarum |
受试生物沙蚕为双齿围沙蚕,购于江苏盐城。受试沙蚕取回之后在海水中暂养一天。实验时挑选大小一致,活动能力强的健康个体进行实验。沙蚕的生物学数据见表3。

|
表3 受试生物沙蚕情况 Tab. 3 Biology measure of Perinereis aibuhitensis |
实验装置在直径为14 cm,高为19 cm,2 L的玻璃容器内进行,容器要在实验开始前用实验海水浸泡两天。选用63~125 μm疏浚物进行实验。每次实验设置掩埋梯度及受试生物的个数见表4,分别为:0 cm(对照组,A组)、2 cm(B组)、4 cm(C组)、6 cm(D组)、8 cm(E组)、10 cm(F组)、12 cm(G组)。每组设置3个平行样。

|
表4 各实验组疏浚物掩埋深度及 受试生物的数量 Tab. 4 Burial depth of dredged materials and number of Ruditapes philippinarum |
实验开始时将菲律宾蛤仔置于玻璃容器的底部,取事先混有海水的疏浚物覆盖于各容器的底部,并达到设定的掩埋深度,最后弃去容器内的上清液,并加1 L新鲜的海水,高度在7 cm左右,开始实验观测。实验周期设置为96 h。
对于沙蚕来说,因为受试生物活动能力较强,因此在实验开始时将沙蚕置于容器底部,取已浸泡在海水中的疏浚物放置在底部的沙蚕之上并达到预定的掩埋深度,最后加入新鲜的海水开始实验观测。实验周期为96 h。
每24小时观测受试生物1次,记录异常的行为个体,并记录各组实验海水的水温、盐度、pH、DO值、受试生物存活数量等数据。实验期间菲律宾蛤仔组海水的平均温度为15.09 ℃,盐度为23.78,pH为7.65,DO为4.0 mg/L,每天用虹吸的方法更换上覆水为新鲜的海水一次,并在换水之后向各组受试生物投喂小球藻;沙蚕组海水的平均温度为13.4 ℃,盐度为21.50,pH为7.66,每天用虹吸的方法更换上覆水为新鲜的海水一次。
2 结果 2.1 受试生物在疏浚物中的迁移 2.1.1 菲律宾蛤仔的迁移情况受试生物被疏浚物掩埋后,能在疏浚物垂直方向和水平方向上迁移,在疏浚物中会有明显的活动痕迹。菲律宾蛤仔具有较强的迁移能力,菲律宾蛤仔被埋在疏浚物中,其要伸出进出水管进行换气、取食等活动,可以观察到进出水管的长度可达身体长度的1~2倍,因此,在对其垂直迁移观察的过程中可通过观测进出水管是否伸出疏浚物表面来判断其存活状态。
当粒度为63~125 μm时,对照组(A组)24 h时10只菲律宾蛤仔均存活;48 h时其中一平行组有1只死亡,到96 h时又死亡1只,其他两个平行组全部存活。G组96 h均未发现菲律宾蛤仔有进出水管露出疏浚物表面或有菲律宾蛤仔迁移到疏浚物表面。此粒度下96 h迁出个数即为存活的个体数。各组平均迁移个数随时间变化情况见图2。

|
图2 平均迁移个数随时间变化情况(63~125 μm) Fig.2 The average number of migration along with the change of the time(63~125 μm) |
当粒度为63 μm以下时,A组96 h中并没有个体死亡。各组平均迁移个数随时间变化情况见图3。由于此粒度下疏浚物过于细小,开始掩埋时由于含水量较高造成菲律宾蛤仔无法向上移动;但随着时间的推移疏浚物向下挤压造成其无法移动,只能伸出水管进行摄食以及呼吸,因此在此粒度下存活个数与迁出的个数并没有直接的联系,存活个数在实验结束时逐个进行检验。

|
图3 平均迁移个数随时间变化情况(63 μm以下) Fig.3 The average number of migration along with the change of the time |
当粒度为63 ~125 μm时,由于沙蚕具有较强的迁移能力,因此当掩埋发生时沙蚕能很快地迁至疏浚物的表面。掩埋完成后5 min内几乎所有的沙蚕都迁至疏浚物的表面;仅12 cm组一个平行中有2只沙蚕被掩埋后未能迁移至疏浚物表面而死亡,其他组的沙蚕由于在迁出过程中受到损伤在迁移至疏浚物表面后有一定的死亡。由于63~125 μm疏浚物颗粒较大,颗粒与颗粒之间较为疏松,生物在迁移过程中不会留下迁移的轨迹,亦不会留下洞穴,因此这种粒度掩埋的沙蚕很快就迁至疏浚物表明,没有发现其中有存活的沙蚕。
当粒度为63 μm以下时,实验过程中对照组没有死亡,仅有两只反应迟钝,实验组沙蚕在实验开始后很快就迁移至疏浚物的表面。由于本次实验用的疏浚物粒度为63 μm以下,颗粒较小,相对来说比较致密,因此沙蚕迁出疏浚物表面所用的时间较63~125 μm的疏浚物所用的时间稍长一些。沙蚕在疏浚物中迁移有明显的轨迹,当爬出洞穴的沙蚕受到刺激时,其快速地缩回洞穴中。96 h里实验组中各有一部分的沙蚕死亡,总体来说随着掩埋深度的增加死亡个数有所增加。
2.2 掩埋深度与受试生物死亡率的关系 2.2.1 受试生物的存活率表5显示96 h后各组底栖生物存活率情况。实验结果显示,当粒度为63~125 μm时,对照组菲律宾蛤仔96 h存活率为93.33%;而其他对照组均没有个体死亡,符合固相疏浚物毒性试验对照组生物质量控制标准[16]。

|
表5 各组受试的存活率 Tab. 5 Survival rates of different groups% |
当粒度为63~125 μm时,从表5中可以看出,随着疏浚物掩埋深度的增加,菲律宾蛤仔的存活率在降低,其死亡率在增加。利用Spss软件对疏浚物的掩埋深度与该组菲律宾蛤仔死亡率进行回归分析,结果表明,掩埋深度与死亡率之间存在极其显著正相关关系(R2=0.9073,P<0.01),回归曲线见图4。

|
图4 疏浚物掩埋深度与菲律宾蛤仔 死亡率的回归曲线(粒度为63~125 μm) Fig.4 Regression curve of burial depth and mortality of Ruditapes philippinarum |
根据此回归曲线求出了此粒度下菲律宾蛤仔的25%、50%、75%、100%死亡时疏浚物的预测掩埋深度以及95%置信区间,预测到菲律宾蛤仔25%死亡的掩埋深度是4.3 cm,95%置信区间为(1.3~7.3) cm;预测4d-LC50为6.8 cm,95%置信区间为(2.8~10.7) cm;预测4d-LC75为9.2 cm,95%置信区间为(4.4~14.1) cm;预测4d-LC100为11.7 cm,95%置信区间为(6.0~17.5) cm。
当粒度为63μm以下时,对掩埋深度与菲律宾蛤仔死亡率进行回归分析,结果表明,掩埋深度与菲律宾蛤仔死亡率之间存在极其显著正相关关系(R2=0.903 1,P<0.01),回归曲线见图5。

|
图5 疏浚物掩埋深度与菲律宾蛤仔死亡率 的回归曲线(粒度为63 μm以下) Fig.5 Regression curve of burial depth and mortality of Ruditapes philippinarum |
根据此回归曲线求出了此粒度下菲律宾蛤仔的25%、50%、75%、100%死亡时疏浚物的预测掩埋深度和95%置信区间,预测到菲律宾蛤仔25%死亡的掩埋深度是5.5 cm,95%置信区间为(0.7~10.3) cm;预测96 h-LC50为11.1 cm,95%置信区间为(4.2~18.0) cm;预测96 h-LC75为16.7 cm,95%置信区间为(7.7~25.7) cm;预测96 h-LC100为22.3 cm,95%置信区间为(11.2~33.3) cm。
2.2.3 掩埋深度与沙蚕死亡率的关系从表5可以看出,当粒度为63~125 μm时,掩埋深度较低,沙蚕几乎都存活;随着掩埋深度的增加沙蚕出现一定的死亡,掩埋深度越大死亡率稍微增加。仅12 cm组中有两只未能迁移出表面而死亡,其他掩埋组的沙蚕虽及时迁至疏浚物的表面,但是在掩埋及迁移的过程中可能造成一定的损伤,故其虽迁移至表面,但是随着时间的推移一部分个体死亡还是无法避免的。
当粒度为63 μm以下时掩埋深度大的组死亡率明显比掩埋深度小的组大,随着掩埋深度的增加其死亡率也在增加。沙蚕的死亡率与本实验所设置疏浚物掩埋深度之间没有显著相关关系,但是可以推测出该粒度下的疏浚物掩埋对于沙蚕来说影响极其有限,这与其有着较活跃的运动能力有着密切的关系。
3 讨论 3.1 掩埋对两种生物影响的差异菲律宾蛤仔隶属于软体动物双壳纲、帘蛤目、帘蛤科、蛤仔属,是我国沿海广泛养殖的经济贝类之一,属于广温、广盐性品种,也是自然海区底栖生物群落常见优势种。栖息在低潮带及数米深的泥沙海底,栖息底质在含砂量为70%~80%砂泥滩中数量最多。含砂量很少的泥滩以及含泥量极少的砾石或砂质地带,虽然也有发现,但数量比较少。蛤仔以发达的斧足挖掘泥砂而营穴居生活。涨潮时,迁至滩面,伸出水管进行相应的呼吸、摄食和排泄等活动;落潮后或遇到外界刺激时,其会紧闭双壳,或伸缩足来活动,退至穴中,在滩面上留出两个靠得很近的由进、出水管形成的孔[13, 14, 18]。双齿围沙蚕在分类学上属于环节动物门、多毛纲、游走目、沙蚕科,可分为头部、躯干部和尾部。躯干部由许多结构相似的体节组成,每个体节的两侧具外伸的肉质扁平突起,即疣足。沙蚕在潮间带极为常见,也在深海中出现,在岩岸石头下、石缝中、海藻间,以及软底质或珊瑚礁中均占优势,同时喜欢栖息于有淡水流入的沿海滩涂、潮间带中区到潮下带的沙泥中[15]。两种受试生物分属于不同的底栖类群,即软体动物和多毛类。
底栖生物不同掩埋深度其存活率也不尽相同。一般来说,随着疏浚物掩埋深度的增加,贝类的存活率也会相应的下降。晁敏等[19]的研究结果显示:当掩埋深度为0 cm时,尖紫蛤的存活率为100%;掩埋深度为6 cm时,存活率为56.7%;掩埋深度为10 cm时,存活率为16.7%。本研究显示掩埋深度增加,菲律宾蛤仔的存活率相应减小,死亡率与掩埋深度存在显著的相关关系,这与他的研究结果相似。然而对于双齿围沙蚕来说,随着掩埋深度的增加死亡率有一定程度的增加,但是死亡率与掩埋深度之间并没有显著的相关关系,掩埋深度对其死亡率影响不显著。
对贝类来说其运动能力有限,主要靠腹足来运动,当受到刺激时为了保护自己贝类停止运动、摄食等活动;而对沙蚕来说疣足是其运动器官,除了身体的头部和尾部几节无疣足外,剩余体节都具有疣足,这就加强了其运动的能力,当受到外界刺激时其会加强运动来躲避刺激和敌害等。这从实验中可以得到印证,粒度为63~125 μm、掩埋时间为24 h时,0、2、4、6、8、10、12 cm组菲律宾蛤仔平均迁至疏浚物表面的个数分别为10、8.3、7、4.3、1.7、0、0,而双齿围沙蚕在掩埋完成后5 min内几乎都迁至疏浚物的表面;当粒度为63 μm以下、掩埋时间为24 h时,仅2 cm组有菲律宾蛤仔迁出,平均迁出个数为1.7,而沙蚕在掩埋开始后就迁至疏浚物表面。在实验过程中发现菲律宾蛤仔被掩埋时,其会紧闭双壳,一动不动地呆在被掩埋的位置;而沙蚕被掩埋时,其会不停地划动疣足向上运动,即当掩埋结束后沙蚕也几乎都迁至疏浚物的表面。两个类群运动的策略以及运动能力的强弱造成相同掩埋条件下不同的存活情况。
3.2 不同粒度对生物存活影响的差异在实验过程中,菲律宾蛤仔在63~125 μm疏浚物中有相当一部分能够迁移至疏浚物的表面,而在63 μm以下疏浚物中仅在掩埋深度比较小时迁移出很小一部分,63 μm以下的疏浚物相对于63~125 μm疏浚物粘度高,在迁移的过程中63 μm以下的疏浚物阻力较大,在相同的掩埋条件下粒度较大的迁移到疏浚物表面的个数要比粒度小的多。从两种粒度下掩埋深度与菲律宾蛤仔96 h 25、50、75和100%死亡之间的关系可以看出,菲律宾蛤仔死亡率在25%、50%、75%、100%时,两种粒度下粒度小的死亡掩埋深度大,粒度大的反而小;说明粒度在63以下时,菲律宾蛤仔在96 h里表现出更强的存活能力。从存活和迁出情况对比显示,虽然在63 μm以下能够暂时存活,但是其没有能够有效迁出,消除不利影响,这可以看出菲律宾蛤仔更适合砂质的底质中生活,这也符合贝类生活习性,这是其长期适应的结果。而对于沙蚕,其在两种粒度下都能很快地迁移至疏浚物的表面,但是在63~125 μm疏浚物中迁移未有迁移的管道形成,此粒度下疏浚物比较松散,当迁移发生时较松的结构导致已形成的管道被掩埋,因此沙蚕只能停留在该粒度疏浚物的表面;而在63 μm以下疏浚物中迁移其能形成迁移的管道,当沙蚕受到刺激时其很快地缩回到管道当中,这与其营钻洞生活相似,这样其可以躲避敌害等外界刺激,其更适合在能形成栖管的泥沙质中生存。
与季晓等[20]的实验结果对比发现:当粒度为63~125 μm时,10 cm以下掩埋深度都有蛤仔迁出疏浚物表面,96 h-LC50为6.8 cm,192 h-LC50为8.4 cm,发现时间对于蛤仔半致死深度影响不大;这是因为个体受压迫后迅速地迁出疏浚物的表面,而对于迁至疏浚物的个体来说其都会存活,而没有迁出个体将会死亡。当粒度为63 μm以下时,仅6 cm以下掩埋深度有蛤仔迁至疏浚物表面,96 h-LC50为11.1 cm,192 h-LC50为7.1cm。对于菲律宾蛤仔来说造成时间不同半致死深度不同的原因是:虽然短时间内个体未能有效迁至疏浚物表面,但是个体仍然存活;但是随着时间的延长,胁迫程度的加深会使在疏浚物中的个体死亡。通过比较我们发现,由于贝类迁移能力有限,为保障个体存活,63~125 μm疏浚物掩埋深度不宜超过10 cm,而63 μm以下疏浚物掩埋深度不宜超过6 cm。
3.3 疏浚物处置对生物的的影响疏浚物在海上的处置,对于生活在海底的生物存在潜在的威胁,其处理方式直接影响到海洋生物的生存以及生理,影响生态系统的稳定。本实验显示,不同的粒度、掩埋深度对于不同底栖生物影响不同,因此海上处置疏浚物的过程中,合理控制疏浚物的粒度以及疏浚物沉积的厚度对于疏浚区生物的保护具有积极的意义,有利于生物群落在海底的快速重建。
| [1] | 张玉芬, 陈声亮. 疏浚物海洋倾废的物理归宿及其对环境的影响[J]. 海洋通报, 1995, 14(5): 67-94. ZHANG Y F, CHEN S L. Physical end of dredged materials in Marine Dumping and effect to the environment[J]. Marine Science Bulletin, 1995, 14(5): 67-94. |
| [2] | 张运林, 秦伯强, 陈伟民, 等. 悬浮物浓度对水下光照和初级生产力的影响[J]. 水科学进展, 2004, 15(5): 615-620. ZHANG Y L, QIN B Q, CHEN W M, et al. Experimental study on underwater light intensity and primary productivity caused by variation of total suspended matter[J]. Advances in Water Science, 2004, 15(5): 615-620. |
| [3] | VAN DUIN E H S, BLOM G, LOS F J, et al. Modeling underwater light climate in relation to sedimentation, resuspension, water quality and autotrophic growth[J]. Hydrobiologia, 2001, 444(1/3): 25-42. |
| [4] | 李纯厚, 林燕棠, 杨美兰, 等. 南海海港疏浚淤泥悬浮物对海洋动物的急性毒性效应[J]. 中国环境科学, 1997, 17(6): 550-553. LI C H, LIN Y T, YANG M L, et al. The acute toxicity of the sludge suspended solution from a Port of South China Sea to marine animals[J]. China Environmental Science, 1997, 17(6): 550-553. |
| [5] | 王云龙, 成永旭, 徐兆礼, 等. 长江口疏浚土悬沙对中华绒螯蟹幼体发育和变态的影响[J]. 中国水产科学, 1999, 6(5): 20-23. WANG Y L, CHENG Y X, XU Z L, et al. Effects of suspended dredging sediment on the larval development and molt of Chinese crab Eroicheir sinensis[J]. Journal of Fishery Sciences of China, 1999, 6(5): 20-23. |
| [6] | 王金秋, 徐兆礼, 石椿, 等. 长江口疏浚弃土悬沙对褶皱臂尾轮虫的影响[J]. 应用生态学报, 2002, 13(7): 871-874. WANG J Q, XU Z L, SHI C, et al. Effect of suspended silt from dredging at Yangtze estuary on Brachionus plicatilis[J]. Chinese Journal of Applied Ecology, 2002, 13(7): 871-874. |
| [7] | GARDNER M B. Effects of turbidity on feeding rates and selectivity of bluegills[J]. Transactions of the American Fisheries Society, 1981, 110(3): 446-450. |
| [8] | BUNT C M, COOKE S J, SCHREER J F, et al. Effects of incremental increases in silt load on the cardiovascular performance of riverine and lacustrine rock bass, Ambloplites rupestris[J]. Environmental Pollution, 2004, 128(3): 437-444. |
| [9] | 周勇, 马绍赛, 曲克明, 等. 悬浮物对半滑舌鳎胚胎和初孵仔鱼的毒性效应[J]. 渔业科学进展, 2009, 30(3): 32-37. ZHOU Y, MA S S, QU K M, et al. Toxic effects of suspended substances (SS) on the embryos and newly-hatched larvae of Cynoglossus semilaevis Günther[J]. Progress in Fishery Sciences, 2009, 30(3): 32-37. |
| [10] | BISSON P A, BILBY R E. Avoidance of suspended sediment by juvenile coho salmon[J]. North American Journal of Fisheries Management, 1982, 2(4): 371-374. |
| [11] | WILLFORD W A, MAC M J, HESSELBERG R J. Assessing the bioaccumulation of contaminants from sediments by fish and other aquatic organisms[J]. Hydrobiologia, 1987, 149(1): 107-111. |
| [12] | CIARELLI S, VONCK W A P M A, VAN STRAALEN N M, et al. Ecotoxicity assessment of contaminated dredged material with the marine amphipod corophium volutator[J]. Archives of Environmental Contamination and Toxicology, 1998, 34(4): 350-356. |
| [13] | 庄启谦. 中国动物志—软体动物门, 双壳纲, 帘蛤科[M]. 北京: 科学出版社, 2001. ZHUANG Q Q. Zoography of China, Mollusca, Bivalvia, Veneridae[M]. Beijing: Science Press, 2001. |
| [14] | 吴耀泉. 中国近海菲律宾蛤仔的生态研究[J]. 海洋科学集刊, 1995, 36: 213-216. WU Y Q. Ecological studies on Ruditapes philippinarum in the Chinese coast[J]. Studia Marina Sinica, 1995, 36: 213-216. |
| [15] | 孙瑞平, 杨德渐. 中国动物志, 无脊椎动物, 第三十三卷 环节动物门 多毛纲(二) 沙蚕目[M]. 北京: 科学出版社, 2001: 180-183. SUN R P, YANG D J. Zoography of China, Invertebrate, 33th, Polychaete (Ⅱ), Nereidida[M]. Beijing: Science Press, 2001: 180-183. |
| [16] | 国家海洋局. 疏浚物海洋倾倒生物学检验技术规程[Z]. 国家海洋局, 2003. State Oecanic Adminstration People's Republic Of China. Technical regulations of bioassay test in ocean dumping for dredged materials[Z]. SOA, 2003. |
| [17] | 中华人民共和国国家质量监督检验检疫总局. GB 18668—2002 海洋沉积物质量[S]. 北京: 中国标准出版社, 2002. State Oecanic Adminstration People's Republic of China. Quality of Marine sediment[Z]. SOA, 2002. |
| [18] | 吴云霞, 梁健, 闫喜武, 等. 菲律宾蛤仔营养成分分析与评价[J]. 营养学报, 2012, 34(4): 409-410. WU Y X, LIANG J, YAN X W, et al. Analysis of the nutritional components of manila clam Ruditapes philippinarumm[J]. Acta Nutrimenta Sinica, 2012, 34(4): 409-410. |
| [19] | 晁敏, 沈新强, 陈亚瞿. 长江口疏浚土掩埋对两种贝类存活的影响[J]. 应用与环境生物学报, 2007, 13(5): 674-677. CHAO M, SHEN X Q, CHEN Y Q, et al. Burial Effects of the Yangtze River estuary dredging material on macrobenthos[J]. Chinese Journal of Applied and Environmental Biology, 2007, 13(5): 674-677. |
| [20] | 季晓, 徐韧, 刘玉, 等. 清洁疏浚物掩埋对菲律宾蛤仔成体的存活影响[J]. 海洋通报, 2013, 32(6): 704-709, 716. JI X, XU R, LIU Y, et al. Effects of clean dredging materials burial on Ruditapes philippinarum[J]. Marine Science Bulletin, 2013, 32(6): 704-709, 716. |
2. Key Laboratory of Integrated Monitoring and Applied Technology for Marine Harmful Algal Blooms, SOA, Shanghai 200090, China;
3. College of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China
 2016, Vol. 25
2016, Vol. 25


