胆汁酸(bile acid)是胆固醇代谢过程中产生的一系列固醇类物质,是胆汁的重要组成部分。胆汁酸能促进脂肪乳化,提高机体脂肪酶活力,促进脂类物质的消化吸收,调节脂类代谢[1, 2, 3];同时胆汁酸可以通过双向调控来维持体内胆固醇的动态平衡[4, 5];此外,胆汁酸可以有效降低有害菌群数量,预防消化道疾病,减少肠道内毒素[6, 7]。对军曹鱼(Rachycentron canadum)[8]、异育银鲫(Carassius auratus gibelio)[9]等鱼类的研究表明,添加胆汁酸可降低饲料系数,提高增重率,促进脂肪代谢。
大菱鲆(Scophthalmus maximus L.),又名多宝鱼,属鲆科(Bothidae)、菱鲆属(Scophthalmus),是我国重要的海水养殖品种之一。目前,关于胆汁酸在大菱鲆配合饲料中的应用已有报道[10],但仅仅局限于对比添加与不添加的效果,而没有涉及配合饲料中的适宜添加量。因此,本实验通过在基础饲料中添加不同梯度的胆汁酸,研究其对大菱鲆幼鱼生长、体组成、脂肪代谢酶活力及血清生化的影响,以期为胆汁酸在鲆鲽鱼类配合饲料中的应用提供参考。
1 材料与方法 1.1 实验饲料配方及制作以鱼粉和豆粕为主要蛋白源,鱼油为脂肪源,设计粗蛋白含量为50%,粗脂肪含量为14%的基础饲料配方,分别以0、0.03%、0.06%、0.09%及0.12%的胆汁酸等量替代基础饲料中的α-纤维素,配制5组等氮等能的实验饲料,命名为D1、D2、D3、D4及D5组,实验饲料配方及其基本营养成分见表1。各含量高于5%的饲料固体原料按配比称重后粉碎过80目标准筛后,采用逐级扩大的方法加入胆汁酸、维生素及矿物质等含量低于5%的固体原料,再加入新鲜鱼油及适量蒸馏水混匀,用小型颗粒饲料挤压机制成2 mm大小的颗粒,60 ℃烘干后,-20 ℃保存备用。
| 表1 实验饲料配方及其基本营养成分 Tab.1 Formulation and approximate composition of experimental diet |
养殖实验在山东省海洋资源与环境研究院封闭循环水系统中进行,实验用鱼购自蓬莱宗哲养殖有限公司。实验开始前,800尾大菱鲆幼鱼暂养于循环水系统[蓝色养殖水桶(Ф=70 cm,H=80 cm),水深45 cm,水流速约为2 L/min]中,期间投喂对照组饲料,使其适应养殖环境及实验饲料。21 d后挑选体质健壮、规格整齐的平均体质量为26.5 g的大菱鲆幼鱼450尾平均置于15个实验桶中,每桶30尾鱼,每种饲料投喂3个实验桶,养殖实验持续56 d。剩余的鱼同时投喂对照组饲料,56 d后用于确定鳗弧菌半致死浓度。
期间控制水温为16.5 ℃,DO>6 mg/L,NH4+-N及NO2--N<0.05 mg/L,每天投饵2次(08:30,16:00),日投喂量为初始体重的1.5%,并根据摄食及残饵情况随时调整,上午投喂前30 min开灯,保持光照,下午投喂后30 min关灯。每次投喂10 min后,从系统自带的排水口,将残饵排出,计数并计算残饵量。
1.3 样品采集养殖实验结束后,禁食24 h,记录每桶鱼数量并称总质量,计算成活率和增重率;每桶随机取10尾鱼,用MS-222麻醉,测量体质量和体长后,用无菌注射器进行尾静脉取血,然后3尾用作全鱼,剩余7尾在冰盘上解剖分离内脏团、消化道、肝胰脏及背部肌肉,称重并保存,用于脏体比、肝体比等指标计算及酶学和基本组成的测定;血液放入4 ℃冰箱中静置4 h后,以3 000 r/min的速度离心15 min,分离血清,用于血清生化指标的测定。所有样品均保存于-80 ℃待测。
1.4 攻毒实验
养殖实验样品采集完后,每桶挑选15尾规格较一致的实验鱼用作攻毒实验。实验用鳗弧菌(Vibrio anguillarum)由中国科学院海岸带研究所提供,培养及稀释方法参见文献[10],最终应用菌液浓度为2.5×108 cfu/L,由预实验得到大菱鲆幼鱼鳗弧菌感染后60 h的LD50为0.4×107 cfu/g,故每尾鱼腹腔注射150 μL进行攻毒。注射后,将实验鱼放于相同的水体中,保证溶氧充足,每隔2 h观察1次,及时将死鱼捞出,每隔12 h统计累积死亡率,实验持续60 h。
CV(%)=100×(Nd/Ne)
(1)
WG(g)=Wf -Wi
(2)
WGR(%)= 100×WG/Wi
(3)
SGR(%/d)= 100×(lnWf -lnWi)/56
(4)
FCR= FI/WG
(5)
DFI(%)= 100×FI/[( Wi + Wf)/2×56]
(6)
PER(%)= 100×WG /(FI×CP)
(7)
LER(%)= 100×WG /(FI×CL)
(8)
SR(%)= 100×Ns/Ne
(9)
VSI(%)= 100×WV/WB
(10)
HIS(%)= 100×WH/WB
(11)
ISI(%)= 100×WI/WB
(12)
SSI(%)= 100×WS/WB
(13)
CF(g/cm3)= 100×WB /LB3
(14)
饲料及肌肉中水分采用105 ℃恒重法测定(GB/T6435—2006),粗蛋白采用杜马斯燃烧法测定(Leco FP528,USA),粗脂肪采用索氏抽提法测定(GB/T6433—2006),粗灰分采用灰化法测定(GB/T6438—2007),能量采用氧弹仪燃烧法测定(Parr 6100,USA)。
1.5.3 脂肪代谢酶脂肪酶(lipase,LPS)的测定采用聚乙烯醇橄榄油乳化液水解法,试剂购自南京建成生物工程研究所;肝脏肝酯酶(hepatic lipase,HL)、脂蛋白酯酶(lipoprotein lipase,LPL)采用酶联免疫法测定,试剂购自上海酶联生物科技有限公司,蛋白采用考马斯亮蓝法测定。
1.5.4 血清生化指标及脂肪代谢酶血清中谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(asparate aminotransferase,AST)、碱性磷酸酶(alkaline phosphatase,AKP)、总蛋白(total protein,TP)、白蛋白(albumin,ALB)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TCHO)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)及低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)采用全自动生化分析仪测定(Hitachi 7020,Japan),试剂购自北京利德曼生化股份有限公司。
1.6 数据统计实验所得数据采用Microsoft office Excel 2007统计后,用SPSS®(SPSS,Inc,Chicago,IL)11.0进行单因素方差分析(One-way ANOVA),结果以平均值±标准差表示,差异显著(P<0.05)时用Duncan’s检验进行多重比较。
2 结果 2.1 饲料中添加胆汁酸对大菱鲆幼鱼生长及形体指标的影响随着饲料中胆汁酸含量的增加,实验大菱鲆幼鱼的增重率、特定生长率、摄食率、蛋白质效率、脂肪效率、脏体比及肠体比均呈先上升后平稳的趋势(表2),生长性能指标均在D3组达到最高值,显著高于D1及D2组(P<0.05),与D4及D5组无显著差异(P>0.05)。D3、D4及D5组饲料系数显著低于D1及D2组(P<0.05),但三者之间差异不显著(P>0.05)。添加胆汁酸对实验大菱鲆幼鱼成活率无显著影响(P>0.05)。
| 表2 胆汁酸对大菱鲆幼鱼生长及形体指标的影响 Tab.2 Effects of dietary bile acid on growth performance and figure index of turbot juveniles |
以增重率为评价指标,经折线模型回归分析表明,体质量为26.5 g的大菱鲆幼鱼饲料中胆汁酸的适宜添加量为0.09%。
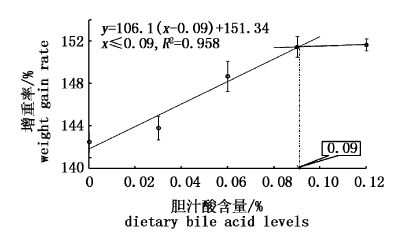
|
图1 胆汁酸对大菱鲆幼鱼增重率的影响 Fig.1 Relationship between weight gain rate and dietary bile acid for turbot juveniles based on broken-line regression analysis |
由表3可知,随着饲料中胆汁酸含量的增加,实验鱼全鱼水分、粗脂肪及粗灰分含量显著降低,而粗蛋白含量均显著升高(P<0.05);随着饲料胆汁酸含量的增加,肌肉中水分及粗脂肪含量显著降低,而粗蛋白及粗灰分含量显著升高(P<0.05)。
| 表3 胆汁酸对大菱鲆幼鱼全鱼及肌肉基本成分的影响 Tab.3 Effects of dietary bile acid on approximate composition of whole fish and muscle of turbot juveniles |
由表4可知,随着饲料中胆汁酸含量的增加,实验大菱鲆幼鱼前肠中脂肪酶活力及肝脏中脂蛋白脂酶活力呈先上升后平稳趋势,D4及D5组活力显著高于D1组(P<0.05);肝脏中肝脂酶活力呈显著上升趋势(P<0.05)。
| 表4 胆汁酸对大菱鲆幼鱼脂肪代谢酶活力的影响 Tab.4 Effects of dietary bile acid on fatty enzymatic activities of turbot juveniles |
由表5可知,饲料中胆汁酸显著降低了大菱鲆幼鱼血清中谷丙转氨酶及谷草转氨酶活力,提高了碱性磷酸酶活力(P<0.05);血清中总蛋白及白蛋白的含量随着饲料胆汁酸含量的增加而显著升高(P<0.05);血清中甘油三酯、总胆固醇、高密度脂蛋白胆固醇及低密度脂蛋白胆固醇含量均随饲料胆汁酸含量的升高而下降(P<0.05)。
| 表5 胆汁酸对大菱鲆幼鱼血清生化指标的影响 Tab.5 Effects of dietary bile acid on biochemical indices of serum of turbot juveniles |
鳗弧菌感染12 h后,实验鱼开始出现死亡,死亡鱼体表现为鱼鳞脱落、鳍部出血、眼球突出、内脏团肿胀等典型鳗弧菌疾病症状。24~36 h是大菱鲆幼鱼感染死亡率最高的时间段,感染48 h后,D1组的累积死亡率已接近100%(97.78%),显著高于D3、D4及D5组(P<0.05)(图2)。D3、D4及D5组实验鱼感染60 h后的累积死亡率显著低于D1组(P<0.05)。
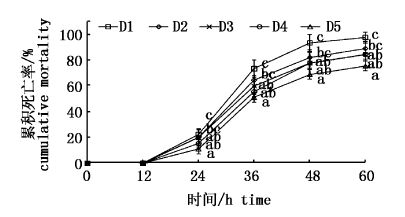
|
图2
胆汁酸对大菱鲆幼鱼感染鳗弧菌后累积死亡率的影响
Fig.2
Effects of dietary bile acid on cumulative mortality of turbot infected with Vibrio anguillarum
同列上标小写字母不同表示二者之间差异显著(P<0.05)。 Different small letters in same column mean significant differences (P<0.05). |
本实验中,添加胆汁酸能显著提高大菱鲆幼鱼的增重率及特定生长率等生长性能指标,与在虹鳟(Oncorhynchus mykiss)上的研究一致。饲料添加胆汁酸显著提高了实验鱼的摄食率,研究表明,动物的摄食量主要由摄入的能量决定的[11, 12],由此可以推测胆汁酸可以提高蛋白、脂肪等能量物质的利用率,从而提高了养殖动物的生长性能。孙建珍[13]比较了两个脂肪水平下添加胆汁酸均能促进大菱鲆的生长性能,且低脂肪组(10%)添加胆汁酸的促生效果优于高脂肪组(18%),但是由于其实验中饲料粗蛋白含量较低,其实验鱼的增重率最高仅为70%左右,远低于本实验结果,由此可见,胆汁酸仅具有促生长作用,而蛋白质及脂肪等营养元素才是影响其生长的关键因子。本实验选择了大菱鲆较为适宜的蛋白脂肪含量进行实验[14, 15],结论更具有实际意义。
本实验条件下,以增重率为评价指标,经折线回归分析,体质量26.5 g的大菱鲆幼鱼饲料中胆汁酸的最适添加量为0.09%,这个含量与孙建珍等[10]研究结果存在较大差异,其研究是以比较添加与否的效果为实验目的,而本研究通过单因素梯度实验研究其最适添加量为实验目的。此外,研究表明,当机体内胆汁酸浓度增大后,核受体法尼醇X受体(FXR)会被激活,抑制胆固醇7α羟化酶(CYP7A1)转录,从而降低机体胆汁酸合成的速度[16, 17, 18]。因此,仍需要更长时间的实验来验证添加外源性胆汁酸对大菱鲆生理的影响。
随着胆汁酸含量的增加,实验鱼全鱼水分、粗脂肪及粗灰分含量有了显著降低,而粗蛋白含量有了显著升高,这与在异育银鲫[19]及军曹鱼[8]上的研究一致。研究证明,大菱鲆鱼体脂肪含量与饲料脂肪含量有显著正相关性[20, 21],而本实验中在饲料脂肪含量一致的前提下,随着胆汁酸含量的增加,鱼体脂肪有了显著下降,证明了胆汁酸调控机体脂肪代谢[22]。
3.2 饲料中添加胆汁酸对大菱鲆幼鱼脂肪代谢的影响本实验通过研究组织脂肪代谢酶(肠道脂肪酶、肝脂酶、脂蛋白脂酶)及血脂指标(甘油三酯、胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇)来研究胆汁酸对大菱鲆机体脂肪代谢的影响。肠道脂肪酶是脂肪吸收的关键酶,肝脂酶和脂蛋白脂酶是肝脏脂肪降解的关键酶,而血脂指标反映了机体脂肪代谢状况。本实验结果发现,3种代谢酶活力随着胆汁酸含量的升高而显著增加,说明胆汁酸通过调控酶活促进了脂肪的利用[22]。肝脂酶和脂蛋白脂酶活力的升高,导致了血脂中甘油三酯[8]、胆固醇、高密度脂蛋白胆固醇及低密度脂蛋白胆固醇[23]浓度的降低,这与在星斑川鲽(Paralichthys olivaceus)上的研究一致[24]。在人及小鼠上的研究表明,脂肪肝会显著降低肝脂酶及脂蛋白脂酶的活力[25, 26],本实验中添加胆汁酸提高了两种酶的活力,说明胆汁酸可能对肝脏有一定的保护作用,但还需要其他指标来佐证。
3.3 饲料中添加胆汁酸对大菱鲆幼鱼免疫能力的影响本实验以谷丙转氨酶、谷草转氨酶及碱性磷酸酶酶活力变化及鳗弧菌攻毒后60 h内的累积死亡率来评价实验大菱鲆的健康状态。谷丙转氨酶及谷草转氨酶常用来评价机体肝脏功能的状况,酶活升高表示肝脏功能受损;在半滑舌鳎(Cynoglossus semilaevis)及大菱鲆等水生动物上的研究表明碱性磷酸酶具有抗菌及促消化的双重作用[27, 28]。本实验中,添加胆汁酸降低了大菱鲆血清中谷丙及谷草转氨酶的活力,提高了碱性磷酸酶活力,表明胆汁酸有利于保护肝脏健康,提高免疫力。同时攻毒实验结果表明,添加0.06%、0.09%及0.12%胆汁酸的累积死亡率显著低于不添加组,且3组之间无显著差异,说明添加胆汁酸能显著提高实验鱼的抗病力。孙建珍等在不同脂肪梯度的饲料中添加等量的胆汁酸,发现脂肪含量显著影响大菱鲆抗鳗弧菌感染能力,并推测是饲料脂肪含量通过影响其生长性能来影响其抗病力,或者是因为胆汁酸提高了机体免疫力[14],本实验也发现了类似现象。胆汁酸盐具有抑制革兰氏阳性菌能力,对革兰氏阴性菌痢疾志贺氏菌(Shigella dysenteriae)的生长无显著影响[29],而鳗弧菌属于革兰氏阴性菌,因此不太可能是通过胆汁酸的抗菌作用而降低累积死亡率,更可能是通过其促生长、提免疫的作用提高抗病力。
| [1] | ROMANSKI K W. The role and mechanism of action of bile acids within the digestive system-bile acids in the liver and bile [J].Advances in Clinical and Experimental Medicine, 2007, 16(6): 793-799. |
| [2] | SIRVENT A, CLAUDEL T, MARTIN G, et al. The farnesoid X receptor induces very low density lipoprotein receptor gene expression [J].FEBS Letters, 2004, 566(1/3): 173-177. |
| [3] | WATANABE M, HOUTEN S M, WANG L, et al. Bile acids lower triglyceride levels via a pathway involving FXR, SHP, and SREBP-lc [J]. The Journal of Clinical Investigation, 2004, 113(10): 1408-1418. |
| [4] | RUSSELL D W. Fifty years of advances in bile acid synthesis and metabolism [J]. The Journal of Lipid Research, 2009, 50(S14):S120-S125. |
| [5] | CHARLTON M V, DURRINGTON P N. Human cholesterol metabolism and therapeutic molecules [J]. Experimental Physiology, 2008, 93(1): 27-42. |
| [6] | 刘建强, 张志坚, 王雯, 等. 胆汁酸对肝硬化大鼠肠道细菌移位和内毒素血症的影响[J]. 福建医科大学学报, 2006, 40(3): 231-233. LIU J Q, ZHANG Z J, WANG W, et al. Effects of bile acids on intestinal bacterial translocation and endotoxemia in cirrhotic rats [J]. Journal of Fujian Medical University, 2006, 40(3): 231-233. |
| [7] | TARANTO M P, PEREZ-MAETINEZ G, DE VALDEZ G F. Effect of bile acid on the cell membrane functionality of lactic acid bacteria for oral administration [J].Research in Microbiology, 2006, 157(8): 720-725. |
| [8] | 周书耘. 饲料中磷水平和添加胆汁酸对军曹鱼(Rachycentron canadum)幼鱼生长、体组成和肝脏组成的影响[D]. 广州: 中山大学, 2010: 46-48. ZHOU S Y. Effects of dietary phosphorus and bile acid on growth performance, body composition, liver composition of juvenile cobia(Rachycentron canadum) [D]. Guangzhou: Sun Yat-Sen University, 2010:46-48. |
| [9] | 谭永刚, 魏文志, 曾党胜. 饲料中添加胆汁酸对异育银鲫生长性能的影响[J]. 广东饲料, 2008, 17(1): 25-26. TAN Y G, WEI W Z, ZENG D S. Effects of bile acid supplemented in feed on growth performance of Carassius auratus gibelio[J]. Guangdong Feed, 2008,17(1):25-26. |
| [10] | 孙建珍, 王际英, 马晶晶, 等.不同脂肪水平下添加胆汁酸对大菱鲆(Scophthalmus maximus)幼鱼生长、体组成和脂肪代谢的影响[J].海洋与湖沼, 2014,45(3):617-625. SUN J Z, WANG J Y, MA J J, et al. Effects of dietary bile acids on growth, body composition and lipid metabolism of juvenile turbot(Scophthalmus maximus) at different lipid levels [J]. Oceanologia Et Limnologia Sinica, 2014,45(3):617-625. |
| [11] | 杨玉芝, 李燕舞, 刘敬盛, 等. 胆汁酸对“817”肉杂鸡生产性能及脂肪代射率的影响[J].畜牧与兽医,2009,41(8):42-45. YANG Y Z, LI Y W, LIU J S, et al. Effect of dietary bile acid on growth performance and lipid metabolism ratio of “817” hybrid broilers [J]. Animal Husbandry & Veterinary Medicine, 2009, 41(8):42-45. |
| [12] | BROMLEY P J. Effects of dietary protein, lipid, and energy content on the growth of turbot(Scophthalmus maximus L.)[J]. Aquaculture, 1980,19(4):359-369. |
| [13] | 孙建珍. 添加胆汁酸对大菱鲆(Scophthalmus maximus)幼鱼脂肪利用能力的影响[D]. 上海:上海海洋大学, 2014:15-29. SUN J Z. Effects of dietary lipid and bile acid levels on growth, body composition, digestibility physiology and lipid metabolism of juvenile turbot(Scophthalmus maximus)[D]. Shanghai: Shanghai Ocean University, 2014:15-29. |
| [14] | KROECKEL S, HARJES A G E, ROTH I, et al. When a turbot catches a fly: Evaluation of a pre-pupae meal of the Black Soldier Fly(Hermetia illucens) as fish meal substitute-Growth performance and chitin degradation in juvenile turbot(Psetta maxima) [J]. Aquaculture, 2012, 364-365: 345-352. |
| [15] | PERES H, OLIVA-TELES A. Lysine requirement and efficiency of lysine utilization in turbot(Scophthalmus maximus) juveniles [J].Aquaculture, 2008, 275(1/4): 283-290. |
| [16] | CORTES V A, BYSSO D, MARDONES P, et al. Advances in the physiological and pathological implications of cholesterol [J]. Biological Reviews, 2013, 88(4):825-843. |
| [17] | KORTNER T M, GU J N, KORGDAHL Å, et al. Tran-scriptional regulation of cholesterol and bile acid metabolism after dietary soyabean meal treatment in Atlantic salmon(Salmo salar L.) [J]. British Journal of Nutrition, 2013, 109(4):593-604. |
| [18] | 汉雪梅, 张曦, 陶琳丽, 等. 豆粕替代鱼粉对鱼类胆固醇代谢影响的研究进展[J]. 云南农业大学学报, 2013,28(5):734-740. HAN X M, ZHANG X, TAO L L, et al. The effects of replacing fish meal with soybean meal on cholesterol metabolism in fish: a review [J]. Journal of Yunnan Agricultural University, 2013, 28(5): 734-740. |
| [19] | 林仕梅, 叶元土, 罗莉. 胆汁酸添加剂对异育银鲫生长的影响[J].广东饲料, 2003, 12(3): 14-15. LIN S M, YE Y T, LUO L.The effect of bile acid preparation on the growth of Carassius auratus gibelio [J]. Guangdong Feed, 2003,12(3):14-15. |
| [20] | LEE J K, CHO S H, PARK S U, et al. Dietary protein requirement for young turbot(Scophthalmus maximus L.) [J].Aquaculture Nutrition, 2003, 9(4): 283-286. |
| [21] | CHO S H, LEE S M, LEE J H. Effect of dietary protein and lipid levels on growth and body composition of juvenile turbot(Scophthalmus maximus L.) reared under optimum salinity and temperature conditions [J]. Aquaculture Nutrition, 2005, 11(4): 235-240. |
| [22] | 孙逊, 杨刚毅.胆汁酸对糖脂代谢影响的研究现状[J].国际内分泌代谢杂志, 2008, 28(5): 323-325. SUN X, YANG G Y. Effect of bile acids on glucose and lipid metabolism [J]. International Journal of Endocrinology and Metabolism, 2008, 28(5): 323-325. |
| [23] | CHOI S Y, GOLDBERG I J, CURITSS L K, et al. Interaction between ApoB and hepatic lipase mediates the uptake of ApoB-containing lipoproteins [J].The Journal of Biological Chemistry, 1998, 273(32): 20456-20462. |
| [24] | LEE S M., KIM K D. Effect of various levels of lipid exchanged with dextrin at different protein level in diet on growth and body composition of juvenile flounder Paralichthys olivaceus[J]. Aquaculture Nutrition, 2005, 11(6): 435-442. |
| [25] | 倪燕君, 刘厚钰, 张顺财, 等. 肝脂酶、脂蛋白脂肪酶在脂肪肝发病中的作用[J].中华消化杂志, 1999, 19(54): 324-327. NI Y J, LIU H Y, ZHANG S C, et al. The role of hepatic lipase and lipoprotein lipase in the pathogenesis of fatty liver [J]. Chinese Journal of Digestion, 1999, 19(5):324-327. |
| [26] | AUWERX J, LEROY P, SCHOONJANS K. Lipoprotein lipase: recent contributions from molecular biology [J].Critical Reviews in Clinical Laboratory Sciences, 1992, 29(3/4): 243-268. |
| [27] | 柳旭东, 梁萌青, 林洪, 等. 不同干燥温度鱼粉对半滑舌鳎稚鱼生长、消化酶及碱性磷酸酶活性的影响[J]. 海洋水产研究, 2006,27(2):74-79. LIU X D, LIANG M Q, LIN H, et al. Effects of drying mode for fishmeal on growth, digestive enzymes and alkaline phosphatase activities of Cynoglossus semilaevis Günther postlarvae [J]. Marine Fisheries Research, 2006, 27(2): 74-79. |
| [28] | 杨沛, 李彦先, 胡海滨, 等. 氯化钴在大菱鲆饲料中的安全性评价[J]. 上海海洋大学学报, 2014, 23(4): 535-545. YANG P, LI Y X, HU H B, et al. Safety evaluation of dietary cobalt dichloride in turbot[J]. Journal of Shanghai Ocean University, 2014, 23(4):535-545. |
| [29] | 刘玉芳, 欧杰. 草鱼胆汁酸与细菌生长试验[J]. 上海水产大学学报, 1998, 7(1):33-37. LIU Y F, OU J. Study on bile acid from grass carp bile and its bacteriostatic effect [J]. Journal of Shanghai Fisheries University, 1998, 7(1):33-37. |
 2015, Vol. 24
2015, Vol. 24


