2. 大洋渔业资源可持续开发省部共建教育部重点实验室, 上海 201306;
3. 上海海洋大学 国际海洋研究中心, 上海 201306
黄鳍金枪鱼(Thunnus albacares)属大洋性洄游鱼类,喜集群,主要分布于世界三大洋的热带水域,而印度洋的黄鳍金枪鱼主要分布在非洲东部沿海、马达加斯加群岛、阿拉伯海、印度半岛沿海以及印度-澳大利亚群岛海域[1]。印度洋黄鳍金枪鱼是我国金枪鱼延绳钓渔船的主要捕捞对象之一[2],在当前国际渔业管理日趋严峻的背景下,印度洋黄鳍金枪鱼渔业也是我国远洋渔业少有的有进一步发展空间的渔业之一[2]。自1992年以来,印度洋黄鳍金枪鱼产量一直维持在30万t以上,约占世界黄鳍金枪鱼总产量的30%[3, 4, 5]。根据2014年印度洋金枪鱼委员会(Indian Ocean Tuna Commission,IOTC)的资源评估,近些年来印度洋黄鳍金枪鱼产量一直维持在MSY(约34.4万吨)附近[2]。在印度洋,延绳钓渔船主要在西部海域捕获黄鳍金枪鱼,由于索马里海盗的影响,变相地保护了黄鳍金枪鱼的资源。
渔业生物学数据是渔业资源评估的基础,由于大洋渔业采样的困难性,很难通过独立的科学调查(fisheries independent survey)去获取,往往只能借助科学观察员项目或者渔捞日志去获取相关数据,而观察员的数据更为准确和全面,IOTC科学会议上也多次对中国的观察员数据高度推介,认为很好地补充了渔捞日志数据的不足[2]。此外,由于海洋生态的变化以及捕捞压力的增大,一些渔业种类的生物学特征也可能发生变化,因此在渔业资源评估工作中,需要不断地补充、更新数据。许多学者对印度洋黄鳍金枪鱼的生物学特征进行了研究[6, 7, 8, 9, 10, 11, 12, 13, 14, 15],但最近几年缺少更新信息。因此,本文利用我国金枪鱼科学观察员近年来获取的数据,对印度洋黄鳍金枪鱼的繁殖生物学进行了研究,这将有助于人们更好地了解印度洋黄鳍金枪鱼的生物特征信息,为印度洋黄鳍金枪鱼的资源评估和管理提供新的信息,以提高资源评估结果的准确性和可靠性,从而为我国的金枪鱼渔业发展服务,本研究也可以为我国参与IOTC的科学事务提供基础数据。
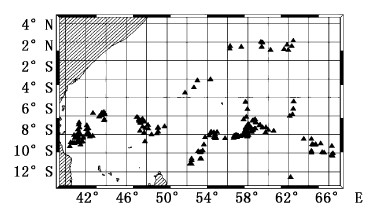
1 材料与方法 1.1 数据来源本文利用我国金枪鱼渔业观察员2012年10月—2013年1月和2013年10月—2014年2月两个航次在印度洋中西部区域(图1)超低温金枪鱼延绳钓渔船采集的黄鳍金枪鱼数据进行分析。共采集1223尾黄鳍金枪鱼样本,观察其捕获时状态、摄食等级、性别、性成熟度,测量其上额叉长(叉长)、加工质量(纯重)和性腺质量等,由于海上原因,某些样本无法测量所有参数。
|
图 1 采样区域 Fig.1 Sampling area |
每天记录渔船作业位置,随机取样测量其纯重(加工后的质量,即去鳃,去尾,去内脏)、叉长(下颌尾叉长,下吻前端至尾柄后端长度),观察其性别、摄食等级、性成熟度及其胃含物等。通过目测法将性腺成熟度划分为Ⅰ (性未成熟)、Ⅱ (性未成熟)、Ⅲ (性成熟)、Ⅳ (性成熟)、Ⅴ (性成熟)和Ⅵ (繁殖后) 6 期。本文生物学测定依据国家海洋调查规范[16]。
1.3 分析方法 1.3.1 数据预处理计算样本叉长和纯重的组距,组距的计算公式如下[17]:

式中:S为组距,R为极差(所求组距的参数的最大值与最小值的差值),N为总尾数。
1.3.2 叉长分析先进行数据描述,然后利用公式(1)计算组距,分别对黄鳍金枪鱼雄性和雌性的叉长进行分析,绘制频率直方图,确定优势叉长组,并采用协方差分析(ANCOVA)检验方法检验雌雄样本叉长分布有无显著差异性[6]。
1.3.3 纯重分析先进行数据描述,然后利用公式(1)计算组距,分别对黄鳍金枪鱼雄性和雌性的纯重进行分析,绘制频率直方图,确定优势纯重组,并采用协方差分析(ANCOVA)检验方法检验雌雄样本纯重分布有无显著差异性[6]。
1.3.4 性比分析统计分析各月性别比分布,利用卡方检验分析各个月的性比是否与1∶1存在显著性差异[18]。
1.3.5 叉长-纯重关系利用幂函数拟合叉长-纯重关系式如下:

式中:a、b为参数,W为纯重,L为叉长。并利用协方差分析(ANCOVA)检验雌雄样本叉长和纯重的关系是否存在显著性差异[18]。
1.3.6 性成熟率根据海洋调查规范中海洋生物调查的标准,性成熟率(Ⅲ期以上性成熟个体所占比率)是鱼类繁殖生物学的重要指标之一,其变动情况反映该种群的繁殖状况,因此本文对此进行着重分析。性成熟率计算公式如下:

式中:X为每月雌性(或雄性)成熟率,f为每月雌性(或雄性)Ⅲ期以上性成熟个体数量,N 为每月雌性(或雄性)样本总数。
1.3.7 性腺指数GSI作为判断鱼类产卵季节的一个重要标准,其计算公式如下:

式中:IGS为性腺指数,W为性腺重量(g),L为叉长(cm)。
1.3.8 初次性成熟叉长利用不同叉长组的性成熟个体比例拟合 Logistic 曲线,估计黄鳍金枪鱼初次性成熟叉长,其计算公式如下:
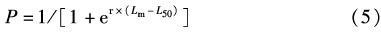
式中:P为叉长组内性成熟个体比率;L50为50%成熟个体叉长;r、Lm为模型回归参数。
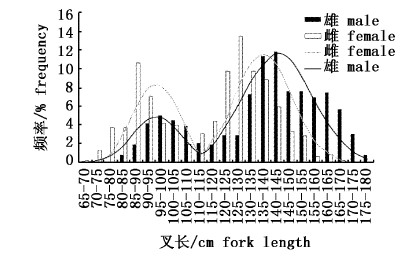
2 结果 2.1 体长体重分析 2.1.1 雌雄叉长组成所采集的雄性样本的叉长范围是65~180 cm,分布呈双峰型,其中优势叉长组是130~165 cm,占雄性样本的60.04%;而雌性样本的叉长范围是75~175 cm,其中优势叉长组是85~95 cm和120~150 cm,占雌性样本的59.38%,分布呈双峰型(图2)。通过ANCOVA检验可知,雌雄叉长分布存在显著性差异(P < 0.05)。
|
图 2 黄鳍金枪鱼叉长频率分布 Fig.2 Fork length frequency distribution for Thunnus albacares |
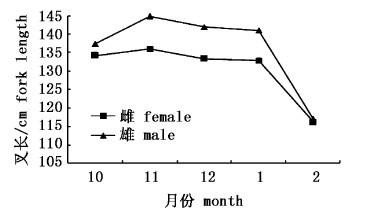
从采样时间上分析可知,10月、11月、12月、1月和2月所采集的雄性样本的平均叉长都比雌性的大,这表明样本中雄性个体大于雌性个体。从11月后雌雄样本的平均叉长递减,2月份所采集的雌雄样本的平均叉长最小(图3)。通过ANCOVA检验可知,1月和2月所采集的雌雄样本的平均叉长分布存在显著性差异(P < 0.05)。
|
图 3 黄鳍金枪鱼各月份的平均叉长分布 Fig.3 Monthly average fork length distribution for Thunnus albacares |
雄性样本的纯重范围是7~88 kg,其中优势纯重组是10~15 kg和30~45 kg,占雄性样本的59.20%;雌性样本的纯重范围是9~79 kg,其中优势纯重组是10~15 kg和30~45 kg,占雌性样本的47.80%,分布呈双峰型(图4)。通过ANCOVA检验可知,雌雄样本的纯重分布不存在显著性差异(P>0.05)。
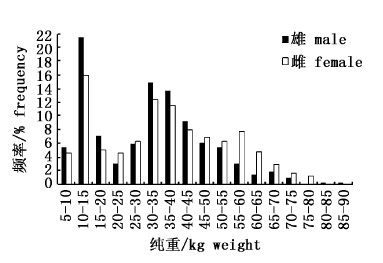
|
图 4 黄鳍金枪鱼纯重频率分布 Fig.4 Dressed weight frequency distribution for Thunnus albacares |
从采样时间上分析可知,10月、11月、12月、1月和2月所采集的雄性样本的平均纯重都比雌性的大,这表明样本中雄性个体大于雌性个体。2月份所采集的雌雄样本的平均纯重都最小。1月和2月所采集的雌雄样本的平均纯重分布存在显著性差异(P < 0.05),见图5。
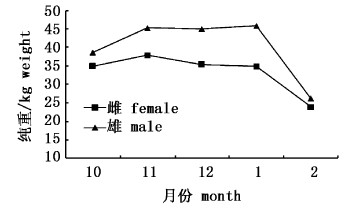
|
图 5 黄鳍金枪鱼各月份的平均纯重分布 Fig.5 Monthly average dressed weight distribution for Thunnus albacares |
根据图2,取115 cm 为叉长间断点将该海域捕获的黄鳍金枪鱼个体分为大、小两个群体。在雄性样本中,大个体所占比例是75.40%;在雌性样本中,大个体所占比例是63.13%。叉长小于115 cm 的雄性平均叉长是97.27 cm,平均体重是14.49 kg;叉长小于115 cm 的雌性个体平均叉长是96.75 cm,平均体重是13.96 kg;通过ANCOVA检验可知:雌、雄个体平均叉长和平均体重均没有体现显著性差异(P >0.05)。叉长大于115 cm 的雄性平均叉长是143.81 cm,平均体重是45.92 kg;雌性个体平均叉长是138.04 cm,平均体重是38.95 kg;由此可见,此样本中雄性平均叉长和平均体重均大于于雌性(P < 0.05);但总体来说,雌、雄个体大小存在显著性差异(P < 0.05)。
2.1.4 雌雄样本的叉长-纯重的关系分别根据雌雄样本的数据利用公式(2)统计出雌性样本的叉长-纯重的关系式为W=7×10-6L3.244 (R2=0.961);雄性样本的叉长-纯重的关系式为W=6×10-6L3.197(R2=0.956)(图6,表1),两者不存在显著性差异(P >0.05)。
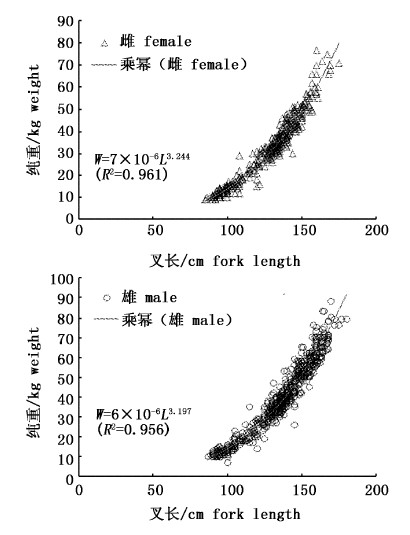
|
图 6 黄鳍金枪鱼的叉长-纯重的关系 Fig.6 The relationship between fork length and dressed weight of Thunnus albacares |
| 表 1 叉长-体重关系的参数估计 Tab.1 Parameters estimation for fork length-dressed weight relationship of Thumus albacares |
共随机测定1223尾样本中雌性有455尾,雄性有618尾,无法鉴别性别的有150尾,样本总性比为0.74∶1。雌雄样本中达到性成熟样本的性比为0.69∶1,经卡方检验显著偏离1∶1(P <0.01),雌性样本数量比例明显小于雄性。总性比从10月的 0.63∶1增长至 12 月的0.85∶1,接近 1∶1(P >0.05),总体性比曲线和达到性成熟的性比曲线随时间推移变化趋势一致,但两者在10月和11月间距较大,其他3月基本接近(图7),这表明12月、1月和2月采集的样本基本已达到性成熟。
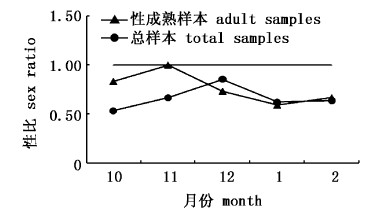
|
图 7 黄鳍金枪鱼各月份性别比分布 Fig.7 Monthly sex ratio distribution of Thunnus albacares |
在可测定性腺重量的810尾样品中,其中性腺成熟度Ⅰ级占总样本的5.19%,优势叉长组是80~110 cm(图8),其所占比例是92.86%;性腺成熟度Ⅱ级占总样本的20.62%,优势叉长组是80~100 cm,其所占比例是77.25%;性腺成熟度Ⅲ级占总样本的10.74%,优势叉长组是90~110 cm和120~140 cm,其所占比例是77.01%;性腺成熟度Ⅳ级占22.47%,优势叉长组是130~150 cm,所占比例是74.18%;性腺成熟度Ⅴ级占40.99%。优势叉长组是130~150 cm,所占比例是64.16%。
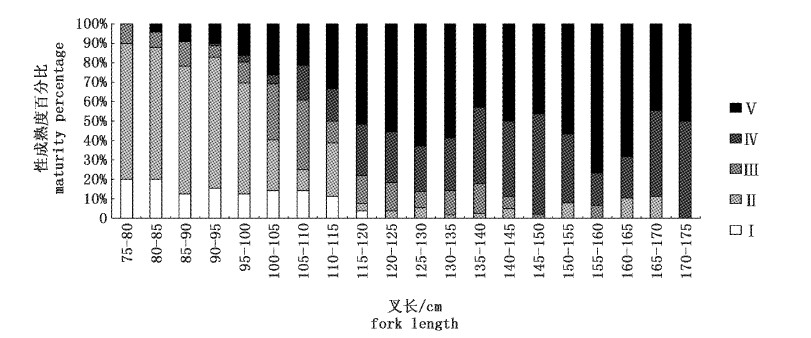
|
图 8 黄鳍金枪鱼叉长-性成熟度的频率分布 Fig.8 Maturity versus fork length frequency distribution for Thunnus albacares |
分别利用各月份的雌雄性成熟个体总量根据公式(3)计算出的性成熟率如表2所示。
总体上分析,雄性的性成熟率比雌性的性成熟率大4.37%,从10月份到2月份,雄性在12月和1月的性成熟率达到最高,分别是70.91%和70.59%,同样数据显示雌性也在12月和1月的性成熟率达到最高,分别是59.09%和66.98%。
| 表 2 各月份黄鳍金枪鱼的性成熟率 Tab.2 Monthly mean of percentage of maturity for Thunnus albacares |
从表3可知,在叉长大于115 cm的大个体中的雌雄性成熟率都很高,但雄性的性成熟率小于雌性,而小个体中雄性的性成熟率大于雌性。
| 表 3 不同群体黄鳍金枪鱼的性成熟率 Tab.3 The percentage of maturity for different size of Thunnus albacares |
利用不同叉长值根据公式(4)计算出的性腺指数值与叉长关系如图9所示,雌性性腺指数随叉长呈现一定的增长。雌性样本的性腺指数是 0.39~5.92;平均值是 2.08(表4),成熟度Ⅱ期的样本中卵巢质量范围是60~295 g;成熟度Ⅲ期的样本中卵巢质量范围是130~870 g;成熟度Ⅳ期的样本中卵巢质量范围是250~1 300 g;成熟度Ⅴ期的样本中卵巢质量范围是160~1 750 g;在雌性样本中性腺指数大于 2的占52.03%。雄性样本的性腺指数是 0.44~3.37,平均值是1.69;成熟度Ⅱ期的样本中精巢质量范围是16~70 g;成熟度Ⅲ期的样本中精巢质量范围是21~915 g;成熟度Ⅳ期的样本中精巢质量范围是56~955 g;成熟度Ⅴ期的样本中卵巢质量范围是118~1 185 g;在雄性样本中性腺指数大于 2的占31.43%。
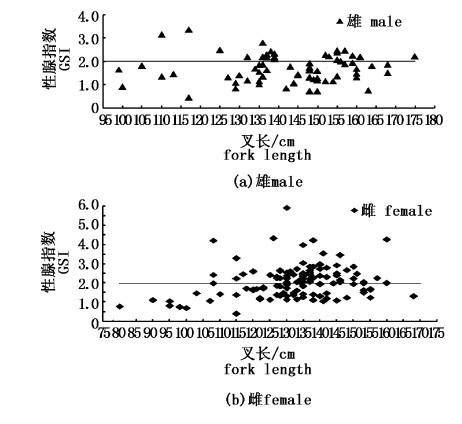
|
图 9 黄鳍金枪鱼性腺指数与叉长关系 Fig.9 The relationship between fork length and GSI of Thunnus albacares |
| 表 4 雌雄性腺指数 Tab.4 The GSI of female and male for Thunnus albacares |
观察员通过目测观察性腺发育情况,经测量可知,各月份都有达到性成熟的个体,其中雌性样本中初次达到性成熟(Ⅲ)的个体有140尾,叉长范围是102~175 cm,平均叉长是139.59 cm(SD=11.89,SE=1.01);而雄性样本中初次达到性成熟(Ⅲ)的个体有138尾,叉长范围是95~180m,平均叉长是146.43 cm(SD=16.44,SE=1.41)。
利用雌雄的叉长数据根据公式(5)计算得到雌雄个体初次性成熟叉长(L50)分别为122.991 cm 和 118.618 cm,雌性略低于雄性。性成熟叉长的 Logistic 曲线(图9)如下:
雌性: P=1/[1+e0.08276×(122.991-Lm)],R2=0.896 6,P=0.000 1;
雄性: P=1/[1+e0.03767×(118.618-Lm)],R2=0.946 3,P=0.000 1。
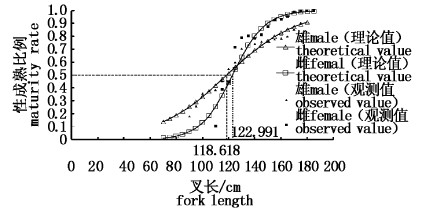
|
图 10 黄鳍金枪鱼初次性成熟叉长 Fig.10 Fork length at first maturity of Thunnus albacares |
我国观察员从印度洋采集的样本中,观察并测量的黄鳍金枪鱼有1 223尾,数据处理结果显示:本次捕获的黄鳍金枪鱼样本的叉长分布呈双峰型,故可分为大小两个群体来研究。叉长大于115 cm的较大个体占优势,雄性叉长大于115 cm的较大个体所占比例比雌性的大,说明较大的群体中雄性明显占优势,较大的群体中雌雄个体存在显著性差异(P <0.05),但较小的群体中雌雄个体不存在显著性差异(P >0.05)。雌雄叉长与纯重的关系图中雌性的叉长与纯重拟合的曲线趋势一致,随着叉长的增大,纯重也相应增大,雌性的叉长与纯重拟合的曲线逐渐落在雄性的下方。总体上讲,雌性个体平均叉长和纯重明显小于雄性个体,存在显著性差异(P <0.05)。SUN等[19]、KIKAWA等[20]、MURPHY等[21]、LENARZ等[22]、SUZUKI等[23]和陈峰等[18]普遍认为叉长低于120 cm的较小群体中雌雄性比接近1∶1,叉长大于130 cm的较大群体中雄性个体占优势。这可能是由雌、雄个体的不同死亡率或成熟后雌、雄不同的生长率所致[24]。数据显示从11月后雌雄个体平均叉长递减,2月份的雌雄平均叉长值最小。
雌雄总体的性比、性成熟个体中雌雄性比和各月份的雌雄性比均不符合1∶1,雄性个体数量较大。朱国平等[6]的研究结果中性比是0.71~0.86(2003年1~6月)和1.00~1.99(2004年1-6月),也显著偏离1∶1。但是随着季节的变化,12月份的雌雄性比接近1∶1,性成熟个体中11月份的雌雄性比接近1∶1,这可能与季节变化相关。
雌雄的性成熟率从10月份逐步增大,雄性的性成熟率在12月份达到最大值70.91%,雌性的性成熟率在1 月份达到最大值66.98%,分别在2月份雌雄的性成熟率降到最小,进一步证明12月份和1月份存在产卵现象。这表明较大群体中的性成熟率很高,而较小群体中也有小部分成熟个体。
雌雄个体的性腺指数随着叉长的变化基本保持一致。性腺指数大于2的雄性个体叉长均在110 cm以上,性腺指数大于2的雌性个体叉长均在108 cm以上。性腺指数大于2的雄性个体平均叉长高于雌性。
雌雄个体初次性成熟叉长分别是122.991 cm和118.618 cm(50%概率),高于陈峰等[18]、ITANO等[24]、SUN等[19]、SCHAEFER等[25]和MCPHERSON等[26]研究的黄鳍金枪鱼的初次性成熟叉长。这也进一步表明中西印度洋黄鳍金枪鱼的性成熟较晚[19]。
随着捕捞技术的进步,不同时期的渔具选择性也发生了变化[27],不同渔具的选择性如延绳钓渔业以捕捞成熟鱼为主,会对本研究的结果造成一定的偏差。但这些结果仍具有说服力,即使在不同的海域或不同的时间段所捕获的黄鳍金枪鱼,其繁殖特性存在相似性。
本文的研究得到了国家远洋渔业工程技术中心、上海市远洋渔业协同创新中心和农业部大洋渔业资源环境科学观测实验站支持,谨致谢忱。
| [1] | 戴小杰, 许柳雄. 世界金枪鱼渔业渔获物物种原色图鉴[M]. 北京: 海洋出版社, 2007: 90-91. DAI X J, XU L X. The world tuna fishery catches species primary colour guide[M]. Beijing: Ocean Press, 2007: 90-91. |
| [2] | Secretariat of the Pacific Community. Tuna fishery year book[M]. Noumea, New Caledonia: Western and Central Pacific Fisheries Commission, 2010: 5-114. |
| [3] | 冯波, 陈新军, 许柳雄. 印度洋黄鳍金枪鱼渔业资源开发策略评价[J]. 农业系统科学与综合研究, 2009, 25(4): 506-510. FENG B, CHEN X J, XU L X. Exploitation strategy evaluation for yellowfin tuna in the Indian Ocean[J]. System Sciences and Comprehensive Studies in Agriculture, 2009, 25(4): 506-510. |
| [4] | 尚合峰. 印度洋黄鳍金枪鱼渔业与资源现状[J]. 水产科技, 2005(6): 13-16.SHANG H F. Yellow fin tuna fishery and stock status in the Indian Ocean[J]. Fisheries Science & Technology, 2005(6): 13-16. |
| [5] | 叶振江, 梁振林, 邢智良, 等. 印度洋东部黄鳍金枪鱼的渔业生物学[J]. 海洋水产研究, 2001, 22(3): 38-42. YE Z J, LIANG Z L, XING Z L, et al. The fishery biology of Thunnus albacares in the East of Indian Ocean[J]. Marine Fisheries Research, 2001, 22(3): 38-42. |
| [6] | 朱国平, 陈新军, 许柳雄. 印度洋中黄鳍金枪鱼生物学特性的初步研究[J]. 海洋渔业, 2006, 28(1): 25-29. ZHU G P, CHEN X J, XU L X. Preliminary study on the fishery biology of yellow fin tuna Thunnus albacares in the western central Indian Ocean[J]. Marine Fisheries, 2006, 28(1): 25-29. |
| [7] | 朱国平, 许柳雄, 周应祺, 等. 印度洋中西部水域黄鳍金枪鱼的食性及其季节性变化[J]. 水产学报, 2008, 32(5): 725-732. ZHU G P, XU L X, ZHOU Y Q, et al. Feeding habits and its seasonal variations of Thunnus albacares in the west-central Indian Ocean[J]. Journal of Fisheries of China, 2008, 32(5): 725-732. |
| [8] | STÉQUERT B, RODRIGUEZ J N, CUISSET B, et al. Gonadosomatic index and seasonal variations of plasma sex steroids in skipjack tuna (Katsuwonus pelamis) and yellowfin tuna (Thunnus albacares) from the western Indian ocean [J]. Aquatic Living Resources, 2001, 14(5): 313-318. |
| [9] | STÉQUERT B, PANFILI J, DEAN J M. Age and growth of yellowfin tuna, Thunnus albacares, from the western Indian Ocean, based on otolith microstructure[J]. Fishery Bulletin, 1996, 94(1): 124-134. |
| [10] | OLIVIER L. Study of the growth of yellowfin tuna (Thunnus albacares) in the Western Indian Ocean based on length frequency data[C]. IOTC Proceedings, 2002(5): 316-327. |
| [11] | ZUDAIRE I, MURUA H, GRANDE M, et al. Reproductive potential of yellowfin tuna (Thunnus albacares) in the western Indian Ocean[J]. Fishery Bulletin, 2013, 111(3): 252-264. |
| [12] | NISHIDA T, TACKX M. Factors affecting distribution of adult yellowfin tuna (Thunnus albacares) and its reproductive ecology in the Indian ocean based on Japanese tuna longline fisheries and survey information[C]. IOTC Proceedings, 2001: 336-389. |
| [13] | STECQUERT B, RAMCHARRUN B, DEAN J M. Preliminary studies of age and growth of yellowfin tuna (Thunnus albacares) in the western Indian ocean[J]. IPTP Collective Volume, 1994, (8): 161-168. |
| [14] | TANTIVALA C. Some biological study of yellowfin tuna (Thunnus albacares) and bigeye tuna (Thunnus obesus) in the eastern Indian ocean[C]. IOTC Proceedings, 2000: 436-440. |
| [15] | POTIER M, MARSAC F, CHEREL Y, et al. Forage fauna in the diet of three large pelagic fishes( lancet fish, swordfish and yellowfin tuna) in the western equatorial Indian Ocean[J]. Fisheries Research, 2007, 83(1): 60-72. |
| [16] | 国家海洋局. GB/T12763. 6-2007海洋调查规范 第6部分: 海洋生物调查[S]. 北京: 中国标准出版社, 2007: 83. State Oceanic Administration People's Republic of China. GB/T12763. 6-2007 Marine bioligical survey[S]. Beijing: Standards Press of China, 2007: 83. |
| [17] | 陈国宝, 李永振, 陈丕茂, 等. 鱼类最佳体长频率分析组距研究[J]. 中国水产科学, 2008, 15(4): 659-666. CHEN G B, LI Y Z, CHEN P M, et al. Optimum interval class size of length-frequency analysis of fish [J]. Journal of Fishery Sciences of China, 2008, 15(4): 659-666. |
| [18] | 陈峰, 郭爱, 朱文斌, 等. 南太平洋所罗门群岛海域黄鳍金枪鱼繁殖生物学研究[J]. 热带海洋学报, 2014, 33(2): 45-51. CHEN F, GUO A, ZHU W B, et al. Study on reproductive biology of yellowfin tuna Thunnus albacares in the waters of the Solomon Islands of the South Pacific Ocean[J]. Journal of Tropical Oceanography, 2014, 33(2): 45-51. |
| [19] | SUN C L, WANG W R, YEH S. Reproductive biology of yellowfin tuna in the Central and Western Pacific Ocean[C]. Noumea: the Scientific Committee of the Western and Central Pacific Fisheries Commission, 2005: 1-7. |
| [20] | KIKAWA S. The distribution of maturing bigeye and yellowfin and an evaluation of their spawning potential indifferent areas in the tuna longline grounds in the Pacific[J]. Report of Nankai Regional Fisheries Research Laboratory, 1966 (23): 131-208. |
| [21] | MURPHY G I, SHOMURA R S. Pre-exploitation abundance of tunas in the equatorial central Pacific [J]. Fishery Bulletin, 1972, 70(3): 875-913. |
| [22] | LENARZ W H, ZWEIFEL J R. A theoretical examination of some aspects of the interaction between longline and surface fisheries for yellowfin tuna, Thunnus albacares[J]. Fishery Bulletin, 1979, 76(4): 807-825. |
| [23] | SUZUKI Z. A review of the biology and fisheries for yellowfin tuna, Thunnus albacares, in the western and central Pacific Ocean[J]. FAO Fisheries Technich Paper, 1994, 336(2): 108-137. |
| [24] | ITANO D G. The reproductive biology of yellowfin tuna (Thunnus albacares) in Hawaiian waters and the western tropical Pacific Ocean: project summary[R]. Hawaii: University of Hawaii, Joint Institute for Marine and Atmospheric Research: 1-62. |
| [25] | SCHAEFER K M. Reproductive biology of yellowfin tuna (Thunnus albacares) in the eastern Pacific Ocean[J]. Inter-American Tropical Tuna Commission Bulletin, 1998, 21(5): 205-221. |
| [26] | MCPHERSON G R. Reproductive biology of yellowfin tuna in the eastern Australian fishing zone, with special reference to the north-western Coral Sea [J]. Marine and Freshwater Research, 1991, 42(5): 465-477. |
| [27] | NISHIDA T, SHONO H. Stock assessment of yellowfin tuna (Thunnus albacares) in the Indian Ocean by the age structured production model (ASPM)analyses[C]. Victoria: Indian Ocean Tuna Commission, 2007: 1-17. |
2. Key Laboratory of Oceanic Fisheries Resources Exploitation of Shanghai Education Commission, Shanghai 201306, China;
3. International Centre for Marine Studies, Shanghai Ocean University, Shanghai 201306, China
 2015, Vol. 24
2015, Vol. 24


