2. 上海市水产养殖工程技术研究中心, 上海 201306;
3. 上海高校知识服务平台上海海洋大学水产动物遗传育种中心, 上海 201306
大黄鱼(Larmichthys crocea),属硬骨鱼纲(Osteichthyes),鲈形目(Perciformes),石首鱼科(Sciaenidae),黄鱼属(Larmichthys),具有营养丰富、肉质细嫩等特点,已成为我国福建、浙江、广东沿海地区主要海水养殖鱼类之一。目前大黄鱼养殖仍以投喂冰鲜小杂鱼为主,高品质配合饲料的应用较少。随着集约化养殖及环境保护意识的加强,生产出高效、低成本的大黄鱼配合饲料已成为当务之急。鱼油是大黄鱼配合饲料中最重要的脂肪来源。近年来,水产饲料行业的快速发展导致鱼油的需求量加大,鱼油价格居高不下,导致配合饲料成本增加。寻找其他的脂肪源替代饲料中的鱼油已成为国内外学者的研究热点。
菜籽油的产量大,供应充足,价格比鱼油便宜,二噁英和其他有机污染物较鱼油低[1],因此,菜籽油成为一种重要的鱼油替代脂肪源。已有研究表明,菜籽油部分或完全替代鱼油对鱼类的生长影响不显著。BOWYER等[2]研究发现用菜籽油替代50%的鱼油在水温18 ℃下对黄尾鰤(Seriola lalandi)的生长、特定生长率、饲料系数均无显著性影响。FOUNTOULAKI等[3]研究发现在金头鲷(Sparus aurata L.)饲料中用豆油或菜籽油替代69%的鱼油,对其生长和饲料利用率无显著性影响,但肌肉和肝脏脂肪酸组成受到影响。SHAPAWI等[4]研究发现用棕榈油、棕榈油精、豆油、菜籽油完全替代驼背鲈(Cromileptes altivelis)饲料中的鱼油,在为期8周的生长实验中,对生长、存活率、饲料转换率、蛋白质效率比率、净蛋白利用率、肝脏指数及全鱼组成均无显著性影响,但显著影响了肌肉和脂肪酸的组成。易新文等[5]研究发现菜籽油替代25%、50%、75%、100%鱼油对初始体质量为(13.56±0.05)g大黄鱼生长和体组成无显著影响,但显著影响了大黄鱼的肌肉脂肪酸组成和体色。
本实验以菜籽油及混合植物油替代大黄鱼饲料中的部分鱼油,研究其对大黄鱼幼鱼肌肉、肝脏脂肪及脂肪酸组成的影响,以探索不影响生长及品质的情况下降低大黄鱼配合饲料生产成本的可能性。
1 材料与方法 1.1 实验饲料的制备参照肉食性鱼类的基本营养需求设计6种等氮等能大黄鱼配合饲料(表1),其中对照组(A组)为添加6%的鱼油饲料,B、C、D和E组分别用菜籽油替代对照组中16.67%、33.33%、50.00%和66.67%的鱼油,F组采用混合植物油(棕榈油∶紫苏油∶菜籽油=3.6∶2.5∶1)替代对照组66.67%的鱼油。
| 表1 实验饲料配方及营养组成 Tab.1 Experimental feed formula and nutritional composition |
将各种饲料原料粉碎后过60目筛,按配方比例采用逐级扩大法混匀,加入适量的水,再次混匀后用绞肉机制成直径为2 mm的面条状实验饲料,置于-20 ℃冰柜保存备用。各实验饲料的脂肪酸组成见表2。
| 表2 实验饲料的脂肪酸组成 Tab.2 The fatty acid profiles in the experimental diet (mean±SD,n=3)mg/g |
将购自福建省宁德市三都澳镇富发水产有限公司的大黄鱼鱼苗,空运至海南省昌江市昌化县禄泰虾苗场水泥池中,暂养2周后,禁食24 h,挑选规格[(0.65±0.11)g]一致,体格健康的大黄鱼进行分组。根据实验设计,将2 400尾实验鱼平均分成6个饲料组,每组4重复,置于24个0.7 m×1 m ×1.2 m的网箱内(每个网箱100尾)。养殖实验共50 d,每天饱食投喂3次(7:00,12:00,16:30)。实验期间水温为21.0~26.0 ℃,盐度为29。
1.3 样品采集与处理 1.3.1 样品采集在养殖实验开始时取25尾经过饥饿处理(24 h)的实验用鱼作为初始样,解剖取肝脏和肌肉保存于-20 ℃冰箱,以用于常规分析和脂肪酸分析。 50天养殖实验结束后,每个网箱随机取40尾经过饥饿处理(24 h)的鱼,解剖采集,肝脏,肌肉,于-20 ℃冰箱保存用于常规分析和脂肪酸分析。
1.3.2 常规营养成分分析方法粗蛋白采用元素分析仪(Vario Max CNS)测定;水分用105 ℃烘箱干燥至恒重测定;总脂采用氯仿-甲醇法测定;灰分用550 ℃马福炉灼烧法测定。
1.3.3 生长指标测定生长实验结束后饥饿24 h,计数每网箱中大黄鱼存活数并称重,按照以下公式计算相对增重率、特定生长率、存活率及饵料系数:
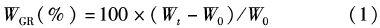
式中:WGR为相对增重率;Wt为第t天大黄鱼的平均体质量;W0为大黄鱼的初始平均体质量。
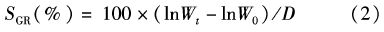
式中:SGR为特定生长率;Wt为第t天大黄鱼的平均体质量;W0为大黄鱼的初始平均体质量;D为采样的间隔时间。
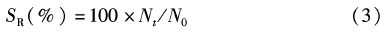
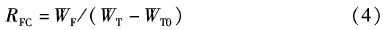
式中:RFC为饵料系数;WF为消耗的饲料总重;WT为第T天大黄鱼总重;WT0为大黄鱼初始总重。
1.3.4 脂肪酸测定脂肪脂肪酸甲酯化采用三氟化硼甲酯化法,以C19烷酸(Sigma)作为内标测定脂肪酸绝对量。具体做法如下:用1mL正己烷溶解三角烧瓶中已经真空干燥的脂肪样品并转移到甲酯化瓶中,加入C19内标后抽真空去除正己烷;加入14%BF3-甲醇(Sigma)溶液2 mL,100 ℃水浴25 min;取出后冷却至室温,加入2 mL苯和2 mL甲醇继续100 ℃水浴25 min;将甲酯化产物完全转移到10 mL离心管中,加入1mL蒸馏水和1 mL正己烷,充分震荡后3 000 r/min离心10 min,取上清液待测。
采用Agilent-7890A型气相色谱以联合Agilent-5975C质谱仪分析脂肪酸。色谱柱为DB-210 122-2332,30 m×0.25 mm×0.25 μm。FID检测进样口温度260 ℃;用流量为1.9 mL/min的高纯度氮气作为载气,氢气和空气流量分别控制在30 mL/min、 300 mL/min。起始温度为60 ℃,并以10 ℃/min的速度提升到190 ℃后,再以5 ℃/min的速度提升到210 ℃,然后以2 ℃/min的速度提升到225 ℃,最后以10 ℃/min的速度提升到245 ℃,共计26.5 min。进样量为1 μL,进样口压力为60 kPa。
根据37种脂肪酸甲酯混标(Sigma,47885-U)的分析图谱和保留时间,以及对每一个色谱峰的质谱图进行标准质谱库(NIST 11版)检索,对样品中脂肪酸进行定性。
根据脂肪酸标准品(Sigma)的分析图谱、保留时间以及质谱的分析对样品脂肪酸进行定性分析,并按照内标法计算各脂肪酸含量的绝对值:
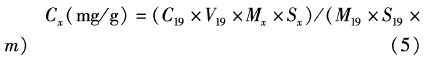
式中:Cx表示某脂肪酸在冻干样品中的含量(mg/g);C19为内标物浓度(mg/mL);V19为内标物加入的体积(mL);M19为内标物甲酯分子量;S19为内标物的峰面积;Mx为某脂肪酸甲酯的分子量;Sx为某脂肪酸的峰面积;m为冻干样品质量(g)。
1.4 数据处理测定结果以平均值±标准差(mean±SD)表示。实验数据用SPSS 17.0软件进行ANOVA单因子方差分析。并用Duncan 氏进行多重比较,P<0.05即认为有显著性差异。
2 结果 2.1 饲料中植物油替代部分鱼油对生长的影响从表3 可知,各饲料处理组间的终末体质量,相对增重率,特定生长率和饵料系数均无显著性差异(P>0.05),但随着菜籽油替代水平的提高,终末体质量,相对增重率,特定生长率呈现降低的趋势,而饵料系数则是呈现升高的趋势。C、D、E组存活率显著低于对照组和F组(P<0.05)。相同替代水平下,混合植物油组大黄鱼幼鱼的生长性能略好于菜籽油组。
| 表3 植物油部分替代鱼油对大黄鱼生长、存活及饲料利用的影响 Tab.3 Effect of partial replacement of fish oil with vegetable oil on growth,survival and feed utilization of Larmichthys crocea(Richardson) |
在实验结束时,对照组(A组)鱼体肌肉的粗蛋白含量最低(58.9%±0.41%);各植物油部分替代鱼油组鱼体的粗蛋白含量均显著高于对照组(P<0.05)。植物油替代组(B、C、D、E和F组)鱼体肌肉的总脂肪百分含量与对照组(A组)无显著性差异(P>0.05);各组肌肉粗灰分无显著性差异(P>0.05)。各处理组肝脏中的总脂百分含量在60%以上,植物油替代组(B、C、D、E和F组)的总脂含量与对照组(A组)无显著性差异(P>0.05),见表4。
| 表4 植物油替代部分鱼油对大黄鱼肌肉常规营养成分及肝脏总脂肪的影响 Tab.4 Effect of partial replacement of fish oil with vegetable oil on muscular biocomposition and total lipid of liver of Larmichthys crocea(Richardson) |
从表5可知,大黄鱼肌肉主要的脂肪酸是16∶0、18∶0、18∶1、18∶2n6、EPA和DHA。肌肉中16∶0、18∶1和18∶2n6的绝对含量随着饲料菜籽油替代鱼油水平的提高呈现先降低后升高的变化趋势(P<0.05),其最低值分别出现在D(50%)组、C(33.33%)组和B(16.67%)组; EPA和DHA的绝对含量变化则是随着饲料菜籽油替代鱼油水平的提高而不断降低(P<0.05)。
| 表5 植物油替代部分鱼油对大黄鱼肌肉脂肪酸组成的影响 Tab.5 Effect of partial replacement of fish oil with vegetable oil on fatty acids in muscle of Larmichthys crocea(Richardson)mg/g |
肌肉中SFAs和MUFAs的绝对含量随着饲料中菜籽油替代鱼油水平的提高而呈现先降低后升高的变化(P<0.05),其最低值分别出现在D(50%)组和C(33.33%)组。随着饲料中菜籽油替代鱼油水平的提高,大黄鱼肌肉中PUFAs的绝对含量逐步降低(P<0.05),n-3PUFAs的绝对含量也随之逐渐降低(P<0.05),而n-6PUFAs的绝对含量随之不断升高(P<0.05)。与E(菜籽油替代)组相比,F(混合植物油替代)组大黄鱼肌肉中16∶0、ARA、EPA、DHA、SFAs、PUFAs,n-3PUFA含量均有显著提高(P<0.05)。
从表6可以看出,大黄鱼肝脏中含量高的脂肪酸是16∶0、16∶1、18∶0、18∶1、18∶2n6、 EPA和DHA。随着饲料中菜籽油替代鱼油水平的提高,大黄鱼肝脏中16∶0、16∶1、EPA和DHA的绝对含量均显著降低(P<0.05);而18∶1、18∶2n6的绝对含量显著升高(P<0.05)。
| 表6 植物油部分替代鱼油对大黄鱼肝脏脂肪酸组成的影响 Tab.6 Effect of partial replacement of fish oil with vegetable on consistent in liver of Larmichthys crocea(Richardson)mg/g |
随饲料中菜籽油替代鱼油水平的提高,SFAs的绝对含量呈现先升高后降低的趋势(P<0.05),其最高值在B(16.67%)组;MUFAs和n-6PUFAs的绝对含量显著升高(P<0.05);PUFAs的绝对含量呈先降低后升高的上下波动变化。与E(菜籽油替代)组相比,F(混合植物油替代)组大黄鱼肝脏中16∶0、16∶1、18∶0和SFAs含量均有显著提高。
3 讨论 3.1 植物油部分替代鱼油对生长、肌肉常规营养成分及肝脏总脂肪的影响随着国内外学者对植物油替代鱼油研究的深入,已有报道提出亚麻籽油[6]、豆油[7]、磷脂油[8]、亚麻油[9]、菜籽油[10, 11]等植物油可部分或全部替代饲料中的鱼油。菜籽油作为一种可再生的相对廉价的替代鱼油的脂肪源,已有较多研究报道。本实验研究发现当基础饲料鱼粉用量为50%、鱼油用量为6%的情况下,用菜籽油替代鱼油16.67%、33.33%、50.00%、66.67%组及混合植物油替代鱼油66.67%组的大黄鱼幼鱼在50天的养殖周期内鱼体相对增重率、特定生长率、饲料系数均与对照组无显著差异(表3)。PETTERSSON等[10]发现用菜籽油替代贝尔湖红点鲢(Salvelinus alpinus)饲料(基础饲料中鱼粉用量为21.8%,鱼油用量为21.8%)中75%的鱼油,养殖79 d鱼体生长与基础饲料组无显著差异。在另一个实验中,虹鳟(Oncorhynchusmykiss)饲料(基础饲料中鱼粉用量为21.8%,鱼油用量为21.8%)中的75%鱼油用菜籽油替代,养殖51天虹鳟的生长与基础饲料组也无显著差异[11]。BELL等[12]用菜籽油逐步替代饲料(基础饲料中鱼粉用量为60%,鱼油用量为19.0%)中的鱼油饲养大西洋鲑(Salmo salar)17周,发现饲料中鱼油被100%替代也不会显著影响大西洋鲑的生长和饲料效率,尽管100%替代组的生长有所下降。然而,DUAN等以大黄鱼[(245.29±7.45)g]为试验材料,12周的养殖试验发现用豆油替代50%鱼油和棕榈油完全替代饲料中的鱼油(基础饲料中鱼粉用量为66.5%,鱼油用量为6.4%)组大黄鱼的增重率较对照鱼油组有显著提高[13]。XU等用不同水平的鱼油替代饲料(基础饲料中鱼粉用量为30%,鱼油用量5.4%)喂养黄斑蓝子鱼(Siganus canaliculatus)8周,发现当添加的豆油占饲料总脂为23%和45%组的试验鱼的生长表现优于鱼油组和豆油占饲料总脂67%组[14]。上述研究结果表明当以生长为评价指标时,海水鱼类饲料中植物油替代鱼油的适宜比例与基础饲料配方、养殖动物的种类及规格、植物油源及饲养周期等因素有关。易新文等[5]也研究了饲料中菜籽油替代鱼油对大黄鱼生长的影响,其以初始体质量为13.56 g的大黄鱼为对象,研究菜籽油分别替代饲料(基础饲料中鱼粉用量为43%,鱼油为7.1%)中25%、50%、75%、100%鱼油后大黄鱼的生长性能,经8周的养殖发现菜籽油替代鱼油不影响大黄鱼的终末体质量、特定生长率及存活率,但100%替代组饲料系数显著高于对照组。其中菜籽油替代鱼油对大黄鱼终末体质量和特定生长率的影响与本试验的研究结果相一致。而本试验中虽未有菜籽油100%替代组,但是随着菜籽油替代比例的增加,大黄鱼饲料系数呈逐渐升高的趋势。本试验中当菜籽油替代33.33%鱼油时,大黄鱼存活率就显著低于鱼油组,这与易新文等的研究结果不同。这可能与大黄鱼的规格及基础饲料配方等因素不同有关。
植物油替代饲料鱼油对养殖鱼类的肌肉生化组成的影响,不同的学者有不同的见解。BELL等[12]认为菜籽油替代鱼油后,大西洋鲑肌肉中的脂肪含量降低,相应的肌肉蛋白含量增加。DUAN等[13]发现与对照组相比,大黄鱼腹部肌肉的脂肪含量在饲料中鱼油被100%豆油或100%棕榈油替代组中显著升高,背部肌肉的脂肪含量及肌肉蛋白含量则不受影响。而黄斑蓝子鱼全鱼及背部肌肉中脂肪及蛋白含量不受饲料鱼油替代水平而有显著变化[14]。虹鳟肌肉中脂肪含量也不因菜籽油替代饲料中鱼油而发生显著变化[11]。本研究中,大黄鱼幼鱼肌肉中脂肪含量也不受植物油替代水平的影响而发生显著变化,类似的结果在军曹鱼(Rachycentron canadum)[15]、黄金鲈(Perca flavescens)[16]、墨瑞鳕(Maccullochella peelii peelii)[17]和黑鲷(Acanthopagrus schlegeli)[18]上也被发现。但是,本研究中大黄鱼幼鱼肌肉蛋白质含量在植物油替代鱼油后都显著高于鱼油对照组(P<0.05),这与BELL等[12]在大西洋鲑上的研究结果相一致。易新文[5]等研究发现饲料(基础饲料中鱼粉用量为43%,鱼油为7.1%)中菜籽油替代25%、50%、75%、100%鱼油后均不影响大黄鱼(初始体质量为13.56 g)的蛋白及脂肪含量。其中对大黄鱼脂肪含量的影响结果与本文相一致,但蛋白质的影响结果不同,这可能与大黄鱼的规格及基础饲料配方等因素不同有关。而且,本研究还发现,相同替代水平下,菜籽油替代鱼油组肌肉蛋白含量比混合植物油替代鱼油组的肌肉蛋白含量要高,表明植物油源也是影响饲料鱼油替代后鱼体生化组成的重要因素。
植物油脂替代饲料鱼油对鱼体肝脏脂肪的积累,大西洋鲑中表现为菜籽油100%替代鱼油组肝脏脂肪含量最高[12];北极嘉鱼肝脏中油脂含量随菜籽油替代比例的增加而显著增加[10];但用植物油100%替代饲料中鱼油,大黄鱼肝脏脂肪含量降低[13]。黄斑蓝子鱼肝脏脂肪含量不受饲料鱼油替代水平而有显著变化[14]。虹鳟肌肉中脂肪含量也不因菜籽油替代饲料中鱼油而发生显著变化[11],本研究中大黄鱼幼鱼肝脏脂肪含量也不因植物油替代饲料鱼油而发生显著变化。表明不同的鱼类及其发育阶段,肝脏对饲料油脂替代有不同的反应。
3.2 植物油部分替代鱼油对肌肉、肝脏的脂肪酸的影响菜籽油中含有较高的油酸(18∶1n9)和亚油酸(18∶2n6),高不饱和脂肪酸含量相对较低[19, 20],紫苏油中含有丰富的亚麻酸(18∶3n3);而海水鱼油中则DHA 和EPA含量高,亚油酸和亚麻酸含量相对低。已有研究表明,饲料中脂肪酸组成会显著影响鱼体组织中脂肪酸的组成[3, 12, 21, 22]。植物油替代饲料鱼油后养殖鱼体中脂肪酸最显著的变化是DHA和EPA含量随饲料鱼油被替代水平的增加而降低[10]。从本实验的研究结果中也发现类似现象,由表2可知,随着菜籽油替代鱼油水平的增加,饲料中油酸的绝对含量显著增加,混合植物油中因含有紫苏油,因此混合植物油替代组饲料的亚麻酸绝对含量显著增加,而饲料中DHA和EPA绝对含量则随植物油替代水平的增加而降低。在大黄鱼肌肉中,表5的结果显示随着饲料中菜籽油替代鱼油水平的增加,肌肉油酸、亚油酸和亚麻酸的绝对含量随之显著增加,而DHA和EPA的绝对含量则相应降低,这与易新文等[5]在大黄鱼饲料中菜籽油替代鱼油的研究结果相一致。在肝脏中,脂肪酸的变化也呈现出与肌肉类似的变化规律(表6)。饲料鱼油被植物油替代后鱼体肌肉及肝脏中脂肪酸的变化规律在其他海水鱼类,如大马哈鱼(Oncorhynchus tshawytscha)[23]、贝尔湖红点鲑(Salvelinus alpinus) [10]、大西洋鲑(Salmo salar)[12, 21, 24]中也得到证实。
由表2可知,F组饲料中ARA和EPA的含量均比A组饲料低,但在鱼体中,肌肉中ARA含量在F组显著高于A组,肌肉中EPA含量在F组显著低于A组(表5),同样在相同替代水平下,混合植物油替代组(F组)饲料中油酸、亚油酸、ARA、EPA和DHA绝对含量与菜籽油替代组(E组)饲料中的相应含量并无显著差异,而亚麻酸含量在混合植物油替代组饲料中显著高于菜籽油替代组饲料。然而对比这两组饲料养殖的大黄鱼肌肉及肝脏中脂肪酸绝对含量,可以发现,鱼体肌肉的DHA、EPA和ARA绝对含量在F组显著高于E组。暗示大黄鱼肌肉中ARA、DHA和EPA的蓄积不但与饲料中该脂肪酸本身含量有关,或许还与其他脂肪酸的含量也有关。大量必需脂肪酸的代谢研究表明,生物体内不同必需脂肪酸之间在代谢途径及生物学功能上存在一定的竞争关系。ARA和EPA都是类二十烷的前体,ARA能够抑制EPA的生物转化[25],同时,EPA能够抑制由ARA生成类二十烷的酶系统,可以调控类二十烷的生成量及生成效率[26],EPA和ARA之间存在竞争关系。
对比F组和E组饲料养殖的大黄鱼肌肉和肝脏中DHA和EPA的变化,鱼体肌肉的DHA和EPA绝对含量在F组显著高于E组,鱼体肝脏的DHA和EPA绝对含量在F组却显著低于E组。表明饲料脂肪酸含量对鱼体不同组织脂肪酸的影响会有不同的效果。而且,相对大黄鱼肌肉的脂肪酸组成,其肝脏的脂肪酸组成更能反映大黄鱼摄食饲料的脂肪酸组成情况。类似的结果在黄斑蓝子鱼中也得到证实[14]。 由于DHA、EPA和ARA在促进动物神经细胞发育、心血管系统保护、抗应激及免疫机能调节等方面具有重要的生物学功能[27, 28]。因此这些脂肪酸的含量是体现海水鱼类营养价值的重要指标,本研究的结果揭示了,尽管大黄鱼的生长不受饲料中植物油脂替代的影响,但大黄鱼肌肉中上述脂肪酸的绝对含量因植物油替代鱼油而降低,表明植物油脂替代饲料鱼油后降低了养殖大黄鱼的营养价值,因此,在大黄鱼上市前的养殖期,植物油脂替代饲料中的鱼油或许是不可取的。
综上所述,本研究表明以相对增重率及特定生长率为参考指标,菜籽油与混合植物油均能替代66.67%鱼油而不影响大黄鱼幼鱼生长。以存活率为参考指标,菜籽油可以替代16.67%鱼油,而混合植物油可以替代66.67%鱼油。饲料中EPA、DHA、ARA含量及ARA和EPA的竞争关系影响着大黄鱼鱼体的营养价值。
| [1] | TURCHINI G M, TORSTENSEN B E, NG W K. Fish oil replacement in finfish nutrition[J]. Reviews in Aquaculture, 2009, 1(1): 10-57. |
| [2] | BOWYER J N, QIN J G, SMULLEN R P, et al. Replacement of fish oil by poultry oil and canola oil in yellowtail kingfish(Serio lalalandi) at optimal and suboptimal temperatures[J]. Aquaculture, 2012, 356-357: 211-222. |
| [3] | FOUNTOULAKI E, VASILAKI A, HURTADO R, et al. Fish oil substitution by vegetable oils in commercial diets for gilthead sea bream(Sparus aurata L.); effects on growth performance, flesh quality and fillet fatty acid profile:recovery of fatty acid profiles by a fish oil finishing diet under fluctuating water temperatures[J]. Aquaculture, 2009, 289(3/4): 317-326. |
| [4] | SHAPAWI R, MUSTAFA S, NG W K. Effects of dietary fish oil replacement with vegetable oils on growth and tissue fatty acid composition of humpback grouper, Cromileptes altivelis(Valenciennes)[J]. Aquaculture Research, 2008, 39(3): 315-323. |
| [5] | 易新文, 张文兵, 麦康森, 等. 饲料中菜籽油替代鱼油对大黄鱼生长、肌肉脂肪酸组成和体色的影响[J]. 水产学报, 2013, 37(5): 751-760.YI X W, ZHANG W B, MAI K S, et al. Effects of dietary fish oil replaced with rapeseed oil on the growth, fatty acid composition and skin color of large yellow croaker(Larimichthys crocea)[J]. Journal of Fisheries of China, 2013, 37(5): 751-760. |
| [6] | 彭墨, 徐玮, 麦康森, 等. 亚麻籽油替代鱼油对大菱鲆幼鱼生长、脂肪酸组成及脂肪沉积的影响[J]. 水产学报, 2014, 38(8): 1131-1139.PENG M, XU W, MAI K S, et al. Growth performance, fatty acids composition and lipid deposition in juvenile turbot(Scophthalmus maximus) fed diets withvarious fish oil substitution levels by linseed oil[J]. Journal of Fisheries of China, 2014, 38(8): 1131-1139. |
| [7] | DENG D F, JU Z Y, DOMINY W G, et al. Effect of replacing dietary menhaden oil with pollock or soybean oil on muscle fatty acid composition and growth performance of juvenile Pacific threadfin(Polydactylus sexfilis)[J]. Aquaculture, 2014, 422-423: 91-97. |
| [8] | 黄劼, 程志萍, 金明昌, 等. 饲料中不同脂肪源替代鱼油对金鲳鱼生长的影响[J]. 长江大学学报: 自然科学版, 2013, 10(17): 48-50.HUANG J, CHENG Z P, JIN M C, et al. Effect of replacement of fish oil with different lipid source on growth of Golden pompano(Trachinotus ov atus)[J]. Journal of Yangtze University:Natural Science, 2013, 10(17): 48-50. |
| [9] | KAMARUDIN M S, RAMEZANI-FARD E, SAAD C R, et al. Effects of dietary fish oil replacement by various vegetable oils on growth performance, body composition and fatty acid profile of juvenile Malaysian mahseer, Tor tambroides[J]. Aquaculture Nutrition, 2012, 18(5): 532-543. |
| [10] | PETTERSSON A, PICKOVA J, BRÄNNÄS E. Effects of crude rapeseed oil on lipid composition in Arctic charr Salvelinus alpinus[J]. Journal of Fish Biology, 2009, 75(6): 1446-1458. |
| [11] | PETTERSSON A, JOHNSSON L, BRÄNNÄS E, et al. Effects of rapeseed oil replacement in fish feed on lipid composition and self-selection by rainbow trout(Oncorhynchus mykiss)[J]. Aquaculture Nutrition, 2009, 15(6): 577-586. |
| [12] | BELL J G, MCEVOY J, TOCHER D R, et al. Replacement of fish oil with rapeseed oil in diets of Atlantic Salmon(Salmo salar) affects tissue lipid compositions and hepatocyte fatty acid metabolism[J]. The Journal of Nutrition, 2001, 131(5): 1535-1543. |
| [13] | DUAN Q Y, MAI K S, SHENTU J, et al. Replacement of dietary fish oil with vegetable oils improves the growth and flesh quality of large yellow croaker(Larmichthys crocea)[J]. Journalof Ocean University of China, 2014, 13(3): 445-452. |
| [14] | XU S D, WANG S Q, ZHNG L, et al. Effects of replacement of dietary fish oil with soybean oil on growth performance and tissue fatty acid composition in marine herbivorous teleost Siganus canaliculatus[J]. Aquaculture Research, 2012, 43(9): 1276-1286. |
| [15] | 林华锋. 3 种植物油替代鱼油对军曹鱼幼鱼生长、血清生化指标和脂肪酸组成的影响[D]. 湛江: 广东海洋大学, 2012.LIN H F. Effects of replacement of dietary fish oil by vegetableoils on growth, serum biochemical parameters andfatty acid profiles of juvenile cobia(Rachycentron canadum)[D]. Zhanjiang: Ocean University of Guangdong, 2012. |
| [16] | MJOUN K, ROSENTRATER K A, BROWN M L. Culture performance and tissue fatty acid compositions of yellow perch(Perca flavescens) fed different dietary lipids[J]. Aquaculture, 2012, 360-361: 17-24. |
| [17] | TURCHINI G M, FRANCIS D S, SENADHEERA S P S D, et al. Fish oil replacement with different vegetable oils in Murray cod: Evidence of an “omega-3 sparing effect” by other dietary fatty acids[J]. Aquaculture, 2011, 315(3/4): 250-259. |
| [18] | PENG S M, CHEN L Q, QIN J G, et al. Effects of replacement of dietary fish oil by soybean oil on growth performance and liver biochemical composition in juvenile black seabream, Acanthopagrus schlegeli[J]. Aquaculture, 2008, 276(1/4): 154-161. |
| [19] | 赵青松, 郭万正, 魏金涛, 等. 油菜籽的营养价值及养殖应用分析[J]. 养殖与饲料, 2011(10): 41-44.ZHAO Q S, GUO W Z, WEN J T, et al. Analyse of nutritional value of rapeseed and breeding application[J]. Farm and Feed, 2011(10): 41-44. |
| [20] | 郝希成, 汪丽萍, 张蕊. 菜籽油脂肪酸成分标准物质的研制[J]. 中国油脂, 2011, 36(6): 68-71.HAO X C, WANG L P, ZHANG R. Preparation, testing and certification of fatty acid reference material of rapeseed oil[J]. China Oils and Fats, 2011, 36(6): 68-71. |
| [21] | TORSTENSEN B E, FRØYLAND L, ØRNSRUD R, et al. Tailoring of a cardioprotective muscle fatty acid composition of Atlantic salmon(Salmo salar) fed vegetable oils[J]. Food Chemistry, 2004, 87(4): 567-580. |
| [22] | SEIERSTAD S L, HAUGLAND Ø, LARSEN S, et al. Pro-inflammatory cytokine expression and respiratory burst activity following replacement of fish oil with rapeseed oil in the feed for Atlantic salmon(Salmo salar L.)[J]. Aquaculture, 2009, 289(3/4): 212-218. |
| [23] | ZUO R T, AI Q H, MAI K S, et al. Effects of dietary docosahexaenoic to eicosapentaenoic acid ratio(DHA/EPA) on growth, nonspecific immunity, expression of some immune related genes and disease resistance of large yellow croaker(Larmichthys crocea) following natural infestation of parasites(Cryptocaryon irritans)[J]. Aquaculture, 2012, 334-337: 101-109. |
| [24] | BELL J G, MCGHEE F, CAMPBELL P J, et al. Rapeseed oil as an alternative to marine fish oil in diets of post-smolt Atlantic salmon(Salmo salar): changes in flesh fatty acid composition and effectiveness of subsequent fish oil “wash out”[J]. Aquaculture, 2003, 218(1/4): 515-528. |
| [25] | FURUITA H, YAMAMOTO T, SHIMA T, et al. Effect of arachidonic acid levels in broodstock diet on larval and egg quality of Japanese flounder Paralichthys olivaceus[J]. Aquaculture, 2003, 220(1/4): 725-735. |
| [26] | BRUCE M, OYEN F, BELL G, et al. Development of broodstock diets for the European Sea Bass(Dicentrarchus labrax) with special emphasis on the importance of n-3 and n-6 highly unsaturated fatty acid to reproductive performance[J]. Aquaculture, 1999, 177(1/4): 85-97. |
| [27] | WATANABE T. Importance of docosahexaenoic acid in marine larval fish[J]. Journal of the World Aquaculture Society, 1999, 24(2): 152-161. |
| [28] | BELL M V, HENDERSON R J, PIRIE B J S, et al. Effects of dietary polyunsaturated fatty acid deficiencies on mortality, growth and gill structure in the turbot, Scophthalmus maximus[J]. Journal of Fish Biology, 1985, 26(2): 181-191. |
| [29] | SARGENT J R, TOCHER D R, BELL J G. The lipids[M]//HALÜERJ E, HARDYR W. Fish Nutrition. 3rd ed. USA:Elsevier, 2002: 181-257. |
2. Shanghai Engineering Research Center of Aquaculture, Shanghai 201306, China;
3. Shanghai University Knowledge Service Platform, Shanghai Ocean University Aquatic Animal Breeding Center, Shanghai 201306, China
 2015, Vol. 24
2015, Vol. 24


