2. 上海水生环境工程有限公司, 上海 200090
浮游植物个体微小,种类繁多,是水域生态系统中最主要的初级生产者[1];它们在水体物质转换和能量循环过程中起着重要作用[2]。研究表明,浮游植物群落结构和生物量能够很好地反映水环境的状态[3],某些特定浮游植物种类的演替可体现水体营养水平的变化[4];反之,环境条件的改变也会直接或间接地影响到浮游植物群落结构[5]。因此,深入地研究浮游植物群落结构与水环境的关系,对深入了解水生态系统的结构和功能、保护和改善水环境具有重要的意义。目前,我国学者已对太湖、滇池、巢湖、东湖、淀山湖、鹤地水库、熊河水库[6, 7, 8, 9, 10, 11, 12]等众多内陆水体的浮游植物群落进行了报道,但迄今为止,对于河口性大型人工水库的研究,仍鲜有报道。
青草沙水库位于长江口南支河段,长兴岛北侧(31°25′-31°29′N,121°34′-121°42′E),由长兴岛头部和北部外侧的中央沙、青草沙以及北小泓、东北小泓等水域组成,总面积近66 km2,年均径流总量为4896×108 m3。水库于2010年启用,从长江江心取水,是目前国内最大的蓄淡避咸的河口江心水库,是上海市最主要的水源地之一。至2020年,按上海2000万人预测,青草沙水库占全市原水供应总规模的50%[13]。因此,对于青草沙水库水质进行规范管理,并维持其水生态系统的稳定十分重要。但目前对于青草沙水库水生生物生态学的研究总体偏少,刘歆璞、胡忠军等人对该水体的浮游动物和鱼类做过少量调查研究[14, 15];而有关浮游植物的研究更是少之又少,相关报道目前仅有3篇[16, 17, 18]。为了弥补青草沙水库藻类生态资料的不足,本文对青草沙水库浮游植物进行周年连续调查,研究河口性水库浮游植物种类及时空特征以及与环境因子的相互关系,为今后水库在不同时期的维护管理工作提供借鉴参考。
1 材料与方法 1.1 采样时间和地点2011年1月、4—12月对青草沙水库浮游植物进行逐月采集和分析。根据青草沙水库形态、水文条件,共设立11个采样点(图1),依照区域的不同划分为个4区位,分别为库外(河口,11#)、库首(1#、2#、3#、4#)、库中(5#、6#、7#)和库尾(8#、9#、10#)。本文中季节划分如下:每年3-5月为春季、6-8月为夏季、9-11月为秋季、12-翌年2月为冬季。
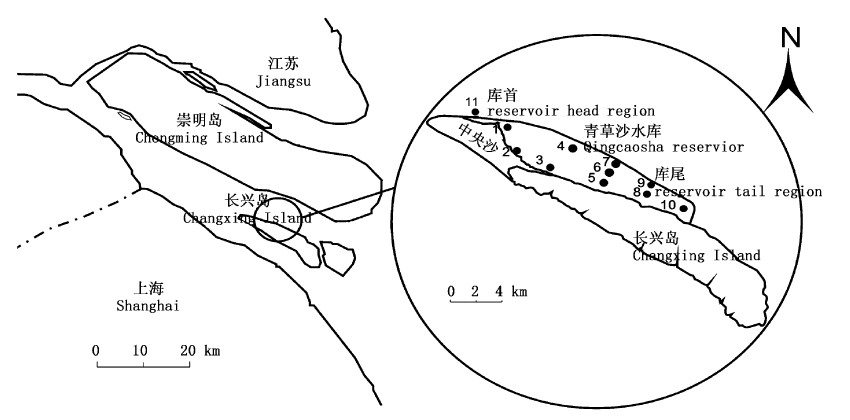
|
图 1 采样点分布图 Fig. 1 Location of sampling sites |
定性样品:用25#浮游生物网采集,光学显微镜下观察,浮游植物种类鉴定参考胡鸿钧[19]、王全喜等[20]著作;定量样品:用5 L采水器分别在0.5 m和离底0.5 m采集两次,取1 L水,加入鲁哥氏碘液和福尔马林溶液固定,静置48 h,浓缩至50 mL,取0.1 mL计数,最后换算为1 L样品中的总细胞数。采样期间,对水体轮虫、枝角类、桡足类等浮游动物进行了同步采集。
水温(T)、溶氧(DO)、pH采用YSI-Professional Plus 多功能水质分析仪直接测定;透明度(SD)采用赛氏透明度盘(黑白盘)直接测定;悬浮物(SS)采用滤膜法测定。
1.3 数理分析方法 1.3.1 优势度的计算
式中:Ni为第i种物种密度,N为该类群总密度,fi为第i种在一年中出现的月份频率[21] 。
1.3.2 多样性指数的计算用Shannon-Wiener多样性指数H′、Margalef丰富度指数D和Pielou均匀度指数J评价浮游动物群落多样性并对水质进行评价[22, 23]:

式中:Pi=Ni/N,Ni表示样品中第i种物种的个体数,N表示样品中所有种类的总个体数,S表示样品中所有物种的种类数。
1.3.3 典范对应分析Canoco 4.5软件对物种数据和环境数据进行CCA分析。对该物种在采样点出现的频度以及其生物量的大小在全年中所占的比例进行降序排列,选取前98% 浮游植物作为CCA 分析的物种矩阵。物种矩阵和环境因子矩阵经过lg(x +1) 转换[24]。为了证明典范对应分析中环境因子对浮游植物解释量的显著性,应对实验进行蒙特卡洛(Monte Carlo)显著性检验(499组排序)。
2 结果 2.1 相关环境因子调查期间,青草沙水库理化因子中,水温(T)年平均值为(19.21±8.50)℃,最高为8月份,最低为1月份;透明度(SD)为(0.68±0.15)m,最高出现在4月份,最低为5月份;溶解氧(DO)为(9.52±1.97)mg/L,1月份和12月份较高,5月份最低;悬浮物(SS)为(5.39±2.93) mg/L,8月份、5月份较高,1月份、9月份较低,pH为8.53±0.44,春冬季较低,夏秋季较高,pH较高,水质偏碱性;方差分析显示,各因子季节间差异均显著(P < 0.05)。
生物因子方面,青草沙浮游动物年均密度为469.1 ind/L,轮虫密度最高,其平均密度为403.9 ind/L,占总密度的86.1%;其次为枝角类,平均密度为42.5 ind/L,占总密度的9.1%;桡足类平均密度为22.7 ind/L,占总密度的4.8%。浮游动物密度高峰出现在秋季,最高峰出现在9-11 月份,均超过了580 ind/L,最高生物密度在10 月达到了1 138.9 ind/L。另外,在5月份浮游动物密度也出现了一个小的峰值(主要为脆弱象鼻溞Bosmina fatalis占优势)。
主要的生物和非生物环境因子全年变化趋势见图2。
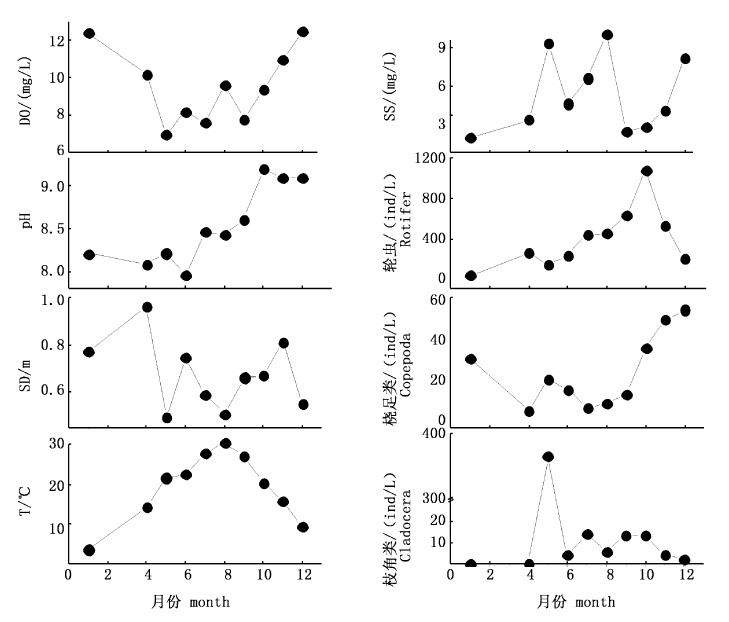
|
图 2 青草沙水库主要环境因子的周年变化 Fig. 2 Annual variations of environmental factors in Qingcaosha Reservoir |
根据2011年1月、4月至12月10次采样分析结果,共观察到浮游植物8门99属223种,其中绿藻门种类数最多,为44属104种,占总种数46.64%;硅藻门24属55种,占24.66%;蓝藻门20属46种,占20.63%;裸藻门5属7种,占3.14%;黄藻门1属4种,占1.79;隐藻门2属3种,占1.35%;甲藻门2属3种,占1.35%;金藻门1属1种,占0.45%。
2.2.2 浮游植物种类时空变化各月的浮游植物种类组成变化为8月种类数最多,达99种,10月最低,为61种,其他各月种类数分别为1月67种,4月64种,5月68种,6月75种,7月70种,9月77种,11月85种,12月80种。绿藻种类数在8月最高(49种),1月最低(28种);硅藻种类数在9月、12月最高(22种),7月最低(14种),蓝藻种类数在8月最高(27种),1月最低(10种)。
从水平分布上看,青草沙浮游植物种类数呈现为库尾种类数最多,为167种,库中为150种,库首为147种,库外入水口最少,为78种,绿藻门和硅藻门种类数库尾大于库首和库中,蓝藻门为库尾略小于库首和库中(图3)。少数咸水或半咸水种类在库内、外均有检出,主要为:卵形褶盘藻(Trybliptychus cocconeiformis),圆筛藻(Coscinodiscus sp.),细长海链藻(Thalassiosira leptopus),中肋骨条藻 (Skeletonema costatum)等。
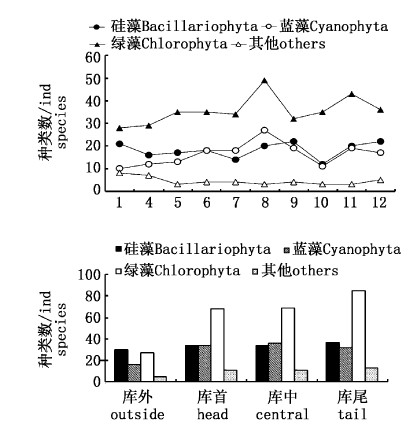
|
图 3 青草沙水库浮游植物种类数时空变化 Fig. 3 Annual and spatial variation of phytoplankton species in Qingcaosha Reservoir |
2011年青草沙浮游植物丰度年平均变化范围为86.37×104~2594.63×104 cell/L,年平均丰度为1050.47×104 cell/L,其中以蓝藻门为主,年平均丰度为729.35×104 cell/L,占总丰度的69.43%,其次为绿藻门,年平均丰度为188.89×104 cell/L,占17.98%;再次为硅藻门,年平均丰度为63.90×104 cell/L,占6.08%;隐藻门年平均丰度为62.16×104 cell/L,占5.92%,黄藻门、裸藻门、金藻门和甲藻门丰度较小,共6.10×104 cell/L,共占总丰度的0.58%。丰度较高的种类有卷曲鱼腥藻(Anabaena circinalis)135.23×104 cell/L、惠氏微囊藻(Microcystis wesenbergii)100.56×104 cell/L、针晶蓝纤维藻(Dactylococcopsis rhaphidioides)53.04×104 cell/L、水华微囊藻(M. flos-aquae)46.07×104 cell/L、小席藻(Phormidittmtertue tentts)41.57×104 cell/L、银灰平裂藻(Merismopedia glauca)40.47×104 cell/L、铜绿微囊藻(M. aeruginosa)39.06×104 cell/L、微小色球藻(Chroococcus minutus)38.61×104 cell/L、球衣藻(Chlamydomonas globosa)38.39×104 cell/L、小环藻(Cyclotella sp.)35.09×104 cell/L、啮蚀隐藻(Cryptomonas erosa)32.25×104 cell/L。
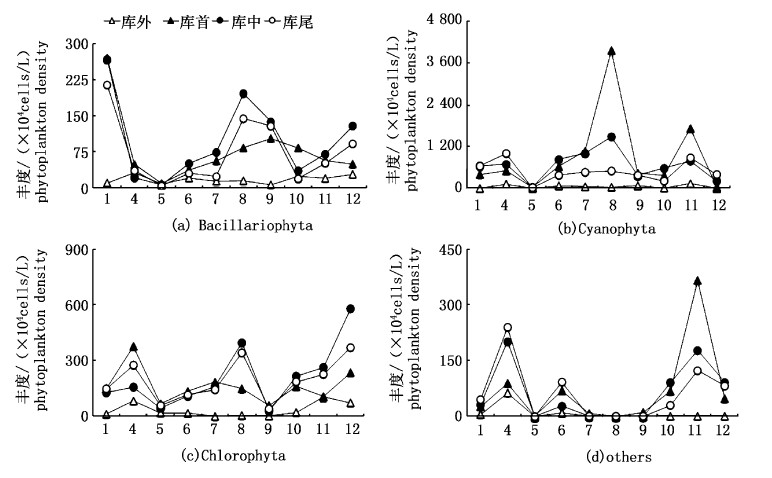
藻类密度周年变化呈“双峰”形态(图4),主峰值出现在8月,丰度为2594.63×104 cell/L;次峰值出现在11月,为1674.39×104 cell/L;丰度最小值出现在5月,为86.37×104 cell/L。不同门类的周年变化见图5,蓝藻在8月出现最多(2178.24×104 cell/L),5月最少(24.02×104 cell/L);绿藻门4月最多(280.09×104 cell/L),9月最少(42.92×104 cell/L);硅藻门1月最多(252.05×104 cell/L),5月最少(5.37×104 cell/L)。根据各门类藻类丰度所占百分比的月份变化显示,1月、9月为蓝藻>硅藻>绿藻;5月-8月为蓝藻>绿藻>硅藻;4月、10月和11月为蓝藻>绿藻>隐藻>硅藻;12月绿藻>蓝藻>硅藻。
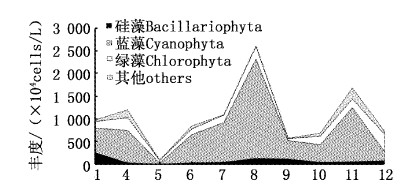
|
图 4 青草沙水库浮游植物丰度2011年周年变化 Fig. 4 Composition of the density of phytoplankton in Qingcaosha Reservoir. |
|
图 5 青草沙水库浮游植物丰度2011年周年变化 Fig. 5 Annual variations of phytoplankton density in Qingcaosha Reservoir |
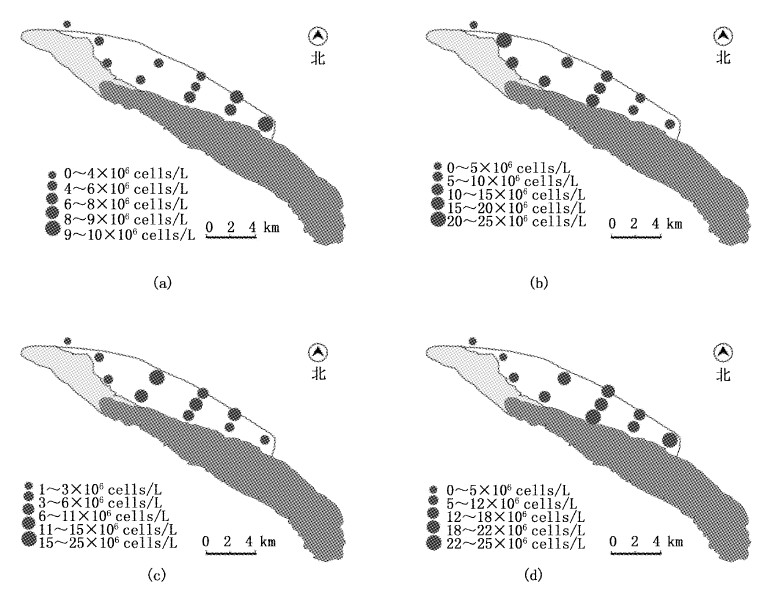
青草沙水库2011年各采样点浮游植物分布见图6。四季库外浮游植物密度变化不明显,春季从库首至库尾,密度呈增加趋势;夏季与春季相反,从库首至库尾呈递减趋势;秋季库首和库尾密度较低,而库中密度较高;冬季库首密度较低,库中和库尾密度较高。
|
图 6
青草沙水库各采样点浮游植物分布
Fig. 6
Spatial distribution of the density of phytoplankton in sites in Qingcaosha Reservoir
a.春季;b.夏季;c.秋季;d.冬季。 a.spring; b. summer; c. autumn; d.winter. |
从水平分布来看,总体而言,青草沙库内全年的丰度表现为:库首>库中>库尾,库外入水口藻类丰度明显低于库内,为106.07×104 cell/L,上、中、库尾年平均丰度分别为1225.70×104 cell/L、1031.42×104 cell/L和810.22×104 cell/L。
2011年浮游植物丰度的年平均百分比(表1)显示:蓝藻占据优势,其平均值达到66.3%;其次为绿藻,约18.96%;硅藻居第三,约8.30%。全年蓝藻门和隐藻门藻类丰度库首>库中>库尾,其中蓝藻门库外和库尾呈显著差异(P < 0.05);绿藻门库中>库尾>库首,其中库外和库尾呈显著差异(P < 0.05),库首和库尾、库中和库尾都呈极显著差异(P < 0.01);硅藻门库中>库首>库尾,其中库外和库尾呈显著差异(P < 0.05),库首和库尾呈极显著差异(P < 0.01,图6)。
| 表 1 青草沙水库浮游植物的年平均百分比 Tab.1 Annual average percentage composition of phytoplankton in Qingcaosha Reserivor |
青草沙水库全年的浮游植物优势种主要为小环藻(Cyclotella sp.)、卷曲鱼腥藻(A. circinalis)、微小色球藻(C. minutus)、针晶蓝纤维藻(D. rhaphidioides)、球衣藻(C. globosa)、啮蚀隐藻(C. erosa)(表1),它们的丰度分别占总丰度的3.6%、13.1%、3.7%、5.1%、3.7%、3.4%。出现频率较高的浮游植物为小环藻(Cyclotella sp.)、球衣藻(C. globosa)、针晶蓝纤维藻(D. rhaphidioides),在各站点出现的年均频率分别为87.43%、86.23%、82.63%。
此外,水华微囊藻(M. flos-aquae)、铜绿微囊藻(M. aeruginosa)、惠氏微囊藻(M. wesenbergii)3种水华蓝藻在7、8、9月高温季节占绝对优势(但在其他月份不占优势);此后,蓝藻优势种演替为卷曲鱼腥藻(A. circinalis)占优势。
各采样点浮游植物优势度(Y)及优势种(Y>0.02)变化表现为:5月出现最多,为10种,其次为12月9种,10月无优势度>0.02的种类,卷曲鱼腥藻(A. circinalis,Y=0.015)和小颤藻(Oscillatoria tenuis,Y=0.01)在该月优势度相对较高。优势种种数呈现冬春季多、夏秋少,优势种所属门类呈现冬春绿藻多,夏秋蓝藻多的特点。
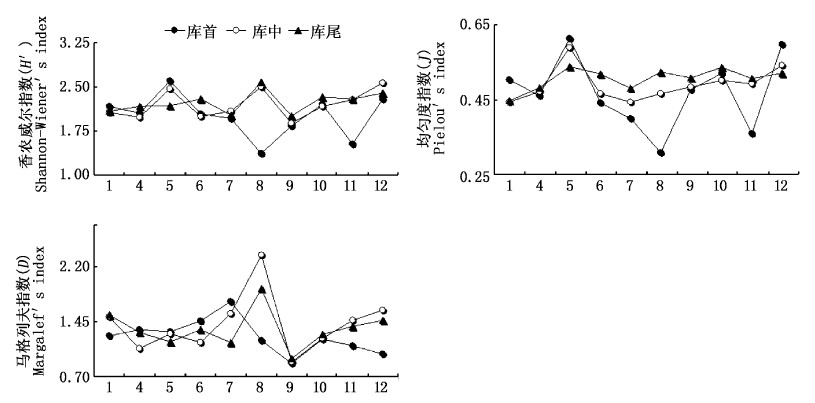
2.6 多样性指数计算青草沙水库各采样点的多样性指数,Shannon-Wiener多样性指数(H′)的周年变化范围为1.57~2.37,年均值为2.08;Margalef丰富度指数(D)变化范围为0.64~1.50,年均值为1.26;Pielou均匀度指数(J)变化范围为0.44~0.52,年均值为0.49。
从水平分布来看,除库外的多样性指数较低外,3种多样性指数在采样点上表现为:库尾>库中>库首。库首、库中、库尾的Shannon-Wiener多样性指数(H′)和Pielou均匀度指数(J)表现出一致的周年变化趋势(图7)。
|
图 7 青草沙水库浮游植物多样性指数的周年变化 Fig. 7 Annual variations of diversity indices of phytoplankton in Qingcaosha Reservoir. |
根据浮游植物丰度和出现的频率,本研究选取了16种浮游植物,这些浮游植物丰度占整个水库浮游植物丰度的98%,全年在各采样点出现频率达到40%以上。再加上出现丰度较高的微囊藻、鱼腥藻和平裂藻,共21种作为CCA分析的浮游植物入选种,其代码见表2。
| 表 2 CCA分析中的浮游植物种类代码 Tab.2 Codes of phytoplankton species for CCA |
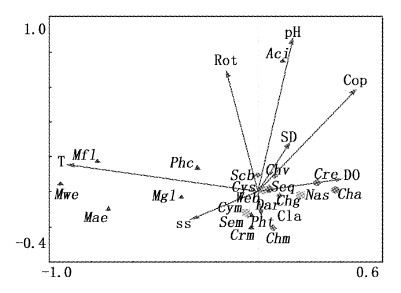
将主要浮游植物丰度和理化、生物因子进行CCA分析,排序结果如图8所示,箭头表征了环境因子在平面上的相对位置,向量长短代表了其在主轴中的作用,箭头所处象限表示环境因子与排序轴之间的相关性的正负。
|
图 8
主要浮游植物丰度与环境因子之间的双轴排序图
Fig. 8
Ordination biplots of phytoplankton density and environmental variables
Rot.轮虫;Cla.枝角类;Cop.桡足类。 Rot.Rotifer; Cla.Cladocera; Cop.Copepoda. |
前两个排序轴的特征值分别为0.118和0.047,环境因子轴与物种排序轴之间的相关系数分别为0.761和0.672,表明环境因子与物种拟合程度均较好。CCA分析中选取的5个理化因子和3个生物因子,水温与第一排序轴成最大负相关(-0.69),说明第一轴从左到右,水温升高;pH与第二排序轴关系最大,为0.58。由图8可见,蓝藻门的微囊藻属和平裂藻属与水温呈正相关,说明这些类群的藻类喜高温,易出现在高温季节;而蓝藻门的卷曲鱼腥藻、微小色球藻和小席藻与水温并无显著正相关关系,并且与微囊藻属的距离较远,说明它们不喜高温,最适生长水温比微囊藻属低,并且占优势的季节不同。绿藻门的类群和硅藻门的小环藻属,与水温无明显相关关系,说明这些类群为广温性物种。而舟形藻sp.以及隐藻门的啮蚀隐藻和尖尾蓝隐藻与水温呈负相关,说明它们主要出现在低温季节。小形月牙藻、小球衣藻等小粒径藻类与轮虫密度呈负相关关系,说明浮游动物对小粒径藻类具有牧食压力。微囊藻属与悬浮物呈正相关,与透明度呈负相关,说明它们多出现在浊度高的水体中;卷曲鱼腥藻与透明度呈正相关,与悬浮物浓度呈负相关,说明该物种主要出现在浊度较低的水体中。
3 讨论 3.1 青草沙浮游植物群落结构周年变化特征青草沙水库作为初建成的河口性水库,其浮游植物群落在种类和丰度组成上具有相应的特点。蓝藻为青草沙水库浮游植物的绝对优势类群,其季节演替表现为:春季以色球藻属、蓝纤维藻属为主,夏季以微囊藻属为主,而秋季则以卷曲鱼腥藻和鞘丝藻属为主。在富营养化的水体中,许多浮游植物尤其是具有浮力或运动能力的藻类,通常能过度生长,形成藻类的水华[25]。蓝藻具有伪空胞、藻胆蛋白、适应宽幅N/P比变化、耐高温等特征,使之能够适应富营养化水体,从而在种群演替中成为优势种[26]。近年来研究[27, 28]表明,长江径流和河口沿岸的排放水体携带大量的营养物质进入河口区,长江口水域富营养化问题日益严重。青草沙水库取水于长江口,入水营养盐浓度高,适宜蓝藻生长。蓝藻优势种季节演替在粒径上表现为春季小型、夏季暴发、秋季丝状的特点。微囊藻属在水温28~32 ℃范围繁殖最快[29],而卷曲鱼腥藻的最适合生长及复苏温度为22~24 ℃[30],这也在一定程度上解释了优势种从夏季的微囊藻属演替成秋季的卷曲鱼腥藻的原因。5月浮游植物丰度最低值的出现,可能是浮游动物密度较高(以脆弱象鼻溞为优势种),对浮游植物的牧食作用较强所致[31, 32]。另外,在本研究中,中肋骨条藻、细长海链藻等咸水性物种主要在4月、11月、12月检测到。这可能与5-10月长江来水较丰,不易发生咸潮入侵,属非咸潮期,而11-4月为咸潮期有关[33]。
在浮游植物多样性方面,3种多样性指数周年波动不大,但Shannon-Wiener多样性指数(H′)和Pielou均匀度指数(J)在夏季开始下降,秋季回升;库首、库中、库尾的Shannon-Wiener多样性指数(H′)和Pielou均匀度指数(J)表现出一致的周年变化趋势。Pielou均匀度指数(J)与蓝藻丰度(H′)呈极显著负相关关系,与Shannon-Wiener多样性指数(H′)呈极显著正相关关系,相关系数分别为-0. 842(P < 0. 001)、0.841(P< 0.001)。蓝藻丰度在夏季达到最高值,种间竞争[34]导致其他门类的密度较低,群落均匀度(J)的改变导致了H′的变化。
3.2 青草沙浮游植物群落结构空间变化特征青草沙浮游植物群落结构在空间分布上差异明显,除库外浮游植物种类数和丰度都很低外,水库内表现为种类数:库首 < 库中 < 库尾,藻类丰度:库首>库中>库尾。这可能因为库外泥沙含量高,透明度低,不利于多种浮游植物生长,导致水库外入口处藻类种类和丰度明显低于库内。水动力改变、浮游动物的牧食作用往往也是导致浮游植物群落结构空间差异的主要因素。有研究[35]表明,在扰动较大和低光照的条件下,蓝藻具有更多的竞争优势,这可能是本研究中库首悬浮物较高,而蓝藻丰度最高的原因。随着水深增加,水体流速减慢,透明度增加,更适宜绿藻生长[36],蓝藻所占比例下降。另本研究中浮游动物密度在空间上表现为:库首 < 库中 < 库尾,其对浮游植物的牧食作用也是影响浮游植物密度变化的原因之一。
3.3 青草沙浮游植物群落结构特征与环境因子的关系浮游植物群落结构及其变化受到理化因子和生物因子的综合影响[37]。CCA双轴排序图中,位于右上角的尖尾蓝隐藻及啮蚀隐藻和溶氧呈正相关,和水温呈显著的负相关,说明隐藻更加适应气温较低、溶氧较高的环境,容易成为冬春季的优势种;有研究[38]表明隐藻属于冷水性种,这可能也与夏季蓝藻过度繁盛会对隐藻产生抑制作用有关[39]。皮状席藻属于蓝藻,其与水温呈显著正相关关系,说明温度的升高有利于其生长繁殖[40]。本研究中,微囊藻属密度与浊度呈正相关关系,与透明度呈负相关,密度从库首至库尾逐步降低,该结果与张红梅等的研究结果一致[16],其原因可能是强光不利于蓝藻生长,而在较低的光照条件下蓝藻可以比其他藻类具有更高的生长速率[41]。但同为蓝藻门的卷曲鱼腥藻却在浊度低的水体中占优势,这可能因为不同蓝藻种属的生理结构和生态功能差异所导致[42]。
除此之外,浮游植物的群落结构还受到生物因子的影响。绿藻中的小球衣藻和小形月牙藻、蓝藻中的微小色球藻、硅藻中的梅尼小环藻以及隐藻中的尖尾蓝隐藻都和轮虫丰度呈负相关关系,可能是由于这些藻类个体都很小,多数滤食性轮虫的适口食物小于5 μm,最适5~10 μm[29],因此这些藻类的丰度会受到轮虫等浮游动物的影响。微囊藻丰度和浮游动物的丰度无明显的相关性,可能是当微囊藻细胞聚集、形成较大的群体后,就可以有效地抵御浮游动物的捕食作用[43]。
4 结论(1)2011年青草沙水库浮游植物共鉴定出8门99属223种,其中绿藻门种类数始终占首位,其次是蓝藻和硅藻。全年中8月种类数最多为99种,库尾种类数高于其他区域为167种。
(2)青草沙水库浮游植物细胞丰度季节变化明显,呈双峰形,蓝藻为青草沙水库浮游植物的绝对优势类群,具有爆发蓝藻水华的潜在风险,在水库今后的管理中,应做好监测和预警工作,以保证饮用水的安全性。
(3)浮游植物优势种主要为小环藻(Cyclotella sp.)、卷曲鱼腥藻(A. circinalis)、微小色球藻(C. minutus)、针晶蓝纤维(D. rhaphidioides)、球衣藻(C. globosa)、啮蚀隐藻(C. erosa)。此外,水华微囊藻(M. flos-aquae)、铜绿微囊藻(M. aeruginosa)、惠氏微囊藻(M. wesenbergii)3种水华蓝藻在夏季占绝对优势,卷曲鱼腥藻(A. circinalis)在秋季占优势。水温、水动力改变和浮游动物牧食作用可能是浮游植物生长和群落演替过程中的主要影响因子。
(4)青草沙作为“避咸蓄淡”型的河口性水库,受咸潮影响不大,盐度不高,仅在个别月份出现了中肋骨条藻、细长海链藻等种类,但总体而言,咸水和半咸水种类出现频次和数量较少。
| [1] | SUIKKANEN S, LAAMANEN M, HUTTUNEN M. Long-term changes in summer phytoplankton communities of the open northern Baltic Sea[J]. Estuarine, Coastal and Shelf Science, 2007, 71(3/4): 580-592. |
| [2] | SONG S Q, SUN J, LUAN Q S, et al. Size-fractionated phytoplankton biomass in autumn of the Changjiang(Yangtze) River Estuary and its adjacent waters after the Three Gorges Dam construction[J]. Chinese Journal of Oceanology and Limnology, 2008, 26(3): 268-275. |
| [3] | SALMASO N, MORABITO G, BUZZI F, et al. Phytoplankton as an indicator of the water quality of the deep lakes south of the Alps[J]. Hydrobiologia, 2006, 563(1): 167-187. |
| [4] | MARCHETTO A, PADEDD B M, MARINANI M A, et al. A numerical index for evaluating phytoplankton response to changes in nutrient levels in deep mediterranean reservoirs[J]. Journal of Limnology, 2009, 68(1): 106-121. |
| [5] | KAMENIR Y, DUBINSKY Z, ZOHARY T. Phytoplankton size structure stability in a mesoeutrophic subtropical lake[J]. Hydrobiologia, 2004, 520(1/3): 89-104. |
| [6] | 钱奎梅, 陈宇炜, 宋晓兰. 太湖浮游植物优势种长期演化与富营养化进程的关系[J]. 生态科学, 2008, 27(2): 65-70. QIAN K M, CHEN Y W, SONG X L. Long-term development of phytoplankton dominant species related to eutrophicarion in Lake Taihu[J]. Journal of Ecological Science, 2008, 27(2): 65-70. |
| [7] | 张梅, 李原, 王若南. 滇池浮游植物种类的动态变化[J]. 云南大学学报:自然科学版, 2006, 28(1): 73-77. ZHANG M, LI Y, WANG R N. Dynamic variation for the species of phytoplankton in Dianchi Lake, China[J]. Journal of Yunnan University: Natural Science, 2006, 28(1): 73-77. |
| [8] | 余涛. 巢湖浮游植物群落结构研究[D]. 合肥: 安徽大学, 2010. YU T. Phytoplankton community structure in Chaohu Lake[D]. Hefei: Anhui University, 2010. |
| [9] | 唐汇娟, 谢平, 刘丽, 等. 武汉东湖浮游植物群落结构的时空变化与环境因子的关系[J]. 中山大学学报:自然科学版, 2008, 47(3): 100-104. TANG H J, XIE P, LIU L, et al. Temporal and spatial variation of phytoplankton structure and its relationship with environmental factors in Lake Donghu[J]. Acta Scientiarum Naturalium Universitatis Sunyatsen, 2008, 47(3): 100-104. |
| [10] | 王丽卿, 施荣, 季高华, 等. 淀山湖浮游植物群落特征及其演替规律[J]. 生物多样性, 2011, 19(1): 48-56. WANG L Q, SHI R, JI G H, et al. Phytoplankton community structure and its succession in Dianshan Lake[J]. Biodiversity Science, 2011, 19(1): 48-56. |
| [11] | 邹红菊, 胡韧, 韩博平. 鹤地水库浮游植物群落的结构与动态[J]. 热带亚热带植物学报, 2010, 18(2): 196-202. ZOU H J, HU R, HAN B P. Structure and dynamics of phytoplankton community in Hedi Reservoir, South China[J]. Journal of Tropical and Subtropical Botany, 2010, 18(2): 196-202. |
| [12] | 张婷, 李林, 宋立荣. 熊河水库浮游植物群落结构的周年变化[J]. 生态学报, 2009, 29(6): 2971-2979. ZHANG T, LI L, SONG L R. Annual dynamics of phytoplankton abundance and community structure in the Xionghe Reservoir[J]. Acta Ecologica Sinica, 2009, 29(6): 2971-2979. |
| [13] | 顾玉亮, 乐勤, 金迪惠. 青草沙上海百年战略水源地[J]. 上海建设科技, 2008(1): 66-69. GU Y L, YUE Q, JIN D H. Qingcaosha, century strategic water sources in Shanghai[J]. Shanghai Construction, Science and Technology, 2008(1): 66-69. |
| [14] | 刘歆璞, 王丽卿, 张宁, 等. 青草沙水库后生浮游动物群落结构及其与环境因子的关系[J]. 生态学杂志, 2013, 32(5): 1238-1248. LIU X P, WANG L Q, ZHANG N, et al. Community structure of metazoan zooplankton and its relationships with environmental factors in Qingcaosha Reservoir of Shanghai, East China[J]. Chinese Journal of Ecology, 2013, 32(5): 1238-1248. |
| [15] | 胡忠军, 吴昊, 陈立侨, 等. 长江口青草沙水库正式供水前的鱼类群落结构特征[J]. 水产学报, 2012, 36(8): 1234-1241. HU Z J, WU H, CHEN L Q, et al. Structure of fish assemblages before drinking-water supplies in Qingcaosha Reservoir of Yangtze River Estuary[J]. Journal of Fisheries of China, 2012, 36(8): 1234-1241. |
| [16] | 张红梅. 青草沙水库藻类增殖及其毒素形成研究[D]. 上海: 复旦大学, 2012. ZHANG H M. The study on algae and the information of toxins in Qingcaosha Reservoir[D]. Shanghai: Fudan University, 2012. |
| [17] | 蒋增辉. 青草沙水库浮游藻类的调查及控制[J]. 净水技术, 2012, 31(5): 9-14. JIANG Z H. Investigation and control of phytoplankton in Qingcaosha Reservoir[J]. Water Purification Technology, 2012, 31(5): 9-14. |
| [18] | 李嘉海, 王绍祥, 朱宜平, 等. 青草沙水库下游排水闸口内浮游藻类群落变化调查[J]. 净水技术, 2014, 33(s1): 30-34. LI J H, WANG S X, ZHU Y P, et al. Survey of changes for phytoplankton algae community inside the downstream gate in Qingcaosha Reservoir[J]. Water Purification Technology, 2014, 33(s1): 30-34. |
| [19] | 胡鸿钧. 中国淡水藻类[M]. 上海: 上海科学技术出版社, 1980. HU Z J. The freshwater algae of China[M]. Beijing: Science Press, 1980. |
| [20] | 王全喜. 上海九段沙湿地自然保护区及其附近水域藻类图集[M]. 北京: 科学出版社, 2008. WANG Q X. Altas of algae in Shanghai Jiuduansha Wetland Nature Reserve and its adjacent waters[M]. Beijing: Science Press, 2008. |
| [21] | 徐兆礼, 陈亚瞿. 东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系[J]. 生态学杂志, 1989, 8(4): 13-15. XU Z L, CHEN Y Q. Aggregated intensity of doninant species of zooplankton in autumn in the East China Sea and Yellow Sea[J]. Journal of Ecology, 1989, 8(4): 13-15. |
| [22] | SHANNON C E, WEAVER W. The mathematical theory of communication[M]. London: University of Illinois Press, 1949. |
| [23] | MARGALEF D R. Information theory in ecology[J]. General System, 1958, 3: 37-71. |
| [24] | 沈会涛, 刘存歧. 白洋淀浮游植物群落及其与环境因子的典范对应分析[J]. 湖泊科学, 2008, 20(6): 773-779. SHEN H T, LIU C Q. Canonical correspondence analysis of phytoplankton community and its environmental factors in the Lake Baiyangdian[J]. Journal of Lake Sciences, 2008, 20(6): 773-779. |
| [25] | SHAPIRO J. Blue-green algae: why they become dominant[J]. Science, 1973, 179(4071): 382-384. |
| [26] | 秦伯强, 王小冬, 汤祥明, 等. 太湖富营养化与蓝藻水华引起的饮用水危机原因与对策[J]. 地球科学进展, 2007, 22(9): 896-906. QIN B Q, WANG X D, TANG X M, et al. Drinking water crisis caused by eutrophication and cyanobacterial bloom in Lake Taihu: cause and measurement[J]. Advances in Earth Science, 2007, 22(9): 896-906. |
| [27] | 周俊丽, 刘征涛, 孟伟, 等. 长江口营养盐浓度变化及分布特征[J]. 环境科学研究, 2006, 19(6): 139-144. ZHOU J L, LIU Z T, MENG W, et al. The characteristics of nutrients distribution in the Yangtze River Estuary[J]. Research of Environmental Sciences, 2006, 19(6): 139-144. |
| [28] | 黄自强, 暨卫东. 长江口水中总磷、有机磷、磷酸盐的变化特征及相互关系[J]. 海洋学报:中文版, 1994, 16(1): 51-60. HUANG Z Q, JI W D. Variation characteristics of total phosphorus, organic phosphorus, phosphate and their relationship in the esturay of the Yangtze River water[J]. Acta Oceanologica Sinica, 1994, 16(1): 51-60. |
| [29] | 赵文. 水生生物学[M]. 北京: 中国农业出版社, 2005. ZHAO W. Hydrobiology[M]. Beijing: Chinese Agriculture Press, 2005. |
| [30] | FAY P. Viability of akinetes of the planktonic cyanobacterium Anabaena circinalis [J]. Proceedings of the Royal Society of London. Series B. Biological Sciences, 1988, 234(1276): 283-301. |
| [31] | 蒋燮治, 堵南山, 中国科学院动物研究所甲壳研究组. 中国动物志 节肢动物门 甲壳纲 淡水枝角类[M]. 北京: 科学出版社, 1979. JIANG X Z, DU N S. Fauna Sinica: Freshwater Cladocera[M]. Beijing: Science Press, 1979. |
| [32] | 郭劲松, 陈杰, 李哲, 等. 156m蓄水后三峡水库小江回水区春季浮游植物调查及多样性评价[J]. 环境科学, 2008, 29(10): 2710-2715. GUO J S, CHEN J, LI Z, et al. Investigation of phytoplankton and assessment of algal diversity on backwater area of Xiaojiang river in three gorges reservoir after its initiate impounding to the water level of 156m in spring[J]. Environmental Sciences, 2008, 29(10): 2710-2715. |
| [33] | 刘小梅, 王晓鹏, 关许为, 等. 青草沙避咸蓄淡水库库容与特征水位研究[J]. 水利水电技术, 2009, 40(7): 5-8. LIU X M, WANG X P, GUAN X W, et al. Study on storage capacity and characteristic water level for Qingcaosha Reservoir[J]. Water Resources and Hydropower Engineering, 2009, 40(7): 5-8. |
| [34] | 陈永灿, 俞茜, 朱德军, 等. 河流中浮游藻类生长的可能影响因素研究进展与展望[J]. 水力发电学报, 2014, 33(4): 186-195. CHEN Y C, YU Q, ZHU D J, et al. Possible influencing factors on phytoplankton growth and decay in rivers: review and perspective[J]. Journal of Hydroelectric Engineering, 2014, 33(4): 186-195. |
| [35] | 孔繁翔, 高光. 大型浅水富营养化湖泊中蓝藻水华形成机理的思考[J]. 生态学报, 2005, 25(3): 589-595. KONG F X, GAO G. Hypothesis on cyanobacteria bloom-forming mechanism in large shallow eutrophic lakes[J]. Acta Ecological Sinica, 2005, 25(3): 589-595. |
| [36] | 吴晓辉, 李其军. 水动力条件对藻类影响的研究进展[J]. 生态环境学报, 2010, 19(7): 1732-1738. WU X H, LI Q J. Reviews of influences from hydrodynamic condition on algae[J]. Ecology and Environmental Sciences, 2010, 19(7): 1732-1738. |
| [37] | RENOLDS C S. The ecology of phytoplankton[M]. Cambridge: Cambridge University Press, 2006: 535. |
| [38] | RENOLDS C S. The ecology of freshwater phytoplankton[M]. Cambridge: Cambridge University Press, 1984:1-384. |
| [39] | 刘霞, 陆晓华, 陈宇炜. 太湖北部隐藻生物量时空动态[J]. 湖泊科学, 2012, 24(1): 142-148. LIU X, LU X H, CHEN Y W. Temporal and spatial dynamics of Cryptophytes biomass in the north of Lake Taihu[J]. Journal of Lake Sciences, 2012, 24(1): 142-148. |
| [40] | NALEWAJKO C, MURPHY T P. Effects of temperature, and availability of nitrogen and phosphorus on the abundance of Anabaena and Microcystis in Lake Biwa, Japan: an experimental approach[J]. Limnology, 2001, 2(1): 45-48. |
| [41] | GONS H J. On the light-limited growth of Scenedesmus protuberans Fritsch[D]. Amsterdams:University of Amsterdam, 1977. |
| [42] | CAREY C C, IBELINGS B W, HOFFMANN E P, et al. Eco-physiological adaptations that favour freshwater cyanobacteria in a changing climate[J]. Water Research, 2012, 46(5): 1394-1407. |
| [43] | LYNCH M, SHAPIRO J. Predation, enrichment, and phytoplankton community structure[J]. Limnology and Oceanography, 2007, 26(1): 86-102. |
2. Shanghai Aquatic Enviromental Engineering Corporation Limited, Shanghai 200090, China
 2015, Vol. 24
2015, Vol. 24


