目前关于河蟹对植物性原料中营养素的利用性已有不少研究报道[1, 2],但对于其中抗营养物质的研究还很不充分。非淀粉多糖(Non-Starch Polysacharides,NSPs)是植物性原料中含量较高的一种抗营养成分,在蛋白质饲料如豆粕、菜粕、棉粕的干物质中,NSPs含量分别达到21.7%、22.0%、28.3%,在能量饲料如小麦、麸皮、玉米麸质的干物质中,NSPs含量分别达到11.9%、37.4%、35.1%[3]。单胃动物因为缺乏相关的消化酶而无法利用它[3],但研究发现NSPs的存在会降低养殖动物的生长性能,抑制营养物质的消化吸收率[4, 5, 6]。
根据其在水中的溶解性,NSPs可分为水溶性NSPs (SNSPs)和水不溶性NSPs (INSPs)。普遍认为SNSPs具高较强的抗营养作用,因其具有较高的粘性[3]。食糜粘性的增加导致消化效率低[5]、吸收速度慢[6]、消化道分泌作用增强[7],从而影响营养物质的利用和养殖动物生长。然而,METZLER-ZEBELI等[8, 9]的研究指出,NSPs的抗营养作用与其化学结构(种类)有关,而粘性不足以解释其对猪肠道微生物和矿物质利用性的影响。此外,REFSTIE等 [10]发现NSPs对不同单胃动物的影响不同。因此,结合养殖动物的生理特点研究不同化学结构的NSPs的生理效应具有重要的实践意义。
本研究比较了水溶性果胶(SP)、水不溶性果胶(ISP)、水溶性木聚糖(SX)和水不溶性木聚糖(ISX)4种NSPs对河蟹生长、体成分、能量和营养物质保留率、血脂及消化酶的影响,旨在揭示NSPs的抗营养作用机制,为河蟹饲料配方的完善提供理论支撑。
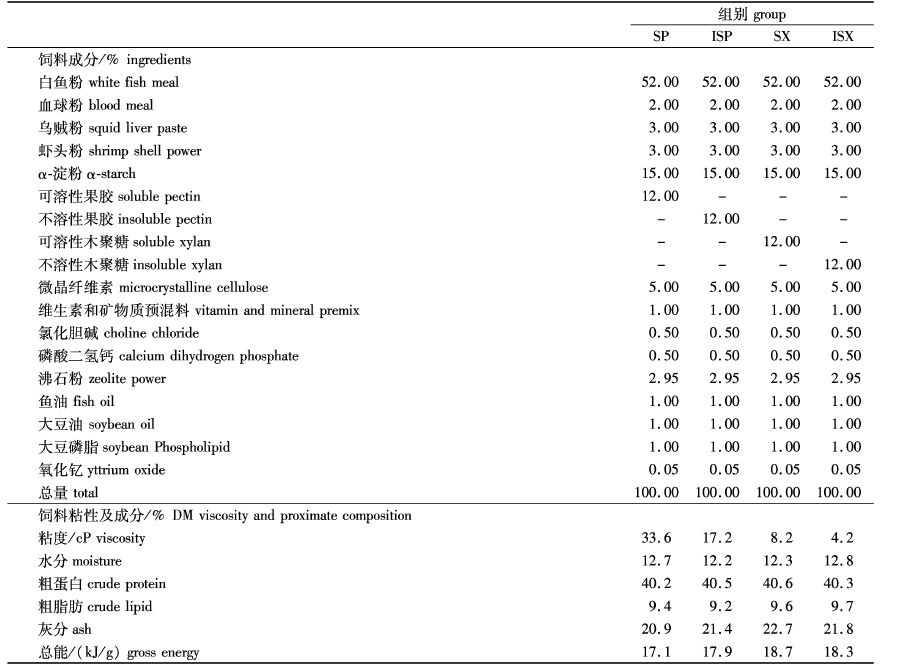
1 材料与方法 1.1 实验饲料实验所用的果胶和木聚糖购自合肥兰旭生物技术有限公司,SP含量为85.9%,ISP含量为81.1%,SX含量为78.7%,ISX含量为88.1%。鱼粉为白鱼粉,由北京桑普生物技术有限公司提供,粗蛋白含量为68%。豆油为市售一级大豆油。其余原料均由鑫裕饲料(苏州)有限公司提供。依据河蟹的营养需求[11],设计了粗蛋白40%、粗脂肪9%、NSP 12%的4种饲料(分别命名为SP组、ISP组、SX组和ISX组),实验饲料配方及营养水平见表1。所有原料粉碎过60目筛,按配方称取混匀后加入20%质量的蒸馏水,用电动绞肉机挤压成直径2 mm的条状物,然后手工切成5 mm左右的颗粒,室温下电风扇吹至水分含量12%左右,于-20 ℃冰箱中保存。
|
表1 实验饲料配方、粘性和营养组成 Tab. 1 Formulation and proximate composition of experimental diets and their viscosity |
饲料概略养分分析参照AOAC(2000)的方法[12]:水分采用105 ℃恒温干燥法测定,粗蛋白采用凯氏定氮法测定,粗脂肪采用索氏抽提法测定,粗灰分采用马弗炉550 ℃灼烧法测定。总能采用XRY-1C氧弹式热量计(上海吉昌地质仪器有限公司)测定。饲料粘度测定参照王杰[13]的方法,将饲料粉碎至过60目筛网后,准确称取50.0 g饲料,放入500 mL三角烧瓶中,加入250 mL 0.1 mol/L氢氧化钠混匀,在40 ℃恒温摇床中提取4 h后,5 000 r/min离心15 min,取上清液采用NDJ-8S数显粘度计(选用1号转子,60 r/min)测定饲料的绝对粘度值。
1.2 实验设计和养殖管理养殖实验在苏州大学东校区养鱼房进行。实验蟹来自阳澄湖现代农业产业园的苗种基地。选体格健壮的蟹苗30只放入直径1.2 m、高1 m的圆缸中暂养。缸内放置长20 cm的波纹管供实验蟹隐蔽。用商品饲料驯养一周,使其适应实验环境及实验饲料。暂养期间剔除死亡的河蟹并相应补全。一周后将实验蟹饥饿处理24 h,重新清点、称重后正式开始实验。实验蟹平均体质量为(1.6±0.7)g,养殖于16个500 L的圆缸中,每缸30个。每种饲料投喂4缸河蟹,随机分配。每天分别于早上7:00(30%)和下午5:00(70%)饱食投喂,上午10:00后排污一次,每两周检测蟹池水质状况。养殖期间水中溶氧5 mg/L以上,pH在7.2~8.0之间,氨氮在0.2 mg/L以下,亚硝酸盐0.1 mg/L以下,硫化氢在0.001 mg/L以下。养殖时间从8月20号到11月25号,为期13周。
1.3 样品采集与分析 1.3.1 生长和体成分分析样品采集前禁食24 h,迅速捕出所有的河蟹,称重并计数,计算成活率和特定生长率。另取3只河蟹用作全蟹成分分析(分析方法同饲料养分测定),并计算能量和营养物质保留率。
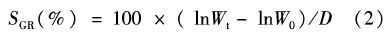
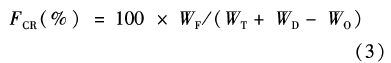
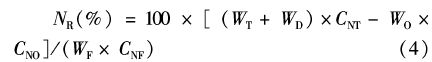
生长实验结束后,每缸选取6只螃蟹,用无菌注射器于其步足基部软膜处进针收集血淋巴1 mL于1.5 mL EP管中,4 ℃静置12 h后,3 500 r/min离心15 min,取上清,液氮速冻后于-80 ℃保存待测。
血清胆固醇和甘油三脂含量采用雅培全自动生化分析仪测定。
1.3.3 淀粉酶和脂肪酶活性分析每缸随机选取6只河蟹,迅速在冰上解剖,将同缸河蟹的肝胰腺混合均匀,取1 g混匀的肝胰腺,加入4倍体积的生理盐水,匀浆后3 500 r/min、4 ℃离心10 min。上清用液氮速冻后-80 ℃保存,备测淀粉酶(AMS) 和脂肪酶(LPS)。
淀粉酶的活性和总蛋白含量测定采用南京建成生物工程研究所生产的试剂盒,脂肪酶的测定参照白燕等[14]的方法使用聚乙烯醇橄榄油乳化液水解法测定。
1.4 数据处理所有数据表示为平均数±标准差,经单因素方差分析后Duncan’s多重比较。统计分析采用SPSS 21.0软件,显著水平设为P <0.05。
2 结果 2.1 不同水溶性的果胶和木聚糖对饲料粘性的影响添加NSP后对饲料粘度的影响较大,添加水溶性果胶后SP组饲料粘度达到33.6 cP,添加水不溶性果胶的ISP组粘度约为SP组的一半,为17.2 cP。相对于果胶而言,木聚糖对饲料粘度的影响较小。添加水溶性木聚糖后,SX组饲料粘性较低只有8.2 cP。水不溶性木聚糖对饲料粘性的影响最小,ISX组粘性仅为4.2 cP。4种饲料的粘性差异明显。
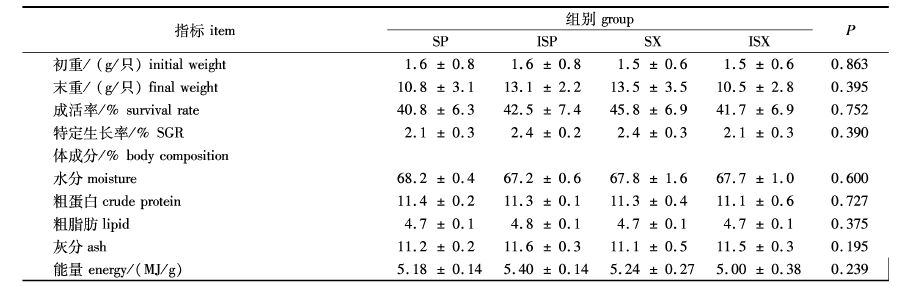
2.2 不同水溶性的果胶和木聚糖对中华绒螯蟹生长和体成分的影响经过13周的饲养,每只河蟹体质量由开始的1.6 g增加到10.5 g以上(表2)。饲喂含有不同水溶性的果胶和木聚糖,中华绒螯蟹的存活率、特定生长率和体成分差异不显著(P > 0.05,表2)。
|
表2 不同水溶性的果胶和木聚糖对河蟹生长和体成分的影响 Tab. 2 Effect of different soluability of pectin and xylan on growth and body composition of Chinese mitten crab |
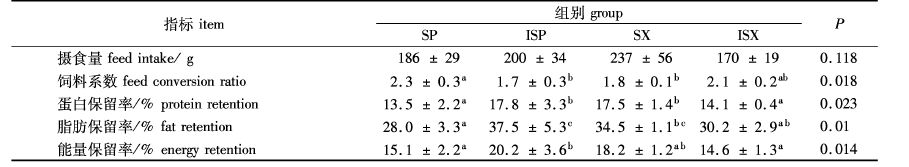
由表3可知,各组河蟹摄食量差异不显著(P>0.05)。不同饲料饲养中华绒螯蟹后饵料系数、蛋白保留率、脂肪保留率和能量保留率的差异显著(P<0.05)。具体表现为SP组的饵料系数高于ISP组和SX组(P<0.05),ISX组与其他的3组差异不显著(P>0.05)。SP组的蛋白保留率、 脂肪保留率和能量保留率低于ISP组(P<0.05),而SX组的蛋白保留率高于ISX组(P<0.05);ISP组与SX组的蛋白保留率、脂肪保留率和能量保留率差异不显著(P>0.05)。
|
表3 不同水溶性的果胶和木聚糖对河蟹饲料利用性的影响 Tab. 3 Impact of different soluability of pectin and xylan on feed utilization of Chinese mitten crab |
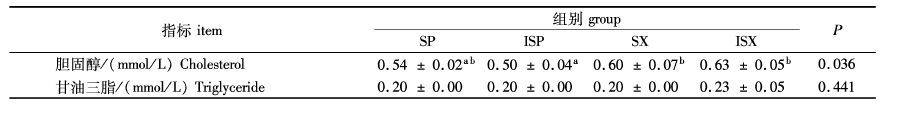
无论果胶还是木聚糖,溶解性对血清总胆固醇的影响不显著(P>0.05),但ISP组低于SX组和ISX组(P<0.05,表4)。甘油三脂在实验组之间差异不显著(P>0.05,表4)。
|
表4 不同水溶性的果胶和木聚糖对河蟹血清指标的影响 Tab. 4 Effect of different soluability of pectin and xylan on serum indexes of Chinese mitten crab |
由表5可知,不同水溶性的果胶和木聚糖对河蟹肝胰腺淀粉酶和脂肪酶活力的影响差异不显著(P>0.05)。

|
表5 不同水溶性的果胶和木聚糖对河蟹肝胰脂肪酶和淀粉酶活性的影响 Tab. 5 Effect of different soluability of pectin and xylan on activity of lipase and amylase in hepatopancreas |
本实验中未观察到NSPs对河蟹生长和消化酶活性的显著影响,但营养保留率各组差异显著(P<0.05,表3)。关于NSP对饲料营养物质利用性的影响已有不少研究报道。AMIRKOLAIE等[15]用含有8%瓜尔胶的饲料饲养尼罗罗非鱼(Oreochromis niloticus L.) 8周,发现瓜尔胶组罗非鱼特定生长率显著低于对照组,干物质、有机物、蛋白质和脂肪消化吸收率也显著降低。LEENHOUWERS等[6]用含有0、4%、8%瓜尔胶的饲料饲养非洲鲶鱼(Clarias gariepinus)5周,发现与对照组相比,添加瓜尔胶后对非洲鲶鱼的特定生长率没有显著影响,但是干物质、蛋白质和能量的消化率显著下降。NSPs对营养物质利用性的影响被认为与其粘性有关,肠道食糜粘度的增加导致营养物质被裹胁在其中[16],肠道内的消化酶无法与底物充分接触而发挥作用[17],同时肠道粘膜不动水层(unstirred water layer)厚度增加,降低营养物质的吸收[18]。本实验中,SP组饲料的粘性为33.6 cP,高于ISP组饲料的17.2 cP,SP组的蛋白、脂肪和能量保留率低于ISP组(P<0.05),与上述报道相支持,提示粘性太高影响河蟹对饲料中营养物质的利用性。
然而,SX组饲料的粘性(8.2 cP)高于ISX组(4.2 cP),其蛋白保留率却高于ISX组(P<0.05),脂肪和能量保留率也高于ISX,差异不显著。这些结果提示当饲料粘性较低时,河蟹对饲料利用性不会随着粘性提高而下降。相反,由于饲料粘性下降,入水后容易溃散,导致溶失的营养成分增加。这可能是SX组营养物质和能量保留率反而高于ISX组的原因之一。
NSP与水分子相互结合形成胶体,产生一定的粘性。但水分含量达到一定水平后,粘性随水分含量增加而降低[19, 20]。水生动物长期生活在水环境中,肠道末端也直接暴露在水中,肠道食糜水分含量一般高于陆生动物[4, 10, 21],因此,饲喂含有相同NSP的饲料,水生动物食糜的粘性可能会低于陆生动物,从而使水生动物对NSP的抗营养作用不如陆生动物敏感[22]。本实验结果表明,ISP组与SX组的营养及能量保留率较高,提示饲料粘度在8.2~17.2 cP之间可能比较有利于河蟹对饲料的利用。
本实验中观察到SP组摄食量有低于ISP组的趋势,这可能也与SP组饲料较高的粘性有关,粘性会影响胃肠道排空时间,高粘性饲料导致胃肠道排空时间延长[3],从而导致摄食量下降[23]。但SX组河蟹摄食量有高于ISX组的趋势。这可能与食糜体积有关,由于SX溶解性高,河蟹摄入相同质量的SX组饲料后食糜体积较ISX组小,饱腹感低,因而摄食量增加。
已有研究表明NSP能与胆汁酸结合,导致胆汁酸直接被排出体外[24],最终减少血液中的胆固醇水平。本次研究结果显示,NSP的溶解性对河蟹血清总胆固醇的影响不显著(P > 0.05),但ISP组低于SX组和ISX组(P <0.05,表4),提示不同种类NSP降低胆固醇的功效不同。此外,虽然ISP组血清胆固醇水平最低,但能量和营养保留率较高。这可能与河蟹特殊的消化吸收机制有关。河蟹没有胆囊,脂类的乳化及吸收可能不依赖胆汁酸,因而NSPs对胆固醇的影响不足以影响到饲料脂肪的吸收利用。
| [1] | 刘畅,周家春.植物多酚抗氧化性研究[J].粮食与油脂, 2011(2):43-46.LIU C, ZHOU J C. Research on antioxidation of plant polyphenols[J]. Cereals & Oils, 2011(2):43-46. |
| [2] | 汪帆,郑文寅,黄建华,等. 20个小麦品种(系)籽粒LOX活性和类胡萝卜素含量及全麦粉色泽的研究[J].麦类作物学报, 2012, 32(1):68-73.WANG F, ZHENG W Y, HUANG J H, et al. Lipoxygenase activity, carotenoids content and wholemill colors in grains of twenty wheat varieties[J]. Journal of Triticeae Crops, 2012, 32(1):68-73. |
| [3] | SINHA A K, KUMAR V, MAKKAR H P S, et al. Non-starch polysaccharides and their role in fish nutrition-A review[J]. Food Chemistry, 2011, 127(4):1409-1426. |
| [4] | LEENHOUWERS J I, TER Veld M, VERRETH J A J, et al. Digesta characteristiscs and performance of African catfish (Clarias gariepinus) fed cereal grains that differ in viscosity[J]. Aquaculture, 2007, 264(1/4):330-341. |
| [5] | BACH KNUDSEN K E, CANIBE N. Breakdown of plant carbohydrates in the digestive tract of pigs fed on wheat-or oat-based rolls[J]. Journal of the Science of Food and Agriculture, 2000, 80(8):1253-1261. |
| [6] | LEENHOUWERS J I, ADJEI-BOATENG D, VERRETH J A J, et al. Digesta viscosity, nutrient digestibility and organ weights in African catfish (Clarias gariepinus) fed diets supplemented with different levels of a soluble non-starch Polysaccharide[J]. Aquaculture Nutrition, 2006, 12(2):111-116. |
| [7] | LONGLAND A C, LOW A G. Digestion of diets containing molassed or plain sugar-beet pulp by growing pigs[J]. Animal Feed Science and Technology, 1989, 23(1/3):67-78. |
| [8] | METZLER-ZEBELI B U, HOODA S, ZIJLSTRA R T, et al. Dietary supplementation of viscous and fermentable non-starch polysaccharides (NSP) modulates microbial fermentation in pigs[J]. Livestock Science, 2010, 133(1/3):95-97. |
| [9] | METZLER-ZEBELI B U, HOODA S, MOSENHIN R, et al. Fermentation affects mineral flux in the gastrointestinal tract of pigs fed diets supplemented with different viscous and fermentable non-starch polysaccharides (NSP)[J]. Livestock Science, 2010, 134(1/3):82-84. |
| [10] | REFSTIE S, SVIHUS B, SHEARER K D, et al. Nutrient digestibility in Atlantic salmon and broiler chickens related to viscosity and non-starch polysaccharide content in different soyabean products[J]. Animal Feed Science and Technology, 1999, 79(4):331-345. |
| [11] | 陈立侨,李二超.中华绒螯蟹营养需求的研究现状和进展[J].饲料工业, 2009, 30(10):1-6.CHEN L Q, LI E C. Current situation and development on nutrition requirement of Eriocheir sinensis [J]. Feed Industry, 2009, 30(10):1-6. |
| [12] | AOAC International. Official Methods of Analysis of AOAC International[M]. 17th ed. Gaithersburg, MD:AOAC International, 2007. |
| [13] | 王杰.黏度法评定小麦非淀粉多糖的含量及低黏度小麦与酶制剂在仔猪日糖中应用[D].呼和浩特:内蒙古农业大学, 2003:17-19.WANG J. Assess quantity of non-starch polysaccharide in wheat by viscosity and apply low viscoid wheats and enzymes in piglets diets[D]. Hohhot:Inner Mongolia Agriculture University, 2003:17-19. |
| [14] | 白燕,王维新.刺参肠道蛋白酶、淀粉酶、脂肪酶与纤维素酶活性的测定方法[J].饲料工业, 2012, 33(20):28-32.BAI Y, WANG W X. Determination of japonicus gut protease, amylase, lipase and cellulase activity[J]. Feed Industry, 2012, 33(20):28-32. |
| [15] | AMIRKOLAIE A K, LEENHOUWERS J I, VERRETH J A J, et al. Type of dietary fibre (soluble versus insoluble) influences digestion, faeces characteristics and faecal waste production in Nile tilapia (Oreochromis niloticus L.)[J]. Aquaculture Research, 2005, 36(12):1157-1166. |
| [16] | FAGBENRO O, JAUNCEY K. Water stability, nutrient leaching and nutritional properties of moist fermented fish silage diets[J]. Aquacultural Engineering, 1995, 14(2):143-153. |
| [17] | CHOCT M, HUGHES R J, WANG J, et al. Increased small intestinal fermentation is partly responsible for the anti-nutritive activity of non-starch polysaccharides in chickens[J]. British Poultry Science, 1996, 37(3):609-621. |
| [18] | DE LANGE C F M, MOUGHAN P J, VERSTEGEN M W A, et al. Characterisation of the non-starch polysaccharides[M]//MOUGHAN P J, VERSTEGEN M W A, VISSER-REYNEVELD M I, et al. Feed Evaluation:Principles and Practice. Wageningen:Wageningen Pers, 2000:77-92. |
| [19] | CASAS J A, MOHEDANO A F, GARCÍA-OCHOA F. Viscosity of guar gum and xanthan/guar gum mixture solutions[J]. Journal of the Science of Food and Agriculture, 2000, 80(12):1722-1727. |
| [20] | MCRORIE J, PEPPLE S, RUDOLPH C. Effects of fiber laxatives and calcium docusate on regional water content and viscosity of digesta in the large intestine of the pig[J]. Digestive Diseases and Sciences, 1998, 43(4):738-745. |
| [21] | JENSEN B B, JØRGENSEN H. Effect of dietary fiber on microbial activity and microbial gas production in various regions of the gastrointestinal tract of pigs[J]. Applied and Environmental Microbiology, 1994, 60(6):1897-1904. |
| [22] | LEENHOUWERS J I, ORTEGA R C, VERRETH J A J, et al. Digesta characteristics in relation to nutrient digestibility and mineral absorption in Nile tilapia (Oreochromis niloticus L.) fed cereal grains of increasing viscosity[J]. Aquaculture, 2007, 273(4):556-565. |
| [23] | IJI P A, SAKI A A, TIVEY D R. Intestinal development and body growth of broiler chicks on diets supplemented with non-starch polysaccharides[J]. Animal Feed Science and Technology, 2001, 89(3/4):175-188. |
| [24] | IKEGAMI S, TSUCHIHASHI F, HARADA H, et al. Effect of viscous indigestible polysaccharides on pancreatic-biliary secretion and digestive organs in rats[J]. The Journal of Nutrition, 1990, 120(4):353-360. |
 2015, Vol. 24
2015, Vol. 24


