2. 上海市水产养殖工程技术研究中心, 上海 201306;
3. 上海高校知识服务平台 上海海洋大学水产动物遗传育种协同创新中心, 上海 201306;
4. 上海鱼跃水产专业合作社, 上海 201611;
5. 遵义市水产站, 贵州 遵义 563000
河蟹学名中华绒螯蟹(Eriocheir sinensis),隶属于节肢动物门(Arthropoda)、甲壳纲(Crustacea)、十足目(Decapoda)、方蟹科(Grapsidae)、绒螯蟹属(Eriocheir)。其肉质鲜美,营养丰富,自古以来就是中国食品的传统美食佳肴,深受人民的欢迎。较高的经济价值使河蟹养殖面积迅速扩大,产量不断提高,但传统养殖技术造成水体富营养化,不仅危及养蟹产业的发展,而且影响人类生活和环境安全[1]。
河蟹生态养殖技术通过保持水域养殖生态系统内消费者、分解者和生产者三者之间物质循环和能量流动的平衡,建立和管理一个能实现生态上自我维持低输入、经济上可行的养殖生态系统,确保长时间内不对周围环境造成明显不利影响的养殖方式[1]。这种生态友好型养殖模式受到国内外的广泛关注。
吴伟等[2]的实验结果表明河蟹生态养殖不会对外界水环境产生不良影响;戴恒鑫等[3]认为河蟹生态养殖池塘大量水生植物对N、P的吸收效果显著,池塘水质显著优于水源区,但是对于河蟹生态养殖池塘浮游生物的研究较少。后生浮游动物作为食物链中不可缺少的一环,它们在物质转化、能量流动、信息传递等生态过程中起着至关重要的作用[4]。后生浮游动物种类组成和生物量的变化可以快速而精确地反映出水体的环境质量变化,而其生物多样性也是水生生态系统的一项重要评价指标[5, 6]。通过对河蟹生态养殖池塘后生浮游动物群落的研究,可提高河蟹养殖池塘的生态效应,促进河蟹产业可持续发展,为生态养殖生产推广提供有力的理论依据。
1 材料与方法 1.1 实验地点实验在上海市松江区泖港镇三泖水产养殖公司养殖场(北纬30°57′10.07″、东经121° 8′38.02″)进行,养殖地点位于黄浦江上游地区,池塘用水为黄浦江水。
1.2 实验材料实验幼蟹由上海鱼跃水产合作社养殖基地提供。每个养殖池塘已经连续多年进行河蟹养殖,3口实验池塘均为8 000 m2的标准化池塘。
1.3 实验设计 1.3.1 池塘处理河蟹养殖池规范整洁,最高水位约1.5 m,坡比1∶3,池底平坦,进排水方便。池塘南北走向,每个池塘前期(6月份前)分为种草区(80%)和暂养区(20%)。暂养区主要种植伊乐藻(Elodea nuttallii),种草区主要种植轮叶黑藻(Hydrilla verticillata),兼种伊乐藻、苦草(Vallisneria natans),水草总面积控制在池塘面积60%左右。
1.3.2 消毒与整塘2012年12月初商品蟹捕捞上市后,采用生石灰(1 125 kg/hm2)、漂白粉(225 kg/hm2)、茶粕(300 kg/hm2),水深1.0 m条件下消毒清塘,一天后排干池水,进行冻晒池底。
水草种植:1月中旬全池种植伊乐藻,面积为全池面积的30%左右,水位控制在30~40 cm。3月初播种苦草种子(7.5 kg/hm2),水位控制在 40~50 cm。4月中旬采用切茎分段扦插法种植轮叶黑藻,种植面积40%左右,水位控制在50~60 cm。种草时,水位控制为超出水草约10 cm。
1.3.3 苗种投放3月上旬投放规格100~160只/kg 幼蟹(9 000只/hm2)。4月初投放螺蛳(7 500 kg/hm2)。4月中旬投放规格为 0.50~0.75 kg/尾的鲢(30尾/hm2),0.4~0.5 kg/尾的鳙(15尾/hm2),鲢鳙投放时需注意适当提高池塘水位。6月下旬投放体长2 cm沙塘鳢(Odontobutis obscurus,3 000 尾/hm2)。7月上旬投放体长2.0 cm日本沼虾(Macrobrachium nipponense,22.5 kg/hm2)。
1.4 采样分析方法 1.4.1 实验方法实验于2013年4至10月进行,每月采样2次,采样时间为8:30-11:00,如遇雨天则延后采样。河蟹池采同一地点水位约为40 cm的水,同一池塘分别采4个点;水源选取3个地点,在水深40 cm处分别取水样。分别取水10 L经25号浮游生物网过滤,4%甲醛溶液固定,实验室镜检。浮游动物的鉴定参考文献[7, 8, 9, 10, 11]。
1.4.2 数据处理与分析生物多样性指数采用Shannon-Wiener 多样性指数(H′):种类和种类中个体分配上的均匀性的综合指标,反映群落结构复杂程度和稳定性。其计算公式:
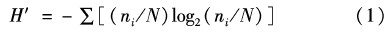
式中:ni为种i的个体数;N为所有物种的总个体数。

式中:ni为第i种的个体数;N为所有物种的总个体数; fi为第i种的出现频率。Y>0.02为优势种。
采用 SPSS 18.0 软件包进行数据统计分析。河蟹养殖池与水源间平均密度、平均生物量和生物多样性指数的比较均采用单因素方差分析(One-Way ANOVA)。
2 结果与分析 2.1 河蟹养殖池与水源后生浮游动物的物种组成与优势种共鉴定出后生浮游动物59种:轮虫25种,枝角类19种,桡足类15种。其中轮虫的优势种为萼花臂尾轮虫(Brachionus calyciflorus)、螺形龟甲轮虫(Keratella cochlearis)、裂痕龟纹轮虫(Anuraeopsis fissa)、暗小异尾轮虫(Trichocerca pusill)、针簇多肢轮虫(Polyarthra trigla)和尾三肢轮虫(Filinia major);枝角类优势种为长肢秀体溞(Diaphanosoma leuchtenbergianum)、短尾秀体溞(Diaphanosoma brachyurun)、蚤状溞(Daphnia pulex)、长额象鼻溞(Bosmina longirostris)和圆形盘肠溞(Chydorus sphaericus);桡足类优势种为锯缘真剑水蚤(Eucyclops serrulatus)、跨立小剑水蚤(Microcyclops varicans)和广布中剑水蚤(Mesocyclops leuckarti)。河蟹池后生浮游动物种类数明显高于水源(表1)。
| 表 1 河蟹养殖池和水源后生浮游动物的种类组成 Tab.1 Composition of metazoan zooplankton in crab pond and river water |
河蟹养殖池后生浮游动物平均密度与水源变化趋势基本一致,后生浮游动物平均密度变化更为剧烈。
河蟹池轮虫平均密度分别在4月29日和6月29日与水源差异显著(P<0.05),见图1。枝角类平均密度分别在5月14日至6月29日和10月15日与水源差异显著(P<0.05),见图2。桡足类平均密度分别在4月29日、5月30日至6月29日、7月29日和10月15日与水源差异显著(P<0.05),见图3。后生浮游动物平均密度分别在4月29日、5月30日至6月29日与水源差异显著(P<0.05),见图4。

|
图 1 河蟹养殖池和水源轮虫平均密度变化 Fig. 1 Variation of the average density ofRotifera in crab ponds and water source |

|
图 2 河蟹养殖池和水源枝角类平均密度变化 Fig. 2 Variation of the average density ofCladocera in crab ponds and water source |

|
图 3 河蟹养殖池和水源桡足类平均密度变化 Fig. 3 Variation of the average density ofCopepoda in crab ponds and water source |

|
图 4 河蟹养殖池和水源后生浮游动物平均密度变化 Fig. 4 Variation of the average density ofthe metazoam zooplankton in crab ponds and water source |
在采样期间,河蟹养殖池后生浮游动物平均生物量多数情况下高于水源。8月14日和8月29日轮虫平均生物量小于水源;枝角类平均生物量在采样期间均大于水源;9月15日桡足类平均生物量小于水源。
河蟹池轮虫平均生物量分别在4月29日和6月29日与水源差异显著(P<0.05),见图5。枝角类平均生物量分别在5月14日至6月29日和10月15日与水源差异显著(P<0.05),见图6。桡足类平均生物量分别在6月14日和6月29日与水源差异显著(P<0.05),见图7。后生浮游动物平均生物量分别在5月14日、6月14日和6月29日与水源差异显著(P<0.05),见图8。

|
图 5 河蟹养殖池和水源轮虫平均生物量变化 Fig. 5 Variation of the average biomass ofRotifera in crab ponds and water source |

|
图 6 河蟹养殖池和水源枝角类平均生物量变化 Fig. 6 Variation of the average biomass ofCladocera in crab ponds and water source |

|
图 7 河蟹养殖池和水源桡足类平均密度变化 Fig. 7 Variation of the average biomass ofCopepoda in crab ponds and water source |

|
图 8 河蟹养殖池和水源后生浮游动物平均密度变化 Fig. 8 Variation of the average biomass ofthe metazoan zooplankton in crab ponds and water source |
河蟹养殖池后生浮游动物Shannon-Wiener生物多样性指数大多数时间高于水源,变化趋势基本与水源一致。由于河蟹养殖池后生浮游动物种类丰富,群落稳定性高,食物充足,所以多样性指数稳定增加。水源后生浮游动物结构稳定性差,多样性指数变化频繁。河蟹池轮虫多样性指数分别在4月29日和6月29日与水源差异显著(P<0.05),见图9。枝角类多样性指数在5月30日与水源差异显著(P<0.05),见图10。桡足类多样性指数分别在4月29日、5月30日和6月29日与水源差异显著(P<0.05),见图11。后生浮游动物多样性指数分别在4月29日、5月30日至6月29日、7月29日和8月14日与水源差异显著(P<0.05),见图12。

|
图 9 河蟹养殖池和水源轮虫Shannon-Wiener多样性指数变化 Fig. 9 Variation of the Shannon-Wiener diversity index of Rotifera in crab ponds and water source |

|
图 10 河蟹养殖池和水源枝角类Shannon-Wiener多样性指数变化 Fig. 10 Variation of the Shannon-Wiener diversity index of Cladocera in crab ponds and water source |

|
图 11 河蟹养殖池和水源桡足Shannon-Wiener多样性指数变化 Fig. 11 Variation of the Shannon-Wiener diversity index of Copepoda in crab ponds and water source |

|
图 12 河蟹养殖池和水源后生浮游动物Shannon-Wiener多样性指数变化 Fig. 12 Variation of the shannon-Wiener deversity index of the metazoan zooplankton in crab ponds and water source |
上海泖港地区生态养殖河蟹池共鉴定出后生浮游动物52种,后生浮游动物种类数明显高于水源,究其原因与生态养殖模式有关。江河中枝角类的种类和数量都不多,主要栖息于湖泊中,尤其在水草丰富的沿岸带种类特别丰富[11]。泖港地区河蟹池种植了轮叶黑藻、伊乐藻和苦草,水草总面积达到池塘面积60%左右,为习居草丛生境的后生浮游动物提供了栖息地和繁殖场所[12]。而水源为开放水域,水流较快、水位上下浮动较大,且缺少后生浮游动物隐藏的水草,不利于习居草丛生境的后生浮游动物生存。故后生浮游动物种类数量和密度要小于河蟹生态养殖池。
3.2 后生浮游动物群落结构与环境因子的关系优势种的种类数和数量对群落结构的稳定性有重要影响,其种类数越多且优势度越小,则群落结构越复杂稳定[15]。本次调查共鉴定出优势种16种,且存在明显的季节更替现象。说明生态养殖池塘的后生浮游动物群落结构处于相对稳定的状态。
多数学者认为决定轮虫种类季节演替的主要因子是水温[16, 17, 18]。轮虫密度高峰期一般出现在水温达到20 ℃以上,水温上升使卵的发育时间相对缩短,同时浮游植物、动物的尸体等在细菌的作用下很快形成碎屑[19],浮游植物大量繁殖,为草食轮虫大量繁殖提供了食物,占据了生态位。此次采样期间,轮虫的密度增长迅速,4月29日达到次高峰,且密度波动较大也是由于其繁殖迅速的特点所致。随着水温的升高,甲壳动物的生长发育加快,5月14日河蟹池水温达到23.5 ℃,适宜的温度使枝角类密度达到最高峰。桡足类密度4月29日达到次高峰,此时无节幼体和桡足幼体为其密度的主要贡献者。
枝角类和轮虫均为滤食性浮游动物,但枝角类较其他浮游动物有着更强的竞争能力[20, 21]。随着食物的大量消耗和空间的局限性,后生浮游动物之间相互排斥使得枝角类平均密度从5月14日开始下降。桡足类缺少了枝角类和轮虫的竞争,同时河蟹饵料的增加,为桡足类从5月14日至6月29日密度的增加提供了充足的食物。河蟹池后生浮游动物的密度高于水源,密度高峰持续的时间也要长于水源。
由于水温过高,水草于8月14日开始衰败死亡,并向水中释放有机碎屑。此后河蟹池后生浮游动物的变化规律与水源基本一致,丧失了生态效应。这与周露洪等[24]的研究结果相似,同样认为水草为河蟹养殖系统发挥生态效应的基础。
后生浮游动物生物量的变化规律与密度基本保持一致。枝角类平均生物量在5月14日和6月29日出现最高峰和次高峰,与生物量贡献较大的枝角类个体晶莹仙达溞和蚤状溞分别在5月和7月份大量繁殖密切相关。桡足类的生物量主要贡献者为无节幼体和桡足幼体。无节幼体被认为是桡足类生长过程中的瓶颈,由于其主要以滤食细菌为主,且滤食效率低,从而对食物资源的多寡比较敏感[25, 26]。桡足类平均生物量在4月29日至6月14日内持续增高,在6月29日出现最高峰。这与陈立婧等[12]在上海世博园后滩的监测结果相似。
营养盐N、P主要通过对藻类生物量的影响来间接影响枝角类的种类密度和生物量的分布[27]。P是浮游植物的主要限制因素,河蟹池中总磷含量一直都高于水源,原因是河蟹池投喂大量饵料,饵料源性的磷释放到养殖水体,从而为后生浮游动物的大量繁殖提供了充足的食物。
pH跟浮游动物的代谢生殖和发育等有密切的关系,水体pH能影响盐类的吸收。河蟹池的pH显著高于水源[3],但处于后生浮游动物生长范围内,故对后生浮游动物现存量影响不大。
3.3 螺蛳、鲢鳙和河蟹对后生浮游动物的影响螺蛳是河蟹成蟹阶段重要的摄食种类。螺蛳的投入不仅为中华绒螯蟹提供了活饵料,而且能净化水质,促进水草生长,为中华绒螯蟹提供良好的生活环境[28]。螺蛳通过摄食藻类、沉水植物和有机碎屑等[29]间接降低河蟹池的氮、磷含量,影响后生浮游动物现存量。
河蟹池由于鱼类放养密度很小,而且水草覆盖率达到60%,易于后生浮游动物隐藏。调查显示,河蟹池大型枝角类和桡足类都比较多,说明养殖池塘的鲢鳙鱼对浮游动物的影响不大。
河蟹在幼蟹阶段,大量摄食枝角类[30],成蟹阶段枝角类已经不能满足河蟹生长,转而趋向于更易于捕食的螺蛳和营养丰富的人工饵料。所以河蟹池中河蟹对于后生浮游动物的影响不大。
研究发现生态养殖池后生浮游动物的平均密度、平均生物量和Shannon-Wiener多样性指数都要高于水源,说明河蟹池后生浮游动物群落更复杂,生态系统更稳定。河蟹生态养殖模式中后生浮游动物种类丰富,生态系统结构复杂,相互作用密切。本文对河蟹池后生浮游动物群落结构变化的研究为河蟹生态养殖模式提供了理论依据。为了进一步巩固河蟹生态养殖的生态效益,水生植物的高温保护和河蟹成熟蜕壳期的投喂模式为今后研究的重要方向。
| [1] | 王武, 李应森.河蟹生态养殖[M].北京:中国农业出版社, 2010: 8-86.WANG W, LI Y S. Ecological culture of Chinese mitten crab aquaculture[M]. Beijing: Chinese Agricultural Press, 2010:8-86. |
| [2] | 吴伟, 范立民, 瞿建宏, 等. 池塘河蟹生态养殖对水体环境的影响[J]. 安全与环境学报, 2006, 6(4): 50-54.WU W, FAN L M, QU J H, et al. Effect of river crab eco-culture in ponds on water environment[J]. Journal of Safety and Enviroment, 2006, 6(4): 50-54. |
| [3] | 戴恒鑫, 马旭洲, 李应森, 等. 湖南大通湖河蟹池塘生态养殖模式对水质净化的试验研究 [J]. 安全与环境学报, 2012, 12(5): 89-94.DAI H X, MA X Z, LI Y S, et al. Purification effect of the ecological culture pattern of Eriocheir sinensis on the water quality in Datong Lake, Hunan[J]. Journal of Safety and Enviroment, 2012, 12(5): 89-94. |
| [4] | 刘超, 禹娜, 陈立侨, 等. 上海市西南城郊河道春季的浮游生物组成及水质评价[J]. 复旦学报:自然科学版, 2007, 46(6): 913-019.LIU C, YU N, CHEN L Q, et al. Zooplankton Communities and Bio-assessment of Five Rivers in the Outskirts Unit of Southwest Shanghai[J]. Journal of Fudan University:Natural Science, 2007, 46(6): 913-919. |
| [5] | 曾阳, 苗明升, 付秀娥, 等. 温榆河浮游动物多样性及水质改善效果评价[J]. 环境科学与技术, 2012, 35(3): 200-205.ZENG Y, MIAO M S, FU X E, et al. Evaluation of water quality improvement in Wenyuhe river based on the analysis of diversity of macro-zooplankton[J]. Environmental Science & Technology, 2012, 35(3): 200-205. |
| [6] | WHITMAN R L, NEVERS M B, GOODRICH M L, et al. Characterization of Lake Michigan coastal lakes using zooplankton assemblages[J]. Ecological Indicators, 2004, 4(4): 277-286. |
| [7] | 韩茂森, 束蕴芳.中国淡水生物图谱[M]. 北京:海洋出版社, 1995: 1-300.HAN M S, SHU Y F. Chinese freshwater organisms Atlas [M]. Beijing: China Ocean Press, 1995: 1-300. |
| [8] | 梁象秋, 方纪祖, 杨和荃. 水生生物学(形态和分类) [M]. 北京:中国农业出版社, 1995: 15-375.LIANG X Q, FANG J Z, YANG H Q. Hydrobiology(morphology and classification) [M]. Beijing: Chinese Agricultural Press, 1995: 15-375. |
| [9] | 王家楫. 中国淡水轮虫志[M]. 北京:科学出版社, 1961: 19-310.WANG J J. Chinese freshwater rotifers [M]. Beijing: Science Press, 1961: 19-310. |
| [10] | 沈嘉瑞. 中国动物志:淡水桡足类[M]. 北京:科学出版社, 1979: 15-264.SHEN J R. Chinese animal: Copepoda [M]. Beijing: Science Press, 1979: 15-264. |
| [11] | 蒋燮治, 堵南山. 中国动物志:淡水枝角类[M]. 北京:科学出版社, 1979 : 15-227.JIANG X Z, DU N S. Chinese animal: Cladocer [M]. Beijing: Science Press, 1979: 15-227. |
| [12] | 陈立婧, 吴艳芳, 景钰湘, 等. 上海世博园后滩湿地枝角类群落结构的周年动态 [J]. 应用生态学报, 2012, 23(10): 2863-2870.CHEN L J, WU Y F, JING Y X, et al. Annual dynamics of cladocera community structure in Backshore Wetland of Expo Garden, Shanghai[J]. Chinese Journal of Applied Ecology, 2012, 23(10): 2863-2870. |
| [13] | 日本生态学会环境问题专门委员会. 环境和指示生物(水域分册) [M]. 北京:中国环境科学出版社, 1987: 14-263. Environmental issues special committee of the ecological society of Japan. Environmental and biological indicator(water volume) [M]. Beijing: China Environmental Science Press, 1987: 14-263. |
| [14] | 沈韫芬, 章宗涉, 龚循矩, 等. 微型生物监测新技术[M]. 北京:中国建筑工业出版社, 1990: 18-483.SHEN Y F, ZHANG Z S, GONG X J, et al.New technology of micro biological monitoring [M]. Beijing: China Architecture & Building Press, 1990: 18-483. |
| [15] | DANILOV R, EKELUND N G A. The efficiency of seven diversity and one similarity indices based on phytoplankton data for assessing the level of eutrophication in lakes in central Sweden[J]. The Science of the Total Environment, 1999, 234(1-3): 15-23. |
| [16] | 温新利, 席贻龙, 张雷, 等. 青弋江芜湖段轮虫群落结构和物种多样性的初步研究[J]. 生物多样性, 2004, 12(4): 387-395.WEN X L, XI Y L, ZHANG L, et al. Community structure and species diversity of rotifer in the Wuhu section of the Qingyi River[J]. Biodiversity Science, 2004, 12(4): 387-395. |
| [17] | MAY L. Rotifer occurrence in relation to water temperature in Loch Leven, Scotland[J]. Hydrobiologia, 1983, 104(1): 311-315. |
| [18] | ARORA J, MEHRA N K. Seasonal dynamics of rotifers in relation to physical and chemical conditions of the river Yamuna (Delhi), India[J]. Hydrobiologia, 2003, 491(1-3): 101-109. |
| [19] | DITTY J G, SHAW R F. Larval development, distribution, and ecology of cobia Rachycentron canadum(Family: Rachycentridae) in the northern Gulf of Mexico[J]. Fishery Bulletin, 1992, 90(4): 668-677. |
| [20] | ANDERSON D H, BENKE A C. Growth and reproduction of the cladoceran Ceriodaphnia dubia from a forested floodplain swamp[J]. Limnology and Oceanography, 1994, 39(7): 1517-1527. |
| [21] | 崔福义, 林涛, 马放, 等.水源中水蚤类浮游动物的孳生与生态控制研究[J]. 哈尔滨工业大学学报, 2002, 34(3): 399-403.CUI F Y, LIN T, MA F, et al. Excess propagation and ecological control of water flea of zooplankton in raw water[J]. Journal of Harbin Institute of Technology, 2002, 34(3): 399-403. |
| [22] | GILBERT J J. Suppression of rotifer populations by Daphnia: A review of the evidence, the mechanisms and the effects on zooplankton community structure[J]. Limnology and Oceanography, 1988, 33(6): 1286-1303. |
| [23] | MACISAAC H J, GILBERT J J. Competition between rotifers and cladocerans of different body sizes[J]. Oecologia, 1989, 81(3): 295-301. |
| [24] | 周露洪, 谷孝鸿, 曾庆飞, 等. 固城湖围垦区池塘河蟹养殖环境影响及模式优化研究[J]. 生态与农村环境学报, 2013, 29(1): 36-42.ZHOU L H, GU X H, ZENG Q F, et al. Environmental effects and structural optimization of crab culture in ponds in reclamation zones of Gucheng lake[J]. Journal of Ecology and Rural Environment, 2013, 29(1): 36-42. |
| [25] | SHERR E B, SHERR B F. High rates of consumption of bacteria by pelagic ciliates[J]. Nature, 1987, 325(6106): 710-711. |
| [26] | HOPP U, MAIER G. Survival and development of five species of cyclopoid copepods in relation to food supply: experiments with algal food in a flow‐through system[J]. Freshwater Biology, 2005, 50(9): 1454-1463. |
| [27] | 刘建康. 高级水生生物学[M]. 北京:科学出版社, 1999: 12-351.LIU J K. Advanced aquatic biology [M]. Beijing: Science Press, 1999: 12-351. |
| [28] | 董江水, 陈红军, 王新华. 螺蛳投放量对中华绒螯蟹规格、产量和成活率的影响[J]. 水产科学, 2009, 28 (11): 691-694.DONG J S, CHEN H J, WANG X H. Effects of snails feeding rates on size, yield and survival of Chinese mitten crab eriocheir sinensis[J]. Fisheries Science, 2009, 28 (11): 691-694. |
| [29] | CONNOR M S, TEAL J M, VALIELA I. The effect of feeding by mud snails, Iiyanassa obsoleta (Say), on the structure and metabolism of a laboratory benthic algal community[J]. Journal of Experimental Marine Biology and Ecology, 1982, 65(1): 29-45. |
| [30] | 张庆阳, 吕东锋, 马旭洲, 等. 稻蟹共作系统对浮游甲壳动物群落的影响[J]. 上海海洋大学学报, 2014, 23(6): 834-841.ZHANG Q Y, LÜ D F, MA X Z, et al. The impact of rice-crab culture system on crustacean zooplankton community[J]. Journal of Shanghai Ocean University, 2014, 23(6): 834-841. |
2. Shanghai Engineering Research Center of Aquaculture, Shanghai 201306, China;
3. Shanghai University Knowledge Service Platform, Shanghai Ocean University, Shanghai 201306, China;
4. Shanghai Yuyue aquaculture cooperative, Shanghai 201611, China;
5. Zunyi Fisheries Technical Entension station, Zunyi 56300, Guizhou, China
 2015, Vol. 24
2015, Vol. 24


