2. 农业部长江下游渔业资源环境科学观测实验站, 江苏无锡 214081;
3. 中国水产科学研究院内陆渔业生态环境和资源重点开放实验室, 江苏无锡 214081;
4. 西北农林科技大学动物科技学院, 陕西杨凌 712100;
5. 陕西省农业分子生物学重点实验室, 陕西杨凌 712100
性腺分化相关基因参与了低等鱼类的性别决定过程。在这些性腺分化相关基因中,芳香化酶(aromatase,由cyp19a1a基因编码)是雄激素向雌激素转化的关键酶,诸多的转录因子能通过调控芳香化酶的活性进而调节内源E2的生成,如抗缪勒氏管激素基因 (anti-Mullerian hormone,amh),X染色体上剂量敏感性反转和先天性肾上腺发育不全决定区基因1 (dosage sensitive sex-reversal,adrenal hypoplasia congenital critical region on the X-chromosome,gene 1,dax1),类固醇调控因子1 b (steroidogenic factor-1b,nr5a1b),叉头框样蛋白2 (Forkhead transcriptional factor 2,foxl2),DM结构域转录因子1 dmrt1[1, 2]。结构高度保守的雌、雄激素受体在鱼类性腺发育中也发挥着重要作用[3],且外/内源性激素能直接通过胞内的雌、雄激素受体激活基因来达到调控通路的目的。同样,类固醇合成酶类通路也调控着内源性E2的合成并参与到鱼类的性腺发育之中[1]。
作者在前期工作中已获得三大类彭泽鲫性腺发育相关基因,这些基因包括(1)性腺分化相关基因(dmrt1a、dmrt1b、dmrt1c、foxl2、nr5a1b、SRY样HMG盒结构基因9a sox9a和DEAD-box RNA解旋酶vasa);(2)雌、雄激素受体基因(雌激素受体α1 esr1、雌激素受体α2 er alpha2、雌激素受体β2 esr2a、雌激素受体β1 esr2b和雄激素受体ar);(3)类固醇合成相关基因(3β羟化类固醇脱氢酶3bhsd、11β羟化类固醇脱氢酶2 11bhsd2、胆固醇侧链裂解酶1 cyp11a1、17α羟化酶/17,20碳链裂解酶a1 cyp17a1和类固醇急性调节蛋白star)。本实验室前期将经人工雌核发育技术繁育的彭泽鲫F1仔鱼置于实验室和野外进行养殖,野外池塘养殖出现极少数的雄鱼,而在实验室条件下获得了较大比例的雄鱼(实验室养殖雄鱼比例为43.6%,池塘养殖则为4.7%)。实验室养殖PccF1精巢中类固醇合成酶类基因的表达量显著高于卵巢中对应基因的表达量,但池塘养殖的PccF1精巢中绝大部分类固醇合成酶类基因的表达量极显著低于卵巢中对应基因的表达量。
前期研究结果说明实验室和池塘养殖PccF1雌、雄鱼出现差别的基因,主要为类固醇合成酶类基因及调控芳香化酶的转录因子;且这些基因的差异表达可能与彭泽鲫体内性激素的合成或调控相关,从而产生出现不同比例雄鱼的现象。本研究分别选择高、低密度养殖条件下PccF2雄、雌鱼,采用实时定量PCR技术对上述候选的差异表达基因进行了比较研究,从基因表达方面分析造成雄鱼较多的可能原因,为研究雌核发育鱼类的性腺分化机制提供参考依据。
1 材料与方法 1.1 实验材料人工雌核发育彭泽鲫F1于2011年4月20日在湖北荆州窑湾养殖基地进行(水温18 ℃),父本兴国红鲤(C. carpio var. red style)选择基地养殖池中3~5龄(1600 ± 175)g,母本选择2龄经雌核发育繁殖的成鱼(450 ± 15)g (n=300),雌雄鱼采用腹部检查法分辨,本研究中实验用鱼采用1雄1雌进行繁殖并重复2次,人工催产雌鱼采用hCG (400 IU/kg鱼),LRH-A (6 μg/kg鱼)和鲤垂体干粉(每公斤鱼1 mg,用0.7%NaCl溶解)剂量配合进行,两次注射间隔时间为6~8 h,雄鱼减半。人工雌核发育PccF2操作参照文献[4]中的方法于2012年4月10日进行,母本选择2龄PccF1雌鱼,父本选择与催产等与PccF1操作相同。彭泽鲫的受精卵是以红鲤的精子来激活彭泽鲫成熟卵细胞得到的,然后转入20 ℃左右的孵化桶中。子代约3~4 d出膜,半月龄PccF2带回实验室采用125 L大玻璃缸养殖(600尾,120 cm×40 cm×80 cm),将F2按高、低养殖密度分别放置160、80尾进行养殖,从2012年4月15日开始养殖,到2014年1月15日止。1月龄内喂食蛋黄。1月龄-2月龄按0.1% (w/w)喂食卤虫Artemia naupli,之后选择商品化的鱼用饲料。卤虫孵化方法按盐度10~15 ,pH 7.5~8.5,在28 ℃充氧培养,第二天收卵,喂食之前用清水洗净。彭泽鲫养殖条件:水温(25±1)℃;光周期14 h∶ 10 h (白/黑);pH 7.1 ± 0.5; 溶解氧(7.16 ± 0.16)mg/L。
1.2 PccF2雌雄鱼生物学指标测定及雌雄鱼比例统计分别选取高、低密度养殖组中的雄、雌鱼各10尾,进行生物学指标(全长、全重、肝重和性腺重)的测定,性体指数GSI (gonadosomatic index)=性腺重/全重×100,肝体指数HSI (hepatosomatic index)=肝重/全重×100,肥满度 (condition factor) = (全重/全长3)×100。从F2高、低密度养殖组中分3批连续抽取80、40尾鱼进行雌雄性别比例的统计,按照传统的腹部检查法(轻压腹部是否能挤出精液,卵巢腹部柔软)初步将鱼分为两类,并进行性别比例的统计(按总数)。统计后按20%比例抽取个体采用组织切片法进行验证。
1.3 PccF2雌雄鱼组织学切片观察解剖彭泽鲫F2,取其性腺固定于4%的多聚甲醛24 h后分别包在纱布内,流水冲洗12 h后将固定好的卵巢用自来水冲洗12~24 h,经上行梯度乙醇70%、80%、95%、100%Ⅰ、100%Ⅱ脱水,后经二甲苯透明,置于石蜡中进行包埋。采用石蜡切片机连续进行6 μm厚切片,将切片贴在处理好的载玻片上,50 ℃烘片3 h后,放置于37 ℃烘箱中,次日进行常规组织学苏木精-伊红(Hematoxylin-eosin staining,HE)染色。组织切片染色步骤:已烘干的切片脱蜡步骤为置于二甲苯Ⅰ溶液中5 min,置于二甲苯Ⅱ溶液中10 min;复水步骤为置于100%乙醇Ⅰ溶液中2 min,置于100%乙醇Ⅱ溶液中3 min,置于95%乙醇溶液中3 min,置于95%乙醇溶液中3 min,80%乙醇 中2 min,70%乙醇中2 min;再经蒸馏水洗2 min;37 ℃苏木精染核10 min;自来水洗 10 s后置于1.0% 盐酸乙醇处理 20 s,再进行蓝化(即自来水冲洗10 min)。采用伊红染细胞质5 min;蒸馏水洗浮色10 s;再经下行梯度乙醇脱水:70% 乙醇30 s,80% 乙醇30 s,90% 乙醇1 min,95% 乙醇2 min,100% 乙醇Ⅰ2 min,100% 乙醇Ⅱ2 min;二甲苯透明(二甲苯Ⅰ2 min→二甲苯Ⅱ2 min);中性树胶封片。采用光学显微镜观察切片,并用NIKON TE2000-U系统进行拍摄。
1.4 PccF2雌、雄鱼性腺中总RNA的提取、质量检测及反转录实验分别取低、高密度养殖组中的雌、雄鱼各10尾进行解剖,参照文献[5]中的方法进行性腺总RNA提取、质量检测及反转录操作。
1.5 PccF2不同密度养殖组雌、雄鱼性腺中性腺发育有关基因表达差异参照文献[5]报道的内参基因筛选办法,本研究中内参基因采用tubulin。本研究中将实验室养殖下雌、雄鱼之间的差异基因记为组合Ⅰ;将池塘养殖下雌、雄鱼之间的差异基因记为组合Ⅱ。检测的基因选择组合Ⅰ和Ⅱ中存在变化的基因,这些变化的基因包括性腺分化相关基因(dmrt1a、dmrt1b、dmrt1c、amh、foxl2)、雌激素受体基因(esr1和esr2a)和类固醇合成酶类相关基因(3bhsd、11bhsd2、cyp17a1、cyp19a1a和star)。参见文献[5]中的方法进行荧光实时定量PCR的操作,引物见表1。
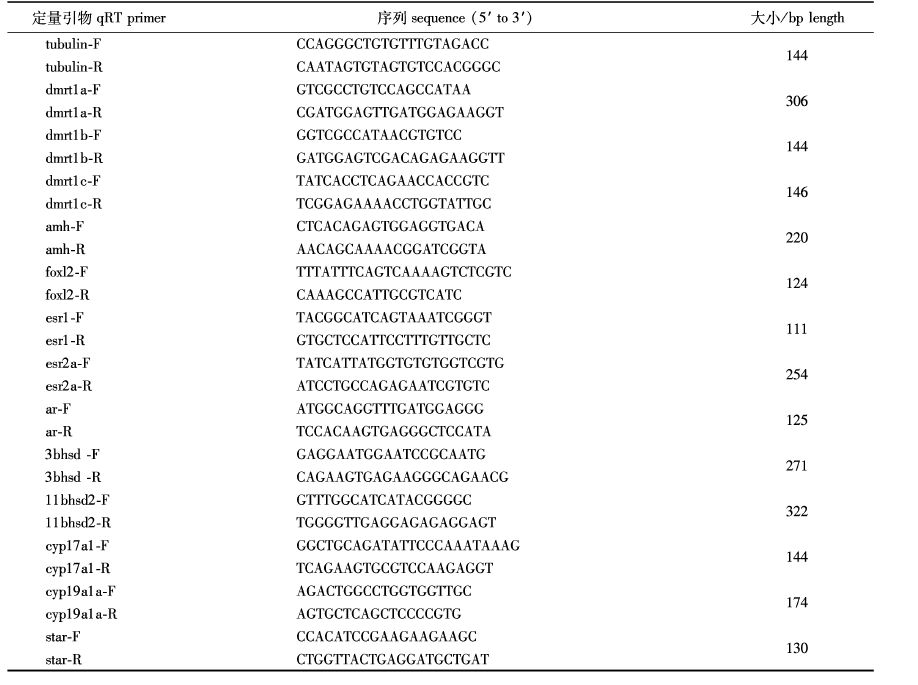
|
表1 定量引物 Tab. 1 qRT-PCR primers |
应用SPSS 18.0统计学分析软件对实验数据进行分析。实验数据采用2-ΔΔCt方法[6],数据结果均用“平均值±标准差”的方法表示。数据分析使用单因素方差分析,P<0.05表明差异显著,用不同字母a,b表示。
2 结果 2.1 实验室不同密度养殖组PccF2雌、雄鱼生物学指标及雌、雄鱼比例实验室养殖F2群体低密度养殖组中雌、雄鱼全长、全重、GSI显著高于高密度养殖组中的雌、雄鱼(表2)。对F2分组养殖的雌雄鱼进行统计,发现高密度养殖组中出现了高比例的雄鱼(雄鱼所占总比例为25%),而低密度养殖组(3.3%)出现雄鱼的数量较少。
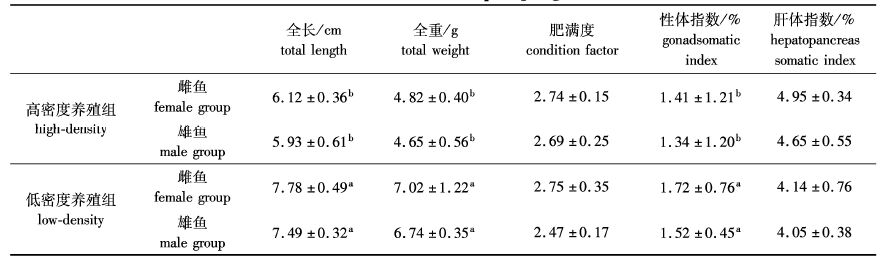
|
表2 实验室不同密度养殖PccF2雌、雄鱼生物学指标 Tab. 2 The bioindicator for male and female PccF2 offspring cultured in different densities |
实验室不同密度养殖组PccF2雌、雄鱼组织切片见图版。实验室高、低密度养殖组中的雄性F1鱼出现了未成熟的精原细胞(图版-1),对应的高、低密度养殖组中雌鱼出现了未成熟的卵母细胞(图版-2)。
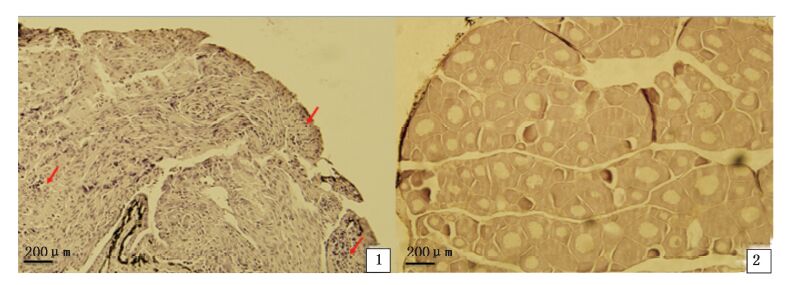
|
图版 实验室养殖F2雌、雄鱼组织学观察 Plate Photomicrographs of testes and ovaries sections of PccF2 under laboratory culture conditions 4.实验室高密度养殖组精巢(80×),红色箭头表示未成熟精原细胞; 2.实验室低密度养殖组卵巢(80×)。ℯℯ 4.testes,80×,arrow in 4 showed immature spermatocytes; 2. ovaries,80×. |
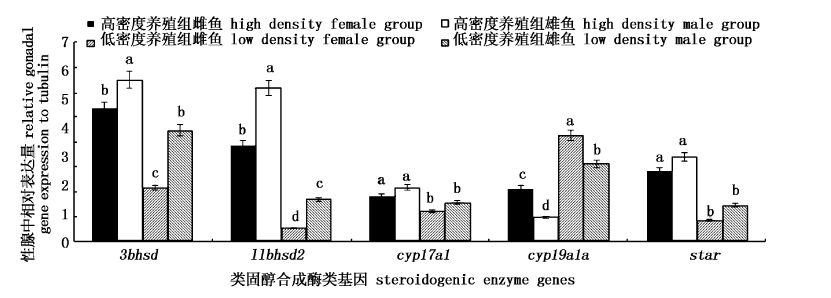
在实验室不同密度养殖组PccF2雌、雄鱼性腺中,我们对上述基因进行了检测,差异见图1-图3。针对不同性别彭泽鲫来说,在高、低密度养殖组中,雌鱼dmrt1c、cyp19a1a表达显著高于雄鱼中对应基因的表达(图1,图3); amh在不同密度雌、雄鱼之间的差异相反;雌鱼dmrt1a、dmrt1b、3bhsd和11bhsd2的表达量显著低于雄鱼中对应基因的表达量(图1,图3)。
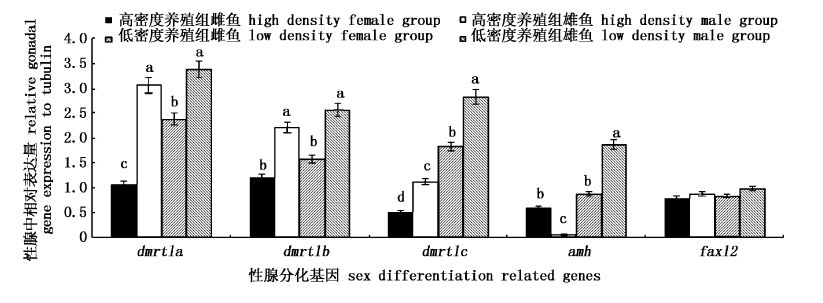
|
图1 PccF2实验室不同密度养殖雌、雄鱼性腺中性腺分化有关基因表达差异 Fig.1 Relative sex differentiation related gene expressions between male and female gonadal tissue compared with tubulin from F2 of Pengze crucian carp cultured in different density in laboratory glass tanks |
|
图3 PccF2实验室不同密度养殖雌、雄鱼性腺中类固醇合成酶类基因表达差异 Fig.3 Relative steroidogenesis enzyme gene expressions between male and female gonadal tissuecompared with tubulin from F2 of Pengze crucian carp cultured in different density in laboratory glass tanks |
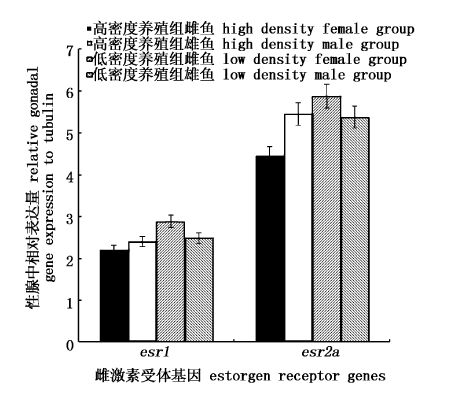
针对不同养殖密度来说,高密度养殖组中dmrt1c基因表达量显著低于低密度养殖组中的表达量;而高密度养殖组中cyp17a1和star基因表达量显著高于低密度养殖组中的表达量。foxl2、esr1和esr2a表达在不同养殖密度、不同性别彭泽鲫中的表达无显著性变化(图1,图2)。总体上讲,实验室养殖F2雌、雄鱼基因表达差异主要为类固醇合成酶类基因。与实验室养殖F1雌、雄鱼基因表达差异相比,F2 dmrt1a/b基因表达和类固醇合成酶类基因表达(3bhsd、11bhsd2、cyp17a1及star)在雌、雄鱼差异表达上是一致的,且在雄鱼中表达量高。
|
图2 PccF2实验室不同密度养殖雌、雄鱼性腺中雌雄激素受体基因表达差异 Fig.2 Relative steroid receptor gene expressions between male and female gonadal tissue compared with tubulin from F2 of Pengze crucian carp cultured in different density in laboratory glass tanks |
前期研究中,实验室和池塘养殖F1雌、雄鱼在类固醇合成酶类基因表达上存在差异,实验室养殖下PccF1雄鱼类固醇合成较为活跃,而池塘养殖下的PccF1雌鱼类固醇合成较为活跃,导致产生几乎接近于全雌彭泽鲫雌核发育群体。不管是针对不同密度,还是针对同一养殖密度下的雌、雄鱼,差异表达基因主要是dmrt1s (除dmrt1c)和类固醇合成酶类基因,和实验室养殖的PccF1雌、雄鱼差异结果一致。此结果说明雄鱼类固醇合成活动虽较雌性彭泽鲫活跃,但雌鱼体内的芳香化酶基因的表达始终要高于雄鱼体内相应基因的表达,一方面与基因表达相呼应,也说明雌鱼为了维持自己的第二性征需要足够量的雌激素,而雄鱼没有卵巢器官,活跃的性激素合成途径让雄鱼体内积累了足够多的雌激素,雄鱼受到反馈抑制,芳香化酶基因的表达被显著抑制;另一方面还说明实验室分不同密度养殖的雌、雄鱼类固醇合成途径不同,体现在F1、F2雄鱼类固醇合成酶类基因表达始终要极显著高于雌鱼,这可能与鱼类特殊的雌核发育有关。不管是雄鱼还是雌鱼,高密度养殖组鱼体内类固醇合成酶类基因(cyp17a1和star)的表达量始终要高于低密度养殖组,说明拥挤会改变鱼体内激素合成的方向,密度高可能会引起子代向雄鱼方向转化,这些差异可能主要是通过类固醇合成酶类基因的表达进而影响内源性激素的合成,进而改变雌雄鱼比例。
转录因子能参与期间芳香化酶活性的调控,如赛托利细胞分化的分子标志物(sox9a,dmrt1,amh)和精巢发育的标志物(dax1)都被证明能够抑制NR5A1/foxl2-介导的cyp19a1a基因的转录和卵母细胞的发育[7];foxl2能够直接或间接调控NR5A1诱导cyp19a1a的转录从而激活E2产生[8]。本研究中,雌鱼amh和cyp19a1a表达极显著高于雄鱼。截至目前,鱼类amh的功能还不是很清楚,一般认为amh在两性鱼类的性别形成和功能维持中都能发挥作用[9]。amh在雌鱼中的高表达抑制了雌鱼类固醇合成途径,减少内生雌激素的合成,但是鱼自身具有自分泌和旁分泌调控[10]及脑-垂体-性腺轴的反馈抑制[1, 7, 8],以维持体内激素的平衡。
3.2 造成雄鱼较多的其他因素分析目前有研究采用性别判定方程[11, 12]、核型[13]等方法[14]来鉴定雌、雄鱼,且产生高比例雄鱼的原因较多[15],从遗传学角度看,微小染色体的产生(supernumerary chromosome fragments)能对鱼类的性腺分化造成影响[16],也有杂交的因素[17]。最近在半滑舌鳎上的研究表明伪雄鱼后代中90%以上的ZW个体性转变为伪雄鱼,且伪雄鱼后代中的伪雄鱼保留了父本伪雄鱼的甲基化模式,造成了养殖苗种中生理雄鱼比例明显偏高[18]。前期研究中利用流式细胞仪检测PccF1、F2子代DNA,结果表明子代DNA值在134~162之间,且已经有研究表明经雌核发育的彭泽鲫后代为三倍体[19],排除存在因紫外照射导致精子DNA损伤造成微小染色体的产生[20]。关于环境和激素对鱼类的性别决定影响也有不少报道,温度[21]、密度、pH、盐度、光照、溶氧、群体信号和食物丰度等都可以在不同程度上影响鱼类性别[7]。前期研究中在实验室养殖F1、F2中出现较大比例雄鱼,可能跟水温有关。实验室养殖温度较高,冬季野外养殖温度较低,高温能够抑制芳香化酶的活力[1, 22],体内雄激素过高从而产生更多的雄性鱼。不能确定温度是彭泽鲫性腺分化主要因素的原因在于相同温度处理下金鱼性别易受到父母本的影响[23],也就是说温度性别决定也需要依赖一定的遗传背景。前期研究实验室养殖彭泽鲫使用的饲料来自于商品化饲料,粗蛋白含量丰富,利用率和转化效率很低。但池塘水体中浮游植物丰度较高,浮游动物主要有原生动物、轮虫、枝角类、桡足类。利用F2对F1进行的验证实验中,对F2按照不同养殖密度进行分开养殖,采用相同水体积、投饵和同样管理,能够排除温度营养等因素,与此同时,1雄1雌也能保证同组后代的一致性。前期研究也表明实验室环境下氨氮含量较池塘高,最近有研究表明营养和氨氮也能够改变南亚野鲮(Labeo rohita)体内雌雄激素和甲状腺激素的水平[24]。高浓度氨氮跟鲫鱼激素水平也有关[25]。高浓度氨氮能否改变彭泽鲫体内的激素水平需要进一步研究。
| [1] | WU G C, TOMY S, LEE M F, et al. Sex differentiation and sex change in the protandrous black porgy, Acanthopagrus schlegeli[J]. General and Comparative Endocrinology, 2010, 167(3):417-421. |
| [2] | LI M H, YANG H H, LI M R, et al. Antagonistic roles of Dmrt1 and Foxl2 in sex differentiation via estrogen production in tilapia as demonstrated by TALENs[J]. Endocrinology, 2013, 154(12):4814-4825. |
| [3] | 温海深,董双林.硬骨鱼类雌激素受体及其在生殖调节中的作用研究[J].中国海洋大学学报:自然科学版, 2008, 38(3):367-370.WEN H S, DONG S L. Studies on oestrogen receptors and their physiological functionin the reproductive regulation of teleosts[J]. Periodical of Ocean University of China(Natural Science), 2008, 38(3):367-370. |
| [4] | 尤锋,许建和,倪静,等.牙鲆同质雌核发育人工诱导研究[J].高技术通讯, 2008, (8):874-880.YOU F, XU J H, NI J, et al. Study on artificial of mitogynogenetic diploid in Paralichthys olivaceus[J]. Chinese High Technology Letters, 2008, (8):874-880. |
| [5] | ZHENG Y, WANG L H, LI M, et al. Molecular characterization of five steroid receptors from pengze crucian carp and their expression profiles of juveniles in response to 17α-ethinylestradiol and 17α-methyl testosterone[J]. General Comparative Endocrinology, 2013, 191:113-122. |
| [6] | LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4):402-408. |
| [7] | 邓思平,陈松林,田永胜,等.半滑舌鳎的性腺分化和温度对性别决定的影响[J].中国水产科学, 2007, 14(5):714-719.DENG S P, CHEN S L, TIAN Y S, et al. Gonadal differentiation and effects of temperature on sex determination in half-smooth tongue-sole, Cynoglossus semilaevis [J]. Journal of Fishery Sciences of China, 2007, 14(5):714-719. |
| [8] | WANG D S, KOBAYASHI T, ZHOU L Y, et al. Foxl2 up-regulates aromatase gene transcription in a female-specific manner by binding to the promoter as well as interacting with ad4 binding protein/steroidogenic factor 1[J]. Molecular Endocrinology, 2007, 21:712-725. |
| [9] | KLVVER N, PFENNIG F, PALA I, et al. Differential expression of anti-müllerian hormone (amh) and anti-müllerian hormone receptor type Ⅱ (amhrⅡ) in the teleost Medaka[J]. Developmental Dynamics, 2007, 236(1):271-281. |
| [10] | LUCKENBACH J A, YAMAMOTO Y, GUZMÁN J M, et al. Identification of ovarian genes regulated by follicle-stimulating hormone (Fsh) in vitro during early secondary oocyte growth in coho salmon[J]. Molecular and Cellular Endocrinology, 2013, 366(1):38-52. |
| [11] | 郭弘艺,魏凯,谢正丽,等.长江口银色鳗的形态指标体系及其雌雄鉴别[J].水产学报, 2011, 35(1):1-9.GUO H Y, WEI K, XIE Z L, et al. Analysis of morphological index system and discrimination of male and female silver eels (Anguilla japonica) collected at the Yangtze River Estuary[J]. Journal of Fisheries of China, 2011, 35(1):1-9. |
| [12] | 周丽青,杨爱国,柳学周,等.半滑舌鳎染色体核型分析[J].水产学报, 2005, 29(3):417-419.ZHOU L Q, YANG A G, LIU X Z, et al. The karyotype of the tonguefish Cynoglossus semilaevis[J]. Journal of Fisheries of China, 2005, 29(3):417-419. |
| [13] | 徐冬冬,尤锋,楼宝,等.条石鲷雌雄鱼核型及C-带的比较分析[J].水生生物学报, 2012, 36(3):552-557.XU D D, YOU F, LOU B, et al. Comparative analysis of karyotype and C-banding in female and male Oplegnathus fasciatus[J]. Acta Hydrobiologica Sinica, 2012, 36(3):552-557. |
| [14] | 杨东,余来宁.鱼类性别与性别鉴定[J].水生生物学报, 2006, 30(2):221-226.YANG D, YU L N. Sex and sex identification of fish[J]. Acta Hydrobiologica Sinica, 2006, 30(2):221-226. |
| [15] | 桂建芳.鱼类性别和生殖的遗传基础及其人工控制[M].北京:科学出版社, 2007:63-81.GUI J F. Genetic Basis and Artificial Control of Sexuality and Reproduction in Fish[M]. Beijing:Science Press, 2007:63-81. |
| [16] | FELIP A, ZANUY S, CARRILLO M, et al. Induction of triploidy and gynogenesis in teleost fish with emphasis on marine species[J]. Genetica, 2001, 111(1):175-195. |
| [17] | 覃钦博,戴婧,刘少军,等.异源三倍体鲫鲂的遗传组成和生殖特性观察[J].水产学报, 2014, 38(3):356-361.QIN Q B, DAI J, LIU S J, et al. Characteristics of genetic composition and reproduction in allotriploid hybrids of red crucian carp(♀)×blunt snout bream(♂)[J]. Journal of Fisheries of China, 2014, 38(3):356-361. |
| [18] | CHEN S, ZHANG G, SHAO C, et al. Whole-genome sequence of a flatfish provides insights into ZW sex chromosome evolution and adaptation to a benthic lifestyle[J]. Nature Genetics, 2014, 46(3):253-260. |
| [19] | 李名友,周莉,杨林,等.彭泽鲫的分子遗传分析及其与方正银鲫A系的比较[J].水产学报, 2002, 26(5):272-276.LI M Y, ZHOU L, YANG L, et al. Molecular genetic analysis on Pengze crucian carp and comparison with strain A of gynogenetic silver crucian carp[J]. Journal of Fisheries of China, 2002, 26(5):272-276. |
| [20] | IHSSEN P E, MCKAY L R, MCMILLAN I, et al. Ploidy manipulation and gynogenesis in fishes:cytogenetic and fisheries applications[J]. Transactions of the American Fisheries Society, 1990, 119(4):698-717. |
| [21] | 姚延丹,龙华,陈建武,等.鱼类性别决定及其研究方法进展[J].上海海洋大学学报, 2009, 18(1):94-100.YAO Y D, LONG H, CHEN J W, et al. The progress in fish sex-determination and its research methods[J]. Journal of Shanghai Ocean University, 2009, 18(1):94-100. |
| [22] | KARUBE M, FERNANDINO J I, STROBL-MAZZULLA P, et al. Characterization and expression profile of the ovarian cytochrome P-450 aromatase (cyp19A1) gene during thermolabile sex determination in pejerrey, Odontesthes bonariensis [J]. Journal Experiment Biology Part A:Ecological Genetics and Physiology, 2007, 307(11):625-636. |
| [23] | CONOVER D O, KYNARD B E. Environmental sex deter-mination:Interaction of temperature and genotype in a fish[J]. Science, 1981, 213(4507):577-579. |
| [24] | CIJI A, SAHU N P, PAL A K, et al. Nitrite-induced alterations in sex steroids and thyroid hormones of Labeo rohita juveniles:effects of dietary vitamin E and L-tryptophan[J]. Fish Physiology and Biochemistry, 2013, 39(5):1297-1307. |
| [25] | SINHA A K, LIEW H J, DIRICX M, et al. Combined effects of high environmental ammonia, starvation and exercise on hormonal and ion-regulatory response in goldfish (Carassius auratus L.)[J]. Aquatic Toxicology, 2012, 114-115:153-164. |
2. Scientific Observing and Experimental Station of Fishery Resources and Environment in the Lower Reaches of the Changjiang River, Ministry of Agriculture;Wuxi 214081, Jiangsu, China;
3. Key Open Laboratory of Ecological Environment and Resources of Inland Fisheries, Chinese Academy of Fishery Sciences, Wuxi 214081, Jiangsu, China;
4. College of Animal Science and Technology, Northwest A & F University, Yangling 712100, Shaanxi, China;
5. Shaanxi Key Laboratory of Molecular Biology for Agriculture, Yangling 712100, Shaanxi, China
 2015, Vol. 24
2015, Vol. 24


