中华绒螯蟹(Eriocheir sinensis),俗称河蟹,其生活周期可分为溞状幼体、大眼幼体、仔蟹、幼蟹、成蟹等几个阶段[1]。仔蟹期是河蟹大眼幼体变态后,从“游泳型”转向“爬行型”的起始阶段,是身体增长变化最大的阶段,是河蟹生活周期的转型时期,对外界环境较为敏感,也是生产上蟹种培育过程中的关键时期。仔蟹期根据其蜕壳频率通常分为仔Ⅰ期、仔Ⅱ期、仔Ⅲ期、仔Ⅳ期和仔Ⅴ期共5个阶段[2]。研究仔蟹每个阶段的生长特点及其对环境的敏感性,有助于我们更加深入了解河蟹生长的生物学过程,为更好地开展仔蟹及蟹种培育打下基础。
甲壳动物的生长发育总是与蜕壳联系在一起,而蜕壳受到神经系统、内分泌系统和多种激素以及外界环境的协同调控[3, 4, 5]。在不同蜕壳时期,Y-器官分泌的蜕皮激素(ecdysteroid hormones,EH)的含量会相应地发生变化,进而调控蜕壳的正常进行。然而蜕皮激素需通过蜕皮激素受体(ecdysone receptor,EcR)和维甲类 X 受体(retinoid X receptor,RXR)这两个基因作为媒介而发挥作用[6, 7]。此外,蜕皮激素的分泌以及甲壳动物的蜕壳也受到其他相关激素的调控或影响,如蜕皮抑制激素(MIH) 、高血糖激素(CHH) 、性腺抑制激素(GIH)和大颚器抑制激素(MOIH)等 [8, 9, 10, 11, 12, 13, 14, 15, 16]。因此,开展CHH、GIH、MIH、EcR以及RXR 这5个基因在甲壳动物蜕壳与生长过程中的表达差异,有助于我们增强对河蟹等甲壳动物生长发育的认识。
近10余年来,河蟹养殖在我国取得了迅猛发展,但有关仔蟹不同发育时期在不同养殖条件下的生长研究还比较薄弱,对其生长差异的内在原因与机理尚待进一步研究。本文通过分析不同饲养环境下仔蟹在不同发育时期的生长差异及其5个蜕壳相关基因表达情况,探讨生长表型、基因表达与饲养环境的互作,以期为中华绒螯蟹的蜕壳生长研究与健康养殖提供新资料。
1 材料与方法 1.1 实验材料和表型性状测量取同一家系的大眼幼体分别放养于室外小型水泥池(3 m×3 m×1 m,光滑磁砖贴面,内放水花生;投放大眼幼体60 g)和室内玻璃钢水槽(120 cm×45 cm×50 cm,内放水花生,投放大眼幼体3 g)两种环境。实验期间,室外水泥池的平均水温为25.4 ℃,溶解氧平均为7.0 mg/L,pH为8.2;室内水槽的平均水温为23.0 ℃,溶解氧为6.5 mg/L,pH为7.6。由于仔Ⅰ、仔Ⅱ期的河蟹个体规格很小,每次只测量10只仔蟹的群体体质量,重复3次,然后换算其个体均质量;仔Ⅲ-仔Ⅴ期的个体规格变大,实行单只测量体质量,每次测量30只仔蟹,计算其个体均质量。同时,每个发育时期选取10只仔蟹保存于-80 ℃冰箱中用于基因表达分析。
利用SPSS 17.0、EXCEL 2007等软件进行生长差异的统计分析、相关参数作图和显著性检验。
1.2 基因表达分析本文共选取5个蜕壳相关基因(CHH、GIH、MIH、EcR和RXR)进行分析。
1.2.1 总RNA提取与cDNA合成分别对大眼幼体及两种环境下不同时期的仔蟹整体研磨提取总RNA,每个发育时期设置3个重复,并反转录合成cDNA。 RNA提取采用AxyPrep Multisource Total RNA MiniPrep Kit (AxyGen 09113KD1)试剂盒,反转录采用PrimeScript®RT reagent Kit试剂盒(宝生物工程大连有限公司)。
1.2.2 实时荧光定量PCR分析利用NCBI公布的上述5个基因序列,设计荧光定量PCR引物,以中华绒螯蟹β-actin基因为内参,设计内参引物β-actinF和β-actinR(表1)。应用Bio-Rad CFX96 进行PCR扩增,反应参数:预变性94 ℃ 3 min;然后94 ℃ 30 s、60 ℃ 30 s、72 ℃ 2 min,共40个循环;最后72 ℃ 10 min,溶解曲线 60~94 ℃ 。
| 表 1 本实验所用的荧光定量PCR引物序列 Tab.1 Primers used for realtime quantitative PCR in this study |
按照 2-△△Ct 方法进行荧光定量的数据分析[17],用SPSS 17.0进行单因素方差分析(ANOVA)和Dunnett方法多重比较。
2 结果与分析 2.1 不同饲养环境的仔蟹生长差异室外池塘与室内水槽两种饲养环境下仔蟹5个发育时期的体质量表型值列于表2,其生长动态如图1所示。可以看出,从仔Ⅰ-仔Ⅴ,室外池塘饲养的平均体质量由9.07 mg增加到235.97 mg,增长了26.02倍,平均每次蜕壳增长6.5倍;室内水槽饲养的平均体质量由8.46 mg增加到189.93 mg,增长了22.45倍,平均每次蜕壳增长5.6倍。从仔Ⅰ期开始,室外池塘的仔蟹体质量均显著大于室内水槽的仔蟹体质量(P < 0.05)。
| 表 2 室外池塘与室内水槽饲养环境下5个仔蟹发育期的体质量表型值(平均值±标准差) Tab.2 Individual mean weight of larva Chinese mitten crab at five developmental stages reared in the outdoor pond and indoor closet conditions (Mean±SD) |

|
图 1 室外池塘与室内水槽饲养环境下仔蟹的生长动态 Fig.1 Growth dynamic of larva Chinese mitten crab reared in the outdoor pond and indoor closet conditions |
在大眼幼体阶段,MIH和GIH两个基因的表达量显著高于其他基因(P < 0.05),而RXR基因的表达量又显著高于EcR和CHH这两个基因(P < 0.05,图2)。结果表明在相同的大眼幼体时期,5个蜕壳相关基因存在显著的表达差异。
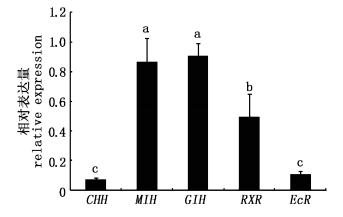
|
图 2 5个蜕壳相关基因在中华绒螯蟹大眼幼体阶段的表达情况 Fig.2 Expression profiles of the five molting-related genes in megalopas of Chinese mitten crab 不同字母表示差异显著性水平(P < 0.05),图5同此。 The different letters indicate the significant level, same as Fig.5. |
在室外池塘,从仔Ⅰ-仔Ⅴ,MIH、GIH和CHH基因具有相似的表达模式,均随着仔蟹的发育(仔Ⅰ-仔Ⅳ)呈下降趋势,仔Ⅴ期又略有上升;而RXR基因的表达模式与之相反,随着仔蟹的发育呈上升趋势;而EcR基因在各发育阶段无显著的表达差异 (P > 0.05,图3)。在室内水槽,MIH、CHH与室外条件下表达模式都是呈下降趋势;CHH基因在仔Ⅰ-仔Ⅲ,EcR基因在仔Ⅰ-仔Ⅱ,RXR基因在仔Ⅰ期的表达量均显著高于其他时期(P < 0.05) ;而MIH基因在仔Ⅰ期的表达量显著高于其他时期 (图4)。
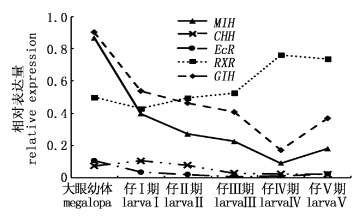
|
图 3 室外池塘条件下各仔蟹期的基因相对表达量 Fig.3 Gene relative expression of larva Chinese mitten crab reared in outdoor pond environment |
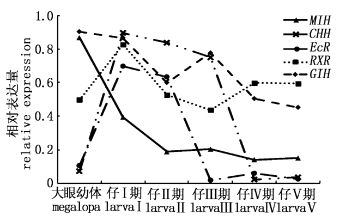
|
图 4 室内水槽条件下各仔蟹期的基因相对表达量 Fig.4 Gene relative expression of larva Chinese mitten crab reared in indoor closet environment |
5个蜕壳相关基因在室外池塘和室内水槽两种环境下的表达对比表明(图5):EcR、CHH和GIH基因在室内水槽中的表达量均高于室外池塘中的表达量,其中CHH基因在仔Ⅰ-仔Ⅲ期,EcR基因在仔Ⅰ-仔Ⅱ期,及GIH基因在仔Ⅰ-仔Ⅴ期的室内水槽的表达均显著高于室外池塘(P < 0.05),而MIH、RXR基因在两种饲养环境的表达无显著差异。该结果表明:MIH、RXR基因的表达受环境的影响较小,而CHH、EcR和GIH基因的表达与环境条件密切相关,存在显著的基因表达与环境互作。
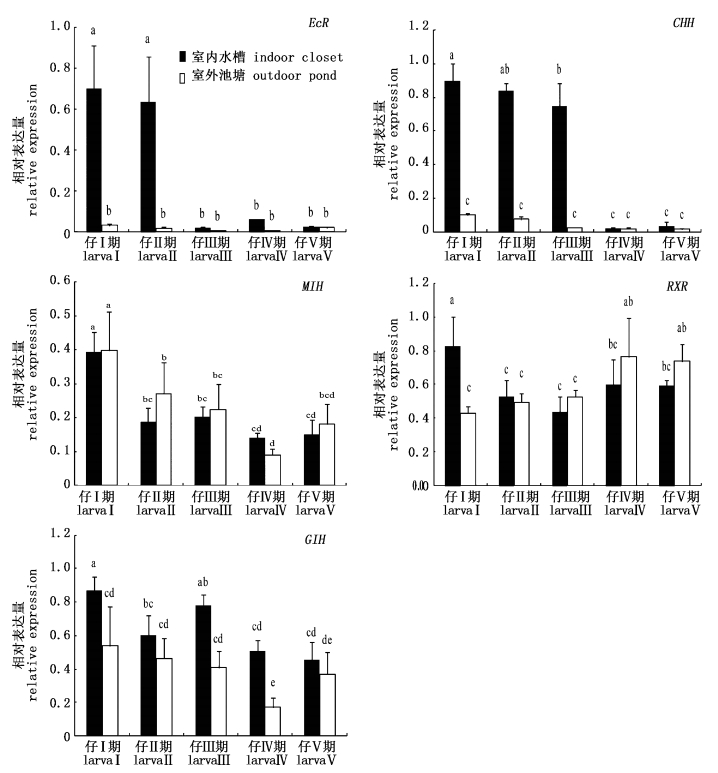
|
图 5 室外池塘与室内水槽饲养环境下仔蟹蜕壳相关基因的表达情况 Fig.5 Expression profiles of the molting-related genes in larva Chinese mitten crab reared in the outdoor pond and indoor closet environments |
对不同饲养环境和不同发育时期的基因表达量进行多重方差分析(表3)表明:除MIH和RXR基因外,CHH、EcR和GIH基因均表现出极显著的环境表达差异(P < 0.01),MIH、CHH、EcR及GIH基因表现出极显著的不同发育时期表达差异(P < 0.01),RXR基因表现出显著的不同发育时期表达差异(P < 0.05);RXR、CHH、EcR和GIH基因的表达表现出极显著饲养环境与发育时期的交互作用(P < 0.01),而MIH基因的表达量无显著的交互作用(P > 0.01)。
| 表 3 饲养环境与发育时期对基因表达量的多重方差分析 Tab.3 Multi-ANOVA analysis of gene expression from rearing environments and developmental stages |
环境对中华绒螯蟹的生长发育有很大影响。有研究发现,河蟹幼蟹的蜕壳与环境密切相关[18],不同的饲养环境下,其生长速度也存在着显著的差异[19, 20, 21, 22, 23]。在其他甲壳动物中也存在类似的现象,如罗氏沼虾在不同大小的池塘中其生长和成活率有显著差异[24];不同盐度、温度、溶解氧等对龙虾、蓝蟹仔蟹的生长有显著影响[25, 26, 27]。本实验中,在室外池塘条件下河蟹仔蟹(仔Ⅰ-仔Ⅴ期)的体质量显著大于室内水槽养殖条件,这也说明环境对仔蟹的生长有显著的影响。
本文对5个蜕壳相关基因在大眼幼体和不同发育时期仔蟹以及养殖环境条件下的表达进行分析,发现MIH基因在大眼幼体时期的表达量显著高于其他仔蟹时期,且随着发育进程,其表达量逐渐降低并保持稳定,表明在大眼幼体时期分泌较高的蜕皮抑制激素,可能造成蜕壳所需的时间较其他发育时期长。有研究表明大眼幼体的蜕皮间隔约6~10 d,而仔蟹期(仔Ⅰ-仔Ⅴ)平均蜕壳时间约4~8 d[4, 28],这与本实验结果相一致。在室外池塘和室内水槽两种环境中,MIH基因的表达量无显著差异,多因素方差分析也表明MIH基因在两种环境下表达差异不显著,说明仔蟹不同发育时期的MIH基因的表达是相对恒定的,且受环境影响较小,这与CHAN的结果相似 [29]。CHH基因在室内水槽条件下的表达量均高于室外池塘条件,这可能是因为室内水槽的养殖环境、水体营养等条件较室外池塘的大水体条件差,进而诱导CHH基因的大量表达。此外,也有研究表明,CHH基因对于环境的敏感度较高,组织缺氧、温度和盐度胁迫、热处理和重金属等刺激等都可能引起CHH的表达显著升高[3, 5, 9, 30],这与本实验的结果是相符的。室内水槽的水体较小,水质变化较大,易产生不良刺激引起河蟹仔蟹的应激反应,从而引起CHH基因的表达量显著升高。本实验中,MIH,GIH以及CHH具有类似的基因表达模式,可能是因为这3个基因均来自于CHH神经多肽激素家族,因而具有相似的生物学功能[8],同时也在一定程度上反映了这3个基因对河蟹的蜕壳生长具有协同调控的作用;而RXR基因的表达模式与GIH基因的表达模式完全相反,在GIH表达量很高的情况下,RXR的表达量反而低,推测这两个基因对河蟹的蜕壳生长具有一定程度的拮抗作用。
本文通过分析不同养殖条件下、不同发育时期仔蟹的体质量变化以及蜕壳相关基因的表达情况,结果显示不同养殖环境对河蟹仔蟹的生长具有显著影响,揭示了仔蟹不同发育时期的生长规律并阐述了相关功能基因对仔蟹蜕壳、生长以及发育的协同调控作用。MIH、RXR基因的表达不受环境的影响,而CHH、EcR和GIH基因的表达与环境条件密切相关。MIH、GIH以及CHH对河蟹的蜕壳具有协同调控的作用,而RXR与GIH对河蟹的蜕壳具有一定程度的拮抗作用。
| [1] | 王武, 王成辉, 马旭洲. 河蟹生态养殖: 第二章, 河蟹的生物学特性[M]. 2版. 北京: 中国农业出版社, 2013: 44-48. WANG W, WANG C H, MA X Z. Ecological cultivation of Chinese mitten crab [M]. 2nd ed. Beijing: Chinese Agricultural Press, 2013: 44-48. |
| [2] | 张列士. 河蟹的增养殖[J]. 水产科技情报, 2001, 28(1): 35-39. ZHANG L S. Aquaculture of Chinese mitten crab[J]. Fisheries Science & Technology Information, 2001, 28(1): 35-39. |
| [3] | 申玉春, 陈作洲, 刘丽, 等. 盐度和营养对凡纳滨对虾蜕壳和生长的影响[J]. 水产学报, 2012, 36(2): 290-299. SHEN Y C, CHEN Z Z, LIU L, et al. The effects of salinity and nutrition on molt and growth of Litopenaeus vannamei[J]. Journal of Fisheries of China, 2012, 36(2): 290-299. |
| [4] | 朱小明, 李少菁. 甲壳动物幼体蜕皮的调控[J]. 水产学报, 2001, 25(4): 379-384. ZHU X M, LI S J. Regulation of molting in crustacean larvae[J]. Journal of Fisheries of China, 2001, 25(4): 379-384. |
| [5] | BUCHHOLZ F, BUCHHOLZ C. Chapter six-growth and moulting in northern krill (Meganyctiphanes norvegica Sars)[J]. Advances in Marine Biology, 2010, 57: 173-197. |
| [6] | CHUNG A C K, DURICA D S, HOPKINS P M. Tissue-specific patterns and steady-state concentrations of ecdysteroid receptor and retinoid-X-receptor mRNA during the molt cycle of the fiddler crab, Uca pugilator[J]. General and Comparative Endocrinology, 1998, 109(3): 375-389. |
| [7] | RIDDIFORD L M, CHERBAS P, TRUMAN J W. Ecdysone receptors and their biological actions[J]. Vitamins and Hormones, 2000, 60: 1-73. |
| [8] | 杨济芬, 朱冬发, 沈建明, 等. 甲壳动物高血糖激素家族生理功能研究进展[J]. 动物学杂志, 2009, 44(1): 151-158. YANG J F, ZHU D F, SHEN J M, et al. Physiological significance of crustacean hyperglycemic hormone family[J]. Chinese Journal of Zoology, 2009, 44(1): 151-158. |
| [9] | MORRIS S, POSTEL U, MRINALINI, et al. The adaptive significance of crustacean hyperglycaemic hormone (CHH) in daily and seasonal migratory activities of the Christmas Island red crab Gecarcoidea natalis[J]. The Journal of Experimental Biology, 2010, 213(17): 3062-3073. |
| [10] | CHANG E S, PRESTWICH G D, BRUCE M J. Amino acid sequence of a peptide with both molt-inhibiting and hyperglycemic activities in the lobster, Homarus americanus[J]. Biochemical and Biophysical Research Communications, 1990, 171(2): 818-826. |
| [11] | KHAYAT M, YANG W J, AIDA K, et al. Hyperglycaemic hormones inhibit protein and mRNA synthesis in in vitro-incubated ovarian fragments of the marine shrimp Penaeus semisulcatus[J]. General and Comparative Endocrinology, 1998, 110(3): 307-318. |
| [12] | LIU L, LAUFER H, WANG Y J, et al. A neurohormone regulating both methyl farnesoate synthesis and glucose metabolism in a crustacean[J]. Biochemical and Biophysical Research Communications, 1997, 237(3): 694-701. |
| [13] | ZARUBIN T P, CHANG E S, MYKLES D L. Expression of recombinant eyestalk crustacean hyperglycemic hormone from the tropical land crab, Gecarcinus lateralis, that inhibits Y-organ ecdysteroidogenesis in vitro[J]. Molecular Biology Reports, 2009, 36(6): 1231-1237. |
| [14] | FANJUL-MOLES M L. Biochemical and functional aspects of crustacean hyperglycemic hormone in decapod crustaceans: review and update[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2006, 142(3/4): 390-400. |
| [15] | CHUNG J S, ZMORA N, KATAYAMA H, et al. Crustacean hyperglycemic hormone (CHH) neuropeptides family: functions, titer, and binding to target tissues[J]. General and Comparative Endocrinology, 2010, 166(3): 447-454. |
| [16] | DE KLEIJN D P, SLEUTELS F J G T, MARTENS G J M, et al. Cloning and expression of mRNA encoding prepro-gonad-inhibiting hormone (GIH) in the lobster Homarus americanus[J]. FEBS Letters, 1994, 353(3): 255-258. |
| [17] | LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT Method[J]. Methods, 2001, 25(4): 402-408. |
| [18] | 张堂林, 李钟杰. 中华绒螯蟹幼蟹蜕壳的生态学观察[J]. 湖泊科学, 1999, 11(4): 333-337. ZHANG T L, LI Z J. Ecological observation on molting of juveniles of the Chinese mitten crab, Eriocheir sinensis[J]. Journal of Lake Science, 1999, 11(4): 333-337. |
| [19] | 程建新, 宋学宏, 吴林坤, 等. 养殖水环境对中华绒螯蟹不同营养供给模式的响应[J]. 水生生物学报, 2008, 32(5): 657-668. CHENG X, SONG X H, WU L K, et al. Effects of feeding models on water quality for chinese mitten crab Eriocheir sinensis[J]. Acta Hydrobi Ologica Sinica, 2008, 32(5): 657-668. |
| [20] | 洪美玲. 水中亚硝酸盐和氨氮对中华绒螯蟹幼体的毒性效应及维生素E的营养调节[D]. 上海: 华东师范大学, 2007.HONG M L. Toxieity of ambient nitrite and ammonia on Eriocheir sinensis juveniles and nutritional modulation of dietary VE[D]. Shanghai: East China Normal University, 2007. |
| [21] | 汪留全, 周婉华. 池养中华绒螯蟹幼蟹生长特性的初步研究[J]. 水产学报, 1989, 13(1): 17-23. WANG L Q, ZHOU W H. The growth characteristics of juvenile of woolly handed crab (Eriocheir sinensis) cultivated in pond[J]. Journal of Fisheries of China, 1989, 13(1): 17-23. |
| [22] | 王悦如, 李二超, 龙丽娜, 等. 中华绒螯蟹对盐度变化的适应及其渗透压调节的研究进展[J]. 海洋渔业, 2011, 33(3): 352-360. WANG Y R, LI E C, LONG L N, et al. Review on the osmoregulation and adaptation to salinity changes of Chinese mitte ncrab Eriocheir sinensis[J]. Marine Fisheries, 2011, 33(3): 352-360. |
| [23] | 徐建荣, 沈颂东, 张加梅, 等. 环境条件对中华绒螯蟹大眼幼体蜕壳生长的影响[J]. 水产科学, 2006, 25(10): 505-508. XU J R, SHEN S D, ZHANG J M, et al. Influence of environment on molting and growth of Chinese mitten crab (Eriocheir sinensis) Megalopa[J]. Fisheries Science, 2006, 25(10): 505-508. |
| [24] | 杨国梁, 罗坤, 孔杰, 等. 罗氏沼虾不同养殖条件下的生长和存活率相关分析[J]. 海洋水产研究, 2008, 29(3): 74-79. YANG G L, LUO K, KONG J, et al. Correlation of growth and survivorship for Macrobrachium rosenbergii in different culture conditions[J]. Marine Fisheries Research, 2008, 29(3): 74-79. |
| [25] | CHITTLEBOROUGH R G. Environmental factors affecting growth and survival of juvenile western rock lobsters Panulirus longipes (Milne-Edwards)[J]. Marine and Freshwater Research, 1975, 26(2): 177-196. |
| [26] | GUERIN J L, STICKLE W B. Effects of salinity gradients on the tolerance and bioenergetics of juvenile blue crabs (Callinectes sapidus) from waters of different environmental salinities[J]. Marine Biology, 1992, 114(3): 391-396. |
| [27] | LEFFLER C W. Some effects of temperature on the growth and metabolic rate of juvenile blue crabs, Callinectes sapidus, in the laboratory[J]. Marine Biology, 1972, 14(2): 104-110. |
| [28] | 张列士, 陆锦天. 中华绒螯蟹(Eriocheir sinensis)蜕壳和生长的研究进展[J]. 水产科技情报, 2001, 28(6): 246-250. ZHANG L S, LU J T. Advances in studies on molting and growth in Chinese mitten crab, Erocheir sinensis[J]. Fisheries Science & Technology Information, 2001, 28(6): 246-250. |
| [29] | CHAN S M, CHEN X G, Gu P L. PCR cloning and expression of the molt-inhibiting hormone gene for the crab (Charybdis feriatus)[J]. Gene, 1998, 224(1/2): 23-33. |
| [30] | 李莉. 高血糖激素(CHH)在对虾渗透调节和血糖代谢中调控机制的初步研究[D]. 青岛: 中国海洋大学, 2011. LI L. Study on Crustacean hyperglycemia hormone (CHH) modulates the osmoregulation and Glucose metabolism of Litopenaeus vannamei[D]. Qingdao: Ocean University of China, 2011. |
 2015, Vol. 24
2015, Vol. 24


