糖类物质作为三大营养物质之一,是水产饲料中廉价的供能物质。在鱼类饲料中添加适宜水平的糖类物质可以节约蛋白质的使用,增加ATP的形成,有利于氨基酸的活化,促进鱼体自身蛋白质的合成[1]。更重要的是,饲料中糖类物质的添加不仅降低水产养殖的成本,还可以减少氮、磷等对环境的污染,促进水产养殖业的可持续发展。但是,研究表明,鱼类对糖的利用能力不高,饲料中糖水平超过一定的限度会引发鱼类抗病能力降低、生长迟缓、高死亡率等现象[2]。而且,鱼类对糖类物质的利用能力取决于鱼的种类、饲料中糖的水平、来源、分子结构的复杂程度和物理状态[3]。
生长激素(growth hormone,GH)是一种重要的多功能内分泌激素,对脊椎动物具有促进生长、性腺发育等多种生理功能[4],其作用是通过类胰岛素生长因子-Ⅰ(Insulin-like growth factor-Ⅰ,IGF-Ⅰ)介导的。IGF-Ⅰ通过与其蛋白和受体的作用,起着促进细胞增殖与分化、抑制细胞凋亡、调节与生殖和免疫相关激素分泌、增加蛋白质的同化作用、促进葡萄糖的吸收与利用等生理作用[5]。同时,动物体的营养状况又对GH和IGF-Ⅰ的生理活动产生反馈性的影响,GH、IGF-Ⅰ和营养状况三者之间存在着相互调控的关系[6, 7]。
目前,关于不同糖类或糖水平对不同种类鱼生长性能的研究已经很多[8, 9, 10, 11],研究结果表明淡水鱼和温水鱼较海水鱼、冷水性鱼类对糖的利用能力强;草食性和杂食性鱼类对糖的利用能力比肉食性鱼类强。但是缺少关于糖类物质对鱼体氨基酸组成影响,以及对生长轴GH/IGF-Ⅰ基因表达影响的研究报道。鲤鱼作为杂食性鱼类,对糖类物质的利用能力较强,WILSON[12]的研究表明鲤鱼利用淀粉的能力优于葡萄糖,并且能耐受400 g/kg 的糖类物质。王道尊[13]的研究表明鲤饲料中可消化糖的适宜水平是40%。松浦镜鲤是黑龙江水产研究所在德国镜鲤选育系(F4)基础上选育的新品种,具有鳞片少、生长速度快、含肉率高、肉质好等特点,有很高的经济价值。本实验以松浦镜鲤为研究对象,选用葡萄糖和淀粉两种糖源,设置25%低糖和50%高糖两个水平,研究不同糖及糖水平对松浦镜鲤体成分、氨基酸组成和GH/IGF-Ⅰ基因表达的影响。
1 材料和方法 1.1 实验动物及日粮松浦镜鲤选自中国水产科学院黑龙江水产研究所。实验组以酪蛋白和鱼粉为主要蛋白源,鱼油和豆油为脂肪源,葡萄糖和淀粉为糖源,配制糖水平为25%和50%的4种等氮等脂的饲料,具体饲料配方见表1。饲料原料经粉碎按配比混合均匀,少量的组分采用逐级扩大法混合,然后用颗粒机制成2 mm颗粒饲料,置于-20 ℃冰箱中保存待用。
| 表 1 基础饲料配方及营养组成(干重) Tab.1 Ingredients and approximate composition of the basal diets (air-dry basis) |
实验选择规格一致的初始体质量为(8.30±0.15) g的健康松浦镜鲤420尾。预饲2周后随机分组。实验饲料分为4组,分别为高淀粉组(HS)、低淀粉组(LS)、高葡萄糖组(HG)和低葡萄糖组(LG)。每组设3个重复,每个重复35尾鱼。实验周期为60 d,每天定时投喂4次,每次投喂以饱食无残饵为准。实验在室内控温循环水族箱里进行,温度为(24±1) ℃,24 h不间断供氧,溶氧大于5 mg/L,每日吸污,每周换去水族箱内2/3水并注入已曝气的水,每日观察记录鱼摄食和死亡情况。
1.3 GH/IGF-Ⅰ基因的表达量检测养殖实验结束后,各组实验鱼饥饿24 h后,分别喂食各组饲料2 h后,每组随机采3尾鱼,取肝脏组织,立即置于液氮中研磨。利用Trizol法提取肝脏组织总RNA,利用PrimeScriptk® RT Master Mix (TaKaRa,Japan) 试剂盒进行反转录,反转录获得的cDNA保存于-20 ℃,用于GH/IGF-Ⅰ基因相对表达量的检测。
根据GenBank上鲤鱼GH基因序列(M27000.1)和鲤鱼IGF-Ⅰ基因序列(D83272.1)设计Real-time PCR的引物,GH:5′-ATCTTCCCTCTGTCTTTCTGC-3′ (F)和5′-AAGTCGGCCAGCTTCTCA-3′ (R),IGF-I: 5′-AGACAGCCCAAGGACAGCA-3′ (F)和5′-TACAGTGGAGCACATCTCTGGAA-3′ (R)。本实验以 β-actin (JQ619774.1)作为内参, β-actin:5′-GGCAGGTCATCACCATCGG-3′ (F) 和 5′-TTGGCATACAGGTCTTTACGG-3′ (R)。所有引物由上海英潍捷基公司合成。
Real-time PCR反应体系根据SYBR Premix Ex Taq (TaKaRa,Japan)试剂盒说明书进行,采用ABI 7500 Real-time PCR 仪(Applied Biosystems,USA)进行分析。数据分析采用比较CT 法(ΔΔCT)。相对表达量= 2-ΔΔCT=2-(ΔCT处理-ΔCT对照)=2-[(CT处理-CT内参)-(CT对照-CT内参)],数据取3 次重复的平均值。
1.4 体成分测定饲养实验60 d 后,停食24 h,每组随机取9尾鱼,用烘干法测定全鱼体水分,凯氏定氮法测定全鱼粗蛋白(总氮×6.25),灼烧法(550 ℃)测定全鱼粗灰分,索氏抽提法测定粗脂肪。
1.5 全鱼氨基酸组成测定每个实验组随机取9尾全鱼,样品前处理:采用盐酸水解法。将风干样粉碎至过0.125 mm网筛,称取试样50~100 mg,置于安瓿管中,加盐酸水解,抽真空,用喷灯封口,放入(110±1)℃的恒温箱中水解22 h,将水解液转入100 mL容量瓶,用NaOH溶液中和,并定容至100 mL,溶液过滤后用日立L-8900型氨基酸自动分析仪测定。由于酸水解破坏了样品中色氨酸,故色氨酸未测定。
1.6 统计分析方法实验结果用SPSS 20.0软件进行单因素和双因素方差分析,进行Duncan’s 多重比较,用平均值±标准误(Mean±SE)表示结果,显著性水平P为0.05。
2 结果 2.1 GH/IGF-Ⅰ表达量分析喂食后2 h 肝脏中GH和IGF-Ⅰ基因mRNA的相对表达量见图1。LG组的GH基因表达量显著高于HS组和LS组(P < 0.05),HG组的GH基因表达量显著高于HS组(P < 0.05)。饲料中添加葡萄糖的实验组GH基因表达量显著高于饲料中添加淀粉的实验组(P < 0.05)。但糖水平对GH基因表达量没有显著影响。饲料中高水平的糖含量抑制了IGF-Ⅰ基因的表达量。HS组的IGF-Ⅰ基因表达量显著低于LS组和LG组 (P < 0.05);HG组的IGF-Ⅰ基因表达量与各组间差异不显著(P > 0.05)。
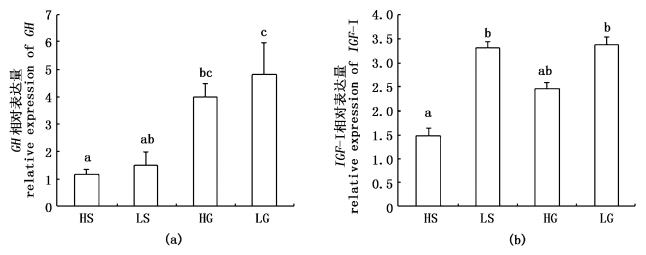
|
图 1
肝脏中GH(a)和IGF-Ⅰ(b)基因相对表达量
Fig.1
The GH(a)and IGF-Ⅰ(b)mRNA expression levels in liver
结果以平均值±标准差形式表示,柱子上不同字母表示基因相对表达量间差异显著(P < 0.05),相同字母则表示差异不显著(P > 0.05)。 The values showed as mean±S.D. Different letters above the bars indicate there was a significantly difference in the relative expression of gene ( |
各实验组的粗蛋白和粗灰分含量差异不显著 (P > 0.05)。HS 组的水分值显著低于其他实验组(P < 0.05),粗脂肪含量显著高于其他各组(P < 0.05)。饲料中糖类型和糖水平对体成分指标不存在显著交互作用(P > 0.05),见表2。
| 表 2 不同糖及糖水平对松浦镜鲤体成分的影响 Tab.2 Effects of dietary carbohydrates and carbohydrates levels on body composition of Songpu mirror carp |
各实验组的氨基酸组成见表3。必需氨基酸组成结果显示,HS 组的Leu含量显著低于LG组 (P < 0.05);其他必需氨基酸含量各组间差异不显著(P > 0.05)。半必需氨基酸组成结果显示,各实验组的His和Arg含量差异不显著(P > 0.05)。非必需氨基酸结果显示,HS组的Cys含量显著低于LG组 (P < 0.05),Ala含量显著低于LS组和LG组 (P < 0.05);其他非必需氨基酸含量各组间差异不显著(P > 0.05)。必需氨基酸总量、非必须氨基酸总量和总氨基酸含量各组间差异不显著(P > 0.05)。饲料糖类型和糖水平对氨基酸组成不存在显著的交互作用(P > 0.05)。
| 表 3 不同糖及糖水平对松浦镜鲤氨基酸组成的影响 Tab.3 Effects of dietary carbohydrates and carbohydrates levels on amino acid composition of Songpu mirror carp |
GH/IGF-Ⅰ轴是调控鱼类生长发育的关键因子之一,能够调控鱼体的生长、能量代谢、繁殖、摄食、渗透压和免疫等多种生理功能。已有报道证实 GH 处理后可以加快脊椎动物身体的生长和发育;并且通过转基因技术,进一步在哺乳动物和鱼类中证实了 GH 对生长的促进作用[14, 15, 16]。在肝脏中,GH的主要功能就是与GHR结合后刺激IGF-Ⅰ的合成与分泌,从而促进组织的生长与分化[17]。对于硬骨鱼类,已有研究报道血浆GH和IGF-Ⅰ 浓度及二者在肝脏中的 mRNA 表达量与饲料蛋白能量比、饲料必需氨基酸(IAA)和非必需氨基酸(DAA)的比例以及饲料蛋白和脂肪来源具很强的相关性[18, 19, 20, 21]。本实验的结果显示,淀粉组的GH表达量显著低于葡萄糖组,HS组的IGF-Ⅰ基因显著低于LS组和LG组,说明高淀粉对GH基因和IGF-Ⅰ基因的表达起到了抑制作用。从特定生长率的结果看,淀粉组与低葡萄糖组的结果差异不显著[22],说明GH和IGF-Ⅰ基因虽然受到了高淀粉的抑制作用,但并未对特定生长率产生影响。研究表明,GH可以抑制脂肪相关基因STAT5的表达[23, 24, 25],从而减少脂肪的含量。因此本实验中高淀粉组的GH基因表达受到抑制,从而促进了脂肪相关基因的表达,致使该组全鱼粗脂肪含量显著高于其他各组。
有研究表明饮食中的碳水化合物会显著降低血浆中色氨酸与大量中性氨基酸的比值(TRP/LNAA)[26],泌乳素和饮食中蛋白质与碳水化合物的比值可以调节哺乳期乳腺的氨基酸转运子SNAT2的表达[27],这些研究说明饮食中碳水化合物的含量会影响氨基酸的组成,但目前,饲料中添加糖类物质对鱼类氨基酸组成的影响研究很少。本实验中HS组的亮氨酸、半胱氨酸和丙氨酸含量均显著低于LG组。这些氨基酸在动物体内都具有特殊的功能:亮氨酸是多种物质如蛋白质的组成成分,是生酮氨基酸,BLOMSTRAND等认为亮氨酸起到类似胰岛素的作用,促进蛋白质的合成[28],其代谢产物酮异己酸能够抑制糖原异生,减缓肌肉蛋白的分解[29];半胱氨酸是非必需氨基酸,在动物体内是通过蛋氨酸和丝氨酸合成的;丙氨酸是生糖氨基酸,能协助葡萄糖代谢。有研究表明,IGF与氨基酸的转运及氨基酸的吸收有关 [30, 31]。在本实验中,高淀粉抑制了IGF-Ⅰ基因的表达,对这些氨基酸的含量产生了影响。必需氨基酸亮氨酸的降低一方面可能影响了其体内氨基酸的代谢通路,进而影响了非必需氨基酸半胱氨酸和丙氨酸的含量,另一方面对糖原异生作用的抑制降低,促使HS组的全鱼脂肪含量显著增加。
4 结论本实验条件下,饲料中添加不同糖和糖水平对松浦镜鲤的GH/IGF-Ⅰ基因表达量、体成分和氨基酸组成都有了显著的影响。饲料中添加高水平的淀粉抑制了GH基因和IGF-Ⅰ基因的表达,同时增加了全鱼粗脂肪含量、降低了一些氨基酸的含量。
| [1] | 谭肖英, 罗智, 刘永坚. 鱼类对饲料中糖的利用研究进展[J]. 中国饲料, 2006, (6): 19-23.TAN X Y, LUO Z, LIU Y J. Review of carbohydrate utilization in fish feed[J]. China Feed, 2006, (6): 19-23. |
| [2] | DIXON D G, HILTON J W. Influence of available dietary carbohydrate content on tolerance of waterborne copper by rainbow trout, Salmo gairdneri Richardson [J]. Journal of Fish Biology, 1981, 19(5): 509-518. |
| [3] | COUTO A, ENES P, PERES H, et al. Effect of water temperature and dietary starch on growth and metabolic utilization of diets in gilthead sea bream (Sparus aurata) juveniles[J]. Comparative Biochemistry and Physiology. Part A: Molecular & Integrative Physiology, 2008, 151(1): 45-50. |
| [4] | LE ROITH D, BONDY C, YAKAR S, et al. The somatomedin hypothesis: 2001 [J]. Endocrine Reviews, 2001, 22(1): 53-74. |
| [5] | JONES J I, CLEMMONS D R. Insulin-like growth factors and their binding protein: biological actions [J]. Endocrine Reviews, 1995, 16(1): 3-34. |
| [6] | RENAVILLE R, HAMMADI M, PORTETELLE D. Role of the somatotropic axis in the mammalian metabolism [J]. Domestic Animal Endocrinology, 2002, 23(1/2): 351-360. |
| [7] | 陈乃松, 周洁, 靳利娜, 等. 禁食对大口黑鲈生长和肝脏IGF-Ⅰ mRNA表达丰度的影响[J]. 中国水产科学, 2010, 17(4): 713-720. CHEN N S, ZHOU J, JIN L N, et al. Effects of fasting on growth and expression abundance of IGF-Ⅰ mRNA in largemouth bass (Micropterus salmoides) [J]. Journal of Fishery Sciences of China, 2010, 17(4): 713-720. |
| [8] | ELLIS S C, REIGH R C. Effects of dietary lipid and carbohydrate levels on growth and body composition of juvenile red drum, Sciaenops ocellatus[J]. Aquaculture, 1991, 97(4): 383-394. |
| [9] | GARCIA-GALLEGO M, BAZOCO J, SANZ A, et al. A comparative study of the nutritive utilization of dietary carbohydrates by eel and trout[C]//KAUSHIK S J, LUQUET P. Fish Nutrition in Practice 6th International Symposium on Fish Nutrition and Feeding.COLLOQUES-INRA, 1994: 939-943. |
| [10] | HUTCHINS C G, RAWLES S D, GATLIN III D W. Effects of dietary carbohydrate kind and level on growth, body composition and glycemic response of juvenile sunshine bass (Morone chrysops♀×M. saxatilis♂) [J]. Aquaculture, 1998, 161(1/4): 187-199. |
| [11] | TIAN L X, LIU Y J, HUNG S S O, et al. Effect of feeding strategy and carbohydrate source on carbohydrate utilization by grass carp (Ctenopharyngodon idella) [J]. American Journal of Agriculture and Biological Sciences, 2010, 5(2): 135-142. |
| [12] | WILSON R P. Utilization of dietary carbohydrate by fish [J]. Aquaculture, 1994, 124(1/4): 67-80. |
| [13] | 王道尊. 鱼用配合饲料[M]. 北京: 农业出版社, 1995: 86-88. WANG D Z, Compound feed for fish [M]. Beijing: Agriculture Press, 1995: 86-88. |
| [14] | CHEN T T, MARSH A G, SHAMBLOTT M, et al. Structure and evolution of fish growth hormone and insulin-like growth factor genes[J]. Fish Physiology, 1994, 13: 179-209. |
| [15] | YOWE D L, EPPING R J. Cloning of the barramundi growth hormone-encoding gene: a comparative analysis of higher and lower vertebrate GH genes[J]. Gene, 1995, 162(2): 255-259. |
| [16] | FORSYTH I A, WALLIS M. Growth hormone and prolactin-molecular and functional evolution [J]. Journal of Mammary Gland Biology and Neoplasia, 2002, 7(3): 291-312. |
| [17] | BECKMAN B R, SHIMIZU M, GADBERRY B A, et al. The effect of temperature change on the relations among plasma IGF-Ⅰ, 41-kDa IGFBP, and growth rate in postsmolt coho salmon [J]. Aquaculture, 2004, 241(1/4): 601-619. |
| [18] | PÉREZ-SÁNCHEZ J, LE BAIL P Y. Growth hormone axis as marker of nutritional status and growth performance in fish [J]. Aquaculture, 1999, 177(1/4): 117-128. |
| [19] | GÓMEZ-REQUENI P, MINGARRO M, KIRCHNER S, et al. Effects of dietary amino acid profile on growth performance, key metabolic enzymes and somatotropic axis responsiveness of gilthead sea bream (Sparus aurata)[J]. Aquaculture, 2003, 220(1/4): 749-767. |
| [20] | GÓMEZ-REQUENIA P, MINGARROA M, CALDUCH-GINERA J A, et al. Protein growth performance, amino acid utilisation and somatotropic axis responsiveness to fish meal replacement by plant protein sources in gilthead sea bream (Sparus aurata) [J]. Aquaculture, 2004, 232(1/4): 493-510. |
| [21] | BENEDITO-PALOS L, SAERA-VILA A, CALDUCH-GINER J A, et al. Combined replacement of fish meal and oil in practical diets for fast growing juveniles of gilthead sea bream (Sparus aurata L.): Networking of systemic and local components of GH/IGF axis [J]. Aquaculture, 2007, 267(1/4): 199-212. |
| [22] | LI J N, XU Q Y, WANG C A, et al. Effects of dietary glucose and starch levels on the growth, haematological indices and hepatic hexokinase and glucokinase mRNA expression of juvenile mirror carp (Cyprinus carpio)[J]. Aquaculture Nutrition, 2015, doi: 10.1111/anu.12278. |
| [23] | RICHTER H E, ALBREKTSEN T, BILLESTRUP N. The role of signal transducer and activator of transcription 5 in the inhibitory effects of GH on adipocyte differentiation[J]. Journal of Molecular Endocrinology, 2003, 30(2): 139-150. |
| [24] | HANSEN L H, MADSEN B, TEISNER B, et al. Characterization of the inhibitory effect of growth hormone on primary preadipocyte differentiation[J]. Molecular Endocrinology, 1998, 12(8): 1140-1149. |
| [25] | CARREL A L, ALLEN D B. Effects of growth hormone on adipose tissue[J]. Journal of Pediatric Endocrinology & Metabolism, 2000, 13(s2): 1003-1009. |
| [26] | WOLEVER T M S, JENKINS D J A, ANDERSON G H. Metabolic response to test meals containing different carbohydrate foods: 2. Plasma amino acid responses and amino acid ratios[J]. Nutrition Research, 1988, 8(6): 583-592. |
| [27] | VELÁZQUEZ-VILLEGAS L A, LÓPEZ-BARRADAS A M, TORRES N, et al. Prolactin and the dietary protein/carbohydrate ratio regulate the expression of SNAT2 amino acid transporter in the mammary gland during lactation[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 2015, 1848(5): 1157-1164. |
| [28] | BLOMSTRAND E, ELIASSON J, KARLSSON H K R, et al. Branched-chain amino acids activate key enzymes in protein synthesis after physical exercise[J]. The Journal of Nutrition, 2006, 136(1): 269S-273S. |
| [29] | GRIINARI J M, MCGUIRE M A, DWYER D A, et al. The Role of insulin in the regulation of milk protein synthesis in dairy cows[J]. Journal of Dairy Science, 1997, 80(10): 2361-2371. |
| [30] | FANG J, MAO D, SMITH C H, et al. IGF regulation of neutral amino acid transport in the BeWo choriocarcinoma cell line (b30 clone): Evidence for MAP kinase-dependent and MAP kinase-independent mechanisms [J]. Growth Hormone & IGF Research, 2006, 16(5/6): 318-325. |
| [31] | TOGAWA M, KIKKAWA R, HANEDA M, et al. Insulin-like growth factor I (IGF-Ⅰ) stimulates glucose and amino acid uptake in cultured glomerular mesangial cells[J]. Journal of Diabetic Complications, 1991, 5(2/3): 184-185. |
 2015, Vol. 24
2015, Vol. 24


