2. 国家海洋局海洋赤潮灾害立体监测技术与应用重点实验室, 上海 200137;
3. 上海交通大学环境科学与工程学院, 上海 200240
聚球蓝细菌(Synechococcus)最早发现于1979年,是微微型(0.5~2.0 μm)球粒状光合自养原核生物[1, 2],是海洋蓝细菌最主要的代表性类群之一。大量研究发现:聚球蓝细菌广泛分布在热带、亚热带和温带[3, 4, 5],在热带和温带海域,其密度通常在103~106 cells/mL[6],在某些海域,如秋季的西北印度洋海域,其表层的蓝细菌密度可高达108 cells/mL[7]。由于聚球蓝细菌在海洋中密度大,生物量循环迅速,能量转换效率高而越来越受到海洋生态学家的重视[8, 9, 10]。聚球蓝细菌是全球碳循环的主要参与者和初级生产力的主要贡献者之一,海洋中的聚球蓝细菌和原绿球藻每年要从大气中吸收约1×1010 t碳,相当于海洋固定大气二氧化碳总量的三分之二[10]。在贫营养的地中海,聚球蓝细菌对浮游植物总生物量超过50%,是光合作用生产量的主要贡献者[11]。在热带太平洋,聚球蓝细菌对浮游植物总生物量的贡献达25%~90%,对总初级生产力的贡献达20%~80%[8];而在世界大多数海区,聚球蓝细菌对浮游植物的总生物量贡献达20%,对总初级生产力的贡献达60%[12]。因此,聚球蓝细菌被公认为存在于世界海洋的大多数海区中是,浮游植物的一个重要组成部分[10, 13, 14]。
自20世纪80年代以来我国也开展了大量相关的调查与研究工作。宁修仁等1986年在长江口海域开展了聚球蓝细菌分布的相关调查[9],黄邦钦等在1997-1998年对台湾海峡、厦门西侧海域的聚球蓝细菌开展了分布、生长速率等相关调查与实验研究[15, 16, 17]。孙晟等2000-2001年对我国东、黄海的聚球蓝细菌的生态分布特征开展了研究[18]。白晓歌等在2006年夏季和冬季对我国北黄海开展了聚球藻以及水文参数间的相关性调查研究[19],宋洪军等2006年对我国南黄海聚球蓝细菌的生态分布特征也开展了相关的调查与研究工作[20]。近年来尚未有对东海海域聚球蓝细菌及其生态环境的大规模调查研究的报道,本文通过对东海聚球蓝细菌密度、生态环境要素的测定,阐明其生态分布及其与环境要素相关性的分析,为进一步了解聚球蓝细菌在生态动力学及生物地球化学循环中的作用提供科学依据。
1 材料与方法 1.1 调查区域与站位设置2006年7-8月对东海(26°~30°N,120°~127.5°E)进行了调查,共设15条断面,91个大面站(图1)。
|
图1 采样站位分布示意图 Fig.1 Map of the sampling stations |
样品的采集与保存按照《我国近海海洋综台调查与评价专项技术规程》[21]进行。各调查站位根据水深设定0.5 m、10 m、30 m和底层。聚球蓝细菌水样采用CTD带的Niskin(2 L)采水器采集,水样(体积50 mL)采用多聚甲醛固定(终浓度为1%),样品经液氮速冻后存放于低温冰箱(-20 ℃)内。
1.3 聚球蓝细菌的计数及生物量的计算方法计数取水样20 mL,抽滤到直径为25 mm、孔径为0.2 μm的黑色核孔滤膜上,抽滤负压不超过50 kPa,将滤膜放在载玻片上,在滤膜上加一滴水样,盖上盖玻片。用落射荧光显微镜(Leica DMLA,50W高压汞灯,蓝色光道) 10倍目镜、40倍物镜下进行计数,随机取至少20个视野计数具有光亮的桔黄色荧光的聚球蓝细菌细胞[21]。
聚球蓝细菌密度计算公式:

聚球蓝细菌的生物量占浮游植物生物量的百分比(CB/PB)为聚球蓝细菌生物量与浮游植物生物量的比值。其中,聚球蓝细菌生物量(CB)按细胞含碳量按150 fgC/cell[18, 22]计算,浮游植物生物量(PB)按照叶绿素a与C单位之间转换,根据经验常数每单位的叶绿素相当于43单位的C得出[22]。
1.4 其他环境理化参数的测定其他理化参数:叶绿素a采取萃取荧光法测定,活性磷酸盐采取抗坏血酸还原磷钼蓝法测定,硝酸盐采用锌镉还原法,亚硝酸盐采用重氮-偶氮法,铵盐采用次溴酸钠氧化法,水温、盐度、浊度采用CTD法测定,具体方法按照《我国近海海洋综合调查与评价专项技术规程》执行。
1.5 相关性分析利用Pearson相关分析的方法对聚球蓝细菌细胞密度、聚球蓝细菌生物量占浮游植物总生物量的百分比(CB/PB)与环境要素的相关性进行分析,相关数据处理利用SPSS 11.5统计软件进行。
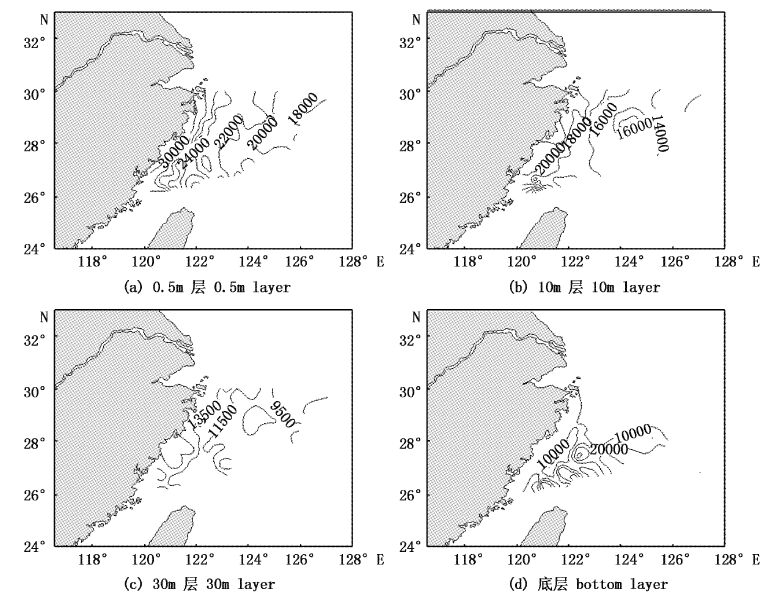
2 结果 2.1 水平分布特征调查海域聚球蓝细菌平均细胞密度为1.65×104 cells/mL,变化范围为1.21×104~5.24×104 cells/mL,生物量平均值为4.85 μgC/L,变化范围为0.84~7.86 μgC/L。0.5 m层和10 m层聚球蓝细菌平均密度分别为2.33×104 cells/mL和1.74×104 cells/mL,其水平分布规律基本一致,等值线基本与浙江沿岸海岸线平行,呈现由近岸向外部海域递减的趋势,而未呈现明显的南北变化差异。30 m层和底层聚球蓝细菌平均密度分别为1.21×104 cells/mL和1.25×104 cells/mL,细胞密度明显要低于0.5 m和10 m层。其中,30 m层水平分布上总体较为均匀,底层水平分布上北部海域水平分布变化差异较小,南部海域则表现为外部高于近岸海域,呈现由近岸向东南外部海域递增的趋势(图2)。
|
图2 东海海域夏季聚球蓝细菌细胞密度水平分布图(cells/mL) Fig.2 Horizontal distribution of Synechococcus abundance in the East China Sea in summer(cells/mL) |
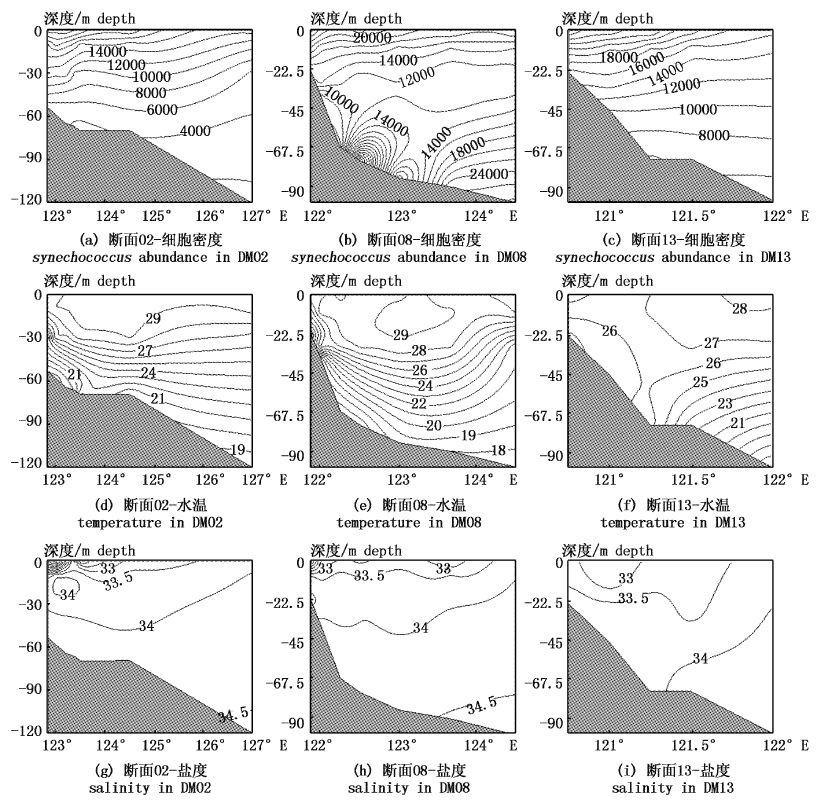
由于调查海域面积较大,本文由南至北分别选取了3条较为典型的断面(DM02、DM08、DM13)对聚球蓝细菌及水温、盐度环境分布情况进行分析。
DM02断面:平均细胞密度为1.34×104 cells/mL,变化范围为1.55×103~2.53×104 cells/mL。该断面夏季垂向分布特点显著,海水稳定度大,垂向混合最弱,垂直分层现象明显,呈现由0.5 m层向底层逐渐递减的趋势(图3)。
|
图3 DM02、DM08、DM13断面聚球蓝细菌细胞密度(cells/mL)、水温(℃)和盐度垂直分布图 Fig.3 Vertical distribution of Synechococcus abundance,temperature and salinity in DM02,DM08 and DM13 sections |
DM08断面:平均细胞密度为1.79×104 cells/mL,变化范围为4.47×103 ~ 4.32×104 cells/mL,从垂直分布上,30 m以浅的水体中细胞数量呈现由0.5 m层向下逐渐递减的趋势,层化现象较为明显,40 m以深海域则呈现逐渐向底层递增的趋势,最高达到4.32×104 cells/mL。西半部为大于34的高盐水,沿斜坡向近岸爬升至40深处,断面东半部,30 m以深为大于34的高盐水占据;水温的垂直分布与DM02断面相似,垂向水温上分3层结构:0.5 m层水温高于28 ℃;而近底层水温低于18 ℃,下层低温水沿斜坡向近岸爬升显著;上、下层之间为温跃层,深度介于5~80 m之间,断面西半部跃层强度较大而跃层厚度较小,相反断面东半部跃层强度较小而跃层厚度较大(图3)。
DM13断面:平均细胞密度为1.60×104 cells/mL,变化范围为4.89×103 ~2.95×104 cells/mL。垂直分布上层化现象明显,明显呈现由0.5 m层向底层逐渐递减的趋势。而盐度垂向上变化较小,34的高盐水向近岸侵入有限,高盐水沿斜坡向近岸仅爬升至60~70 m深处。该断面121.3°E以西海域,水温高且分布较为均匀;121.3°E以东海域水温层化显著。垂向上同样也分3层结构:0.5 m层水温高于28 ℃;而近底层水温低于16 ℃,下层低温水被阻挡在锋面以东,沿斜坡向近岸爬升实力较弱(图3)。
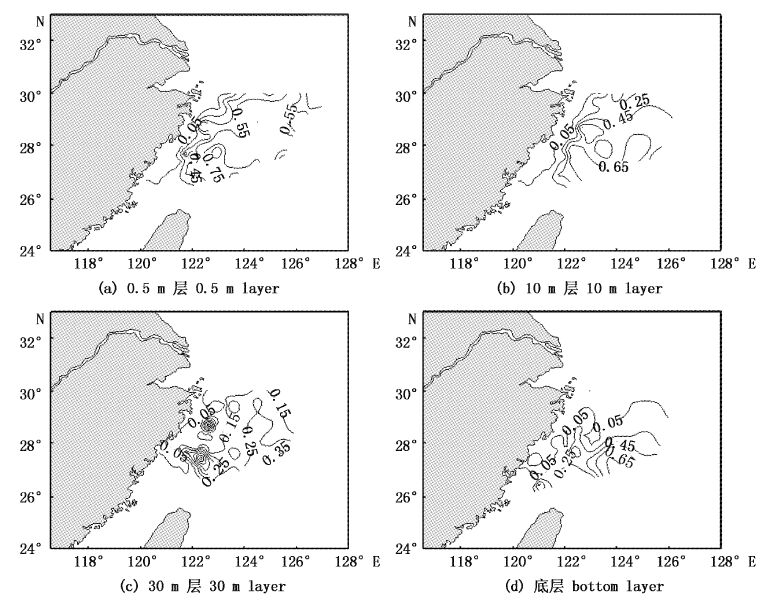
2.3 聚球蓝细菌生物量占浮游植物总生物量的百分比总体上CB/PB与叶绿素a浓度水平分布趋势基本呈相反趋势,叶绿素a含量区域主要在近岸海域,而CB/PB较高区域主要是外部海域。调查海域聚球蓝细菌的生物量占浮游植物生物量的百分比(CB/PB)平均为22.65%,变化范围为0.61%~95.49%。
0.5 m层水体CB/PB平均值为31.38%,变化范围为0.71%~95.49%,水平分布呈现由近岸向外部海域逐渐递增的趋势,近岸等值线密集,且基本与海岸线平行,外部较为稀疏,并在外部海域形成高值区;CB/PB与叶绿素a含量水平分布呈相反的变化趋势,CB/PB高值区主要集中在外部海域,而叶绿素a含量高值区则主要集中在近岸海域。10 m层,CB/PB平均值为15.81%,变化范围为0.79%~90.12%,水平分布趋势基本与0.5 m层水体一致,呈现由近岸向外海递增的趋势,同时呈现北部向南部海域递增的趋势,并在南部外海形成高值区,CB/PB与叶绿素a含量水平分布趋势的关系基本与0.5 m层水体一致,呈相反变化趋势。30 m层CB/PB平均值为30.00%,变化范围为0.61%~84.42%,分布趋势与0.5 m层和10 m层有所区别,分别在调查海域中部和南部形成两个高值区;底层CB/PB平均值为14.36%,变化范围为1.53%~94.19%,水平分布趋势与0.5 m层和10 m层较类似,呈现由近岸向外、由北向南递增的趋势,并在南部外海海域形成高值区,该区域CB/PB高达40%以上(图4)。
|
图4 东海海域夏季CB/PB水平分布图(cells/mL) Fig.4 Horizontal distribution of CB/PB in the East China Sea in summer |
聚球蓝细菌细胞密度及CB/PB与环境要素的相关性分析结果表明:细胞密度与CB/PB、叶绿素a及水温呈显著性正相关(P<0.01),与硝酸盐、总无机氮和活性磷酸盐成显著性负相关(P<0.01),而与亚硝酸盐、铵盐以及悬浮物浓度相关性不显著。CB/PB与水温成显著性正相关(P<0.01),与叶绿素a、硝酸盐、亚硝酸盐、总无机氮、活性磷酸盐和浊度成显著性负相关(P<0.01),与铵盐、盐度和悬浮物相关性不显著(表1)。
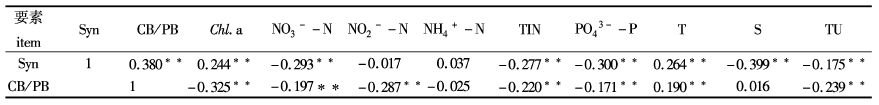
|
表1 聚球藻细胞密度及其占浮游植物生物量百分比与环境因子的相关性分析 Tab. 1 The correlation coefficient between Synechococcus abundance and CB/PB and environmental factors |
本文聚球蓝细菌细胞密度水平和垂直分布特征为近岸高于外部海域,0.5 m层和10 m层明显高于30 m层和底层,各层之间层化现象明显。受多个方面的因素影响,主要包括营养盐、光照、水温和海流等。
本文研究结果表明该海域营养盐分布趋势呈现由近岸向外部海域递减的趋势,已有研究表明大部分聚球蓝细菌能利用硝酸盐和氨做为它们生长所需的氮源[23, 24],近岸高浓度营养盐对聚球蓝细菌的生长有一定的促进作用。同时相关性分析结果表明,聚球蓝细菌密度水平分布与营养盐分布趋势并不一致,其主要原因为近岸大部分海域呈富营养化,营养盐基本处于过剩状态,因此营养盐基本上不能成为影响聚球蓝细菌生长的主要因素,而在外部海域由于营养盐含量的下降,其逐渐成为影响聚球蓝细菌生长的因素之一。同时由于聚球蓝细菌自身的生物学特性:粒径小、比表面积大,因此即使在寡营养海域仍能够生长良好,据报道聚球蓝细菌在磷酸盐含量处于nmol/L级水平上仍可生长[25],形成以其为起点的微食物网,作为经典食物链的补充,从而维持生态系统的稳定性。
聚球蓝细菌密度与水温呈现明显的正相关性,其细胞密度总体水平分布规律与水温水平分布规律也较为吻合。根据WATERBURY研究调查发现:聚球蓝细菌最适生长温度较高,为17~25 ℃[26],而根据VAULOT和TARRAN研究结果认为,聚球蓝细菌适宜生长范围在20~25 ℃[23, 24]。此次调查结果表明:夏季调查海域海水平均温度为25.67 ℃,变化范围为15.86 ~ 30.59 ℃,基本处于聚球蓝细菌最适生长水温。虽然在相关性程度上有所争议[27, 28, 29],但现有大量研究结果一致认为水温为影响聚球蓝细菌的主要影响因素[30, 31]。
聚球蓝细菌垂直分布特征主要由其生长方式决定。聚球蓝细菌主要通过光合作用,利用无机营养盐进行自身生长,光照对其生长具有较明显的影响[32],因此表层和10 m层细胞密度明显高于30 m和底层。同时由于其浮游生物的特性,分布受海流的影响较为明显。根据水温和盐度调查结果显示,夏季该海域水体稳定度大,垂向混合弱,只有30 m以浅水体混合较为充分,因此这也很程度上影响了聚球蓝细菌的垂向分布。
根据CB/PB与叶绿素a相关性分析发现:两者呈显著负相关性,对比CB/PB和叶绿素a水平分布规律发现,CB/PB高值区基本处于外部海域,而近岸海域CB/PB则相对较低,而叶绿素a含量则明显呈现近岸高、外部低的分布规律。其主要为受近岸营养盐含量较高的影响,浮游植物在近岸的生长以及对浮游植物总生物量的贡献较为明显,而营养盐较为贫乏的外部海域,浮游植物的生长受营养盐条件的限制,而聚球蓝细菌由于对营养盐条件的要求相对较低,因此在对浮游植物总生物量的贡献上明显提升,这与BURKILL等人的研究结果一致,认为在寡营养海域,聚球蓝细菌是初级生产力的主要贡献者[33]。
4 结论水温和光照是影响聚球蓝细菌生长的重要因素之一。东海海域夏季聚球蓝细菌生物量分布具有非常鲜明的特点:近海生物量高于外海,受夏季水体垂向混合弱、水体层化的影响,聚球蓝细菌细胞垂向分布上层化现象明显。聚球蓝细菌生物量在总浮游植物生物量中所占比例平均为22.65%,其高值区主要分布在营养盐水平相对较低的外海。
| [1] | JOHNSON P W, SIEBURTH J M. Chroococcoid cyanobacteria in the sea:A ubiquitous and diverse phototrophic biomass[J]. Limnology and Oceanography, 1979, 24(5):928-935. |
| [2] | WATERBURY J B, WATSON S W, GUILLARD R R L, et al. Widespread occurrence of a unicellular, marine, planktonic, cyanobacterium[J]. Nature, 1979, 277(5694):293-294. |
| [3] | STOCKNER J G, ANTIA N J. Algal picoplankton from marine and freshwater ecosystems:multidisciplinary perspective[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1986, 43(12):2472-2503. |
| [4] | STOCKNER J G. Phototrophic picoplankton:An overview from marine and freshwater ecosystems[J]. Limnology and Oceanography, 1988, 33(4):765-775. |
| [5] | STOCKNER J G. Autotrophic picoplankton in freshwater ecosystems:The view from the summit[J]. Internationale Revue der gesamten Hydrobiologie und Hydrographie, 1991, 76(4):483-492. |
| [6] | MURPHY L S, HAUGEN E M. The distribution and abundance of phototrophic ultraplankton in the North Atlantic[J]. Limnology and Oceanography, 1985, 30(1):47-58. |
| [7] | BURKILL P H, LEAKEY R J G, OWENS N J P, et al. Synechococcus and its importance to the microbial foodweb of the northwestern Indian Ocean[J] Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 1993, 40(3):773-782. |
| [8] | LI W K W, SUBBA RAO D V, HARRISON W G, et al. Autotrophic picoplankton in the tropical ocean[J]. Science, 1983, 219(4582):292-295. |
| [9] | 宁修仁,沃格D.长江口及其毗连东海水域蓝细菌的分布和细胞特性及其环境调节[J].海洋学报, 1991, 13(4):552-559.NING X R, VAULOT D. The distribution and cell characteristicsof cyanobacteria and its environmental regulation in Yangtze Riverestuary and adjacent East China Sea[J]. Acta Oceanologica Sinica, 1991, 13(4):552-559. |
| [10] | ITURRIAGA R, MITCHELL B G. Chroococcoid cyanobacteria:a significant component in the food web dynamics of the open ocean[J]. Marine Ecology Progress, 1986, 28:291-297. |
| [11] | UYSAL Z. Vertical distribution of marine cyanobacteria Synechococcus spp. in the Black, Marmara, Aegean, and eastern Mediterranean seas[J]. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 2006, 53(17/19):1976-1987. |
| [12] | CARON D A, LIM E L, MICELI G, et al. Grazing and utilization of chroococcoid cyanobacteria and heterotrophic bacteria by protozoa in laboratory cultures and a coastal plankton community[J]. Marine Ecology Progress, 1991, 76(3):205-217. |
| [13] | 焦念志,杨燕辉.四类海洋超微型浮游生物的同步监测[J].海洋与湖沼, 1999, 30(5):506-511.JIAO N Z, YANG Y H. Simultaneous monitoring of autotrophic picoplankton and heterotrophic bacteria[J]. Oceanologia et Limnologia Sinica, 1999, 30(5):506-511. |
| [14] | 肖天,王荣.东海异养细菌生产力的时空分布[J].海洋与湖沼, 2000, 31(6):664-670.XIAO T, WANG R. Distribution of heterotrophic bacterial production in the East China Sea[J]. Oceanologia et Limnologia Sinica, 2000, 31(6):664-670. |
| [15] | 黄邦钦,洪华生,林学举,等.台湾海峡微微型浮游植物的生态研究Ⅰ.时空分布及其调控机制[J].海洋学报, 2003, 25(4):72-82.HUANG B Q, HONG H S, LIN X J, et al. Ecological study on picophytoplankton in the Taiwan Strait Ⅰ. spatial and temporal distribution and its controlling mechanism[J]. Acta Oceanologica Sinica, 2003, 25(4):72-82. |
| [16] | 黄邦钦,洪华生,林学举,等.台湾海峡微微型浮游植物的生态研究Ⅱ.类群组成、生长速率及其影响因子[J].海洋学报, 2003, 25(6):99-105.HUANG B Q, HONG H S, LIN X J, et al. Ecological study on picophytoplankton in the Taiwan StraitⅡ. group composition, growth rate and its affecting factors[J]. Acta Oceanologica Sinica, 2003, 25(6):99-105. |
| [17] | 黄邦钦,林学举,洪华生.厦门西侧海域微微型浮游植物的时空分布及其调控机制[J].台湾海峡, 2000, 19(3):329-336.HUANG B Q, LIN X J, HONG H S. Distribution and environmental controlling of picophytoplankton in western Xiamen waters[J]. Journal of Oceanography in Taiwan Strait, 2000, 19(3):329-336. |
| [18] | 孙晟,肖天,岳海东.秋季与春季东、黄海蓝细菌(Synechococcus spp.)生态分布特点[J].海洋与湖沼, 2003, 34(2):161-168.SUN S, XIAO T, YUE H D. Distribution character of Synechococcus spp. in the East China Sea and the Yellow Sea in autumn and spring[J]. Oceanologia et Limnologia Sinica, 2003, 34(2):161-168. |
| [19] | 白晓歌.北黄海浮游病毒的丰度变化及其与微微型浮游植物、异养细菌相关性研究[D].青岛:中国海洋大学, 2007.BAI X G. Analysis of virioplankton abundance and correlation with picoplankton and heterotrophic bacteria in the Northern Yellow Sea[D]. Qingdao:Ocean University of China, 2007. |
| [20] | 宋洪军.南黄海夏冬两季超微型浮游植物初步研究[D].青岛:国家海洋局第一海洋研究所, 2007.SONG H J. A preliminary study of ultraphytoplankton in the Southern Yellow Sea in summer and winter[D]. Qingdao:The First Institute of Oceanography, SOA, 2007. |
| [21] | 国家海洋局.我国近海海洋综合调查与评价专项技术规程[S].北京:海洋出版社, 2006.State Oceanic Administration. Technical specification for comprehensive survey and evaluation of offshore marine in China[S]. Beijing:Marine Press, 2006. |
| [22] | WANG R, FAN C L. Copepods feeding activities and its contribution to downwards vertical flux of carbon in the East China Sea[J]. Oceanologia et Limnologia Sinica (in Chinese), 1997, 28(6):579-587. |
| [23] | VAULOT D, LEBOT N, MARIE D, et al. Effect of phosphorus on the Synechococcus cell cycle in surface Mediterranean waters during summer[J]. Applied and Environmental Microbiology, 1996, 62(7):2527-2533. |
| [24] | TARRAN G A, ZUBKOV M V, SLEIGH M A, et al. Microbial community structure and standing stocks in the NE Atlantic in June and July of 1996[J]. Deep-Sea Research Ⅱ, 2001, 48(4/5):963-985. |
| [25] | IKERA T, OHKI K, TAKAHASHI M, et al. Study on phosphate uptake of the marine cyanophyte Synechococcus sp. NIBB 1071 in relation to oligotrophic environments in the open ocean[J]. Marine Biology, 1997, 129(1):195-202. |
| [26] | WATERBURY J B, WATSON S W, VALOIS F W, et al. Biological and ecological characterization of the marine unicellular cyanobacterium Synechococcus[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1986, 214:71-120. |
| [27] | 肖天,王荣.春季与秋季渤海蓝细菌(聚球蓝细菌属)的分布特点[J].生态学报, 2002, 22(12):2071-2078.XIAO T, WANG R. Distribution of Synechococcus in the Bohai Sea in autumn and spring[J]. Acta Ecologica Sinica, 2002, 22(12):2071-2078. |
| [28] | XIAO T, JIAO N Z, WANG R. Quantitative distribution of cyanobacteria and bacteria in Jiaozhou Bay[M]//DONG J, JIAO L. Study on Ecology of Jiaozhou Bay. Beijing:Science Press, 1995:118-124. |
| [29] | 赵三军,肖天,李洪波,等.胶州湾聚球菌(Synechococcus spp.)蓝细菌的分布及其对初级生产力的贡献[J].海洋与湖沼, 2005, 36(6):534-540.ZHAO S J, XIAO T, LI H B, et al. Distribution of Synechococcus spp. in Jiaozhou Bay[J]. Oceanologia et Limnologia Sinica, 2005, 36(6):534-540. |
| [30] | CHIANG K P, KUO M C, CHANG J, et al. Spatial and temporal variation of the Synechococcus population in the East China Sea and its contribution to phytoplankton biomass[J]. Continental Shelf Research, 2002, 22(1):3-13. |
| [31] | JIAO N Z, YANG Y H, HONG N, et al. Dynamics of autotrophic picoplankton and heterotrophic bacteria in the East China Sea[J]. Continental Shelf Research, 2005, 25(10):1265-1279. |
| [32] | 张昊飞,王金辉,刘材材.聚球蓝细菌赤潮及生态学意义[J].海洋环境科学, 2008, 27(s1):105-108.ZHANG H F, WANG J H, LIU C C. Synechococcus spp. bloom and its ecological significance[J]. Marine Environmental Science, 2008, 27(s1):105-108. |
| [33] | BURKILL P H, LEAKEY R J G, OWENS N J P, et al. Synechococcus and its importance to the microbial foodweb of the northwestern Indian Ocean[J]. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 1993, 40(3):773-782. |
2. Key Laboratory of Integrated Monitoring and Applied Technology for Marine Harmful Algal Blooms, SOA, Shanghai 200137, China;
3. School of Environmental Science and Engineering, Shanghai Jiaotong University, Shanghai 200240, China
 2015, Vol. 24
2015, Vol. 24

