2. 山东省农产品贮运保鲜技术重点实验室, 山东 济南 250103;
3. 山东省淡水渔业科学研究院, 山东 济南 250117
黄霉素(Flavomycin)可以通过干扰细胞壁的结构物质肽聚糖的生物合成来抑制细菌的繁殖,具有抗菌作用强、性能稳定、不易产生耐药性等优点,且有研究证实,其对鲤(Cyprinus carpio)[1]、草鱼(Ctenopharyngodon idellus)[2]和异育银鲫(Carassius auratus gibelio)[3]等均有一定的促生长效果,曾被广泛地应用于水产饲料中。喹烯酮(Quinocetone) 作为喹乙醇的合理替代品,是我国在国际上首创的一类新兽药,在水产上,其可以有效地提高养殖动物的成活率,并且对水质也有一定的改良作用[4-5]。但作为抗菌素药物的通性,随着水产养殖集约化模式的发展,滥用乱用必会带来药物残留、耐药菌株的产生以及环境污染的各种问题,农业部发布的《饲料添加剂品种目录(2013)》禁止了抗生素作为饲料添加剂在养殖业的应用,因此业界不得不寻求健康无污染的生态制剂来代替。枯草芽孢杆菌(Bacillus subtilis)作为一种新型的微生态制剂,具有耐酸、耐碱、耐高温和耐挤压的优点,在动物肠道代谢增殖过程中可起到调节肠道菌群、增强消化酶活性、提高免疫力和抗病性的作用[6],并且安全无残留。目前,枯草芽孢杆菌在畜禽[7-8]和水产上[9-11]已经在一定范围内进行了研究与应用,但是有关枯草芽孢杆菌对鲤的免疫相关酶活性以及与抗菌素的比较研究尚未见报道,本试验通过比较枯草芽孢杆菌与黄霉素、喹烯酮对于鲤幼鱼生长、消化酶和免疫相关酶活性的影响,探索以其替代这两种抗菌素的可行性,为制备鲤无抗饲料提供理论依据。
1 材料与方法 1.1 试验材料试验鱼先用基础饲料每天以体质量的2.0%~2.5%投喂驯化7 d,试验开始时选用身体健康、大小均一的鲤幼鱼,随机分成4个处理,每个处理3个平行,每个平行放养30尾,试验鱼平均体质量为(24.39±0.30) g。基础饲料配方参照鲤营养需求与饲料标准[12]设计,由济南金三沅饲料厂加工成直径为2 mm的颗粒饲料,阴干后保存于4 ℃的冷库备用。G1、G2和G3组在基础饲料中分别添加进口黄霉素(4 mg/kg,富乐旺)、喹烯酮(125 mg/kg,济南旭博生物科技有限公司)和枯草芽孢杆菌(300 mg/kg,济南同创生物技术有限公司),含量为2×1010 cfu/g,三者的添加量分别参考任泽林等[1]、杨莉[13]和徐文彦等[14]的相关研究。基础饲料配方及营养成分见表 1。

|
表 1 基础饲料配方及营养组成 Tab.1 Formulation and chemical composition of the basal diet |
试验在国家农产品现代物流工程技术研究中心(济南)的水产动物养殖实验室内进行,采用循环养殖系统,试验鱼饲养于12个直径80 cm高80 cm的圆柱形水桶中,盛200 L经充分曝气的自来水,每隔两天换水10%,每日定时、定点、定量投喂3次(8:30,14:30,20:30),投喂量为鱼体质量的3.0%~4.0%,并根据摄食情况适当调节,保持充气。饲养时间为56 d,期间水温25~30 ℃,pH 7.1~7.3,溶解氧为5.7~6.5 mg/L,铵态氮含量<0.4 mg/L,亚硝酸盐氮含量<0.064 mg/L。
1.3 测定指标及方法 1.3.1 样品制备养殖试验结束后先禁食24 h,记录各桶鱼的数量及总质量,计算增重率、投饵系数和成活率。每桶取6尾鱼,测量体质量、体高和体长,计算肥满度,再用经抗凝剂湿润的注射器从尾静脉取血,3 000 r/min离心10 min,制得血清后分装于1.5 mL Eppendorf管中,并立即保存于-20 ℃的冰箱内备用,采样鱼经解剖后取内脏称重,剥离出肝胰脏、后肠和侧线上方的肌肉,肝胰脏称重,并保存于-20 ℃的冰箱中备用。
1.3.2 生长性能指标 (1)
(1)
式中:WGR为增重率;W1为末均重;W0为初均重。
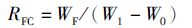 (2)
(2)
式中:RFC为投饲系数;WF为投饵量;W1为末均重;W0为初均重。
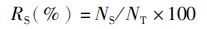 (3)
(3)
式中:RS为成活率;NS为成活尾数;NT为总尾数。
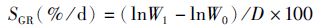 (4)
(4)
式中:SGR为特定增长率;lnW1为末均重;lnW0为初均重;D为饲养天数。
1.3.3 形体指标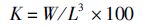 (5)
(5)
式中:K为肥满度;W为体质量;L为体长。
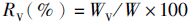 (6)
(6)
式中:RV为脏体比;WV为内脏重;W为体质量。
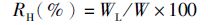 (7)
(7)
式中:RH为肝体比;WL为肝胰脏重;W为体质量。
1.3.4 肌肉成分分析将肌肉4 ℃解冻后剁碎制成肉糜,采用105 ℃恒重法(GB/T 5009)先测定水分,将剩余的干物质碾碎后过40目筛,混合均匀,分别采用灰化法(GB/T 6438—2007)、凯氏定氮法(GB/T 6432—94)和氯仿-甲醇提纯法[15]测定其粗灰分、粗蛋白和粗脂肪。
1.3.5 消化指标的测定粗酶液的制备:分别取1.0 g左右的后肠和肝胰脏加入9倍体积0.86%的预冷生理盐水,剪碎后冰浴匀浆(8 000 r/min,10 s/次,连续4次),再在4 ℃、3 000 r/min的条件下离心10 min,取上清液测定酶活性和组织中总蛋白含量。
蛋白酶和脂肪酶活性的测定分别采用福林酚法和聚乙烯醇橄榄油乳化法[16],蛋白酶活力的定义为1 mL酶液在40 ℃条件下,1 min水解酪素产生1 μg酪氨酸为一个酶活力单位。脂肪酶活力的定义为40 ℃、pH=7.5的条件下,脂肪酶水解脂肪每分钟产生1 μg脂肪酸的酶量定义为一个活力单位。淀粉酶活性和组织中总蛋白质含量均采用南京建成生物工程研究所的试剂盒测定。
1.3.6 免疫指标的测定血清溶菌酶(LSZ)、超氧化物歧化酶(SOD)、碱性磷酸酶(AKP)、谷草转氨酶(GOT)和谷丙转氨酶(GPT)的活性均采用南京建成生物工程研究所的试剂盒测定。
LSZ采用比浊法中的空白对照法,含量(U/mL) =(测定管透光度UT15-空白管透光度OT15)/(标准管透光度ST15-空白管透光度OT15)×标准管浓度(200 U/mL)×样本测试前稀释倍数)。
SOD采用黄嘌呤氧化酶法,1个SOD活力单位(U)定义为每毫升血清中SOD抑制率达50%时对应的酶量。
1个AKP金氏单位定义为100 mL血清在37 ℃与基质作用15 min产生1 mg酚的量。
GOT和GPT含量(U/g)通过绝对吸光度查标准曲线求得。
1.4 数据统计与分析试验数据以平均值±标准误(Mean±SE)表示,采用SPSS 19.0对所得数据进行单因素方差分析,若差异性显著,则进行Duncan氏多重比较,显著水平为P<0.05。
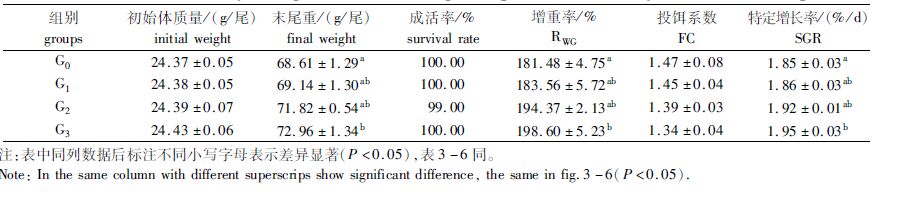
2 结果 2.1 3种添加剂对鲤幼鱼生长性能的影响从表 2可以看出,添加300 mg/kg的枯草芽孢杆菌对鲤幼鱼具有显著的促生长作用(P<0.05),增重率和特定增长率分别比对照组(G0组)提高了9.43%和5.41%,而添加4 mg/kg的进口黄霉素或125 mg/kg的喹烯酮对鲤幼鱼的生长指标没有显著作用。
|
表 2 3种添加剂对鲤幼鱼生长性能的影响 Tab.2 Effect of dietary adding three additives on growth performance of the juvenile common carp |
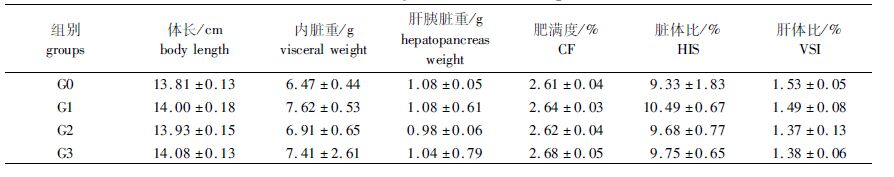
由表 3可知,无论是添加300 mg/kg的枯草芽孢杆菌,还是4 mg/kg的进口黄霉素或125 mg/kg的喹烯酮喂养鲤幼鱼,对其形体指标和内脏指数均没有显著影响。
|
表 3 3种添加剂对鲤幼鱼形体指标和内脏指数的影响 Tab.3 Effect of dietary adding three additives on physical indicators and visceral index of the juvenile common carp |
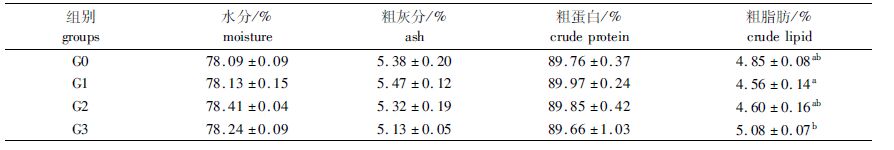
从表 4可知,各试验组鲤幼鱼肌肉中的水分、粗灰分和粗蛋白含量均无显著性差异(P>0.05),而添加枯草芽孢杆菌的G3组鱼体的粗脂肪含量显著高于添加黄霉素的G1组(P<0.05),而与添加喹烯酮的G2组以及对照G0组均未见显著性差异(P>0.05)。
|
表 4 3种添加剂对鲤幼鱼肌肉成分的影响 Tab.4 Effect of dietary adding three additives on muscle composition of the juvenile common carp |
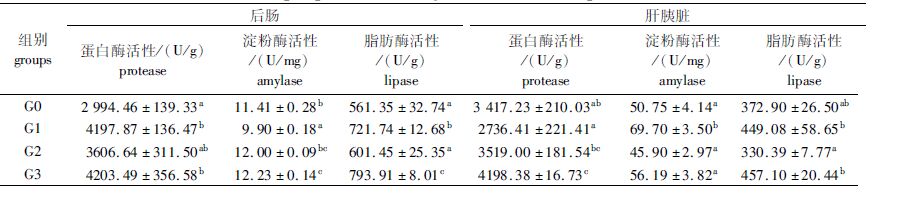
由表 5可知,添加300 mg/kg的枯草芽孢杆菌可以显著提高鲤幼鱼后肠蛋白酶、肝胰脏蛋白酶、后肠淀粉酶的活性(P<0.05),因此,枯草芽孢杆菌对鲤幼鱼具有显著的促消化作用(P<0.05);添加4 mg/kg的进口黄霉素可显著提高后肠蛋白酶、脂肪酶以及肝胰脏淀粉酶的活性(P<0.05),对鲤幼鱼也具有一定的促进消化作用,而添加125 mg/kg的喹烯酮则未见显著的促消化效果(P>0.05),此外,在对后肠脂肪酶活性的促进作用中,枯草芽孢杆菌组显著高于黄霉素组(P<0.05)。
|
表 5 3种添加剂对鲤幼鱼后肠和肝胰脏消化酶活性的影响 Tab.5 Effect of dietary adding three additives on digestive enzymes activities in hind gut and hepatopancreas of the juvenile common carp |
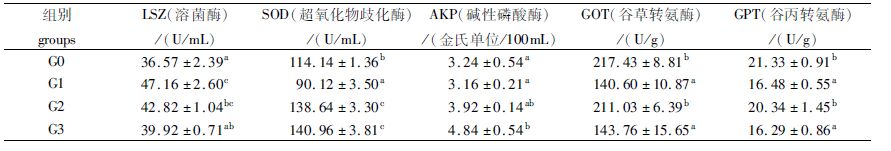
由表 6可知,添加300 mg/kg枯草芽孢杆菌血清SOD和AKP的含量分别较对照组提高23.50%和49.38%(P<0.05),GOT和GPT分别较对照组降低33.88%和23.62%(P<0.05),对LSZ活性则没有显著性影响(P>0.05);添加4 mg/kg的进口黄霉素可显著降低GOT及GPT的含量(P<0.05,35.34%,23.63%),喹烯酮组SOD的活性则提高21.46%(P<0.05);而且,这两种抗菌素可分别显著提高28.96%、17.09%的血清LSZ含量(P<0.05)。
|
表 6 3种添加剂对鲤血清非特异性免疫相关酶活性的影响 Tab.6 Effect of dietary adding three additives on immunity enzymes in serum of the juvenile common carp |
枯草芽孢杆菌的促生长原理是菌体含有大量营养物质,如蛋白质、矿物质和维生素等,可以起到营养补充的效果,且其在代谢过程中产生的多种酶类可以促进动物对食物的消化和吸收[17]。而黄霉素和喹烯酮均属抗菌素类,其促生长机理均是通过抑制肠道细菌的组成,使肠道菌群的代谢活动有益于动物,从而间接地改善营养物质的消化和利用[18-19]。任泽林等[1]研究证明黄霉素在鲤饲料中的最适添加量为2~4 mg/kg,杨莉[13]也证实饲料中添加100 mg/kg的喹烯酮可以有效提高鲤的增重率和特定增长率,本实验在饲料中分别添加了300 mg/kg的枯草芽孢杆菌、4 mg/kg的黄霉素以及125 mg/kg的喹烯酮,结果显示只有枯草芽孢杆菌组的促生长效果最为显著,与殷海成等[20]在用枯草芽孢杆菌(4×108 cfu/kg、6×108 cfu/kg及8×108 cfu/kg)对黄河鲤(♂)与建鲤(Cyprinus carpio var Jian,♀)杂交F1(幼鱼,27~28.5 ℃)的研究结果相似,徐文彦等[14]在饲料中添加0.2‰、0.3‰、0.4‰的枯草芽孢杆菌饲喂黄河鲤(幼鱼,22~24 ℃),其增重率也显著增加。说明饲喂含枯草芽孢杆菌的饲料的确可以达到促进鲤幼鱼生长的效果。通过以上研究,笔者认为,对于适宜添加量的黄霉素和喹烯酮来说,饲料中添加300 mg/kg的枯草芽孢杆菌的促生长效果优于这两种抗菌素,这可能是由于枯草芽孢杆菌具有抗菌和营养的双重促生长效果,而黄霉素和喹烯酮只有抗菌作用。
3.2 3种添加剂对鲤幼鱼消化酶活性的影响本试验结果表明,添加枯草芽孢杆菌(300 mg/kg)组鲤幼鱼的后肠蛋白酶、淀粉酶、脂肪酶及肝胰脏蛋白酶活性均得到显著提高,由于鱼类的消化能力与其消化酶活力密切相关,酶活越强表明消化能力越强[21],这表明枯草芽孢杆菌可以显著提高鲤幼鱼的消化能力。刘小刚等[22]发现,在异育银鲫饵料中添加200 mg/kg、100 mg/kg的芽孢杆菌可显著提高其肠道与肝胰脏中蛋白酶和淀粉酶活性,这一结论在团头鲂(Megalobrama amblycephala)[23]中也得到验证;许国焕等[24]也发现添加枯草芽孢杆菌(3.0×1011 cfu/kg)饲料组的奥尼罗非鱼(Oreochromis nibticus ×O.aureus)干物质表观消化率和蛋白质表观消化率均比对照组显著提高,以上研究结果均证明适量添加枯草芽孢杆菌可以提高淡水养殖鱼类的肠道和肝胰脏的消化酶活性,这也是其能促进生长的重要原因。高春生等[25]和冷向军等[3] 在分别对淇河鲫(Carassius auratus in Qihe River)和异育银鲫的研究中均证明黄霉素可以提高其消化酶的活性,本试验显示,黄霉素(4 mg/kg)可显著提高鲤幼鱼后肠蛋白酶和脂肪酶以及肝胰脏淀粉酶的活性(P<0.05),说明饲料中添加黄霉素也可以提高鲤幼鱼消化能力。另外,目前尚未见喹烯酮对淡水养殖鱼类消化酶活性有显著性影响的报道,本实验结果也显示,喹烯酮(125 mg/kg)对鲤幼鱼没有促消化作用。相对于抗菌素组,枯草芽孢杆菌组鲤幼鱼后肠淀粉酶的活性显著高于黄霉素组(P<0.05),脂肪酶活性也显著高于黄霉素组和喹烯酮组(P<0.05),肝胰脏蛋白酶和脂肪酶的活性分别显著高于黄霉素和喹烯酮组(P<0.05),所以枯草芽孢杆菌对提高鲤幼鱼消化酶活性的作用显著优于这两种抗菌素。
3.3 3种添加剂对鲤幼鱼血清非特异性免疫相关酶活性的影响由于鱼类体内缺乏高等动物体液免疫中的主要免疫球蛋白IgG,不具备抗体生成的二次反应,因此,非特异性免疫在其免疫防御中具有重要意义[26]。DUNIER等[27]认为水产动物体内的溶菌酶(LSZ)是一种重要的非特异性防御因子,其可以通过水解革兰氏阳性菌细胞壁中的糖苷键破坏细胞壁,因此对革兰氏阳性菌的杀灭效果较好,对革兰氏阴性菌在补体和抗体的参与下也有杀灭作用;超氧化物歧化酶(SOD)是一种重要的抗氧化酶,通过清除体内多余的自由基,从而使动物免除自由基造成的危害;碱性磷酸酶(AKP)不仅与磷代谢密切相关,而且是重要的解毒体系[28],也是动物非特异性免疫的重要因子;谷草转氨酶(GOT)、谷丙转氨酶(GPT)是肝脏细胞中活性最强、分布最广的转氨酶,如果肝脏出现病变,肝细胞通透性会增大,酶即释放于血清中,因此血浆中GOT、GPT的含量可以作为肝功能的检测指标。所以这几种酶可以为检验动物非特异性免疫能力提供重要的参考标准。
枯草芽孢杆菌促进免疫作用的机理表现为口服之后,其可以作用于肠道集合淋巴结的抗原结合位点或通过调整动物的微生物群落间接发挥免疫活性作用,从而提高动物的防御能力,起到防病、抗病的效果[29]。本试验结果显示,与对照组相比,饲喂含枯草芽孢杆菌(300 mg/kg)饲料组鱼的SOD和AKP活性显著升高(P<0.05),GOT和GPT活性显著降低(P<0.05),说明枯草芽孢杆菌对鲤幼鱼也可以起到改善免疫指标的作用,与其应用于黄姑鱼(Nibea albiflora)[30] 和草鱼[31]的研究结果相一致;田娟等[18]和李婵等[32]在对草鱼和虹鳟(Oncorhynchus mikiss)的研究均显示,黄霉素组(8 mg/kg)非特异性免疫指标无显著变化,而本试验则显示黄霉素组(4 mg/kg)LSZ活性显著升高(P<0.05),GOT和GPT活性显著降低(P<0.05),说明该添加量的黄霉素可以对鲤幼鱼非特异性免疫指标产生一定的影响;喹烯酮进入机体后要经过脱氧代谢,对生物体会造成一定的氧化应激,且随浓度的增加、时间的延长SOD活性先增加后降低[33]。李金善等[5]用不同量的喹烯酮泼洒于水体或饲喂鲫(Carassius aumtus),结果显示,试验组的成活率均高于对照组。本试验证实,喹烯酮组(125 mg/kg)鲤幼鱼的LSZ和SOD活性显著高于对照组(P<0.05),但是否免疫能力也得到提高还需进一步验证。与两种抗菌素组相比,枯草芽孢杆菌组鲤幼鱼的SOD的活性显著高于黄霉素组(P<0.05),且GOT、GPT活性显著低于喹烯酮(125 mg/kg)组(P<0.05),但是机体免疫力的高低并不取决于免疫相关酶活性的高低,而是是否能在有异物入侵时能够迅速产生充分的反应并在异物清除后能恢复正常状态,所以不能断言饲喂枯草芽孢杆菌组的鲤幼鱼的抗病能力一定高于抗菌素组,还有待于进一步研究。
| [1] | 任泽林, 曾虹, 郭庆, 等.黄霉素对鲤鱼生产性能的影响[J]. 中国饲料, 1997: 18–19. REN Z L, ZENG H, GUO Q, et al.Effects of flavomycin on growth performance in Common Carp (Cyprinus carpio)[J]. China Feed, 1997: 18–19. |
| [2] | 罗莉, 周初霞, 叶元土, 等.四种促生长剂对草鱼生产性能影响的比较研究[J]. 饲料世界, 2003: 49–52. LUO L, ZOU C X, YE Y T, et al.The Comparative study of four growth-promoting agents on the growth performance in Grass Carp (Ctenopharyngodon idellus)[J]. The World Feed, 2003: 49–52. |
| [3] | 冷向军, 李小勤, 刘尧军, 等.黄霉素对异育银鲫生长和粗蛋白质消化率影响[J]. 中国饲料, 2005: 35–36. LENG X J, LI X Q, LIU Y J, et al.Effects of flavomycin on growth and protein digesti-bility of Crucian Carp (Carassius auratus gibelio)[J]. China Feed, 2005: 35–36. |
| [4] | 张秀珍, 刘云, 徐英江, 等.新型喹噁啉类药物在水产养殖中的有效性及安全性研究进展[J]. 食品安全质量检测学报, 2013, 4(1): 38–44. ZHANG X Z, LIU Y, XU Y J, et al.Effectiveness and security of the new type of quinoxalines in aquaculture[J]. Journal of Food Safety and Quality, 2013, 4(1): 38–44. |
| [5] | 李金善, 赵荣材, 王玉春, 等.饲料添加新药喹烯酮预防鱼病效果的观察[J]. 中兽医医药杂志, 1999: 11–12. LI J S, ZHAO R C, WANG Y C, et al.The study of dietary Quinocetone on preventing fish diseases[J]. Journal of Traditional Chinese Veterinary Medicine, 1999: 11–12. |
| [6] | 李振晖, 吴润.枯草芽孢杆菌饲料添加剂的研究进展[J]. 中国饲料添加剂, 2013: 8–13. LI Z H, WU R.Research advancement of bacillus subtilis used as feed additive[J]. China Feed Additions, 2013: 8–13. |
| [7] | 林维雄, 陈一萍, 叶文盛, 等.枯草芽孢杆菌对生长肥育猪生长性能的影响[J]. 福建畜牧兽医, 2012, 34(4): 17–18. LIN W X, CHEN Y P, YE W S, et al.Effects of bacillus subtilis on the growth performance of swine[J]. Fujian Journal of Animal Husbandry and Veterinary Medicine, 2012, 34(4): 17–18. |
| [8] | 郝生宏, 董晓芳, 佟建明, 等.耐制粒枯草芽孢杆菌对肉仔鸡生产性能、血清生化指标及粪便大肠杆菌的影响[J]. 中国畜牧杂志, 2010, 46(19): 54–56. HAO S H, DONG X F, TONG J M, et al.Effect of pelleting-resistant Bacillus subtilis on the growth performance, serum biochemical indices and fecal Escherichia coli in broilers[J]. Chinese Journal of Animal Science, 2010, 46(19): 54–56. |
| [9] | 潘亚均, 胡治稳.应用枯草芽孢杆菌制剂调节南美白对虾养殖池的水质[J]. 中国水产, 2007: 97–98. PAN Y J, HU Z W.Effects of bacillus subtilis on water quality adjusting in pacific white shrimp pond (Penaeus vannamei Boone)[J]. China Fisheries, 2007: 97–98. |
| [10] | 刘慧玲, 黄翔鹄, 李长玲, 等.不同浓度的枯草芽孢杆菌对罗非鱼鱼苗的养殖水体水质及其抗病力的影响[J]. 水产养殖, 2009, 30(10): 5–9. LIU H L, HUANG X H, LI C L, et al.Effect of different concentrations of Bacillus substilis on water quality and disease resistence of tilapia fry[J]. Journal of Aquaculture, 2009, 30(10): 5–9. |
| [11] | 温俊, 孙鸣.枯草芽孢杆菌制剂对牙鲆生长性能的影响[J]. 饲料研究, 2008: 59–61. WEN J, SUN M.Effects of bacillus subtilis on the growth performance of flounder (Paralichthys olivaceus)[J]. Feed Research, 2008: 59–61. |
| [12] | 赖铭勇.鲤鱼的营养需要与饲料配制[J]. 内陆水产, 2004, 29(7): 31–32. LAI M Y.The nutrition requirement and feed formulation technology of common carp (Cyprinus carpio)[J]. Inland Aquatic Product, 2004, 29(7): 31–32. |
| [13] | 杨莉. 喹烯酮抗菌促生长作用及在鲤、斑点叉尾鮰体内的药物动力学研究[D]. 雅安: 四川农业大学, 2010. YANG L. Study on antibiosis, growth promotion effect and pharmacokinetics of quinocetone in Common Carp (Cyprinus carpio Linnaeus) and Channel catfish (Ictalurus punctatus)[D]. Ya'an: Sichuan Agricultural University, 2010. |
| [14] | 徐文彦, 郭国军, 唐国盘, 等.枯草芽孢杆菌对黄河鲤鱼生产性能及消化酶活性的影响[J]. 湖北农业科学, 2013, 52(10): 2380–2382. XU W Y, GUO G J, TANG G P, et al.Effect of Bacillus subtilis on growth performance and activity of digestive enzyme of Cyprinus carpio[J]. Hubei Agricultural Sciences, 2013, 52(10): 2380–2382. |
| [15] | FOLCH J, LEES M, SLOANE-STANLEY G H.A simple method for the isolation and purification of total lipides from animal tissues[J]. The Journal of Biological Chemistry, 1957, 226(1): 497–509. |
| [16] | 中山大学生物系生化微生物学教研室.生化技术导论[M].北京: 人民教育出版社, 1978: 53,58-54,59. The Biochemical Microbiology Department of Biology Department of Sun Yat-sen University.Introduction to biotechnology[M].Beijing: People Education Press, 1978: 53,58-54,59. |
| [17] | GHOSH K, SEN S K, RAY A K.Characterization of Bacilli isolated from the gut of rohu, Labeo rohita, fingerlings and its significance in digestion[J]. Journal of Applied Aquaculture, 2002, 12(3): 33–42. DOI:10.1300/J028v12n03_04 |
| [18] | 田娟, 冷向军, 李小勤, 等.黄霉素、肉碱对草鱼生长性能、肌肉成分和血清生理生化指标的影响[J]. 饲料工业, 2008, 29(22): 11–14. TIAN J, LENG X J, LI X Q, et al.Effect of flavomycin, carnitine on growth performance, meat composition and physiological and biochemical indexes in Ctenopharyngodon idellus[J]. Feed Industry, 2008, 29(22): 11–14. |
| [19] | 何凤艳.喹烯酮饲料添加剂的应用研究[J]. 今日畜牧兽医, 2007: 56–57. HE F Y.Research on feed additive quinocetone[J]. Today Animal Husbandry And Veterinary Medicine, 2007: 56–57. |
| [20] | 殷海成, 杨国浩, 管军军.枯草芽孢杆菌对杂交鲤鱼生长性能的影响[J]. 粮食与饲料工业, 2012: 50–52. YIN H C, YANG G H, GUAN J J.Effects of Bacillus subtilis on growth performance of hybrid carp[J]. Cereal & Feed Industry, 2012: 50–52. |
| [21] | KUMLU M, JONES D A.The effect of live and artificial diets on growth, survival, and trypsin activity in larvae of Penaeus indicus[J]. Journal of the World Aquaculture Society, 1995, 26(4): 406–415. DOI:10.1111/jwas.1995.26.issue-4 |
| [22] | 刘小刚, 周洪琪, 华雪铭, 等.微生态制剂对异育银鲫消化酶活性的影响[J]. 水产学报, 2002, 26(5): 448–452. LIU X G, ZHOU H Q, HUA X M, et al.Effects of dietary Bacillus sp. and selenoyeast on activities of digestive enzymes of allogynogenetic crucian carp[J]. Journal of Fisheries of China, 2002, 26(5): 448–452. |
| [23] | 吴阳, 鲁康乐, 刘文斌, 等.饲料中添加低聚木糖与枯草芽孢杆菌对团头鲂生长、消化、免疫和抗氧化功能的影响[J]. 江苏农业科学, 2013, 41(3): 183–186. WU Y, LU K L, LIU W B, et al.Feed of dietary xylo-oligosaccharide and bacillus subtilis on growth performance, digest ability, immunity and anticxidant funciion of Megalobrama amblycephala Yih[J]. Jiangsu Agricultural Sciences, 2013, 41(3): 183–186. |
| [24] | 许国焕, 吴月嫦, 付天玺, 等.微生物制剂对奥尼罗非鱼生长及饲料表观消化率的影响[J]. 中国饲料, 2008: 26–28. XU G H, WU Y C, FU T X, et al.Effects of microorganisms on growth performance and apparent digestibility of feed nutrients in Oreochromis niloticus×O. aureus[J]. China Feed, 2008: 26–28. |
| [25] | 高春生, 杨国宇, 范光丽, 等.黄霉素对淇河鲫生长性能、体成分和消化酶活性的影响[J]. 西北农林科技大学学报(自然科学版), 2007, 35(12): 48–52. GAO C S, YANG G Y, FAN G L, et al.Effects of flavomycin on growth performance, whole body composition and activities of digestive enzymes in Carassius auratus gibelio var[J]. Journal of Northwest A & F University (Natural Science Edition), 2007, 35(12): 48–52. |
| [26] | 迟淑艳, 周歧存, 周健斌, 等.β-葡聚糖对奥尼罗非鱼生长性能及抗嗜水气单胞菌感染的影响[J]. 中国水产科学, 2006, 13(5): 767–774. CHI S Y, ZHOU Q C, ZHOU J B, et al.Effects of dietary β-glucan on growth performance and disease resistance of juvenile hybrid tilapia (Oreochromis aureus ♂ × Oreochromis niloticus ♀)[J]. Journal of Fishery Sciences of China, 2006, 13(5): 767–774. |
| [27] | DUNIER M, SIWICKI A K, DEMAËL A.Effects of organo-phosphorus insecticides: effects of trichlorfon and dichlorvos on the immune response of carp (Cyprinus carpio): III. In Vitro effects on lymphocyte proliferation and phagocytosis and in Vivo effects on humoral response[J]. Ecotoxicology and Environmental Safety, 1991, 22(1): 79–87. DOI:10.1016/0147-6513(91)90049-U |
| [28] | CHENG T C.Functional morphology and biochemistry of molluscan phagocytes[J]. Annals of the New York Academy of Sciences, 1975, 266: 343–379. DOI:10.1111/nyas.1975.266.issue-1 |
| [29] | 李春凤, 林显华, 谷巍.谷草芽孢杆菌在饲料生产及环境防治中的应用[J]. 中国饲料, 2003: 10–13. LI C F, LIN X H, GU W.The application of Bacillus subtilis on the feed production and environment control[J]. China Feed, 2003: 10–13. |
| [30] | 张赛乐, 闫茂仓, 陈少波, 等.枯草芽孢杆菌对黄姑鱼免疫机能的影响[J]. 科技通报, 2012, 28(11): 61–65. ZHANG S L, YAN M C, CHEN S B, et al.Effects of Bacillus subtilis on immune function of Nibea albiflora[J]. Bulletin of Science and Technology, 2012, 28(11): 61–65. |
| [31] | 李卫芬, 张小平, 宋文辉, 等.养殖水体中添加芽孢杆菌对草鱼免疫和抗氧化功能的影响[J]. 中国水产科学, 2012, 19(6): 1027–1033. LI W F, ZHANG X P, SONG W H, et al.Effects of Bacillus preparation added to culture water on immunity and antioxidant activities in grass carp (Ctenopharyngodon idella)[J]. Journal of Fishery Sciences of China, 2012, 19(6): 1027–1033. |
| [32] | 李婵, 白岚, 徐奇友, 等.不同促生长剂对虹鳟生长性能及非特异性免疫机能的影响[J]. 大连水产学院学报, 2008, 23(3): 179–184. LI C, BAI L, XU Q Y, et al.Effects of dietary growth promoter supplementation on growth performance and non-specific immunity function in rainbow trout Oncorhynchus mykiss[J]. Journal of Dalian Fisheries University, 2008, 23(3): 179–184. |
| [33] | 安红红, 张华威, 宫向红, 等.喹烯酮对刺参幼参生长、非特异性免疫及抗应激能力的影响[J]. 中国海洋大学学报(自然科学版), 2015, 45(3): 67–72. AN H H, ZHANG H W, GONG X H, et al.Effect of quinocetone on the growth performance, non-specific immunity and anti-stress ability juvenile sea cucumber[J]. Periodical of Ocean University of China(Natural Science), 2015, 45(3): 67–72. |
2. Shandong Province Key Laboratory of Storage and Transportation Technology of Agricultural Products, Jinan 250103, Shandong, China;
3. Shandong Freshwater Fisheries Research Institute, Jinan 250117, Shandong, China
 2016,
Vol. 25
2016,
Vol. 25


