2. 中国水产科学研究院淡水渔业研究中心农业部淡水渔业和种质资源利用重点实验室, 江苏无锡 214128
刀鲚(Coilia nasus),隶属于硬骨鱼纲(Osteichthyes)、鲱形目(Clupeirformes)、鳀科(Engraulidae)、鲚属(Coilia),又名长颌鲚,俗称刀鱼,是我囯长江中下游重要的洄游型肉食性鱼类。刀鲚以肉质鲜嫩肥美,肥而不腻而著称,与鲥鱼、河豚并称为“长江三鲜”[1]。历史上,刀鲚的年产量和资源量都相当丰富,近年来,由于过度捕捞、水体污染及长江水域生态环境的变化等诸多因素的影响,刀鲚的产量连年下降,资源严重衰退,个体低龄化,群体趋小化,难以形成渔汛[2]。随着刀鲚灌江纳苗[3]、池塘扩繁[4]、人工繁殖及苗种培育技术[5, 6]等的突破,刀鲚正逐渐成为具有较高经济价值的特种养殖对象。但是刀鲚习性较特殊,受到刺激后反应强烈,出水极易死亡,“离水即死”的问题导致捕捞和运输困难,逐渐成为限制其规模化养殖和产业化的“瓶颈”[7]。因此,以刀鲚为研究对象,深入阐述和研究鱼类应激过程中的生理变化和下丘脑-垂体-肾间组织轴(hypothalamus-pituitary-interrenal axis,HPI)神经内分泌调控机制,有着广泛而重要的生理意义和实践意义。目前,国内外关于水生动物运输应激方面的研究不多,在美洲鲥(Alosa sapidissima)[8]、欧亚鲈鱼[9](Perca fluviatilis L.)、大西洋鲑[10](Salmo salar L.)等鱼类中都有一些报道。
鱼类的运输、拉网和操作胁迫等物理因子刺激可以引发其应激反应。刀鲚应激反应强烈,是研究应激调控机理的良好材料。王宇等研究了刀鲚的捕捞操作胁迫过程中内分泌因子的变化。结果表明,促肾上腺皮质激素(CRH)、硬骨鱼紧张肽(UI)、阿黑皮素原(POMC)等内分泌相关基因通过下丘脑-垂体-肾间组织轴(HPI)参与刀鲚应激反应调节[11]。杜富宽等通过对比应激前后刀鲚肝脏转录组,发现其应激反应会全面启动代谢和免疫相关基因的表达,肝脏代谢的瞬时增强,诱发了氧化应激反应,进而导致肝脏等组织受到一定程度的损伤,造成机体不可逆转的生理变化[12]。从草本植物甘草的根、茎中提取出来的甘草甜素(glycyrrhizin,GL)具有增强免疫、抗氧化、抗溃疡、抗炎、抗病毒、抗血栓、抗肿瘤、抗突变、抗菌、抗补体活性,调控细胞凋亡及糖皮质激素样作用[13, 14, 15, 16]。因此,本研究通过模拟装载和运输实验,在生化水平和基因水平,研究了运输应激对刀鲚的生理生化指标和HPI轴基因表达的影响,对刀鲚难以运输的机理进行探讨,同时探讨GL在运输胁迫过程中,如何影响HPI轴基因表达变化,如何影响氧化应激相关生化指标的变化,以期为解决刀鲚的运输难题提供参考。
1 材料与方法 1.1 实验材料刀鲚取自中国水产科学研究院淡水渔业研究中心宜兴屺亭养殖基地,室内水泥池驯养,体长(184.39±15.39)mm,体质量(17.5±4.8)g,水温(17±1)℃左右。
GL(含量10%,医药级)购自河南盛之德商贸有限公司;蛋白定量测试盒,谷胱甘肽过氧化物酶(GSH-PX)测试盒,丙二醛(MDA)测试盒,过氧化氢酶(CAT)测试盒和脂质过氧化物(LPO)测试盒购自南京建成生物工程研究所;RNAiso plus,PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)和SYBR Premix Ex TaqTMⅡ(Tli RNaseH Plus) 购自TaKaRa (Japan)。
1.2 运输实验实验开始前,设置一系列浓度梯度的水箱,将5尾刀鲚放入水箱中,每隔一段时间观察刀鲚的死亡情况,最终确定GL的最佳浓度为0.02 g/L。将8个水箱分为两组,实验组加入GL,对照组不加GL。实验组和对照组各48尾鱼,每箱12尾鱼,4个水箱分别用于运输2、4、6和8 h取材,另取6尾鱼作为应激0点。每组每个时间点取6尾鱼,用浓度为100 mg/L MS-222快速深度麻醉,每尾鱼在取样前进行体长、体重等常规生物学数据测量,其中3尾用于基因表达分析,分别取脑、肝脏、头肾部分组织,放入1.5 mL离心管(RNAase free)中,每个离心管加入1 mL RNAiso Plus试剂;3尾取肝脏组织,用于氧化应激生化指标的测定,并于-20 ℃的冰箱保存。
1.3 肝脏氧化应激指标的测定在肝脏样品解冻后,准确称取0.15 g肝脏组织,按质量(g)∶体积(mL)=1∶9的比例加入9倍体积的4 ℃生理盐水,匀浆,制成10%匀浆液,2 500 r/min离心10 min,取200 μL分装至6个离心管中。肝脏上清液蛋白含量采用考马斯亮蓝法测定;肝脏上清液GSH-PX、MDA、CAT和LPO分别采用比色法、硫代巴比妥酸法、可见光法和比色法测定,操作方法按照说明书进行。
1.4 总RNA提取、反转录及实时荧光定量PCR按照RNAiso plus说明书上的方法提取并纯化总RNA,通过琼脂糖凝胶电泳检测RNA的完整性,然后以总RNA为模板,根据TaKaRa反转录试剂盒中的操作说明,反转录合成cDNA,保存在-20 ℃的冰箱备用。CRH、UI、POMC和GR等应激相关基因,以管家基因β-actin作为内参,引物B1和B2见表1,采用嵌合荧光法进行Real Time PCR 扩增反应,在ABI PRISM 7500 Real-time PCR System仪器中进行检测和分析。Real Time PCR反应体系:SYBR Premix Ex TaqTMⅡ(Tli RNaseH Plus)(2×) 10 μL,PCR Forward Primer(10 μmol/L) 0.8 μL,PCR Reverse Primer(10 μmol/L) 0.8 μL,ROX Reference Dye(50×) 0.4 μL,template*3 1 μL,dH2O 7 μL,共20 μL。

|
表1 本研究用到的引物序列 Tab. 1 Sequences of primers used in this study |
所有实验数据均用Excel 2010进行统计,计算平均值和标准差,所有结果均以平均值±标准差(Mean±SD)表示。实验数据采用SPSS 20.0 for window 7 64bit统计软件包中的单因素方差分析(One-way ANOVA)和Duncan’s多重比较,检验各组间的差异,不同的大小写字母表示各组之间比较差异显著(P<0.05)。以管家基因β-actin作为内参,运用2-ΔΔCt 法计算基因相对表达量,应激相关基因所有数据以平均相对表达量展现。
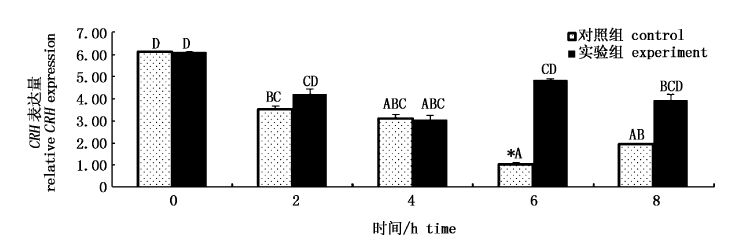
2 结果与分析 2.1 HPI轴应激相关基因的表达如图1所示,对照组中,2、4、6和8 h时CRH的表达水平显著低于0 h(P<0.05),6 h时CRH表达量最低,整体呈下降趋势。与对照组相比,除了6 h时实验组CRH表达量较高外,其他各时间点均无明显差异(P>0.05),实验组CRH表达水平整体上高于对照组。
|
图1
GL对脑中CRH基因表达量的影响
Fig.1
Effect of GL on relative CRH mRNA expression in brain
*表示同一时间点差异显著(P<0.05);柱状图上方不同的大写字母表示不同时间点差异显著(P<0.05),图2-图8同。 * indicates significant differences at the same point of time (P<0.05); bars with different upper capital letters at different points of time have significant difference,the same as Fig.2-Fig.8. |
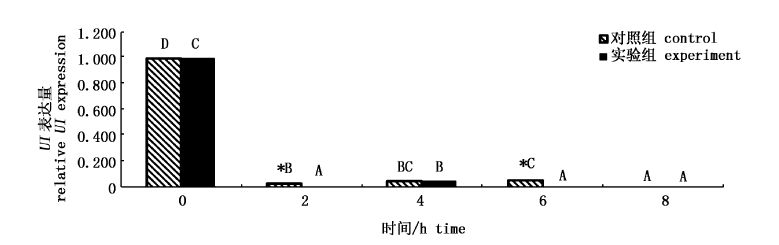
如图2所示,对照组中,2、4、6和8 h时UI的表达水平显著低于0 h,UI表达水平先下降,然后略有回升(6 h时),8 h时有最小值。实验组UI的变化规律与对照组相似,2和6 h时的表达量显著低于对照组(P<0.05)。
|
图2 GL对脑中UI基因表达量的影响 Fig.2 Effect of GL on relative UI mRNA expression in brain |
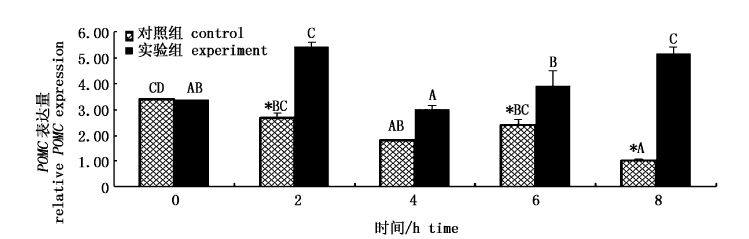
从图3可见,对照组中POMC的表达量呈逐渐下降趋势,8 h时POMC的表达量最低。实验组POMC的变化趋势与对照组相反,整体呈上升的趋势,除4 h时POMC表达量与对照组无明显差异外,其他各时间点实验组POMC的表达量均显著高于对照组(P<0.05)。
|
图3 GL对脑中POMC基因表达的影响 Fig.3 Effect of GL on relative POMC mRNA expression in brain |
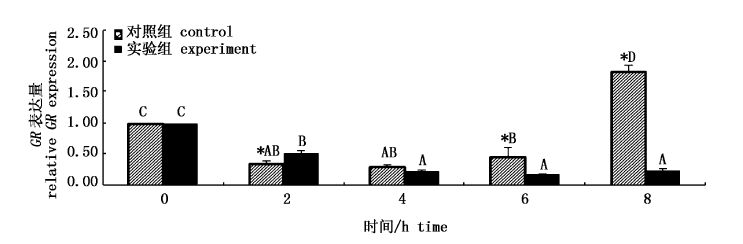
从图4可见,对照组中,2、4和6 h时GR的表达量低于0 h时,8 h时GR的表达量高于0 h(P<0.05),整体呈现“高-低-高”的变化特点。与对照组相比,2 h时实验组GR的表达水平高于对照组,而6 h和8 h时,实验组GR的表达水平低于对照组(P<0.05),实验组GR表达水平整体呈逐渐下降趋势。
|
图4 GL对头肾中GR基因表达量的影响 Fig.4 Effect of GL on relative GR mRNA expression in head kidney |
从图5可见,与0 h相比,2 h时CAT活性显著降低(P<0.05),4 h时活性最低,6和8 h时活性有所升高,但活性仍明显低于0 h(P<0.05),整体呈现“U”型变化趋势,这表明运输应激使CAT活性降低。实验组和对照组相比,无统计学差异(P>0.05),变化规律与对照组相似。
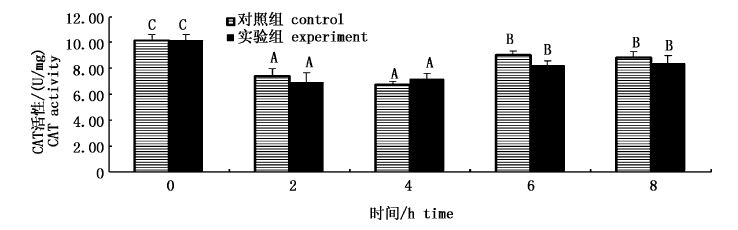
|
图5 GL对肝脏中CAT活性的影响 Fig.5 Effect of GL on CAT activity in liver |
从图6可见,与对照组相比,实验组各时间点无显著性差异(P>0.05)。对照组中,2和4 h时相比于0 h时无明显变化,6 h时GSH-PX活性显著升高(P<0.05),酶的活性最高,8h时酶活性下降。
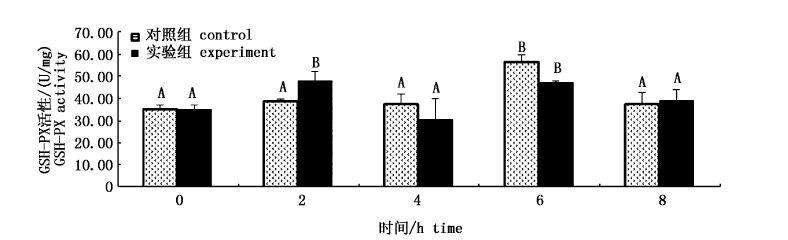
|
图6 GL对肝脏中GSH-PX活性的影响 Fig.6 Effect of GL on GSH-PX activity in liver |
如图7所示,对照组2 h时MDA含量升高(P<0.05),此后一直维持在较高水平。与对照组相比,6 h时,实验组MDA含量较高(P<0.05),此时MDA的含量有最大值,其他各时间点无显著差异。
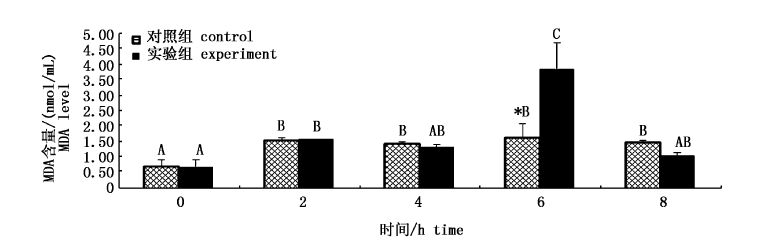
|
图7 GL对肝脏中MDA含量的影响 Fig.7 Effect of GL on MDA levels in liver |
如图8所示,对照组中各时间点与0 h时相比无统计学差异(P>0.05)。与对照组相比,2、4和6 h时差异不显著,8 h时,实验组LPO的含量高于对照组(P<0.05),含量最高。
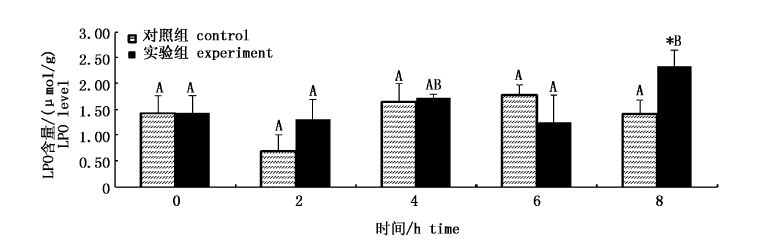
|
图8 GL对肝脏中LPO含量的影响 Fig.8 Effect of GL on LPO levels in liver |
鱼类的HPI在环境胁迫与鱼体神经内分泌的联系中占主导地位。当鱼类发生应激时,机体立即在神经和内分泌系统水平上发生反应,导致HPI轴强烈兴奋,然后引起组织与器官水平上一系列功能与结构的变化,包括呼吸系统、心血管系统、能量代谢、水盐平衡及免疫系统等各方面的改变,最终导致个体或群体水平上的变化,如存活率、生长速率、免疫力、繁殖性能及行为的改变等[17, 18]。应激发生后,下丘脑释放的CRH和UI,促进POMC基因表达,引起促肾上腺皮质激素(ACTH)的合成和释放。ACTH通过血液循环作用于肾间组织,促使肾间组织分泌皮质醇,引起一系列生理变化和生物学效应[19, 20]。在硬骨鱼中,CRH系统被认为主要在鱼脑的视前区分泌[21],该区类似于哺乳动物的下丘脑室旁核,同样能调控下游皮质醇的变化[22]。UI在端脑和下丘脑都有表达,垂体中没有分布[23]。在硬骨鱼类中,POMC基因主要在下丘脑的侧结节核(LTN)中表达[24]。GR在肝脏、肾脏、鳃和脑中均有表达[25]。经过检测,我们发现CRH、UI和POMC表达水平均显著下降,这与刀鲚的操作胁迫[11]结果类似。CRH、UI、POMC和GR是HPI轴上应激调控的重要基因,经常作为HPI轴活动的标志性基因。CRH、UI、POMC和GR均发生了不同程度的表达变化,表明刀鲚运输应激激活了HPI轴。HPI轴是应激调控的起始,HPI轴基因表达变化通过级联反应引起相关激素的变化,导致物质代谢变化来应对外界环境的刺激,进而影响抗氧化应激能力,从而可能引发氧化应激。
3.2 运输胁迫对肝脏氧化应激指标的影响目前的研究显示,有毒化学物质如四氯化碳[26]、重金属[27]等可以引发机体氧化应激,氧化应激可以引起细胞膜损伤、细胞凋亡,严重的导致肝脏损伤,甚至个体死亡[28]。动物机体内存在一套由抗氧化酶系统和抗氧化物质组成较为完善的抗氧化体系,主要由一些被氧化应激诱导的酶类如SOD、CAT、GSH-PX和抗氧化物质,如谷胱甘肽(GSH)等组成。在正常生理条件下,机体产生的自由基包括超氧阴离子、羟自由基、单线态氧与过氧化氢等能不断被抗氧化系统清除,使自由基的产生与消除处于一种动态平衡中,从而起到免除自由基对生物分子的损伤作用[29]。而当生物体内不断产生和蓄积的自由基超过了机体自身的清除能力时,就会产生氧化胁迫 [30]。过多的自由基会攻击蛋白质、脂质、核酸、糖类等生物大分子,引起脂质过氧化反应,使酶失活,蛋白质变性,DNA链断裂,生成LPO和MDA。因此,LPO和MDA水平既可判定机体脂质过氧化的程度,也可间接反映自由基产生、生物活性,抗氧化能力强弱及细胞的损伤程度[31]。本研究中,运输过程中CAT活性明显下降,GSH-PX活性先略有升高再下降,MDA含量显著增加,这与邵斌等[32]研究结果类似。结合以上结果来看,作为氧化应激的重要生物学指标CAT和MDA在刀鲚应激反应后发生了显著变化,运输过程中刀鲚的抗氧化能力减弱,机体氧化还原平衡遭到破坏,体内产生了有毒害作用的自由基,这表明刀鲚运输应激激活了体内的氧化应激反应。研究显示,化学物质铜[27]和四溴双酚A[33]可降低CAT的活性,增加MDA的含量,引起氧化应激。运输作为物理操作因子,与化学因子一样可引起氧化应激,而目前很少有报道这种物理操作也可以引发氧化应激反应,这或许是刀鲚运输应激引发死亡的重要原因之一。但是,对于物理操作也可以诱发氧化应激的原因和作用机理,有待进一步阐述和研究。
3.3 GL的调控作用GL是甘草中的活性物质,具有多种功用,主要用于肝病领域,在人类和畜禽类等动物中的研究较多,而在水生动物中的应用与研究较少。本研究中添加GL的实验组GR的表达量下降,POMC和CRH表达量增加,这表明GL对HPI轴上基因表达有一定的影响,引起某些基因表达水平的变化。GR作为HPI轴上的负反馈调节因子,能够特异性地与靶基因的启动子结合影响基因的表达,抑制CRH和POMC表达[34]。应激过程中GR表达水平下调,其通过信号转导途径对POMC和CRH启动子的抑制作用减弱,使POMC和CRH转录增多。下丘脑释放的CRH与垂体促肾上腺激素释放激素受体结合,激活信号通路,促进POMC基因表达,引起ACTH的合成和释放[35]。研究表明,GL可通过血脑屏障到达大脑,与大脑皮层、丘脑和脑干结合[36]。甘草酸可提高促肾上腺皮质激素释放因子(CRF)受体的结合活性和基因表达水平[37],从而提高POMC表达量,而应激过程中下丘脑可能存在超短正反馈的机制[38],使得CRH表达水平增加。本实验采用浸泡方式给药,结果显示GL对肝脏CAT、GSH-PX、MDA和LPO无显著影响。王朝霞等报道GL口服给药的吸收率较低,生物利用率低[39],我们推测给药方式不同可能影响GL的吸收率。总体而言,GL可以影响HPI轴基因表达变化,但是对氧化应激相关指标的影响不大。这可能是GL的影响作用还不足以影响到下游的代谢变化,进而影响氧化应激反应,其对于HPI轴上基因调控,有待于进一步的深入研究。
| [1] | 徐钢春.刀鲚(Coilia nasus)性腺发育、人工繁殖及早期生活史的研究[D].南京:南京农业大学, 2010:1-69.XU G C. The gonad development regularity, artificial reproduction and early life history of Coilia nasus[D]. Nanjing:Nanjing Agricultural University, 2010:1-69. |
| [2] | 黄仁术.刀鱼的生物学特性及资源现状与保护对策[J].水利渔业, 2005, 25(2):33, 37.HUANG R S. The biological characteristics, resource and protection strategy for Coilia ectenes[J]. Reservoir Fisheries, 2005, 25(2):33, 37. |
| [3] | 张呈祥,陈平,郑金良.长江刀鲚灌江纳苗与养殖[J].科学养鱼, 2006(7):26.ZHANG C X, CHEN P, ZHENG J L. Breeding of Coilia nasus achieved from the Yangtze river[J]. Science Fish Farming, 2006(7):26. |
| [4] | 徐钢春,徐跑,顾若波,等.池养刀鲚(Coilia nasus)鱼种的摄食与生长[J].生态学杂志, 2011, 30(9):2014-2018.XU G C, XU P, GU R B, et al. Feeding habits and growth characteristics of pond-cultured Coilia nasus fingerlings[J]. Chinese Journal of Ecology, 2011, 30(9):2014-2018. |
| [5] | 徐钢春,魏广莲,李建林,等.基于线粒体DNA D-loop序列分析养殖刀鲚与湖鲚的遗传多样性[J].大连海洋大学学报, 2012, 27(5):448-452.XU G C, WEI G L, LI J L, et al. The genetic diversity of farmed tapertail anchovy Coilia nasus and Coilia nasus taihuensis by mitochondrial D-loop genes analysis[J]. Journal of Dalian Ocean University, 2012, 27(5):448-452. |
| [6] | 王威克.长江刀鲚人工繁殖技术获阶段性突破[N].中国渔业报, 2009-6-8(4).WANG W K. The staged breakthroughs of artificial reproduction of Coilia nasus in Yangtze River[N]. China Fisheries News, 2009-6-8(4). |
| [7] | 沈林宏,戴玉红,顾树信,等.长江刀鲚幼鱼的采集与运输技术研究[J].水产养殖, 2011(5):4-6.SHEN L H, DAI Y H, GU S X, et al. Studies on collection and transport of Coilia nasus juvenile[J]. Aquaculture, 2011(5):4-6. |
| [8] | 杜浩,危起伟,甘芳,等.苯唑卡因对美洲鲥运输应激的缓解作用研究[J].中国水产科学, 2006, 13(5):787-793.DU H, WEI Q W, GAN F, et al. Transport stress catabatic effect of anesthetic benzocaine on American shad Alosa sapidissima[J]. Journal of Fishery Sciences of China, 2006, 13(5):787-793. |
| [9] | ACERETE L, BALASCH J C, ESPINOSA E, et al. Physiological responses in Eurasian perch (Perca fluviatilis, L.) subjected to stress by transport and handling[J]. Aquaculture, 2004, 237(1/4):167-178. |
| [10] | IVERSEN M, FINSTAD B, NILSSEN K J. Recovery from loading and transport stress in Atlantic salmon (Salmo salar L.) smolts[J]. Aquaculture, 1998, 168(1/4):387-394. |
| [11] | 王宇,卢丹琪,李伟萍,等.急性操作胁迫对刀鲚应激反应相关神经内分泌因子的影响[J].水产学报, 2014, 38(6):804-813.WANG Y, LU D Q, LI W P, et al. The effect of acutehandling stress on the stress-related neuroendocrine factor in Coilia nasus[J]. Journal of Fisheries of China, 2014, 38(6):804-813. |
| [12] | DU F K, XU G C, NIE Z J, et al. Transcriptome analysis gene expression in the liver of Coilia nasus during the stress response[J]. BioMed Central Genomics, 2014, 15:558. |
| [13] | MICHAELIS M, GEILER J, NACZK P, et al. Glycyrrhizin inhibits highly pathogenic H5N1 influenza A virus-induced pro-inflammatory cytokine and chemokine expression in human macrophages[J]. Medical Microbiology and Immunology, 2010, 199(4):291-297. |
| [14] | 邵玉蓝,曹岗,熊耀康.甘草生物活性研究的某些新进展[J].中国实用医药, 2009, 4(13):228-230.SHAO Y L, CAO G, XIONG Y K. Some new progress of Liquorice biological activity in research[J]. China Practical Medicine, 2009, 4(13):228-230. |
| [15] | ASL M N, HOSSEINZADEH H. Review of pharmacological effects of Glycyrrhiza sp. and its bioactive compounds[J]. Phytotherapy Research, 2008, 22(6):709-724. |
| [16] | 高艳青,王红勤,杨君.复方甘草甜素的临床应用[J].内蒙古医学杂志, 2005, 37(4):352-354.GAO Y Q, WANG H Q, YANG J. The clinical application of compound glycyrrhizin[J]. Inner Mongolia Medical Journal, 2005, 37(4):352-354. |
| [17] | 王庆萍,方春林,芮学党.鱼类的应激反应[J].江西水产科技, 2013(3):36-39.WANG Q P, FANG C L, RUI X D. The stress response of fishes[J]. Jiangxi Fishery Sciences and Technology, 2013, 37(4):352-354. |
| [18] | 胡应高.鱼类的应激反应[J].淡水渔业, 2004, 34(4):61-64.HU Y G. The stress response of fishes[J]. Freshwater Fisheries, 2004, 34(4):61-64. |
| [19] | 洪磊,张秀梅.环境胁迫对鱼类生理机能的影响[J].海洋科学进展, 2004, 22(1):114-121.HONG L, ZHANG X M. Effects of environmental stress on physiological function of fish[J]. Advances in Marine Science, 2004, 22(1):114-121. |
| [20] | 鲍经伟.猪促肾上腺皮质激素释放激素基因mRNA表达和DNA多态性的比较研究[D].南京:南京农业大学, 2007:1-52.BAO J W. Comparative study on mRNA expression and DNA polymorphism of corticotropin releasing hormone in pigs[D]. Nanjing:Nanjing Agricultural University, 2007:1-52. |
| [21] | BERNIER N J, ALDERMAN S L, BRISTOW E N. Heads or tails Stressor-specific expression of corticotropin-releasing factor and urotensin I in the preoptic area and caudal neurosecretory system of rainbow trout[J]. Journal of Endocrinological Investigation, 2008, 196(3):637-648. |
| [22] | SINGH R, RAI U. Immunomodulatory role of urotensins in teleost Channa punctatus [J]. General and Comparative Endocrinology, 2011, 170(3):613-621. |
| [23] | BERNIER N J, LIN X W, PETER R E. Differential expression of corticotropin-releasing factor (CRF) and urotensin I precursor genes, and evidence of CRF gene expression regulated by cortisol in goldfish brain[J]. General and Comparative Endocrinology, 1999, 116(3):461-477. |
| [24] | LICINIO J, BONGIORNO P B, GOLD P W, et al. The gene encoding for the novel transacting factor proopiomelanocortin corticotropin-releasing hormone responsive element binding protein 1(PCRH-REB-1) is constitutively expressed in rat pituitary and in discrete brain regions containing CRH or CRH receptors:Pathophysiological implications[J]. Endocrinology, 1995, 136(10):4709-4712. |
| [25] | MOMMSEN T P, VIJAYAN M M, MOON T W. Cortisol in teleosts:dynamics, mechanisms of action, and metabolic regulation[J]. Reviews in Fish Biology and Fisheries, 1999, 9(3):211-268. |
| [26] | HUO H Z, WANG B, LIANG Y K, et al. Hepatoprotective and antioxidant effects of licorice extract against CCL4-induced oxidative damage in rats[J]. International Journal of Molecular Sciences, 2011, 12(10):6529-6543. |
| [27] | ATLI G, CANLI M. Response of antioxidant system of fresh water fish Oreochromis niloticus to acute and chronic metal (Cd, Cu, Cr, Zn, Fe) exposures[J]. Ecotoxicology and Environmental Safety, 2010, 73(8):1884-1889. |
| [28] | 刘淑兰,翟少伟.氧化应激对鱼类的影响及其模型的研究进展[J].水产养殖, 2012(2):48-51.LIU S L, ZHAI S W. Research progress of effects of oxidative stress on fish and oxidative stress model[J]. Aquaculture, 2012(2):48-51. |
| [29] | 麦康森,艾庆辉,徐玮,等.水产养殖中的环境胁迫及其预防-营养学途径[J].中国海洋大学学报, 2004, 34(5):767-774.MAI K S, AI Q H, XU W, et al. Stress in aquaculture and its prevention with emphasis on nutritional methods[J]. Periodical of Ocean University of China, 2004, 34(5):767-774. |
| [30] | 臧元奇.刺参(Apostichopus japonicus Selenka)对典型环境胁迫的生理生态学响应及其机制研究[D].青岛:中国海洋大学, 2012:1-118.ZANG Y Q. Ecological and physiological mechanisms on typical environmental factors in sea cucumber, Apostichopus japonicas Selenka[D]. Qingdao:Ocean University of China, 2012:1-118. |
| [31] | VIARENGO A, CANESI L, MARTINEZ P G, et al. Pro-oxidant processes and antioxidant defence systems in the tissues of the Antarctic scallop (Adamussium colbecki) compared with the Mediterranean scallop (Pecten jacobaeus)[J]. Comparative Biochemistry and Physiology, 1995, 111(1):119-126. |
| [32] | 邵斌,张彩霞,赵茹茜,等.运输对仔猪抗氧化功能和促炎细胞因子产生的影响[J].畜牧兽医学报, 2009, 40(10):1545-1549.SHAO B, ZHANG C X, ZHAO R Q, et al. Effect of transportation on the antioxidative capacity and proinflammatory cytokines in piglets[J]. Chinese Journal of Animal and Veterinary Science, 2009, 40(10):1545-1549. |
| [33] | FENG M B, QU R J, WANG C, et al. Comparative antioxidant status in freshwater fish Carassius auratus exposed to six current-use brominated flame retardants:A combined experimental and theoretical study[J]. Aquatic Toxicology, 2013, 140-141:314-323. |
| [34] | DATSON N A, MORSINK M C, MEIJER O C, et al. Central corticosteroid actions:search for gene targets[J]. European Journal of Pharmacology, 2008, 583(2/3):272-289. |
| [35] | 吴丽敏.大鼠抑郁症模型中糖皮质激素、促肾上腺皮质激素释放激素作用的研究[D].合肥:中国科学技术大学, 2007:1-126.WU L M. Studies on the function of glucocorticoid and corticotrophin releasing factor in rat model of depression[D]. Hefei:University of Science and Technology of China, 2007:1-126. |
| [36] | MIZOGUCHI K, KANNO H, IKARASHI Y, et al. Specific binding and characteristics of 18β-glycyrrhetinic acid in rat brain[J]. Public Library of Science One, 2014, 9(4):1-8. |
| [37] | HANAFUSA J, MUNE T, TANAHASHI T, et al. Altered corticosteroid metabolism differentially affects pituitary corticotropin response[J]. American Journal of Physiology-Endocrinology and Metabolism, 2002, 282(2):E466-E473. |
| [38] | 李留安,杨晓静,金天明,等. CRH与应激反应及行为的研究进展[J].黑龙江畜牧兽医, 2010(7):28-30.LI L A, YANG X J, JIN T M, et al. The research progress of CRH and stress responses and stress behavior[J]. Heilongjiang Animal Science and Veterinary Medicine, 2010(7):28-30. |
| [39] | 王朝霞,宋丽君,杨贵贞.甘草甜素的研究现状[J].中国中西医结合杂志, 2002, 22(10):796-798.WANG Z X, SONG L J, YANG G Z. Current status of study on glycyrrhizin[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2002, 22(10)796-798. |
2. Key Open Laboratory of Genetic Breeding and Aquaculture Biology of Freshwater Fishes, Ministry of Agriculture, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214128, Jiangsu, China
 2015, Vol. 24
2015, Vol. 24


