目前,水产养殖系统中高密度、高污染、高发病率以及缺乏有效的疫病防治措施已经成为制约养殖业健康发展的关键因素[1, 2]。生物絮团技术(Biofloc technology,BFT)为我们提供了解决以上问题的方法,其不仅可以实现养殖系统零换水条件下水质稳定,也可以增加养殖动物的饵料来源,还可以提升养殖水体中微生物群落多样性和稳定性,减少病原菌滋生[3, 4, 5, 6]。BFT是通过人为添加碳源调节水体C/N,提高水体异养微生物活性和数量,利用微生物同化作用,将水体中氨氮等有害氮源转化成菌体蛋白,再通过养殖动物摄食的方式将N素从养殖水体中移出,从而起到调控水质、促进营养物质循环再利用的作用[3, 7, 8]。DE SCHRYVER等[9]研究发现生物絮团系统中TN的去除,特别是TAN的去除,均是异养微生物起主导作用,当碳源添加于养殖水体中,异养微生物会被充分激活,微生物群落结构改变,养殖系统中微生物群落具有更好的丰富性、稳定性和缓冲性[10, 11, 12]。文献[9, 12, 13, 14, 15]均利用了分子生物学技术手段证实了添加碳源后的生物絮团系统微生物群落结构发生了较大变化。异养微生物的结构与活性决定了BFT应用的成败,而异养微生物的结构与活性是由碳源种类决定的,碳源种类的选择在很大程度上决定着生物絮团的结构和稳定性[16],碳源选择已成为影响生物絮团形成的关键因素。人们通过试错法初步筛选了适用于生物絮团系统的碳源(丙三醇、米糠、木薯粉、蔗糖、淀粉、糖蜜和葡萄糖等)[4, 17],但以上碳源的筛选并没有针对性,未能从养殖水体和生物絮团微生物碳源需求出发,因此了解养殖水体和生物絮团系统本底微生物的碳源代谢特征显得十分重要。
Biolog技术是一种通过测试微生物对单一碳源利用程度,反映微生物群体水平的生理功能轮廓以及描述微生物群落水平多样性(community-level physiological profiling,CLPP)的分析方法,是目前已知的研究微生物代谢功能多样性很有力的方法。本研究以葡萄糖为碳源培育生物絮团系统,探讨生物絮团系统的形成对养殖水体水质和微生物碳代谢的影响,为生物絮团碳源需求和微生物功能多样性信息提供数据支撑,也为构建水环境微生物生态调控的基础理论和实用性技术提供参考。
1 材料与方法 1.1 实验材料与养殖管理养殖实验于2012年5月-7月在珠江水产研究所精准养殖实验基地进行,选择规格相同的6口水泥池为试验池,每口水泥池体积为12 m3,水深1.0 m,其中3口(B1、B2、B3)作为实验组用于生物絮团培养,3口(C1、C2、C3)为对照组。6口塘配合养殖草鱼,草鱼来自广东省中山食品水产进出口集团有限公司养殖基地,草鱼体长10~14 cm,体重为60.5~68.5 g,每口水泥池投放400尾。实验池塘用遮阳棚覆盖,减少阳光照射,培养期间不换水。水源为珠江所内池塘养殖用水,用40目筛绢过滤后使用,水体总悬浮物(TSS)为18.30 mg/L,氨氮为(0.58±0.10) mg/L,亚硝酸盐氮为(0.08±0.03) mg/L,硝酸盐氮为(0.71±0.25) mg/L。养殖期间连续24 h不间断曝气,DO维持在5.0 mg/L以上,水温28~32 ℃,pH7.0~8.0,如pH低于6.5,用碳酸氢钠调节。
根据AVNIMELECH[18]总结的生物絮团养殖系统的C/N公式,根据饲料投喂量调整葡萄糖的添加量,实验中的C/N指添加物质(饲料和葡萄糖) 的碳元素与氮元素的质量比,计算所需葡萄糖的量,使C/N=20∶1。葡萄糖添加为每天一次。
1.2 实验方法 1.2.1 水样采集与水质测定实验期间,每天测定溶氧、温度; 每3天测定pH、氨氮、亚硝酸盐氮、硝酸盐氮等水质指标;溶氧、温度采用光学溶解氧测量仪(PRO-ODO)测定,pH采用pH计测定;水体中的氨氮、亚硝酸盐氮和硝酸盐氮含量的测定参照《水和废水监测分析法》(第四版) [19]进行。其中,氨氮浓度的测定采用纳氏试剂分光光度法、亚硝酸盐氮浓度的测定采用萘乙二胺光度法、硝酸盐氮浓度的测定采用紫外分光光度法。
1.2.2 微生物样品采集与Biolog测定实验结束时(30 d)对实验组和对照组6口池塘进行微生物代谢功能对比分析,水样为池中心和四周的表层混合样,保存在50 mL灭菌离心管中。所有水样冰浴低温带回实验室,立即进行Biolog分析。
选取Biolog-ECO板进行水样微生物碳代谢特征研究。在无菌条件下取定量水样放入灭菌的0.9%生理盐水中,充分震荡后按比例配置成微生物加样液,将加样液倾倒在无菌加样槽中,加入25 ℃预热的Biolog-ECO微板中,每孔加150 mL。将加好样的Biolog-ECO微平板加盖,25 ℃恒温培养,每隔12 h读取各孔在590 nm波长下的光密度,直至光密度值稳定为止,总共培养时间为168 h。参考TIQUIA[20]的方法,选取96 h的Biolog 平均光密度吸收值进行后续数据的处理。
1.3 计算方法水体微生物群落利用碳源的能力,用平均吸光值AWCD表示,其计算公式为:
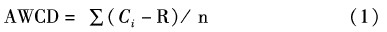
式中:Ci为所测定的31个碳源孔的吸光值;R为对照孔的吸光值;n为培养基碳源的总数目(n=31)。
丰富度指数是指被利用的碳源的总数目,为每孔中(C-R) 的值大于0.25的孔个数[21]。
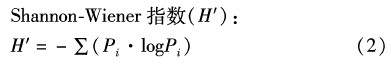
式中:Pi为有培养基的孔和对照孔的光密度值差与整板总差的比值,即Pi=(Ci-R)/∑(Ci-R)[22]。
Simpson指数(D)又称优势度指数,是对多样性方面的集中性度量。计算公式为:

Pielou均匀度指数是群落实测多样性与最大多样性的比率。计算公式为:

式中:S为被利用碳源总数目。
1.4 统计方法用主成分分析法(Principal Component Analysis,PCA)和方差分析(Analysis of Variance,ANOVA ) 确定不同样点间水中微生物群落代谢的相异程度,统计分析通过Canoco 4.5 和SPSS 18.0 统计软件实现,数据统计和绘图通过Microsoft Excel 2007来完成。
2 结果与分析 2.1 生物絮团对养殖水体水质的影响 2.1.1 温度、溶氧、pH及TSS值变化试验期间对照组C3出现死鱼现象,故统计对照组数据时仅采用C1和C2。试验期间对照组和实验组水温为28~32 ℃,溶氧5.3~8.9 mg/L,pH 7.0~8.0。其中,实验组和对照组之间pH差异不大,表明碳源强化对养殖池塘的pH影响不显著。
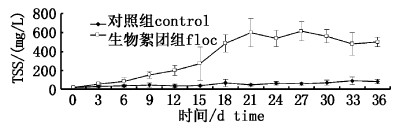
随着养殖时间的延长,生物絮团组TSS浓度逐渐高于对照组(P < 0.05)。对照组试验期间TSS一直处于较低水平,维持在18.3~90.0 mg/L之间(图1);生物絮团组TSS浓度水平呈现先升高再趋于平衡的趋势,21 d时TSS浓度达到600 mg/L,并趋于平衡。实验结束时生物絮团组TSS浓度是对照组的6倍,表明生物絮团养殖水体可以显著提高总固体悬浮物(TSS)含量。
|
图 1 生物絮团组与对照组TSS变化 Fig. 1 TSS in control and floc treatments throughout the experimental period |
生物絮团组氨氮水平呈现先升高后下降的趋势,在12 d氨氮浓度达到最大值2.53 mg/L,随后浓度开始下降(图2)。而对照组氨氮水平随着养殖时间的延长呈逐渐增加的趋势,直到实验结束氨氮浓度达到最大值为2.73 mg/L。

|
图 2 生物絮团组与对照组试验期间氨氮含量变化 Fig. 2 Ammonia nitrogen in control and floc treatments throughout the experimental period |
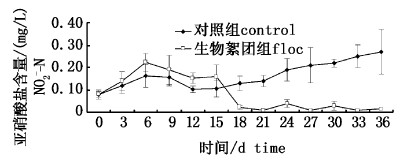
生物絮团组亚硝酸氮的变化规律与氨氮变化趋势相似,呈现先升高后下降的趋势(图3)。对照组亚硝酸氮浓度整体呈现上升的趋势,直到实验结束时浓度最大为0.27 mg/L。
|
图 3 生物絮团组与对照组试验期间亚硝酸氮含量变化 Fig. 3 Nitrite nitrogen (NO2--N) in control and floc treatments throughout the experimental period |
生物絮团组硝酸盐氮浓度整体保持在较低水平,平均值为0.63 mg/L(图4)。对照组整体呈现上升的趋势,18 d后浓度上升明显,保持在2.46 mg/L的浓度水平。
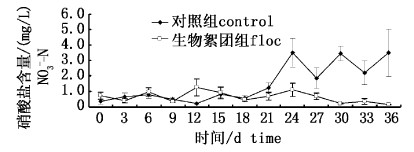
|
图 4 生物絮团组与对照组试验期间硝酸氮含量变化 Fig. 4 Nitrate nitrogen (NO3--N) in control and floc treatments throughout the experimental period |
(1)碳源平均吸光值(AWCD )变化特征
12 h以内水体微生物活性较低,12 h至96 h平均吸光值随着培养时间延长而逐步增大,108 h后水体微生物平均吸光值进入稳定期。对比2组AWCD值发现,108 h后生物絮团组水体微生物对碳源的利用率大于对照组(P < 0.05),这一趋势直至实验结束,表明养殖水体中添加葡萄糖增加了水体微生物的代谢活性(图5)。
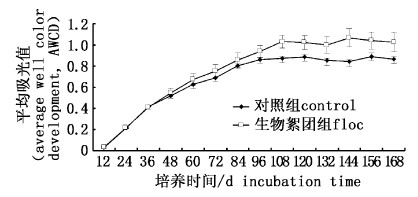
|
图 5 生物絮团组与对照组水体微生物AWCD值变化特征 Fig. 5 Average Well Color Development (AWCD) of the Biolog-ECO plates for control and floc treatments |
(2)水体微生物的不同类型碳源代谢特征
按化学基团的性质,对ECO板上的31种碳源分成6类,即羧酸类、氨基酸类、碳水化合物、聚合物类、胺类、酚类。将6大类碳源的C-R值进行平均,绘制图6。由图6可知,6类碳源的利用率均随时间的延长而增强,生物絮团组与对照组水体微生物对聚合物类、碳水化合物类和氨基酸类3大类的利用程度存在较大差异。以ECO板培育168 h为时间点,对各个处理组的不同类型碳源进行C-R值比较,对照组:碳水化合物>氨基酸类>胺类>聚合物类>羧酸类>酚类;生物絮团组:聚合物类>碳水化合物>氨基酸类>胺类>羧酸类>酚类。对比2组对6大类碳源的代谢差异,发现生物絮团组聚合物类和碳水化合物的AWCD值明显高于对照组(P < 0.05),其他4种没有明显差异(P>0.05)。表明养殖水体中添加葡萄糖明显提高了对聚合物类和碳水化合物的代谢强度。
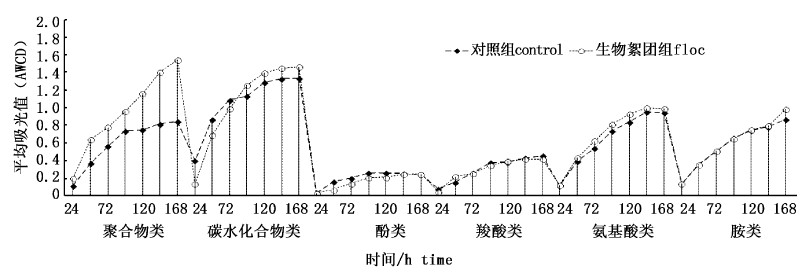
|
图 6 水体微生物对6大类碳源的利用特征 Fig. 6 Changes in AWCD for six substrate categories |
根据ECO板培养96 h光密度数据C-R,计算96 h的Shannon-Wiener指数、Pielou均匀度指数、Simpson指数、丰富度指数(表1)。 从表1可以看出,生物絮团组Shannon-Wiener指数和丰富度指数明显高于对照组(P < 0.05),而Pielou均匀度指数和Simpson指数均没有显著差异(P>0.05)。
| 表 1 水体微生物群落多样性指数 Tab.1 Diversity indices of microorganism communities in control and floc treatments |
选择Biolog-ECO测试实验中96 h 作为分析时间点,对Biolog 测试获得数据进行标准化变换后,应用Canoco for Windows 4.5实施主成分分析(图7)。第1主成分为66.9%,第2主成分为12.4%,共占79.3%。样方间距离的大小表示样方间的相似程度,距离越近相似程度越高。其中对照组样点(C1、C2)较集中,生物絮团样点(B1、B2、B3)相对分散。另外还可以看出,不同处理组(图标)在不同碳源投射点的相对位置(箭头)代表该碳源在该类型的贡献程度,即贡献大小,顺着箭头的方向,表示贡献程度越大,反之,表示贡献程度越小 [23]。
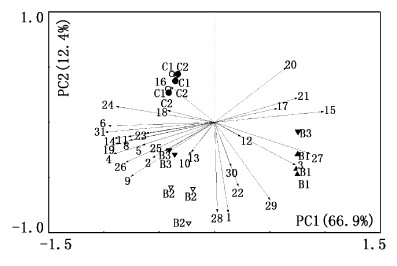
|
图 7 两组养殖水体微生物对Biolog板中底物碳源代谢主成分分析 Fig. 7 Patterns of microbial communities as revealed by principal component analysis (PCA) of Biolog plate data profiles C1、C2为对照组(Control);B1、B2、B3为生物絮团组(Floc);1. 吐温40(Tween 40); 2. 吐温80(Tween 80); 3. α-环式糊精(α-Cyclodextrin); 4. 肝糖(Glycogen); 5. D-纤维二糖(D-Cellobiose); 6. α-D-乳糖(α-D-Lactose); 7. β-甲基-D-葡萄糖苷(β-Methyl-D-Glucoside); 8. D-木糖(D-Xylose); 9. i-赤藓糖醇(i-Erythritol); 10. D-甘露醇(D-Mannitol); 11. N-乙酰-D-葡萄糖氨(N-Acetyl-D-Glucosamine); 12. D-葡萄糖胺酸(D-Glucosaminic Acid); 13. α-D-葡萄糖-1-磷酸(α-D-Glucose-1-Phosphate); 14. D,L-α-磷酸甘油(D,L-α-Glycerol Phosphate); 15. D-半乳糖酸内脂(D-Galactonic Acid Lactone); 16. D-半乳糖醛酸(D-Galacturonic Acid); 17. 2-羟基苯甲酸(2-Hydroxybenzoic Acid); 18. 4-羟基苯甲酸(4-Hydroxybenzoic Acid); 19. γ-羟丁酸(γ-Hydroxybutyric Acid); 20. 衣康酸(Itaconic Acid); 21. α-丁酮酸(α-Ketobutyric Acid); 22. D-苹果酸(D-Malic Acid); 23. 丙酮酸甲酯(Pyruvic Acid Methyl Ester); 24. L-精氨酸(L-Arginine); 25. L-天门冬酰胺(L-Asparagine); 26. L-苯基丙氨酸(L-Phenylalanine); 27. L-丝氨酸; 28. L-苏氨酸(L-Serine); 29. 甘氨酰-L-谷氨酸(Glycyl-L-Glutamic Acid); 30. 苯乙胺(Phenylethylamine); 31. 腐胺(Putrescine)。 |
表2列出了31种碳源与前两个主成分之间的相关系数(相关系数r>0.55),碳源的相关性越高,表明碳源对样方间的区分的贡献率越大。一个较高的相关系数并不代表该碳源的实际利用程度也高,而意味着样方间的碳源利用率差异性最高。表2显示,2组水体微生物代谢基质主成分1相关系数0.55以上的基质有19种,相关系数大于0.85的有8种(其中聚合物类1种、碳水化合物3种、羧酸类1种、胺类1种、氨基酸类2种);主成分2相关系数0.55以上的基质仅有4种,说明养殖对照组和生物絮团组水体微生物代谢功能群落结构的差异主要体现在主成分1相关系数高的基质上。
| 表 2 不同碳源类型与前两个主成分的相关系数 Tab.2 Correlation coefficients of the first two principal components (PC1 and PC2) from the water samples collected a. All substrates with an r value> 0.5 are shown (P < 0.001);r=Pearson correlation coefficient |
通过向养殖水体中添加葡萄糖可以明显降低氮污染,促进生物絮团的形成。实验结束时,对比生物絮团组和对照组水体微生物对碳源需求能力发现,生物絮团组明显提高了养殖水体微生物活性(AWCD),特别是提高了对聚合物类和碳水化合物的代谢强度。
3.1 添加葡萄糖对生物絮团形成和养殖水体水质的影响本研究显示,利用葡萄糖培养生物絮团过程中总固体悬浮物(TSS)含量持续增加。TSS、浑浊度(turbidity)和可沉淀固体量(settleable solids)是衡量絮团生物量的3大重要指标[24, 25, 26]。AVNIMELECH[27]和DE SCHRYVER[13]等把TSS含量作为养殖水体生物絮团培养成熟与否的指示指标,当TSS含量在200~500 mg/L时,生物絮团系统较稳定,处理氮源污染效果最好。本实验生物絮团组18天前TSS含量持续增加,其中12天后TSS含量达到200 mg/L以上,18天后TSS含量进入稳定期,并保持在480 mg/L以上。在生物絮团系统中,TSS不断的增加是由于零水交换、有机物大量投入和异养微生物快速生长等条件造成的[28],以往大量研究表明,养殖水体中加入碳源后异养微生物被激活,大量繁殖并附着于水体悬浮颗粒上,大量异养微生物富集的颗粒同时会附着大量藻类、原生动物以及其他的池塘物质,然后形成生物絮团[29, 30, 31]。
成熟的生物絮团因其具有好氧、兼氧和厌氧的微生物环境,可供好氧和厌氧菌生长繁殖,并发挥生物脱氮作用,好氧硝化和厌氧反硝化能有效去除水体中的氮源。本实验中生物絮团组18天后NH4+-N和NO2--N含量得到了有效的控制,当生物絮团系统培养18天后进入成熟稳定期,生物絮团发挥了调控水质的作用,异养微生物吸收碳源物质葡萄糖的同时利用了水体中的NH4+-N,通过抑制NH4+-N转化为NO2--N的量来降低养殖水体NO2--N水平。而生物絮团组前期NH4+-N和NO2--N含量没有得到有效的控制,这与生物絮团系统尚未稳定和成熟以及絮团含量不足(TSS)有关,SCHVEITZER等[32]研究表明生物絮团系统TSS含量在400 mg/L以上时才能有较好的硝化速率,当TSS含量低于200 mg/L时,养殖系统硝化细菌不能完全控制NH4+-N和NO2--N含量。大量研究[7, 13, 33, 34, 35, 36, 37]已证实在养殖水体中应用BFT对水质有很好的控制效果。
3.2 添加葡萄糖对养殖水体微生物碳源利用的影响Biolog碳源利用平均值AWCD可以反映微生物群落对单一碳源的整体能力,它提供了在相同碳源条件下不同微生物对碳源利用相比较的可能性[38]。从图5可知,养殖水体中添加葡萄糖显著提高了水体微生物AWCD值,表明生物絮团系统中的微生物具有更高的代谢活性。从表1中同样得出,生物絮团组微生物群落碳代谢多样性指数(Shannon-Wiener指数和丰富度指数)显著高于对照组,HASLUN等[6]研究发现,在生物絮团系统中添加碳源可以提高微生物群落的多样性以及稳定性。本实验室以往的研究证实了生物絮团系统微生物群落结构的变化情况[12, 15],养殖水体经过BFT培养后微生物群落结构转变成以变形菌门、放线菌门和拟杆菌门为主的结构。推测BFT促使养殖水体中微生物群落结构发生了变化,随着微生物群落结构的改变,生物絮团系统的碳代谢活性和代谢多样性得到了显著提升[39]。
微生物对碳源物质的选择性特征是研究微生物群落代谢机制与功能的重要指标。生物絮团系统微生物对碳源的利用规律直接反映了生物絮团中微生物的代谢偏好,从六大类分类碳源来看,絮团微生物对多聚物类和碳水化合物类有代谢偏好,而对酚类和羧酸类代谢利用率最低,其中生物絮团系统微生物提高了多聚物类、碳水化合物类碳源的利用率,而对羧酸类、胺类和羧酸类的代谢利用率没有增加。其中对多聚物类的利用率增加最多,至实验培养168 h增加了84%,碳水化合物类增加了10%。这将为我们了解生物絮团系统微生物营养需求提供数据支撑,并为以后养殖水体生物絮团培养碳源筛选提供可靠依据。
通过对比2组养殖水体对Biolog生态板上31种单一碳源利用的主成分(PCA)分析看出,所有样点聚为3个区域,其中对照组聚在第四象限,集中度较高,生物絮团组离散为2个区域,分布在第二、三象限,离散程度较高。样点间距离越远,相似性越低[40, 41],表明对照组与生物絮团组2组养殖水体在微生物代谢功能上存在较大的差异性,生物絮团组内部样点间也存在一定的差异,而生物絮团组组内代谢差异可能由培养池内微生物本身代谢的差异引起的,具体的原因还需要进一步研究。同时,PCA分析图也可看出31种碳源与样品代谢差异之间的贡献关系,样点间的代谢差异是由特定碳源的代谢差异引起的,其中D-半乳糖醛酸(箭头16)对对照组6个样点的贡献最大,而与L-丝氨酸(箭头27)、α-环式糊精(箭头3)和甘氨酰-L-谷氨酸(箭头29)3种碳源的贡献程度最小,生物絮团组B1样点受碳源L-丝氨酸和α-环式糊精的代谢活性影响最大。主成分分析结果揭示了养殖水体在添加碳源后微生物对碳源的利用产生了选择性偏好,微生物代谢多样性出现了差异,同时从更深层次掌握了生物絮团系统中水体微生物代谢特征,找出了微生物代谢差异的限制性因子,并为养殖水体葡萄糖强化引起的微生物变化提供丰富的信息。
4 结论本实验结果表明添加葡萄糖能提高养殖水体TSS含量,降低氨氮、亚硝酸盐氮和硝酸盐氮,提高水体微生物总体代谢活性和多样性。同时,发现添加葡萄糖培养生物絮团18 d可形成较高浓度水平的生物絮团系统。
| [1] | KAUTSKY N, RÖNNBÁCK P, TEDENGREN M, et al. Ecosystem perspectives on management of disease in shrimp pond farming [J]. Aquaculture, 2000, 191(1/3): 145-161. |
| [2] | MOSS S M, MOSS D R, ARCE S M, et al. The role of selective breeding and biosecurity in the prevention of disease in penaeid shrimp aquaculture [J]. Journal of Invertebrate Pathology, 2012, 110(2): 247-250. |
| [3] | AVNIMELECH Y. Biofloc technology-A practical guide book[M]. 2nd ed. Baton Rouge: The World Aquaculture Society, 2012. |
| [4] | CRAB R, DEFOIRDT T, BOSSIER P, et al. Biofloc technology in aquaculture: beneficial effects and future challenges[J]. Aquaculture, 2012, 356-357: 351-356. |
| [5] | STOKSTAD E. Down on the shrimp farm[J]. Science, 2010, 328(5985): 1504-1505. |
| [6] | HASLUN J A, CORREIA E, STRYCHAR K, et al. Characterization of bioflocs in a no water exchange super-intensive system for the production of food size pacific white shrimp Litopenaeus vannamei [J]. International Journal of Aquaculture, 2012, 2(6): 29-39. |
| [7] | BALLESTER E L C, ABREU P C, CAVALLI R O, et al. Effect of practical diets with different protein levels on the performance of Farfantepenaeus paulensis juveniles nursed in a zero exchange suspended microbial flocs intensive system[J]. Aquaculture Nutrition, 2010, 16(2): 163-172. |
| [8] | FURTADO P S, POERSCH L H, WASIELESKY W. Effect of calcium hydroxide, carbonate and sodium bicarbonate on water quality and zoo technical performance of shrimp Litopenaeus vannamei reared in bio-focs technology(BFT) systems[J]. Aquaculture, 2011, 321(1): 130-135. |
| [9] | DE SCHRYVER P, VERSTRAETE W. Nitrogen removal from aquaculture pond water by heterotrophic nitrogen assimilation in lab-scale sequencing batch reactors[J]. Bioresource Technology, 2009, 100(3): 1162-1167. |
| [10] | WANG F, XIA S Q, YANG D H. Effect of flocculant on microbial populations and function in Chem-Bioflocculation(CBF) treatment process using PCR-DGGE[J]. International Journal of Environment and Pollution, 2009, 38(3): 235-244. |
| [11] | XIA S Q, WANG F, FU Y G, et al. Biodiversity analysis of microbial community in the chem-bioflocculation treatment process[J]. Biotechnology and Bioengineering, 2005, 89(6): 656-659. |
| [12] | 夏耘, 郁二蒙, 谢骏, 等. 基于PCR-DGGE技术分析生物絮团的细菌群落结构[J]. 水产学报, 2012, 36(10): 1563-1571. XIA Y, YUE E M, XIE J, et al. Analysis of bacterial community structure of bio-floc by PCR-DGGE[J]. Journal of Fisheries of China, 2012, 36(10): 1563-1571. |
| [13] | DE SCHRYVER P, CRAB R, DEFOIRDT T, et al. The basics of bio-flocs technology: The added value for aquaculture [J]. Aquaculture, 2008, 277(3/4): 125-137. |
| [14] | CRAB R, KOCHVA M, VERSTRAETE W, et al. Bio-flocs technology application in over-wintering of tilapia [J]. Aquacultural Engineering, 2009, 40(3): 105-112. |
| [15] | 夏耘, 邱立疆, 郁二蒙, 等. 生物絮团培养过程中养殖水体水质因子及原核与真核微生物的动态变化[J]. 中国水产科学, 2014, 21(1): 75-83. XIA Y, QIU L J, YUE E M, et al. Dynamic changes of water quality factors and composition of pro-karyotic and eukaryotic microorganisms during culturing of bio-floc[J]. Journal of Fishery Sciences of China, 2014, 21(1): 75-83. |
| [16] | OEHMEN A. The competition between polyphosphate accumulating organisms and glycogen accumulating organisms in the enhanced biological phosphorus removal process[D]. Brisbane: The University of Queensland, 2005. |
| [17] | CRAB R, CHIELENS B, WILLE M, et al. The effect of different carbon sources on the nutritional value of bioflocs, a feed for Macrobrachium rosenbergii postlarvae[J]. Aquaculture Research, 2009, 41(4): 559-567. |
| [18] | AVNIMELECH Y. Carbon/nitrogen ratio as a control element in aquaculture systems [J]. Aquaculture, 1999, 176(3/4): 227-235. |
| [19] | 国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法[M]. 4 版. 北京: 中国环境科学出版社, 2002. Sate enviromental protection administration of China. Water and wastewater monitoring and analysis methods[M].4rd ed, Beijing:China Environment Science Press, 2012. |
| [20] | TIQUIA S M. Metabolic diversity of the heterotrophic microorganisms and potential link to pollution of the Rouge River[J]. Environmental Pollution, 2010, 158(5): 1435-1443. |
| [21] | ROGERS B F, TATE R L. Temporal analysis of the soil microbial community along a toposequence in Pineland soils [J]. Soil Biology & Biochemistry, 2001, 33(10): 1389-1401. |
| [22] | DOBRANIC J K, ZAK J C. A microtiter plate procedure for evaluating fungal functional diversity [J]. Mycologia, 1999, 91(5): 756-765. |
| [23] | 董立国, 蒋齐, 蔡进军, 等. 基于Biolog-ECO技术不同退耕年限苜蓿地土壤微生物功能多样性分析[J]. 干旱区研究, 2011, 28(4): 630-637. DONG L G, JAING Q, CAI J J, et al. Analysis on functional diversity of edaphon communities in medicago sativa fields of different growth years based on Biolog-ECO plates [J]. Arid Zone Research, 2011, 28(4): 630-637. |
| [24] | RAY A J, LEWIS B L, BROWDY C L, et al. Suspended solids removal to improve shrimp (Litopenaeus vannamei) production and an evaluation of a plant-based feed in minimal-exchange, superintensive culture systems[J]. Aquaculture, 2010, 299(1/4): 89-98. |
| [25] | VINATEA L, GÁLVEZ A O, BROWDY C L, et al. Photosynthesis, water respiration and growth performance of Litopenaeus vannamei in a super-intensive raceway culture with zero water exchange: interaction of water quality variables[J]. Aquacultural Engineering, 2010, 42(1): 17-24. |
| [26] | SCHVEITZER R, ARANTES R, BALOI M F, et al. Use of artificial substrates in the culture of Litopenaeus vannamei (biofloc system) at different stocking densities: effects on microbial activity, water quality and production rates[J]. Aquacultural Engineering, 2013, 54: 93-103. |
| [27] | AVNIMELECH Y, KOCHBA M. Evaluation of nitrogen uptake and excretion by tilapia in biofloc tanks, Using 15N tracing[J]. Aquaculture, 2009, 287(1/2): 163-168. |
| [28] | VAN WYK P. Production of L. vannamei in recirculating aquaculture systems: management and design considerations[C]//RAKESTRAW T T, DOUGLAS L S, MARSH L, et al. Proceedings of the 6th International Conference on Recirculation Aquaculture. Roanoke, 2006: 38-47. |
| [29] | SCHNEIDER O, SERETI V, EDING E H, et al. Molasses as C source for heterotrophic bacteria production on solid fish waste[J]. Aquaculture, 2006, 261(4): 1239-1248. |
| [30] | EBEING J M, TIMMONS M B, BISOGNI J J. Engineering analysis of the stoichiometry of photoautotrophic, autotrophic, and heterotrophic removal of ammonia-nitrogen in aquaculture systems[J]. Aquaculture, 2006, 257(1/4): 346-358. |
| [31] | SCHNEIDER O, SERETI V, MACHIELS M A M, et al. The potential of producing heterotrophic bacteria biomass on aquaculture waste[J]. Water Research, 2006, 40(14): 2684-2694. |
| [32] | SCHVEITZERA R, ARANTESA R, COSTODIO P F S, et al. Effect of different biofloc levels on microbial activity, water quality and performance of Litopenaeus vannamei in a tank system operated with no water exchange[J]. Aquacultural Engineering, 2013, 56: 59-70. |
| [33] | RAY A J, DILLON K S, LOTZ J M. Water quality dynamics and shrimp (Litopenaeus vannamei) production in intensive, mesohaline culture systems with two levels of biofloc management[J]. Aquacultural Engineering, 2011, 45(3): 127-136. |
| [34] | XU W J, PAN L Q. Effects of bioflocs on growth performance, digestive enzyme activity and body composition of juvenile Litopenaeus vannamei in zero-water exchange tanks manipulating C/N ratio in feed[J]. Aquaculture, 2012, 356-357: 147-152. |
| [35] | EMERENCIANO M, CUZON G, GOGUENHEIM J, et al. Floc contribution on spawning performance of blue shrimp Litopenaeus stylirostris[J]. Aquaculture Research, 2012, 44(1): 75-85. |
| [36] | XU W J, PAN L Q, SUN X H, et al. Effects of bioflocs on water quality, and survival, growth and digestive enzyme activities of Litopenaeus vannamei (Boone) in zero-water exchange culture tanks[J]. Aquaculture Research, 2013, 44(7): 1093-1102. |
| [37] | XU W J, PAN L Q, ZHAO D H, et al. Preliminary investigation into the contribution of bioflocs on protein nutrition of Litopenaeus vannamei fed with different dietary protein levels in zero-water exchange culture tanks[J]. Aquaculture, 2012, 350-353: 147-153. |
| [38] | CHOI K H, DOBBS F C. Comparison of two kinds of Biolog microplates (GN and ECO) in their ability to distinguish among aquatic microbial communities[J]. Journal of Microbiological Methods, 1999, 36(3): 203-213. |
| [39] | SALOMO S, MVNCH C, RÖSKE I. Evaluation of the metabolic diversity of microbial communities in four different filter layers of a constructed wetland with vertical flow by BiologTM analysis[J]. Water Research, 2009, 43(18): 4569-4578. |
| [40] | HADWIN A K M, DEL RIO L F, PINTO L J, et al. Microbial communities in wetlands of the Athabasca oil sands: genetic and metabolic characterization[J]. FEMS Microbiology Ecology, 2006, 55(1): 68-78. |
| [41] | 张燕燕, 曲来叶, 陈利顶. Biolog EcoPlateTM实验信息提取方法改进[J]. 微生物学通报, 2009, 36(7): 1083-1091. ZHANG Y Y, QU L Y, CHEN L D. An amendment on information extraction of Biolog EcoPlateTM [J]. Microbiology, 2009, 36(7): 1083-1091. |
 2015, Vol. 24
2015, Vol. 24


