2. 西南大学荣昌校区 水产系, 重庆 402460;
3. 四川农业大学 动物疫病与人类健康四川省重点实验室, 四川 雅安 625014
斑点叉尾鮰(Ictalurus punctatus) 亦称沟鲶(channel catfish) ,属于鲶形目(Siluriformes)、鮰科(Ictaluridae)鱼类,是美国主要的淡水养殖品种之一,1987年我国人工繁殖成功后,目前已经在全国多个省份进行推广养殖。斑点叉尾鮰养殖中,疾病是影响其健康养殖的重要因素,每年由细菌性病害造成的损失超过年度养殖损失的10%[1]。2006—2007年,广西网箱养殖的斑点叉尾鮰连续暴发疾病,死亡率高达90%,给当地的斑点叉尾鮰养殖带来严重的经济损失[2, 3]。经本实验室鉴定,导致该养殖地区斑点叉尾鮰大规模死亡的病原为海豚链球菌,菌株命名为DGX07[4]。
近年来关于海豚链球菌病的防治报道逐渐增多,其中免疫防治主要采用传统的全菌灭活疫苗,集中使用于虹鳟[5]、罗非鱼[6]和大菱鲆[7]等的海豚链球菌病防治中,并取得了较好的效果,而全菌灭活苗往往特异性比较强,对于新型血清型的病原不具有保护作用,使用范围受到较大限制。海豚链球菌(Streptococcus iniae)为β-溶血型链球菌,但不属于兰氏分型中的任何类型。该菌是一种重要的鱼类致病菌,能够感染虹鳟、罗非鱼、鲑鱼、澳洲肺鱼、黄狮鱼、比目鱼、斑点叉尾鮰等多种鱼类,每年在全球水产行业中带来的经济损失近1亿美元。随着分子生物学的发展,关于海豚链球菌基因工程疫苗的研究也陆续展开,但是研究还处于起步阶段,距离生产应用可能还具较长时间。本文以海豚链球菌C5a肽酶作为研究抗原,以克隆和表达的主要功能活性区域免疫健康斑点叉尾鮰,通过抗体水平测定和免疫保护率评价该亚单位疫苗的免疫效果,以期为斑点叉尾鮰海豚链球菌病的免疫防治提供候选疫苗。
1 材料与方法 1.1 实验菌株和实验动物斑点叉尾鮰源海豚链球菌分离株DGX07由四川农业大学鱼病研究中心分离鉴定并保存。斑点叉尾鮰(60 g±5 g)购于四川蒲江某养殖场,实验前在四川农业大学水产系水泥养殖池(1.5 m×1.0 m×1.5 m)中暂养2周,并进行细菌性和寄生虫疾病检测。
1.2 抗原制备将重组蛋白pSCPI复性后用核酸蛋白仪测定蛋白浓度,并用PBS将pSCPI稀释成1.2 mg/mL。
1.3 兔抗斑点叉尾鮰IgM血清制备 1.3.1 斑点叉尾鮰IgM的提取和纯化健康斑点叉尾鮰用MS-222麻醉至死,尾静脉采血获得血液,血液在室温静置2 h,然后转入4 ℃冰箱过夜,4 000 r/min,4 ℃离心30 min后收集上清,重复一次,获得血清放-80 ℃保存备用。
硫酸铵粗提[8]:吸取10 mL血清于小烧杯中缓慢加入pH 7.0的饱和硫酸铵溶液,使其终浓度达33%,4 ℃过夜,10 000 r/min,20 min离心后将上清加入终浓度为33%的饱和硫酸铵,4 ℃过夜,离心取沉淀。沉淀溶于相同体积0.01 mol/L pH 7.4的PBS中,然后用相同的PBS透析48 h,期间更换透析液,聚乙二醇(PEG-20000)浓缩,获抗体粗提物,-80 ℃保存。
亲硫树脂(Thiophilic Resin)亲和层析提纯斑点叉尾鮰IgM:样品用0.45 μL滤器过滤,防止堵塞填料;用4倍柱床体积的平衡buffer平衡,弃掉流出的液体;上样3~9 mL的样品至柱子,让其流下,然后收集流下的液体,监控未结合的蛋白;用5~10倍柱床体积的平衡buffer洗涤。在280 nm测定流出的液体,测定所有未结合的蛋白已经从填料上洗脱完;用12倍柱床体积的洗脱buffer洗涤结合的免疫球蛋白,收集样品,并在280 nm下进行检测;收集样品经SDS-PAGE鉴定后用PEG-20000浓缩,1 mL分管收集,用核酸蛋白仪测定浓度后放-70 ℃冻存备用。
1.3.2 兔抗斑点叉尾鮰IgM血清制备雄性新西兰大白兔暂养1周后用斑点叉尾鮰IgM进行免疫,免疫程序如表1所示。第3次免疫后耳缘静脉采血,收集血清通过琼扩检测抗体效价,效价达到1∶32时用抗原进行加强免疫,免疫后3 d通过颈动脉放血,收集血清。将所制备的血清过滤除菌后分装,-80 ℃保存。
| 表1 家兔接种免疫程序 Tab 1. Immunization procedure of rabbit |
纯化兔抗斑点叉尾鮰IgM。按照丁炜东等[8]的方法,采用间接ELISA法检测抗体效价。具体步骤:用包被液(pH 9.6,0.05 mol/L碳酸盐缓冲液)将斑点叉尾鮰IgM稀释至20 μg/mL,每孔加入100 μL,4 ℃冰箱过夜包被。然后用5%的牛血清白蛋白于37 ℃封闭1 h,封闭结束后用含0.05%Tween 20的0.01 mol/mL PBST(pH7.4)洗涤液洗涤3次,每次5 min。各孔依次加入2倍梯度稀释的兔抗斑点叉尾鮰IgM血清100 μL,阴性对照孔加PBS,37 ℃温浴1 h,同上洗涤3次。每孔加入100 μL羊抗兔IgG-HRP,37 ℃温浴1 h。每孔加入100 μL新鲜配制的TMB-H2O2底物溶液,于避光处反应30 min,然后每孔加入100 mL 2 mol/L硫酸溶液终止反应,于450 nm下检测每孔OD值。
1.4 免疫免疫前随机选取5尾鱼进行尾静脉采血,通过凝集实验测定实验鱼血清能否与海豚链球菌DGX07株进行反应。同时,分别接种5尾鱼的肝脏、肾脏和脾脏组织于BHI平板,观察有无细菌感染。
将240尾健康斑点叉尾鮰(60 g±5 g)随机分成8组,每组30尾。其中6个组为免疫组,2个组为对照组。免疫剂量分别为1 μg/g、2 μg/g和3 μg/g,每组设置1个平行,每尾鱼注射0.2 mL配比好的抗原,对照组注射等量的PBS。2周后用等量的抗原加强免疫1次。实验在1.5 m×1.0 m×1.5 m水泥池中进行,养殖水体为曝气自来水,实验水温25 ℃±3 ℃,实验期间每天换水1次,每次1/3。
1.5 采血分别于实验第21、28、35、42和49天进行尾静脉采血,采血前每个组随机选取5尾鱼用MS-222进行麻醉。采集的血液室温静置2 h后转入4 ℃冰箱,放置过夜,然后4 000 r/min离心30 min,收集血清,放-80 ℃备用。
1.6 间接ELISA检测抗体效价按照张崇文的方法,用间接ELISA检测免疫鱼产生的特异性抗体效价[9],抗体效价根据P/N值来确定:P/N=(待检血清OD450-空白对照的OD450)/(阴性血清的OD450-空白对照的OD450)。当P/N大于2.1时抗血清的最高稀释倍数为其最终抗体效价。数据以“平均值±标准误”表示,并用单因素方差分析进行显著性检验。
1.7 攻毒
将海豚链球菌DGX07株在健康斑点叉尾鮰体内复壮3次,然后接种于BHI肉汤,于28 ℃过夜培养。以10倍100%的致死剂量(6×108 cfu/mL)为攻毒浓度[10],每尾腹腔注射0.2 mL,每组选取20尾鱼。攻毒实验鱼在90 cm×60 cm×60 cm的水族箱中暂养1周,水温用加热棒控制在28 ℃±1 ℃,养殖用水为曝气自来水,每天换水1/3。攻毒后连续观察14 d,观察死亡情况,记录死亡数量,并分别接种肝脏、肾脏和脾脏组织于BHI平板鉴定攻毒细菌。以相对保护率表示免疫效果:相对保护率(RPS)计算公式为
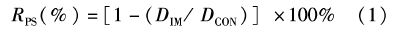
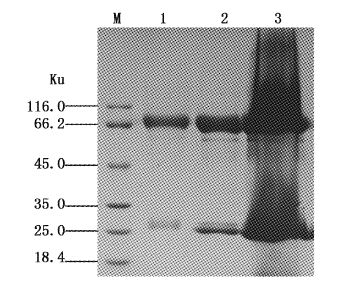
将健康斑点叉尾鮰血清采用饱和硫酸铵法进行粗提,经SDS-PAGE检测后斑点叉尾鮰IgM的重链约70 ku左右,轻链约27 ku左右。采用亲硫树脂(Thiophilic Resin)亲和层析进行纯化,得到了较纯的斑点叉尾鮰重链和轻链(图1)。经核酸蛋白仪检测纯化的斑点叉尾鮰IgM含量达6.4 mg/mL。
|
图1
斑点叉尾鮰IgM SDS-PAGE分析
Fig.1
Analysis of channel catfish serum IgM by SDS-PAGE
M.蛋白质marker; 1.亲硫树脂提取IgM; 2.饱和硫酸铵提取IgM; 3.斑点叉尾鮰血清。 M.protein marker; 1.IgM was purified by Thiophilic Resin; 2. IgM was purified by Saturated ammonium sulfate; 3. Channel catfish serum. |
将纯化的斑点叉尾鮰IgM与弗氏佐剂混合免疫家兔,3免后通过琼脂糖扩散实验检测兔血清抗体效价为1∶32,4免后收集血清并进行纯化。采用间接ELISA的方法测定了兔抗斑点叉尾鮰IgM血清的抗体效价,结果表明,本实验制备的兔抗斑点叉尾鮰抗体效价达1∶51200(表2),可以满足后续免疫检测的要求。
| 表2 兔抗斑点叉尾鮰IgM抗体效价 Tab 2. Titer of rabbit polyclonal sera anti-IgM of channel catfish. |
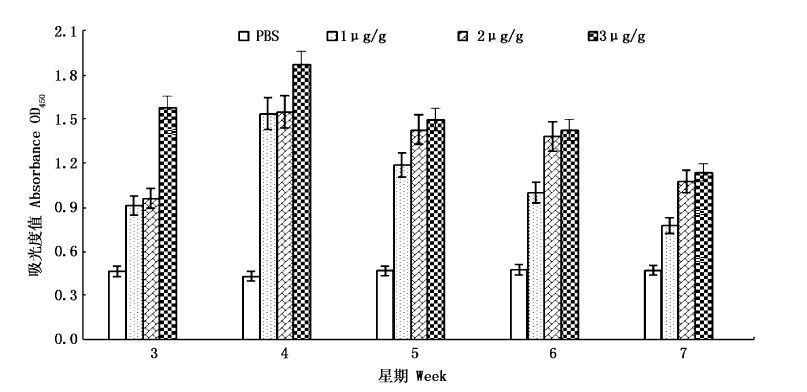
采用间接ELISA的方法测定斑点叉尾鮰抗pSCPI抗体效价,结果表明,免疫后第3周开始实验组各组均出现特异性抗体,免疫后第4周出现最高抗体水平,第5周后开始下降,且各组抗体水平均与对照组差异极显著(P<0.01)。第3周3组间差异显著(P<0.05),第4周 2 μg/g剂量组与3 μg/g剂量组差异不显著(P>0.05),第5周和第6周 1 μg/g剂量组与2 μg/g剂量组差异不显著(P>0.05),第7周 3 μg/g剂量组与1 μg/g剂量组和2 μg/g剂量组差异不显著(P>0.05),见图2。
|
图2 间接ELISA检测斑点叉尾特异性抗体水平 Fig.2 Specific antibody titers of channel catfish by ELISA |
不同剂量抗原免疫4周后用海豚链球菌强毒株DGX07进行攻毒,攻毒后第3天开始出现死亡,14 d各组平均累计死亡率分别为:1 μg/g剂量组死亡率47.5%,2 μg/g剂量组死亡率45%,3 μg/g剂量组死亡率47.5%。平均相对保护率分别为40.63%、43.75%和40.63%(表3)。死亡鱼出现体表和内脏器官出血症状,接种死亡鱼肝脏、肾脏和脾脏组织于BHI平板,长出单一形态细菌,经鉴定为海豚链球菌。根据以上结果表明,重组蛋白pSCPI可以作为防控斑点叉尾鮰海豚链球菌病的疫苗候选。
| 表3 免疫后实验动物保护率 Tab 3. The RPS of experimental animal immunized by vaccine |
分步盐析法是蛋白质技术中最为经典的分离浓缩方法[11],其原理为:高浓度的盐离子在蛋白质溶液中可与蛋白质竞争水分子,从而破坏蛋白质表面的水化膜,降低其溶解度,使之从溶液中沉淀出来。各种蛋白质的溶解度不同,因而可利用不同浓度的盐溶液来沉淀不同的蛋白质。硫酸铵因其溶解度大,温度系数小和不易使蛋白质变性,广泛应用于免疫球蛋白的粗提。本实验依次采用50%和33%的饱和硫酸铵对斑点叉尾鮰的IgM进行粗提,经SDS-PAGE分析发现仍然含有较多的杂带,所以还需要对粗提的IgM进行进一步纯化。目前纯化免疫球蛋白的方法除了常规的饱和硫酸铵(SAS)盐析外,还有柱层析、离子交换层析、疏水层析及亲和层析等方法,其中亲和层析是依靠生物高分子所特有的生物活性进行分离提纯的特异性吸附层析,具有高效、快速、纯化效果好的优点,是提取IgM的最佳方法[12]。鱼类血清IgM的纯化常采用Protein A进行亲和层析。国内已有学者应用rProtein A Sepharose亲和层析法成功分离纯化了黄鳍棘鲷、大黄鱼、紫红笛鲷、青石斑鱼、尖吻鲈和牙鲆的血清IgM[13, 14, 15, 16]。黄婷等采用rProtein A Sepharose亲和层析一步法纯化斑点叉尾鮰血清免疫球蛋白(IgM),结果表明,rProtein A Sepharose亲和层析法可以分离获得高纯度的斑点叉尾鮰血清IgM,但通过SDS-PAGE电泳检测发现只分离到了斑点叉尾鮰血清IgM重链,分子量约101.0 ku,而未见轻链,据分析可能是不同的沉淀方法导致IgM发生变性或重链和轻链未裂解导致[17]。亲硫树脂(Thiophilic Resin)亲和层析是PORATH等1984年建立的,是一种特殊的盐依赖纯化技术,能够明显地结合免疫球蛋白和α-巨球蛋白,其作用原理为:一些免疫球蛋白能够在高盐的环境下结合到固相的载体上,包括接近于硫醚基的磺基,而在低盐的环境中能够将结合蛋白洗脱,广泛应用于IgG、IgY和IgM的纯化。本实验采用亲硫树脂法对饱和硫酸铵粗提的IgM进一步进行纯化,经SDS-PAGE分析,得到了较纯的斑点叉尾鮰IgM重链和轻链,分子量分别约为70 ku和27 ku。因此,该方法能够应用于斑点叉尾鮰血清IgM的分离纯化,且具有较好的纯化效果。
3.2 重组蛋白pSCPI对斑点叉尾的免疫保护效果C5a肽酶在A族链球菌和B族链球菌中不仅是重要的毒力因子,而且是良好的保护性抗原[18, 19]。研究显示A族链球菌的C5a肽酶(streptococcal C5a peptidase of A group,SCPA)能够通过鼻内免疫保护抵抗M49或M1型GAS(B group streptococcal)对小鼠的感染[20],而B族链球菌的C5a肽酶(streptococcal C5a peptidase of B group,SCPB)能够抵抗1a、Ⅱ和Ⅴ型GBS对小鼠的感染[21]。而且,无论用SCPA还是用SCPB蛋白免疫小鼠,都可预防GAS或GBS感染导致的急性肺炎[20, 22]。然而关于C5a肽酶在水产动物上的免疫效果还未见报道。本研究以斑点叉尾鮰作为免疫受试动物,以不同剂量的重组pSCPI蛋白作为抗原进行腹腔注射免疫,采集不同时间点的血清进行抗体效价测定,结果表明pSCPI免疫的斑点叉尾鮰能产生较高的抗体效价,且在免疫后第4周出现最高值,第5周后开始下降,第7周仍然具有抗体效价,推测pSCPI蛋白对斑点叉尾鮰海豚链球菌病具有较长的保护时间。攻毒后第3天试验鱼陆续开始死亡,攻毒后14 d累计死亡率分别为47.5%(1 μg/g剂量组)、45%(2 μg/g剂量组)、47.5%(3 μg/g剂量组)和80%(PBS组),平均相对保护率分别为40.63%、43.75%和40.63%,根据保护率和抗体水平推测2 μg/g为pSCPI免疫斑点叉尾鮰的最佳剂量。以上结果表明重组pSCPI蛋白具有较好的免疫保护作用,能够作为海豚链球菌亚单位疫苗的候选之一。
| [1] | WAGNER B A, WISE D J, KHOO L H, et al. The epidemiology of bacterial diseases in food-size channel catfish[J]. Journal of Aquatic Animal Health, 2002, 14(4): 263-272. |
| [2] | 汪开毓, 陈德芳, 耿毅, 等. 斑点叉尾鮰链球菌病的发生与诊治[J]. 科学养鱼, 2008, (3): 50-51.WANG K Y, CHEN D F, GENG Y, et al. The occurrence and treatment of Streptococcus iniae Isolated from Channel Catfish (Ictalurus punctatus)[J]. Scientific Fish Farming, 2008, (3): 50-51. |
| [3] | 余晓丽, 陈明, 李超, 等. 斑点叉尾鮰暴发性海豚链球菌病的研究[J]. 大连水产学院学报, 2008, 23(3): 185-191.YU X L, CHEN M, LI C, et al. Channel catfish Ictalurus punctatus outbreak infected by bacterium Streptococcus iniae[J]. Journal of Dalian Fisheries University, 2008, 23(3): 185-191. |
| [4] | 陈德芳. 斑点叉尾鮰海豚链球菌病病原学、 病理学和诊断方法研究[D]. 雅安: 四川农业大学, 2011.CHEN D F. Channel Catfish Streptococcus iniae disease etiology, pathology and diagnosis method[D]. Ya'an: Sichuan Agriculture University, 2011. |
| [5] | BERCOVIER H, GHITTINO C, ELDAR A. Immunization with bacterial antigens: infections with streptococci and related organisms[J]. Developments in Biological Standardization, 1997, 90: 153-160. |
| [6] | 张旭丽. 罗非鱼海豚链球菌疫苗研制及胞外产物特性分析[D]. 湛江: 广东海洋大学, 2010.ZHANG X L. Research of Tilapia Streptococcus iniae vaccine and cellular characterization extracellular products[D]. Zhanjiang: Guangdong Ocean University, 2010. |
| [7] | 程爽. 一株海豚链球菌的分离鉴定及其亚单位疫苗研究[D]. 青岛: 中国科学院海洋研究所, 2010.CHENG S. Identification and characterization of a Streptococcus iniae strain SF1 and its subunit vaccine[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2010. |
| [8] | 丁炜东, 曹丽萍, 曹哲明. 草鱼血清 IgM 蛋白的纯化及抗血清的制备[J]. 水生生物学报, 2010, 34(1): 164-169.DING W D, CAO L P, CAO Z M. Purification of serum IgM from garss carp (cienoyharyngodoni dellus) and preparation of rabbit sera anti-IgM[J]. Acta Hydrobiologica Sinica, 2010, 34(1): 164-169. |
| [9] | 张崇文. 哈维氏弧菌外膜蛋白 (OmpK 和 GAPDH) 免疫原性研究及主要海水病原弧菌外膜蛋白交叉保护性抗抗原筛选[D]. 杭州: 浙江大学, 2007.ZHANG C W. Immunogenicity of Vibrio harveyi outer membrane protein (OmpK and GAPDH) and main sea pathogen Vibrio cross-protective outer membrane protein antigen screening[D]. Hangzhou: Zhejiang University, 2007. |
| [10] | CHEN D F, WANG K Y, GENG Y, et al. Streptococcus iniae Isolated from Channel Catfish (Ictalurus punctatus) in China[J]. Israeli Journal of Aquaculture-Bamidgeh, 2011, 63(3): 105-115. |
| [11] | 赵永芳. 生物化学技术原理及应用[M]. 武汉: 武汉大学出版社, 1994.ZHAO Y F. Biochemical technology principles and applications[M]. Wuhan: Wuhan University Press, 1994. |
| [12] | 陈垚, 王石泉, 韩晓冬, 等. 鲫鱼血清和皮肤粘液 IgM 的分离纯化及部分性质的鉴定[J]. 动物学研究, 2003, 24(2): 111-115.CHEN Y, WANG S Q, HAN X D, et al. Purification and partial characterization of Immunoglobulin M from Carassius auratus serum and skin mucus[J]. Zoological Research, 2003, 24(2): 111-115. |
| [13] | 刘振兴, 张殿昌, 苏天凤, 等. 黄鳍棘鲷血清 IgM 的纯化及兔抗血清的制备[J]. 中国水产科学, 2008, 15(1): 129-135.LIU Z X, ZHANG D C, SU T F, et al. Purification of serum IgM in Acanthopagrus latus and preparation of rabbit sera anti-IgM[J]. Journal of Fishery Sciences of China, 2008, 15(1): 129-135. |
| [14] | 鄢庆枇, 韩一凡, 高天翔, 等. 大黄鱼血清 IgM 纯化及其兔抗血清的制备[J]. 中国水产科学, 2006, 13(3): 475-479.YAN Q P, HAN Y F, GAO T X, et al. Purification of serum IgM from large yellow croaker (Pseudosciaena crocea) and preparation of rabbit sera anti-IgM[J]. Journal of Fishery Sciences of China, 2006, 13(3): 475-479. |
| [15] | 刘云, 孙峰, 姜国良. 牙鲆血清免疫球蛋白的分离纯化及部分特性分析[J]. 中国水产科学, 2007, 14(4): 547-553.LIU Y, SUN F, JIANG G L. Purification and partial characterization of serum immunoglobulins from Japanese flounder (Paralichthys olivaceus)[J]. Journal of Fishery Sciences of China, 2007, 14(4): 547-553. |
| [16] | 冯娟, 胡超群. 四种海水养殖鱼类血清免疫球蛋白的分离纯化及分子量测定[J]. 热带海洋学报, 2002, 21(4): 8-13.FENG J, HU C Q. Purification and characteristics of serum immunoglobulins of four major cultured marine fishes in China[J]. Journal of Tropical Oceanography, 2002, 21(4): 8-13. |
| [17] | 黄婷, 张彬, 陈明, 等. 罗非鱼和斑点叉尾鮰血清 IgM 的纯化及兔抗血清的制备[J]. 广西农业科学, 2010, 41(12): 1339-1342.HUANG T, ZHANG B, CHEN M, et al. Purification of serum immunoglobulin (IgM) from tilapia (Oreochromis niloticus) and channel catfish (Ictalurus punctatus) and preparation of their anti-IgM sera in rabbit[J]. Guangxi Agricultural Sciences, 2010, 41(12): 1339-1342. |
| [18] | CLEARY P P, PRAHBU U, DALE J, et al. Streptococcal C5a peptidase is a highly specific endopeptidase[J]. Infection and Immunity, 1992, 60(12): 5219-5223. |
| [19] | CHENG Q, CARLSON B, PILLAI S, et al. Antibody against surface-bound C5a peptidase is opsonic and initiates macrophage killing of group B streptococci[J]. Infection and Immunity, 2001, 69(4): 2302-2308. |
| [20] | CLEARY P P, MATSUKA Y V, HUYNH T, et al. Immunization with C5a peptidase from either group A or B streptococci enhances clearance of group A streptococci from intranasally infected mice[J]. Vaccine, 2004, 22(31/32): 4332-4341. |
| [21] | SANTILLAN D A, RAI K K, SANTILLAN M K, et al. Efficacy of polymeric encapsulated C5a peptidase-based group B streptococcus vaccines in a murine model[J]. American Journal of Obstetrics and Gynecology, 2011, 205(3): 249.e1-249.e8. |
| [22] | CHENG Q, DEBOL S, LAM H, et al. Immunization with C5a peptidase or peptidase-type III polysaccharide conjugate vaccines enhances clearance of group B streptococci from lungs of infected mice[J]. Infection and Immunity, 2002, 70(11): 6409-6415. |
2. Fisheries Department of Southwest University Rongchang Campus, Chongqing 402460, China;
3. Key Laboratory of Animal Disease and Human Health of Sichuan Province, Sichuan Agricultural University, Ya'an 625014, Sichuan, China
 2015, Vol. 24
2015, Vol. 24


