2. 中国水产科学研究院淡水渔业研究中心 农业部淡水鱼类遗传育种与养殖生物学重点开放实验室, 江苏 无锡 214081;
3. 中国水产科学研究院淡水渔业研究中心 中美淡水贝类种质资源保护及利用国际联合实验室, 江苏 无锡 214081
三角帆蚌(Hyriopsis cumingii)是我国主要淡水优质育珠蚌品种,世界上70%的淡水珍珠由其培育而成[1],在珍珠养殖业中占有十分重要的地位。20世纪70年代,我国就突破了三角帆蚌的人工繁育,使我国淡水珍珠养殖业得到快速发展,80年代就超越日本成为珍珠养殖和出口第一大国。
三角帆蚌隶属珠蚌亚科,具有蚌科物种的典型生活史,其钩介幼虫需寄生在特定的寄主鱼身上才能完成变态发育,从而实现人工繁育[2, 3]。已有的研究表明:三角帆蚌钩介幼虫可寄生在黄颡鱼[4]、草鱼[5]、罗非鱼[6]等特定寄主身上,而黄颡鱼的寄生效果最好。在三角帆蚌规模化人工繁殖过程中,在寄生时需合理控制钩介幼虫的寄生数量,在寄生后需为寄主鱼提供理想的栖息环境和条件,确保寄主鱼的成活,提高育苗效率。闻海波[5]研究表明:黄颡鱼的合适寄生量为每千克黄颡鱼20 000~30 000只钩介幼虫。在生产实践中,黄颡鱼寄生后经常发生大量死亡的现象,给育珠蚌苗种生产带来巨大损失,其死亡除了受到环境因子、黄颡鱼自身健康状况影响外,钩介幼虫寄生胁迫可能是引发死亡的重要因素之一。许多学者研究了温度[7]、盐度[8]及溶氧水平[9]等环境因子对黄颡鱼呼吸代谢产生的影响,关于钩介幼虫寄生胁迫对其呼吸代谢的影响还未见报道。本文研究了三角帆蚌钩介幼虫对黄颡鱼正常寄生及过量寄生胁迫条件下呼吸代谢的影响,系统测定了黄颡鱼在寄生前期、寄生中期、寄生后期(幼虫脱落前)及幼虫完全脱落后呼吸代谢变化规律,以期为提高黄颡鱼寄生后的成活率提供理论依据。
1 材料与方法 1.1 寄主鱼及暂养实验用寄主鱼为黄颡鱼,取自淡水渔业研究中心江阴基地,选择规格相似、体格健壮、体表无伤的鱼作为实验材料,平均体质量(60.9±2.7) g。寄生前在循环控温养殖系统中暂养1 周,每日早中晚投喂黄颡鱼配合饲料,实验前停喂24 h。实验用水为充分曝气的自来水,养殖系统水温(23±0.5) ℃,溶氧大于8.68 mg/L,氨氮小于 0.030 mg/L,亚硝酸盐氮小于 0.008 mg/L。
1.2 寄生处理2014年4月,从江阴申港三鲜养殖公司南基地亲蚌培育池中挑选成熟的三角帆蚌雌蚌30只。清洗蚌壳表面的青苔和污物后,按华丹[10]的方法进行人工采苗,按白志毅[4]、闻海波[6]方法进行寄生。
将黄颡鱼随机分成A、B、C 3组,每组3个重复,每个重复30尾,其中A组实验鱼不寄生,作为对照组。根据预备实验结果,B组黄颡鱼的寄生时间为3 min,钩介幼虫寄生数量控制在2 500只/尾左右,为正常寄生组;C组寄生5 min,钩介幼虫数量控制在3 500只/尾左右,为重度寄生组。寄生完成后用清水洗去实验鱼体表未能吸附的钩介幼虫,分别放入循环控温养殖系统50 L的玻璃缸中暂养,暂养过程中不投喂饲料。每天观察黄颡鱼的死亡情况,发现死鱼及时清理。在寄生第5天取寄主鱼鳃丝及鳍条,OLYMPUS解剖镜下统计各组钩介幼虫的寄生数量,每组每个重复各观察3尾实验鱼。
1.3 耗氧率、排氨率的测定耗氧率和排氨率的测定采用静水呼吸室法[12, 13]。呼吸室为5 L的玻璃缸。分别在寄生的第1天(寄生初期)、4天(寄生中期)、8天(寄生后期)和12天(幼虫完全脱落后),随机从A、B、C组每个重复中各取实验鱼9尾,每个呼吸室放3尾鱼,每个重复设 3 个平行,以不放鱼的呼吸室为空白对照。每次呼吸测定实验从上午 9:00开始,2 h后测定实验前后水体溶解氧、氨氮的含量。其中溶解氧测定采用碘量法,氨氮测定采用奈氏比色法。耗氧率[mg/(g·h)]、排氨率[mg/ (g·h)]和氧氮比的计算公式参考杨莹[11]、唐贤明[13]方法。测定结束后寄主鱼放回玻璃缸继续暂养。
1.4 数据分析采用SPSS 11.5统计软件分析实验数据。其中3组实验鱼的耗氧率和排氨率比较分析采用One-way ANOVA 单因素方差分析;同一组不同寄生时间的数据比较也采用One-way ANOVA 单因素方差分析。用Excel 2003绘制相关图表。
2 结果与分析 2.1 钩介幼虫寄生量及寄主鱼成活率A组实验鱼鳃丝及鳍条上未发现钩介幼虫寄生;B组(2 580±14)只/尾;C组(3 244±48)只/尾。t检验分析表明:B组寄主鱼钩介幼虫量显著低于C组(P=0.002)。在本实验条件下,钩介幼虫在寄生后12天内全部脱落。其中C组寄主鱼的成活率最低,为50.0%,比B组低43.3%(表1)。
| 表 1 钩介幼虫寄生量对寄主鱼成活率的影响 Tab.1 Effect of the number of glochidia infected on the survival rate of host fish |
3组实验鱼耗氧率测定结果如图1所示。在整个实验过程中,3组实验鱼的耗氧率介于0.034~0.056 mg/(g·h)之间。多重比较结果显示:3组实验鱼在寄生第1、4、8、12天耗氧率均无显著差异(P>0.05)。在幼虫脱落前,随寄生时间的增加,A、C组实验鱼的耗氧率呈下降趋势,于第8天下降到最低,分别为第1天的83.3%和60.7%;B组耗氧率也有所下降,在第4天即降低到最低点,但与第8天无显著差异(P>0.05)。在幼虫完全脱落后,3组实验鱼的耗氧率比脱落前期均有显著上升(P < 0.05)。
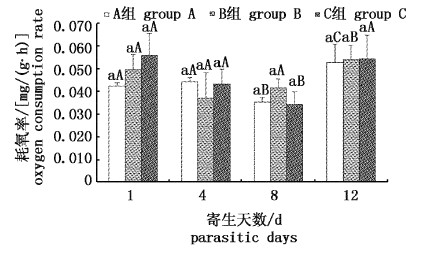
|
图 1
三角帆蚌钩介幼虫寄生对黄颡鱼耗氧率的影响
Fig. 1
Effect of infection stress by glochidia of H. cumingii on oxygen consumption rate in yellow catfish P. fulvidraco
小写字母为同一时间组间比较,大写字母为同组间不同时间比较。 The small letters as the group comparison at the same time, big letters as the time comparison in the same group. |
3组实验鱼的排氨率变化如图2所示。在寄生第1天,A组与B组之间无显著差异,而C组显著高于A组(P=0.003)和B组(P=0.017);在寄生第 4天,3组之间均存在显著差异;在寄生第8天,寄生组(B组和C组)仍显著高于未寄生组(A组,P=0.026,P=0.002),C组排氨率是A组的 2.1 ~ 2.3 倍;至寄生第12天,B组、C组寄生的钩介幼虫完成变态发育全部脱落,A组与B组的排氨率无显著差异(P=0.89),而C组的排氨率显著低于A组(P=0.03)、B组(P=0.036),为A组的50.0%。从整个寄生过程看,3组黄颡鱼的排氨率在幼虫脱落前均呈上升趋势,至第8天达到最大值,其中A组、C组增加不显著,B组在第8天比第4天显著升高(P=0.042);在幼虫完全脱落后,A组排氨率未出现显著变化,B组和C组均比幼虫脱落前显著降低(P=0.015,P=0.001),其中B组排氨率恢复到寄生初期水平,而C组显著低于未脱落前(P < 0.05)。
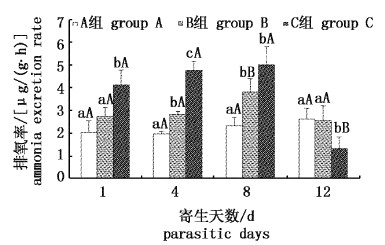
|
图 2
三角帆蚌钩介幼虫寄生胁迫对黄颡鱼排氨率的影响
Fig. 2
Effect of infection stress by glochidia of H. cumingii on ammonia excretion rate of yellow catfish P. fulvidraco
小写字母为同一时间组间比较,大写字母为同组间不同时间比较。 The small letters as the group comparison at the same time, big letters as the time comparison in the same group. |
在寄生第1天,C组O∶N显著低于A、B组(P < 0.05),而A、B组之间无显著差异;在第4、8天,B、C组显著低于A组(P < 0.05),B、C组之间差异不显著,且在第 8天寄生组(B、C组)O∶N为A组的59.5%和54.6%;在第12天,3 组之间均无显著差异。从整个实验过程看,在幼虫脱落前,A组O∶N均无显著变化;B、C组均呈显著下降趋势(P < 0.05),且于寄生第8天显著下降至最低(P < 0.05);至完全脱落后(第12天),A组相比脱落前期未出现显著变化(P>0.05),而B、C组O∶N均显著升高(P < 0.05),并恢复至对照A组的水平,与寄生前期无显著差异(P>0.05),见表2。
| 表 2 钩介幼虫寄生胁迫对黄颡鱼O∶N的影响 Tab.2 Impact of infection stress by glochidia on oxygen/ nitrogen ratio (O∶N) in yellow catfish, P. fulvidraco |
新陈代谢是机体生命活动的基本特征,包括物质代谢与相伴的能量代谢。杨莹等[11]指出耗氧率和排氨率最能反映机体新陈代谢规律、生理和生活状况。闫茂仓等[14]研究表明,鱼(Miichthys miiuy)幼鱼耗氧率和排氨率随温度应激的增强而显著增加,且呈现一定的正相关性;殷名称等[15]对仔鲱(Clupea harenhus L.)的温度应激研究也得到相同结论;柴学军等[16]认为,日本黄姑鱼(Nibea japonica)幼鱼耗氧率和排氨率随盐度增长呈单峰型变化,且有显著影响;唐贤明等[13]对广盐型鱼类大菱鲆(Scophamus maximus L.)幼鱼进行盐度应激实验表明,其耗氧率随盐度改变呈逐渐升高趋势,但无显著变化。不仅温度、盐度等外在因子影响鱼体呼吸代谢,鱼体的生理、生活状态等内在因子,如饥饿、疾病、寄生等也将对呼吸代谢产生显著影响。黄辨非等[17]测定了饥饿应激下欧洲丁鱥(Tinca tinca L.)的耗氧率,结果表明:随饥饿时间延长其耗氧率呈下降趋势,但未产生显著影响。金一春等[18]对白斑狗鱼(Esox lucius)的研究得到相同结果。本文研究了钩介幼虫寄生胁迫对黄颡鱼耗氧率和排氨率的影响。受到寄生胁迫的黄颡鱼,其耗氧率呈下降趋势,但未产生显著变化;原因可能是寄生之后的黄颡鱼处于饥饿状态,导致其耗氧率下降,这与黄辨非等[17]、金一春等[18]结果保持一致。此外,据DODD等[19]和JAMES等[20]研究,钩介幼虫寄生在寄主鱼鳃丝及鳍条上,会诱导鳃丝及鳍条上皮细胞迁移,包裹钩介幼虫形成囊肿,囊肿可能会阻碍寄主鱼对水体氧气的消耗。实验结果表明,寄生胁迫虽未对黄颡鱼耗氧率产生显著影响,但使其产生一定程度的下降。推测可能由于大量囊肿的形成降低了鳃丝和水体的接触面积,对机体呼吸系统产生影响,从而阻碍了黄颡鱼鳃丝对氧气的利用,使其耗氧率降低。
闫茂仓等[14]的研究表明温度应激使鱼幼鱼排氨率显著增加;柴学军等[16]的研究得到盐度应激使仔鲱的排氨率显著增加的结果。本实验表明三角帆蚌钩介幼虫寄生胁迫使寄主鱼排氨率显著增加,在寄生胁迫排除后,正常寄生组恢复至原来水平,而重度寄生组较正常水平显著下降。排氨率是反映鱼体含氮物质代谢的主要指标[17],一定浓度的氨氮即会对鱼体产生影响。本研究结果显示过量寄生使黄颡鱼的成活率明显下降,且实验中排氨率的增加与寄生钩介幼虫数量存在一定的正相关性。陈家长等[21]研究表明:高质量浓度的氨氮会抑制罗非鱼(GIFT Oreochromis niloticus )SOD活性、使溶菌酶活性显著降低,鱼体清除氧自由基的能力减弱,从而对鱼体造成氧化损伤,对机体免疫亦造成影响;胡毅等[22]对青鱼幼鱼氨氮胁迫研究结果表明,在慢性氨氮胁迫下青鱼幼鱼鳃丝Na+/K+-ATP酶均显著降低,急性胁迫将导致青鱼幼鱼肝细胞肿胀、坏死,管壁细胞基膜分离、管壁破裂等,影响肝胰脏正常水平。推测在钩介幼虫大量寄生后,黄颡鱼体含氮物质代谢增加,机体消耗大量能量及营养物质用于钩介幼虫变态发育及自身免疫防御,在寄生胁迫下产生应激反应,这可能是黄颡鱼死亡的重要原因之一。同时,寄主鱼排至水体中较高的氨氮对寄主鱼的成活也可能产生较大影响。
3.2 寄生胁迫下黄颡鱼能量物质的利用特点鱼体在单位时间内消耗氧气的摩尔数除以排出氨氮的摩尔数值定义为O∶N,它能够反映鱼体生命过程中的能量来源情况[14]。糖类、脂肪和蛋白质是鱼体主要的供能物质[23]。因此,计算O∶N可以间接反映3种供能物质的消耗关系。MAYZAND[24]认为,完全以蛋白质氧化供能其O∶N为7 ~ 10;IKEDA[25]认为以蛋白质和脂肪供能时,其O∶N为24左右;随着脂类和碳水化合物被利用比例的增高,其 O∶N逐渐增大,完全以脂肪或碳水化合物供能,其 O∶N将无穷大[26]。单乐州等[27]研究得出:不同种类的鱼其物质能量来源亦不同,饥饿应激下的幼鱼主要以蛋白质为能源;江丽华等[28]研究表明褐菖鲉饥饿时期主要以蛋白质和碳水化合物为能源,随饥饿时间延长,蛋白质的代谢比率增大。本实验结果显示,未寄生组(A 组)O∶N介于49.82~72.52之间,在寄生周期内无显著变化,表明短期饥饿应激尚未对黄颡鱼的O∶N产生显著影响。而B、C组,在幼虫脱落前,O∶N均显著下降至最低,分别为29.64、27.22,接近于蛋白质和脂肪功能的比值24;推测寄生胁迫使寄主鱼含氮物质代谢的增加,并非全部用于寄主鱼的供能或自身消耗,是否有一部分被寄生的钩介幼虫利用将在以后做进一步研究。
| [1] | 李家乐, 钱荣华, 鲍宝龙, 等. 中国五大湖三角帆蚌群体遗传多样性的RAPD分析[J]. 上海水产大学学报, 2005, 14(1): 1-5. LI J L, QIAN R H, BAO B L, et al. RAPD analysis on genetic diversity among the stocks of Hyriopsis cumingii from the five large lakes of China[J]. Journal of Shanghai Fisheries University, 2005, 14(1): 1-5. |
| [2] | HUA D, GU R B. Freshwater pearl culture and production in China[J]. Aquaculture Asia, 2002, 7(1): 6-8. |
| [3] | 闻海波, 顾若波, 华丹, 等. 三角帆蚌遗传育种研究进展[J]. 长江大学学报:自然科学版, 2011, 8(1): 233-236, 239. WEN H B, GU R B, HUA D, et al. Research the genetic breeding progress of triangle mussel, Hyriopsis cumingii[J]. Journal of Yangtze University:Nat Sci Edit, 2011, 8(1): 233-236, 239. |
| [4] | 白志毅, 李家乐, 潘彬斌, 等. 三角帆蚌钩介幼虫在 5 种寄主鱼体寄生效果的比较[J]. 淡水渔业, 2008, 38(1): 3-5, 43. BAI Z Y, LI J L, PAN B B, et al. Comparison of the parasitism effect of glochidia of triangle mussel (Hyriopsis cumingii) in five host fishes [J]. Freshwater Fisheries, 2008, 38(1): 3-5, 43. |
| [5] | 闻海波, 邱丽华, 顾若波, 等. 三角帆蚌钩介幼虫在两种寄主鱼上的寄生效果及其对寄主鱼血浆生化指标的影响[J]. 动物学杂志, 2009, 44(5): 92-97. WEN H B, QIU L H, GU R B, et al. The host efficiency of two kinds of fish for glochidia of Hyriopsis cumingii and impact on plasma biochemical indexes of host fish[J]. Chinese Journal of Zoology, 2009, 44(5): 92-97. |
| [6] | PENG J L, CAO Z D, F S J, et al. Effect of acute low temperature stress on oxygen consumption rate and respiration frequency in Silurus meridionalis and Pelteobag vachelli[J]. Agricultural Science & Technology, 2007, 8(3/4): 73-78. |
| [7] | 邱成功, 徐善良, 林少珍, 等. 不同温度条件下褐菖鲉幼鱼的耗氧率和排氨率[J]. 应用海洋学学报, 2014, 33(1): 84-89. QIU C G, XU S L, LIN S Z, et al. Oxygen consumption and ammonia excretion rates of juvenile Sebastiscus marmoratus under different temperature treatments[J]. Journal of Applied Oceanography, 2014, 33(1): 84-89. |
| [8] | 杨凯, 樊启学, 张磊, 等. 溶氧水平对黄颡鱼稚鱼摄食、生长及呼吸代谢的影响[J]. 淡水渔业, 2010, 40(2): 24-30. YANG K, FAN Q X, ZHANG L, et al. Effects of dissolved oxygen on feed intake, growth and respiratory metabolism of juvenile Pelteobagrus fulvidraco R.[J]. Freshwater Fisheries, 2010, 40(2): 24-30. |
| [9] | PANG X, YUAN X Z, CAO Z D, et al. The effects of dissolved oxygen levels on resting oxygen consumption and swimming performance in Juvenile darkbarbel catfish Peltebagrus vachelli[J]. Acta Hydrobiologica Sinica, 2012, 36(2): 255-261. |
| [10] | 华丹, 徐钢春, 闻海波, 等. 三种寄生鱼对圆背角无齿蚌寄生效果的研究[J]. 浙江海洋学院学报:自然科学版, 2005, 24(3): 213-216. HUA D, XU G C, WEN H B, et al. Study on the host efficiency of the three kings of fish for the Anodonta woodiana pacifica[J]. Journal of Zhejiang Ocean University:Natural Science, 2005, 24(3): 213-216. |
| [11] | 杨莹, 李二超, 姜雪芹, 等. 瓦氏黄颡鱼幼鱼标准代谢的初步研究[J]. 水产科学, 2011, 30(4): 92-196. YANG Y, LI E C, JIANG X Q, et al. The standard metabolism of juvenile dark barbel catfish, Pelteobagrus vachelli[J]. Fisheries Science, 2011, 30(4): 192-196. |
| [12] | 万松良, 葛雷, 张扬, 等. 瓦氏黄颡鱼与黄颡鱼的耗氧率及窒息点[J]. 动物学杂志, 2005, 40(6): 91-95. WAN S L, GE L, ZHANG Y, et al. Oxygen consumption rate and suffocated concentration of Pelteobagrus vachelli and P. fulvidraco[J]. Chinese Journal of Zoology, 2005, 40(6): 91-95. |
| [13] | 唐贤明, 田景波, 王国福, 等. 盐度对大菱鲆幼鱼耗氧率和排氨率的影响[J]. 南方水产, 2006, 2(4): 54-58. TANG X M, TIAN J B, WANG G F, et al. Effects of salinity on metabolic rate of juvenile turbot (Scophamus maxinus)[J]. South China Fisheries Science, 2006, 2(4): 54-58. |
| [14] | 闫茂仓, 单乐州, 邵鑫斌, 等. 温度及体重对鮸鱼幼鱼耗氧率和排氨率的影响[J]. 热带海洋学报, 2007, 26(1): 44-49. YAN M C, SHAN Y Z, SHAO X B, et al. Influences of temperature and weight on respiration and excretion of Miichthy miiuy juvenile[J]. Journal of Tropical Oceanography, 2007, 26(1): 44-49. |
| [15] | 殷名称, BATTY R S, FRANKLIN C E, 等. 温度和活动对仔鲱氧代谢的影响[J]. 海洋与湖沼, 1995, 26(3): 285-294. YIN M C, BATTY R S, FRANKLIN C E, et al. The influence of temperature and activity on oxygen consumption of larval herring(Clupea Harengus L.)[J]. Oceanologia et Limnologia Sinica, 1995, 26(3): 285-294. |
| [16] | 柴学军, 胡则辉, 徐君卓, 等. 盐度和pH对日本黄姑鱼幼鱼耗氧率和排氨率的影响[J]. 浙江海洋学院学报:自然科学版, 2009, 28(2): 146-150. CHAI X J, HU Z H, XU J Z, et al. Effect of salinity and pH on oxygen consumption rate and ammonia excretion rate in juvenile Nibea japonica[J]. Journal of Zhejiang Ocean University:Natural Science, 2009, 28(2): 146-150. |
| [17] | 黄辨非, 熊小东, 罗静波. 饥饿与温度对欧洲丁岁幼鱼耗氧率的影响[J]. 长江大学学报:自然科学版, 2008, 5(4): 38-40. HUANG B F, XIONG X D, LUO J B, et al. Effects of starvation and temperature on oxygen consumption rate of Juvenile Tinca tinca L[J]. Journal of Yangtze University:Nat Sci Edit, 2008, 5(4): 38-40. |
| [18] | 金一春, 胡萍华, 曲学伟, 等. 饥饿对白斑狗鱼耗氧率、代谢率及主要生化指标的影响[J]. 江苏农业科学, 2010(4): 229-232. JIN Y C, HU P H, QU X W, et al. Effects of oxygen consumption rate, metabolic rate and main biochemical index on Esox Lucius[J]. Jiangsu Agricultural Sciences, 2010(4): 229-232. |
| [19] | DODD B J, BARNHART M C, FOBIAN T B, et al. Persistence of host response against glochidia larvae in Micropterus salmoides [J]. Fish & Shellfish Immunology, 2006, 21(5): 473-484. |
| [20] | TREASURER J W, HASTIE L C, HUNTER D, et al. Effects of (Margaritifera margaritifera) glochidial infection on performance of tank-reared Atlantic salmon (Salmo salar)[J]. Aquaculture, 2006, 256(1/4): 74-79. |
| [21] | 陈家长, 臧学磊, 胡耿东, 等. 氨氮胁迫下罗非鱼(GIFT Oreochromis niloticus)机体免疫力的变化及其对海豚链球菌易感性的影响[J]. 生态环境学报, 2011, 20(4): 629-634. CHEN J Z, ZANG X L, HU G D, et al. The immune response of GIFT Oreochromis niloticus and its susceptibility to Streptococcus iniae under stress in different ammonia[J]. Ecology and Environmental Sciences, 2011, 20(4): 629-634. |
| [22] | 胡毅, 黄云, 钟蕾, 等. 氨氮胁迫对青鱼幼鱼鳃丝Na+/K+-ATP酶、组织结构及血清部分生理生化指标的影响[J]. 水产学报, 2012, 36(4): 538-545. HU Y, HUANG Y, ZHONG L, et al. Effects of ammonia stress on the gill Na+/K+-ATPase, microstructure and some serum physiological-biochemical indices of juvenile black carp (Mylopharyngodon piceus)[J]. Journal of Fisheries of China, 2012, 36(4): 538-545. |
| [23] | 王镜岩, 朱圣庚. 生物化学(上册)[M]. 3版. 北京: 高等教育出版社, 2002: 249-251. WANG J Y, ZHU S G. Biochemistry (Volume 1) [M]. 3rd ed. Beijing: Higher Education Press, 2002: 249-251. |
| [24] | MAYZAND P. Respiration and nitrogen excretion of zooplankton. Ⅳ. The influence of starvation on the metabolism and the biochemical composition of some species [J]. Marine Biology, 1976, 37(1): 47-58. |
| [25] | IKEDA T. Nutritional ecology of marine zooplankton [J]. Memoirs of the Faculty of Fisheries Hokkaido University, 1974, 22(1): 91-97. |
| [26] | CONOVER R J, CORNER E D S. Respiration and nitrogen excretion by some marine zooplankton in relation to their life cycles [J]. Journal of the Marine Biological Association of the U. K. 1968, 48(1): 49-75. |
| [27] | 单乐州, 闫茂仓, 吴洪喜, 等. 饥饿及恢复投喂对岁鱼幼鱼生长、耗氧率和排氨率的影响[J]. 水产学报, 2007, 31(s1): 45-51. SHAN Y Z, YAN M C, WU H X, et al. The effect of starvation and refeeding on the growth, respiration and excretion of Miichthy mijuy juvenile[J]. Journal of Fisheries of China, 2007, 31(s1): 45-51. |
| [28] | 江丽华, 朱爱意, 苑淑宾. 饥饿对褐菖鲉代谢水平的影响[J]. 广东海洋大学学报, 2010, 30(6): 82-87. JIANG L H, ZHU A Y, YUAN S B. Effect of starvation on the respiration and excretion of Sebastiscus marmoratus[J]. Journal of Guangdong Ocean University, 2010, 30(6): 82-87. |
2. Sino-US Cooperative Laboratory for Germplasm Conservation and Utilization of Freshwater Mollusks, Freshwater Fisheries Research Center, Wuxi 214081, Jiangsu, China;
3. Key Laboratory of Genetic Breeding and Aquaculture Biology of Freshwater Fishes, Ministry of Agriculture, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, Jiangsu, China
 2015, Vol. 24
2015, Vol. 24



 ±SD
±SD