2. 上海海洋大学 水产与生命学院, 上海 201306;
3. 上海海洋大学 海洋科学学院, 上海 201306
加州鲈鱼(Micropterus salmoides)是一种深受养殖者和消费者喜欢的名贵肉食性淡水鱼,在我国的主要养殖区域是广东、江苏、浙江、四川[1, 2],由于其分布地区比较局限,在实际生活中,因为消费、养殖、科研等目的,常常需要长距离或长时间地运输加州鲈鱼。关于加州鲈鱼的活体运输国内外都有一定的报道。彭爱明[3]和候正大[4]对加州鲈鱼亲鱼的运输方法及运输时的管理做了详细的总结,白俊杰等[5]对我国加州鲈鱼鱼苗、亲鱼和商品鱼运输技术做出了详细的概述,但都未对加州鲈鱼的麻醉运输做具体说明。MS-222(间氨基苯甲酸乙酯甲磺酸盐,C10H15NO5S,Tricaine Methanesulphonate)麻醉剂具有使用浓度低、作用快、作用时间长、复苏快、无毒副作用等优点,是目前唯一被美国FDA批准能用于食用鱼的麻醉剂[6, 7]。MS-222对鲈鱼[8]、金鱼[9]、海水鱼[10]等的麻醉运输在国内都有研究,但对加州鲈鱼的麻醉运输研究却不多。本试验探讨了MS-222对安静状态及模拟运输时加州鲈鱼的麻醉效果,以期为MS-222在加州鲈鱼及其他淡水水产品的麻醉及麻醉运输方面的应用提供理论依据。
1 材料与方法 1.1 试验材料加州鲈鱼购自浙江省湖州市,经过3 h的汽车运输到达实验室,用高锰酸钾溶液消毒后暂养15 d。养殖水为曝气3 d以上的自来水,pH 7.0~8.0,溶氧6.0~8.5 mg/L。试验时选用体重为(294±48)g健康无伤病的鱼。
1.2 试验方法 1.2.1 麻醉试验MS-222购自北京格林恒兴生物科技有限公司。将MS-222溶于水配成10、20、30、40、50、60和70 mg/L的麻醉液。用加热棒和冷水机使水温维持在20 ℃。将停食24 h的加州鲈鱼从水温20 ℃的暂养池中转入到麻醉容器中,每组4尾鱼,鱼水比1∶15,观察鱼体的活动情况,用秒表记录鱼体进入不同麻醉阶段的时间。麻醉24 h后记录存活率,然后转入同等水温的清水中复苏,记录鱼体完全复苏的时间。麻醉和复苏时间为最后一尾试验鱼进入到相应状态的时间。根据麻醉、复苏时间及存活率,选择适宜的MS-222(20.0 mg/L)浓度,再进行不同水温下(10、15、20和25 ℃)的麻醉试验。
在MS-222的作用下,加州鲈鱼在麻醉和复苏阶段表现出一系列不同的行为变化,不同的学者对麻醉和复苏过程的分期标准不尽相同[6, 10],参考COOKE等[12]、魏锁成[13]、刘长琳[14]等的分期标准,结合加州鲈鱼的实际情况,可以将加州鲈鱼的麻醉过程分为6个时期(表1),复苏过程分为4个时期(表2)。
| 表1 麻醉程度分期及鱼类行为特征 Tab. 1 Anesthesia stages and fish behavior characteristics |
| 表2 复苏过程分期及鱼类行为特征 Tab. 2 Recovery stages and fish behavior characteristics |
将10尾已停食24 h的加州鲈鱼从水温20 ℃的暂养池中转入到盛有44 L 20 mg/L MS-222溶液的水槽中,用加热棒和冷水机使水温维持在20 ℃,当试验用鱼全部进入深度镇静状态后开始计时,进行运输。运输装置为LX-100VTR模拟运输振动台,振幅0~25.4 mm、转速100 r/min,模拟运输0、3、10、17和24 h。运输后观察存活率,测定肌肉及血清生化变化,并于清水中复苏,测定完全复苏时间。同时设置基础组,基础组为相同条件下不加麻醉剂运输前的鱼。
1.2.3 肌肉中糖元、乳酸的测定使用T3新世纪紫外可见分光光度计测定,测试试剂盒购自南京建成生物工程研究所。
1.2.4 血清生化指标的测定麻醉运输试验结束后随机取3尾存活的加州鲈鱼用150 mg/L的MS-222快速麻醉后从尾静脉取血,全血不加抗凝剂,于4 ℃放置2 h,待血液明显分层后以3 000 r/min离心20 min,分别收集每尾鱼的血清于2 mL的离心管中,不能及时测定的样品置于-20℃冰箱保存[15]。鱼血清皮质醇(Cortisol)含量使用SH-1000 Lab-全波长酶标仪测定,鱼类Cortisol酶联免疫分析试剂盒购自上海博研生物科技有限公司。血清中天冬氨酸氨基转移酶(AST)、葡萄糖(GLU)、尿素(UREA)、乳酸脱氢酶(LDH)用BS-200全自动生化分析仪测定,试剂盒购自深圳迈瑞生物医疗电子股份有限公司。
1.2.5 数据处理用Microsoft Excel 2007和SPSS 19.0软件对试验结果进行统计分析。在单因素方差分析的基础上采用Duncan氏多重比较法进行分析,统计值为平均值±标准差,显著性水平为P<0.05。
2 结果 2.1 不同浓度MS-222对加州鲈鱼的麻醉效果由表3可知随着MS-222浓度的增加,加州鲈鱼进入相同麻醉时期的时间缩短,而完全复苏的时间延长。在较低的浓度下(10和20 mg/L),鱼体最终会维持在深度镇静期。浓度增加,鱼体的麻醉程度加深。用10~50 mg/L的MS-222麻醉24 h后鱼体依然存在呼吸,在清水中复苏能恢复到正常状态。当浓度达到60 mg/L时,鱼体进入深度麻醉状态,麻醉24 h后一半的鱼停止呼吸,在清水中无法复苏。浓度进一步增加到70 mg/L时,麻醉6 h鱼体就全部停止呼吸,在清水中无法复苏。
| 表3 不同浓度MS-222对加州鲈鱼的麻醉效果 Tab. 3 Anesthetic effects of MS-222 on largemouth bass at different concentration |
由表4可知用20 mg/L的MS-222在10、15、20和25 ℃的水温下麻醉加州鲈鱼,鱼体最终都维持在深度镇静期,麻醉24 h后鱼体都存在呼吸,在清水中都能恢复到正常状态。水温越低,进入相同麻醉状态的时间越短。在10 ℃时,鱼体甚至已经处于轻度镇静期。然而,随着麻醉水温的降低,鱼体完全复苏的时间却在增加。10和15 ℃的复苏时间远远高于20和25 ℃的复苏时间。
| 表4 不同水温下MS-222对加州鲈鱼的麻醉效果 Tab. 4 Anesthetic effects of MS-222 on largemouth bass at different water temperature |
在20 ℃用20 mg/L的MS-222麻醉运输加州鲈鱼17 h后依然能保持100%的存活率,麻醉运输24 h后存活率下降到70%(表5)。将麻醉运输后的鱼在适宜的条件下暂养一周,结果发现麻醉运输24 h的鱼在一周内有4尾相继死去,而其他组的鱼能恢复正常。麻醉运输后鱼的复苏时间随运输时间的增加而增加(表5)。
| 表5 加州鲈鱼麻醉运输后存活率及复苏时间变化 Tab. 5 Changes of survival rate and recovery time of largemouth bass after anesthesia transportation |
由图1可知加州鲈鱼在麻醉后(麻醉运输0 h)和麻醉运输后糖元和乳酸含量发生了一定的变化,且两者之间呈负相关。图1(a)显示,麻醉后糖元含量有轻微的降低,但变化并不显著,麻醉运输后,糖元含量随运输时间的增加显著下降,运输24 h后比基础组降低了36.8%。图1(b)显示,乳酸含量在麻醉后显著升高,且在麻醉运输过程中随运输时间的增加显著升高,运输24 h后比基础组升高了101.7 %。
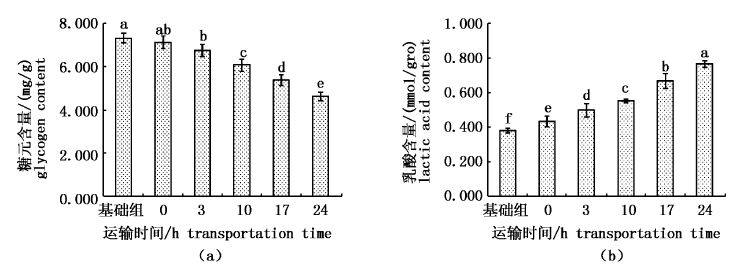
|
图1
加州鲈鱼麻醉运输后肌糖元、乳酸变化
Fig.1
Changes of muscle glycogen & lactic acid of largemouth bass after anesthesia transportation
组间字母不同者差异显著(P<0.05)。 Groups with different letters were significantly different. |
表6显示了加州鲈鱼在麻醉后和麻醉运输后血清一些生化指标的变化。与基础组相比,麻醉运输后血清皮质醇的含量显著升高,而在麻醉运输过程中血清皮质醇的含量差异不显著。麻醉后血清AST活性有轻微的升高,但变化并不显著,麻醉运输前10 h,血清AST活性的变化都不显著,继续运输,其活性显著升高。麻醉运输前10 h,血清UREA的含量与基础组差异不显著,随着运输时间的持续增加,血清UREA含量显著升高。麻醉后血清GLU显著升高,且在麻醉运输过程中,血清GLU含量也不断显著升高。麻醉后血清LDH的活性显著升高,麻醉运输前10 h,其差异不显著,继续运输,血清LDH的活性显著升高。
| 表6 加州鲈鱼麻醉运输后血清生化变化 Tab. 6 Changes of serum biochemical of largemouth bass after anesthesia transportation |
活鱼运输时最佳的麻醉状态是深度镇静期,在此状态鱼体对外界刺激几乎没有反应能力,代谢率下降,但依然能够保持平衡[16],与轻度镇静期相比鱼体显得更为安定,因而有利于鱼类的运输。进一步的麻醉会使鱼体失去平衡,停止游动,可能会因麻醉过深鱼体静卧池底缺氧窒息而死,或者与运输装置撞击发生机械损伤[12],因而都不适于活鱼运输。将深度麻醉的鱼及时放入清水复苏,会经历呼吸恢复、平衡恢复、反应恢复、行为完全恢复四个阶段[14]。活鱼运输时,常希望鱼体在较短的时间内进入并维持在深度镇静期同时使鱼体完全复苏的时间最短、存活率最高。
在20℃时,70 mg/L的MS-222麻醉6 h鱼体就全部死亡,50和60 mg/L的MS-222麻醉后鱼体最终都维持在深度麻醉期,50 mg/L的MS-222麻醉24 h后鱼体能完全复苏,而60 mg/L的MS-222麻醉24 h后一半的鱼不能存活,可见60 mg/L的MS-222是加州鲈鱼麻醉的转折性浓度。10~40 mg/L的MS-222麻醉24 h鱼体都能存活,综合考虑10~20 mg/L的MS-222更适于加州鲈鱼的麻醉运输。
麻醉时的水温对麻醉效果有明显影响。水温越低,入麻时间越短,即麻醉效果随温度的降低而增加,这与廖国璋与庞世勋的研究结果一致[17],可能较低的水温本身对鱼体就有一定的麻醉作用,但也有研究表明麻醉效果随温度的增加而增加[18]。但水温越低复苏时间越久,综合考虑20~25 ℃的水温适于加州鲈鱼的麻醉运输。
3.2 MS-222麻醉运输作用对加州鲈鱼存活率及复苏时间的影响试验实现了麻醉运输加州鲈鱼17 h依然保持100%的存活率,在实际应用中具有重要的商业价值。麻醉运输24 h后鱼体较静态麻醉组(表3)死亡率高,可见振动对加州鲈鱼的存活影响很大,因而在实际操作中应尽可能地减轻振动对鱼体的刺激。由麻醉运输后的肌肉和血清生化变化可以推测,肝脏、肾脏、心肌以及肌肉损伤,乳酸堆积是导致麻醉运输24 h鱼体死亡和迟发性死亡的重要原因。运输时间越久,鱼体就越难复苏,这可能是由于长时间的药物麻醉使得鱼体内麻醉剂积累过多,所以需要较长的时间排除所致。
3.3 MS-222麻醉运输作用对加州鲈鱼肌肉及血清生化变化的影响糖元主要存在于肌肉和肝脏中,是能量的重要来源,鱼类利用肝糖元的能力很差,主要利用肌糖元[19]。正常情况下,肌肉中乳酸含量并不会太高,在运动过度、无氧呼吸过程中会产生大量的乳酸。试验发现,在麻醉和麻醉运输过程中,糖元含量不断下降,与此同时,乳酸含量则不断上升。这可能是由于鱼体处于饥饿状态、加上振动、氨氮等不利条件的不断刺激,血液中的葡萄糖不能满足鱼体对能量的消耗,使得肌肉中的糖元快速分解所致[20],糖元酵解产生能量的同时会伴随着乳酸的生成,LDH活性增加也是导致乳酸含量上升的原因之一。
鱼体发生生理或病理变化时,血液成分会相应地发生变化。因而,血液成分的变化被广泛地用来评价鱼类的健康状况、营养状况及对环境的适应状况,是重要的生理、病理和毒理学指标[21]。
皮质醇能够灵敏地反映鱼体的胁迫状况,鱼体对环境产生应激后,血液中皮质醇水平迅速升高[22]。麻醉后皮质醇含量升高可能是由于麻醉对鱼体造成一定的胁迫,致使鱼体产生了应激反应。振动也能导致皮质醇含量的升高[20],但在麻醉运输过程中皮质醇含量变化不明显,这可能是因为MS-222降低了鱼体对外界刺激的反应能力。
AST是肝脏中连接糖、脂质、蛋白质代谢的重要酶,正常情况下血清AST活性很低而且相对稳定,当肝脏受到损伤时血清AST活性会升高[23, 24]。麻醉运输前10 h,AST活性变化不显著,继续运输,其活性显著升高,可能是由于加州鲈鱼供能不足,需要分解糖、脂质、蛋白质或肝脏受到了损伤。这也是长时间的麻醉运输导致鱼体死亡的原因之一。
尿素是机体内蛋白质代谢的终产物,主要经肾脏从尿液中排泄,肾脏受到损失,血尿素的含量会增加,因而尿素可以作为肾功能的指标。麻醉运输17 h后,血尿素含量显著升高,这可能是由于加州鲈鱼的蛋白质代谢异常,使肾脏受到了损伤。这也是长时间的麻醉运输导致鱼体死亡的另一个原因。
葡萄糖是血液中最重要的能源物质,受神经和激素共同调节。麻醉和麻醉运输后,葡萄糖显著升高,这可能是由于糖元分解所致。
LDH是糖代谢中催化丙酮酸向乳酸转化的酶,无氧酵解[25]、心肌梗死、肝脏疾病、血液病、肌肉损伤都会导致LDH的升高。麻醉后LDH的活性显著升高,可能由于麻醉时发生了无氧呼吸。麻醉运输前10 h,LDH的活性差异不显著,继续运输,LDH的活性显著升高,可能由于长时间的运输使得鱼体心肌、肝脏、肌肉受损所致。这也是长时间的麻醉运输导致鱼体死亡的又一个原因。
| [1] | 白俊杰,李胜杰,邓国成,等.我国加州鲈的养殖现状和养殖技术(上)[J].科学养鱼,2009(6):15-16. BAI J J, LI S J, DENG G C, et al. Breeding situation and breeding technology of largemouth bass in China(On)[J]. Scientific Fish Farming, 2009(6):15-16. |
| [2] | 白俊杰,李胜杰.我国大口黑鲈产业现状分析与发展对策[J].中国渔业经济,2013,31(5):104-108. BAI J J, LI S J. Current status and development trend on China largemouth bass industry[J]. Chinese Fisheries Economics, 2013, 31(5):104-108. |
| [3] | 彭爱明.加州鲈鱼亲鱼的运输管理[J].中国水产,1994(5):37-37. PENG A M. Transportation management of largemouth bass parent fish[J]. China Fisheries, 1994(5):37-37. |
| [4] | 侯正大.加州鲈亲鱼的运输方法[J].内陆水产,2007,32(3):10-10. HOU Z D. Transportation method of largemouth bass parent fish[J]. Inland Fisheries, 2007, 32 (3):10. |
| [5] | 白俊杰,李胜杰,邓国成,等.我国加州鲈的养殖现状和养殖技术(下)[J].科学养鱼,2009(8):12-16. BAI J J, LI S J, DENG G C, et al. Breeding situation and breeding technology of largemouth bass in China(Down)[J]. Scientific Fish Farming, 2009(8):12-16. |
| [6] | MARKING L L, MEYER F P. Are better anesthetics needed in fisheries [J].Fisheries, 1985, 10(6):2-5. |
| [7] | Van EENENNAAM J P, BRUCH R, KROLL K. Sturgeon sexing,staging maturity and spawning induction workshop[C].4th International Sturgeon Symposium, Oshkosh, Wiscons in USA, 2001. |
| [8] | 韩芳.鲈鱼贮运过程中理化和质构变化的研究[D].青岛:中国海洋大学,2011. HAN F. Studies on physicochemical parameters and texture changes of Lateolabrax japonicus meat during storage and transportation[D]. Qingdao: Ocean University of China, 2011. |
| [9] | 向建国,何福林,陈才,等.MS-222麻醉金鱼模拟运输试验[J].水利渔业,2005,25(4):13-15. XIANG J G, HE F L, CHEN C, et al. A simulation transport test by hocusing golden fish with MS-222[J]. Reservoir Fisheries, 2005, 25 (4):13-15. |
| [10] | 周竹君,宋智修,周振红.应用MS-222运输海水鱼初探[J].水利渔业,1999,19(4):54-55. ZHOU Z J, SONG Z X, ZHOU Z H. Preliminary study on application of MS-222 in transportation of marine fish[J]. Reservoir Fisheries, 1999, 19(4):54-55. |
| [11] | CHO G K, HEATH D D. Comparison of tricaine methanesulphonate (MS-222) and clove oil anaesthesia effects on the physiology of juvenile chinook salmon Oncorhynchus tshawytscha (Walbaum)[J]. Aquaculture Research, 2000, 31(6):537-546. |
| [12] | COOKE S J, SUSKI C D, OSTRAND K G, et al. Behavioral and physiological assessment of low concentrations of clove oil anaesthetic for handling and transporting largemouth bass (Micropterus salmoides) [J] . Aquaculture, 2004, 239(1/4):509-529. |
| [13] | 魏锁成.用于鱼类的麻醉剂及麻醉管理[J].西北民族大学学报:自然科学版,2005,26(1):43-45. WEI S C. Anesthetic used for fish and anesthetic management[J]. Journal of Northwest Minorities University for Nationalities: Natural Science, 2005, 26(1):43-45. |
| [14] | 刘长琳,何力,陈四清,等.鱼类麻醉研究综述[J].渔业现代化,2007,34(5):21-25. LIU C L, HE L, CHEN S Q, et al. Review study of fish anesthesia[J]. Fishery Modernization, 2007, 34(5):21-25. |
| [15] | 张饮江,黎臻,谢文博,等.金鱼对低温、振动胁迫应激反应的试验研究[J].水产科技情报,2012,39(3):116-122. ZHANG Y J, LI Z, XIE W B, et al. Experimental study on stress reaction of goldfish under low temperature and vibration stresses[J]. Fisheries Science & Technology Information, 2012, 39(3):116-122. |
| [16] | McFarland W N. A study of the effects of anaesthetics on the behaviour and physiology of fishes[J]. Marine Science Institute of University of Texas, 1959, 6: 23-55. |
| [17] | 廖国璋,庞世勋. MS-222麻醉剂在鱼类运输中的应用[J].广东科技,1998(1):26-27. LIAO G Z, PANG S X. Application of MS-222 anesthetic in fish transportation[J]. Guangdong Science & Technology, 1998(1):26-27. |
| [18] | 杜浩,危起伟,杨德国,等.MS-222、丁香油、苯唑卡因对养殖美洲鲥幼鱼的麻醉效果[J].大连水产学院学报,2007,22(1):20-26. DU H, WEI Q W, YANG D G, et al. Anaesthetic effects of MS-222, clove oil, benzocaine on cultured American Shad Alosa sapidissima fingerlings[J]. Journal of Dalian Fisheries University, 2007, 22(1):20-26. |
| [19] | 白艳龙,谭昭仪,邸向乾,等.黄颡鱼无水保活技术研究[J].食品工业科技,2013,34(1):334-337. BAI Y L, TAN Z Y, DI X Q, et al. Research of the keep-alive technology without water of yellow catfish[J]. Science and Technology of Food Industry, 2013, 34(1):334-337. |
| [20] | 王利娟,程守坤,张饮江,等.水温对加州鲈鱼保活运输的影响[J].渔业现代化,2014,41(2):23-27. WANG L J, CHENG S K, ZHANG Y J, et al. Effect of water temperature on keep-alive transportation for black bass (Micropterus salmoides)[J]. Fishery Modernization, 2014, 41(2):23-27. |
| [21] | 周玉,郭文场,杨振国,等.鱼类血液学指标研究的进展[J].上海水产大学学报,2001,10(2):163-165. ZHOU Y, GUO W Y, YANG Z G, et al. Advances in the study of haemotological indices of fish[J]. Journal of Shanghai Fisheries University, 2001, 10(2):163-165. |
| [22] | 许源剑,孙敏.环境胁迫对鱼类血液影响的研究进展[J].水产科技,2010(3):27-31. XU Y J, SUN M. Research progress of effects of environmental stress on fish blood[J].Fisheries Science & Technology, 2010(3):27-31. |
| [23] | 张永嘉,吴泽阳,许其爵,等.网箱养殖罗非鱼综合症的血清分析[J].水利渔业,1994(2):8-9,47. ZHANG Y J, WU Z Y, XU Q J, et al. Serum analysis of cage aquaculture Tilapia syndrome[J]. Reservoir Fisheries, 1994(2):8-9, 47. |
| [24] | 冯广朋,庄平,章龙珍,等.温度对中华鲟幼鱼代谢酶和抗氧化酶活性的影响[J].水生生物学报,2012,36(1):137-142. FENG G P, ZHUANG P, ZHANG L Z, et al. Effects of water temperature on metabolic enzyme and antioxidase activities in juvenile Chinese sturgeon (Acipenser sinensis)[J]. Acta Hydrobiologica Sinica, 2012, 36(1):137-142. |
| [25] | 董淑丽,王占彬,雷雪芹,等.热应激对动物血液生化指标的影响[J].家畜生态,2004,25(2):54-56. DONG S L, WANG Z B, LEI X Q, et al. Influence of heat stress on biochemical indexes in blood of animal[J]. Ecology of Domestic Animal, 2004, 25(2):54-56. |
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China;
3. College of Marine Science, Shanghai Ocean University, Shanghai 201306, China
 2015, Vol. 31
2015, Vol. 31


