2. 舟山市水产研究所, 浙江 舟山 316000;
3. 舟山市水产技术推广站, 浙江 舟山 316000
目前国内水产养殖主要采取高密度集约化的养殖生产模式,水体中过量的饲料残渣与水产动物的排泄物导致水体中亚硝酸盐氮超标严重,可能会诱发细菌病、病毒病,给水产养殖业造成不可估量的经济损失。因此,养殖水体中亚硝酸盐氮的有效去除是水产业亟需解决的问题之一。
反硝化是硝酸盐或亚硝酸盐被还原成NO2或N2的过程,是自然界氮素循环的一个重要途径之一,传统的理论认为细菌的反硝化是一个严格的厌氧过程。然而,好氧反硝化细菌的发现,突破了传统的理论知识,其为污水生物脱氮技术注入了新的活力,提供了新的方法。好氧反硝化细菌克服了传统的反硝化细菌只能在缺氧条件下进行反硝化的缺点,进行有氧生长且生长周期短,对高浓度的氮耐受力很强[1]。
20世纪80年代,LESLEY等报道了好氧反硝化细菌和好氧反硝化酶系的存在[2],并证实了泛养硫球菌(Thiosphaera pantot ropha)(现更名为脱氮副球菌Paracoccus denitrif-ications)[3]在生长过程中,O2 和NO3-共同存在时,其生长速率比两者单独存在时都高。自好氧反硝化菌发现后,不断有新的好氧反硝化菌株被发现,目前被发现的反硝化细菌主要存在于假单胞菌属(Pseudomonas)[4, 5]、产碱杆菌属(Alcaligenes)[1, 6]、副球菌属(Paracoccus)[7]和芽孢杆菌属(Bacillus)[8, 9, 10, 11]等。
本研究材料取自舟山市水产研究所循环水生物滤池毛刷滤料上的少量污泥,通过富集培养筛选出一种好氧反硝化细菌DB-6,在对其部分生物学特性及反硝化性能进行研究的基础上,确定该菌分类学和系统发育地位,旨在为丰富好氧反硝化细菌种质资源的同时,为该菌在养殖水体的实际应用提供理论基础和技术支撑。
1 材料与方法 1.1 材料 1.1.1 样品来源舟山市水产研究所海水养殖循环水生物滤池中附着在毛刷滤料上的少量污泥。
1.1.2 培养基及检测试剂(1)选择性培养液(g/L):葡萄糖24.0,柠檬酸钠14.7,硝酸钾6.7,氯化铵4.7,磷酸二氢钾1.8,陈海水1 000 mL。(2)分离培养基(g/L):葡萄糖10.0,柠檬酸钠5.0,醋酸钠1.5,氯化铵1.0,硝酸钾1.0,磷酸氢二钠0.6,磷酸二氢钾0.4,硫酸镁0.1,氯化亚铁0.1,酵母膏0.5,琼脂粉20,陈海水1 000 mL,pH 7.6~8.2,121 ℃灭菌20 min;(3)亚硝酸盐还原培养基(g/L):牛肉膏10.0,蛋白胨5.0,亚硝酸钠1.0,蒸馏水1 000 mL,pH 7.3~7.4,121 ℃灭菌15 min。(4)硝酸盐还原培养基(g/L):牛肉膏10.0,蛋白胨5.0,硝酸钾1.0,蒸馏水1 000 mL,pH 7.0~7.6,121 ℃灭菌15 min。(5)反硝化培养基A(g/L):葡萄糖36.0,酵母膏0.5,亚硝酸钠2.1,陈海水1 000 mL,pH 7.6~8.2,121 ℃灭菌15 min。 (6) 反硝化培养基B:(g/L,葡萄糖36,酵母膏0.5,硝酸钠2.6,陈海水1 000 mL,pH 7.6~8.2,121 ℃灭菌15 min。
1.2 方法 1.2.1 好氧反硝化细菌的筛选采样与富集:取舟山市水产研究所海水养殖循环水生物滤池中毛刷,放入采样袋,带回实验室,用灭菌过的海水冲洗毛刷上的附着物即可得到细菌原液。取2.0 mL细菌原液接种于装有98 mL选择培养基的250 mL锥形瓶中,用5层纱布包裹锥形瓶口,28 ℃,100 r/min振荡培养。培养1 d天后添加亚硝酸钠,使之浓度为10 mg/L,之后稳定提高,依次为50 mg/L、100 mg/L、150 mg/L最终为200 mg/L。期间2 d更换一次培养基,以便于有效地富集好氧反硝化细菌。
初筛和复筛:取亚硝酸钠浓度最高的细菌培养液,接种于分离培养基平板上,28 ℃恒温培养2 d,待菌落长出后,经多次划线纯化后分别接入亚硝酸盐与硝酸盐还原培养基中,28 ℃,100 r/min振荡培养2 d,每8 h取培养后的菌液8 000 r/min离心5 min,分别测定亚硝酸盐与硝酸盐的浓度,将筛选出的菌株至于斜面4 ℃保存。将初筛的好氧反硝化菌株先经液体活化培养基(除不加琼脂外其余成分与分离培养基相同)活化,待细胞浓度达到106 CFU/mL,取2%的量接种到反硝化培养基A中与反硝化培养基B中,28 ℃,100 r/min振荡培养,以一组不添加菌液作为对照,进行反硝化性能的测定。每间隔24 h定期测定反硝化培养基中的硝态氮(NO3--N)、亚硝态氮(NO2--N)的浓度,连续测定5 d。
1.2.2 分析方法硝酸盐测定:采用GB17378.4-2007镉柱还原法;亚硝酸盐测定:N-1-萘乙二胺分光光度法;亚硝酸盐标准曲线: y=18.207x+0.0014 (x为样品浓度mg/L; y为吸光值,相关系数 r=0.999 9);亚硝酸盐含量计算公式: y1=c1×x(c1为测定吸光值时提取液的稀释倍数);硝酸盐含量计算公式:y2=c2×x-c1×x(c2为测定吸光值时提取液的稀释倍数)。
NO2--N去除率(%)计算公式:

NO3--N去除率(%)计算公式:

式中:d0表示第0天培养基中亚硝酸盐氮、硝酸盐氮浓度;d5表示第5天培养基中亚硝酸盐氮、硝酸盐氮浓度。
1.2.3 菌株的形态学鉴定将菌株进行革兰氏染色,然后在光学显微镜下观察其菌体形态。
1.2.4 生理生化鉴定参照文献[12]进行形态特征和生理生化特征测定,采用半固体穿刺法检测细菌的需氧性和运动性。
1.2.5 菌株的16S rRNA序列分析及系统发育研究用于16S rRNA PCR反应的引物为通用引物,正向引物为:27F(5′-AGAGTTTGATCCTGGCTCAG-3′),反向引物为:1492R(5′-AAGTCGTAACAAGGTAACC-3′),由上海生物工程有限公司合成,构建25 μL的反应体系:10×buffer 2.5 μL,dNTP 1.0 μL,Mg2+ 2.0 μL,27F 1.0 μL,1 472R 1.0 μL,DNA 1.0 μL,TagE 0.5 μL,ddH2O 16.0 μL,PCR反应条件:94 ℃变性5 min一次;92 ℃ 1 min,58 ℃ 1 min,72 ℃ 2 min 30个循环;最后72 ℃ 10 min;取PCR产物在0.8%的琼脂糖凝胶上进行电泳,采用PCR回收试剂盒回收纯化后送上海生工测序。
将所得序列在GenBank中进行BLAST分析,通过Bioedit 7.0和MEGA 5.0等软件进行多重序列比对分析,并以Neigbor-Joining构建系统发育树。
2 结果与分析 2.1 反硝化细菌的分离与筛选通过富集与分离,初筛与复筛,通过还原培养基初筛得5种菌株,经复筛得到1株既能去除NO2--N又能去除NO3--N的高效好氧反硝化菌株,且无硝酸盐与亚硝酸盐的积累,基本在一周之内即可去除(表1)。
| 表 1 5株菌对NO2--N与NO3--N的去除率 Tab.1 The removal efficiency of 5 strains for NO2--N and NO3--N |
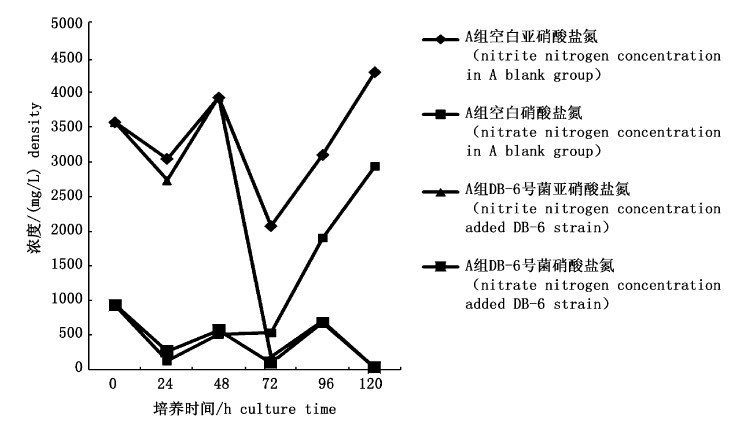
以亚硝酸盐氮作为唯一氮源,测定菌体生长过程中N02--N和NO3--N浓度随时间变化,确定菌株在好氧条件下的反硝化能力,从图1对比看出,空白对照硝酸盐氮和亚硝酸盐氮均升高,DB-6号菌具有较强的反硝化能力,亚硝酸盐氮的含量除了在培养第48 h有升高外,其他时间均无升高现象,由于培养体系中硝酸盐氮转化成亚硝酸盐氮。之后随着硝酸盐氮、亚硝酸盐氮的降低,亚硝酸盐氮从最初的3 570 mg/L降至22 mg/L,去除率达到了99.4%。可以有效还原培养基中的亚硝酸盐氮,且最终无反弹现象。
|
图 1 空白对照与DB-6号菌在A培养基内硝酸盐氮与亚硝酸盐氮的浓度变化 Fig. 1 The changes of concentration of nitrate nitrogen and nitrite nitrogen of control in the culture A |
以硝酸盐氮作为唯一氮源,测定菌体生长过程中N02--N和NO3--N浓度随时间的变化具体见图2。从图中可以对比看出,DB-6号菌对该反硝化培养基具有较强的反硝化能力,可以有效还原培养基中的硝酸盐氮、亚硝酸盐氮,在培养的第24 h,硝酸盐氮少许增加,但亚硝酸盐氮急剧上升,说明此时的硝酸盐氮大部分转化成亚硝酸盐氮,24 h-48 h之间硝酸盐氮急剧降低,亚硝酸盐氮增大达最大值,之后直线下降。且无反弹现象,硝酸盐氮从最初的2 464 mg/L降至27 mg/L,去除率达到98.9%。

|
图 2 空白对照与DB-6号菌在B培养基内硝酸盐氮与亚硝酸盐氮的浓度变化 Fig. 2 The changes of concentration of nitrate nitrogen and nitrite nitrogen of control and DB-6 strain in the culture B |
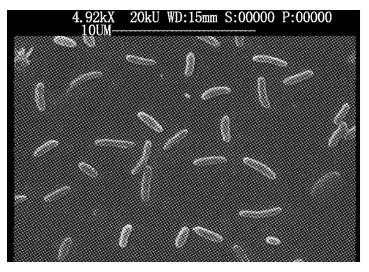
结合平板上的菌落形态和镜检结果以及生理生化特征,DB-6在平板上形成直径3~5 mm的圆形菌落,菌落表面光滑,隆起,呈淡粉色。经革兰氏染色,单细胞呈短杆状状,革兰氏阴性,无芽孢和荚膜(图3,图4)。采用半固体穿刺法对其需氧和运动性测定发现,菌株沿着穿刺线自上而下穿透培养基扩散生长,表明该菌株是兼性菌。生理生化鉴定特征见表2。
|
图 3 DB-6革兰氏染色图 Fig. 3 DB-6 gram diagram |
|
图 4 DB-6菌扫描电镜图 Fig. 4 Scanning electron micrographs of DB-6 |
| 表 2 菌株DB-6的生理生化特征 Tab.2 Physiological and biochemical characteristics of strain DB-6 |
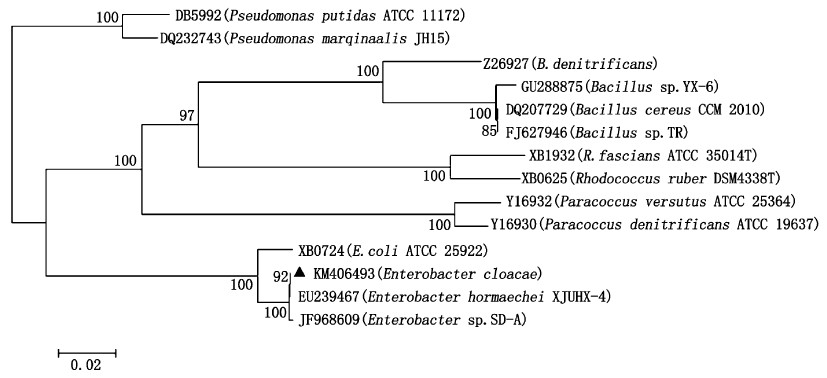
获得目的菌株16S rRNA序列长度为1 445 bp,在Genbank登录号为KM406493,同时,该菌的16S rRNA序列通过Blast检索程序分析,结果表明,与阴沟肠杆菌(Enterobacter cloacae)的同源性达99%,初步鉴定为阴沟肠杆菌(Enterobacter cloacae)。选取GenBank中部分阴沟肠杆菌属和已知好氧反硝化细菌及部分硝化细菌采用Bioedit 7.0进行多重比对,用MEGA 5.0软件中的NJ方法构建系统发育树结果如图5所示。用于系统发育树构建的相关参比菌株的细菌名称、菌株编号和序列登录号见表3。从系统发育树可以看出DB-6(KM406493)与肠杆菌属Enterobacter sp SD-A与 Enterobacter hormaechei XJUHX-4在同一分支上,亲缘关系最近。
|
图 5 以N-J法构建菌株DB-6与其他细菌间基于16S rRNA序列同源性的系统发育树 Fig. 5 Phylogenetic tree generated from an alignment of 16S rRNA of strain DB-6 and other bacteria based on Neighbor-joining method |
| 表 3 用于系统发育树构建的相关参比菌株的信息 Tab.3 The information of phylogenetic trees for the relevant reference strains |
由于好氧反硝化细菌在环境中本来很少且很难成为优势菌,故采用一般筛选方法不易将其筛选出来。本研究通过定量增加亚硝酸盐的含量来驯化反硝化细菌,增加了好氧反硝化细菌转化为优势菌的可能性。从而提高了在好氧条件下反硝化细菌对硝酸盐和亚硝酸盐的去除率,实现了在好氧条件下的反硝化作用。
生物滤池在工厂化循环水养殖系统中起着净化水质作用,其工艺原理为:在滤池中填装一定量的滤料,如毛刷、生化球、陶瓷环等,一些反硝化细菌在其表面附着,待污水流经时,滤料表面生长的硝化细菌与反硝化细菌去除养殖污水中的氨氮、亚硝酸盐等。LESLEY等[2]通过间歇曝气分离筛选出好氧反硝细菌T. p antotrop haLMD82. 5,吕锡武等[13]和孔庆鑫等[14]采用间歇曝气对污水处理中的活性污泥进行驯化,发现了好氧反硝化细菌。在实验中,我们发现这种方法是比较有效的,经富集发现多个有好氧反硝化功能的细菌。本文筛选与鉴定的阴沟肠杆菌(Enterobacter cloacae)具有反硝化功能,在国内外尚属首次报道。
HUNG-SOO等[15]利用菌种Alealigene faecalis strain No.4在好氧状态下处理具有高浓度氨氮(2 000 mg/L)的猪舍废水,反硝化率超过65%,并在控制一定的碳氮比和pH的连续处理状况下,COD和氨氮的去除率达到100%;廖绍安等[16]从淡化养殖虾池筛选到一株活性较高的好氧反硝化菌,在10 h内能将亚硝酸盐氮由26.18 mg/L降至0;邵晴和余晓斌[17]从湖水中分离出来的一株好氧反硝化细菌,能去除水体中99%的亚硝酸盐氮。郭端强等[18]利用BTB培养基从水中富集培养筛选出一株好氧反硝化细菌N22,培养40 h硝酸盐氮去除率达86.39%;杨基先等[19]等利用驯化活性污泥的方式筛选出的G3,在溶氧为4.0 mg/L的条件下,24 h内对NO3--N的去除率为91.09%,但对NO2--N的累积量达到了12.03 mg/L。
从本实验结果可以看出,在反硝化培养基A中,在起始阶段NO2--N有升高趋势,是因为在培养反应过程中部分NO3--N转化成NO2--N,最后两者都下降比较快;在反硝化培养基B中,在起始阶段NO2- -N、NO3--N都有升高趋势,之后NO3--N先急剧下降,NO2--N仍在增加,然后又急剧下降,经过富集培养刷选出的目的菌株对亚硝酸盐氮去除率达99.4%,硝酸盐氮去除率也高达98.9%,该目的菌株既能有效还原NO2--N又能有效还原NO3--N,具有高效的反硝化能力,且无硝酸盐与亚硝酸盐的累积,最终无反弹现象,具备制成脱氮制剂的潜质。
| [1] | JOO H S, HIRAL M, SHODA M.Characteristies of alnroonium removal by heterotro phie nitrifieation-aerobie denitrifieation by alealigenes faeealis No.4 [J]. Jouranl of Bioscinece and bioengineering 2005, 100(2):184-191. |
| [2] | LESLEY A, ROBERTSON L A, KUENEN J G. Thiosphaera pantotropha gen. nov. sp. nov., a facultatively anaerobic, facultatively autotrophic sulfur bacterium [J]. Journal of General Microbiology, 1983, 129:2847-2855. |
| [3] | LUKOW T, DIEKMANN H. Aerobic denitrification by a newly isolated heterotrophic bacterium strain TL1 [J].Biotechnology Letters, 1997, 11(19):1157-1159. |
| [4] | TAKAAYA N, MARIA A B, YASUSHIN S, et al. Aerobic denitrifying bacteria that produce low levels of nitrous oxide [J]. Applied and environmental microbiology, 2003, 69(6):3152- 3157. |
| [5] | SU J J, LIU B Y, LIU C Y. Comparison of aerobic denitrification under high oxygen atmosphere by Thiosphaera pantotropha ATCC35512 and Pseudomonas stutzeri SU2 newly isolated from the active sludge of a piggery wastewater treatment system [J]. Applied and environmental microbiology, 2001, 90(3):457- 462. |
| [6] | SHWU L P, CHONG N M, CHEN C H. Potential applications of aerobic denitrifying bacteria as bioagents inwastewater treatment [J]. Biores Technol, 1999, 68(2):179-185. |
| [7] | PATUREAU D, ZUMSTEIN E, DELGENES J P. Aerobic denitrifiers isolated from diverse natural and managed ecosystems [J]. Microbial Ecol, 2000, 39(2):145-152. |
| [8] | JOONG K K, KYOUNG J P, KYOUNG S C. Aerobic nitrification denitrification by heterotrophic Bacillus strains [J]. Biores Technol, 2005, 96(17):1897-1906. |
| [9] | 杨希, 刘德立, 邓灵福. 蜡状芽孢杆菌好氧反硝化特性研究[J]. 环境科学研究, 2008, 21(3):155-159.YANG X, LIU D L, DENG L. Study on aerobic denitrification characteristics of bacillus cereus [J].Research of Environmental Sciences, 2008, 21(3):155-159. |
| [10] | 马放, 王弘宇, 周丹丹. 好氧反硝化菌株X31的反硝化特性[J]. 华南理工大学学报, 2005, 33(7):42-46.MA F, WANG H Y, ZHOU D D. Denitrification characteristics of an aerobic denitrifying bacterium pseudomonas chloritidismutans strain X31[J].Journal of South China University of Technology (Natural Science Edition), 2005, 33(7):42-46. |
| [11] | 周丹丹, 马放, 王宏宇.关于好氧反硝化菌筛选方法的研究[J]. 微生物学报, 2004, 44(6):837-838.ZHOU D D, MA F, WANG H Y. Study on screening method of aerobic denitrifies [J]. Acta Microbiologica Sinica 2004, 44(6):837-838. |
| [12] | 东秀珠, 蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社, 2001.DONG X Z, CAI M Y. Common bacterial system identification manual[M]. Beijing:Science Press, 2001. |
| [13] | 吕锡武, 李丛娜, 稻森悠平.溶解氧及活性污泥浓度对同步硝化反硝化的影响[J]. 城市环境与城市生态, 2001, 14( 1) : 33-35.LU X W, LI C N, INARNORI Y H, et al. Effect of DO concentration and MLSS on simultaneous nitrification and denitrification[J].Urban Environment & Urban Ecology, 2001, 14(1):33-35. |
| [14] | 孔庆鑫, 李君文, 王新为, 等.一种新的好氧反硝化菌筛选方法的建立及新菌株的发现[J]. 应用与环境生物学报, 2005, 11(2): 222-225.KONG Q X, LI J W, WANG X W, et al. A new screening method for aerobic dentrification bacteria and isolation of a novel strain [J].Chinese Journal of Applied and Environmental Biology, 2005, 11(2):222-225. |
| [15] | HUNG-SOO J, MITSUYO H, MAKOTO S. Piggery wastewater treatment using Alcaligenes faeealis strain No.4 with heterotrcphic nitrifieation and aerobic denitrification [J].Water Researeh, 2006, 40(16):3029-3036. |
| [16] | 廖绍安, 郑桂丽, 王安利, 等.养虾池好氧反硝化细菌新菌株的分离鉴定及特征[J].生态学报, 2006, 26(11):3718-3725.LIAO S A, ZHENG G L, WANG A L, et al. Isolation and characterization of a novel aerobic denitrifier from shrimp pond [J]. Acta Ecologica Sinica, 2006, 26(11):3718-3725. |
| [17] | 邵晴, 余晓斌.好氧反硝化细菌的筛选及反硝化特性研究[J].生物技术, 2008, 18(3):63-65.SHAO Q, YU X B. Isolation and characterization of a strain denitrobacteria[J].Biotechnology, 2008, 18(3):63-65. |
| [18] | 郭端强, 刘海龙, 万亚涛.一株好氧反硝化细菌的分离鉴定及反硝化特性研究[J].生物技术通报, 2012(10):1994-2013.GUO D Q, LIU H L, WAN Y T. Isolation and identification of an aerobic denitrifier and its denitrifying characteristic [J].Biotechnology Bulletin, 2012(10):1994-2013. |
| [19] | 杨基先, 高珊珊, 马放. 一株好氧反硝化细菌的分离鉴定及反硝化能力[J].环境科学学报, 2008, 28(7):1994-2012.YANG J X, GAO S S, MA F. Identification and phylogenetic analysis of an isolated aerobic denitrifier [J].Acta Scientiae Circumstantiae, 2008, 28(7):1994-2012. |
2. Food and Drug Testing Institute of Zhoushan, Zhoushan 316000, Zhejiang, China;
3. Fisheries Technology Extention Station of Zhoushan, Zhoushan 316000, Zhejiang, China
 2015, Vol. 24
2015, Vol. 24


