我国是世界上对虾产量最大、消费量最多的国家,对虾产业是我国渔业经济的第一大支柱产业。数据显示,2009年国内对虾养殖产量130万吨,超过全球总产量的1/3,其中出口量高达21.6万吨。2010年,中国对虾总产量134.8万吨,其中广东产量占35%。南美白对虾( Penaeus vannamei Boone)又称凡纳滨对虾(Litopenaeus vannamei),是广温热带虾类。南美白对虾具有个体大、生长快、营养需求低、抗病力强等优点,对水环境因子变化的适应能力较强,对饲料蛋白含量要求低、出肉率高达65%以上、离水存活时间长等优点,是集约化高产养殖的优良品种,也是目前世界上三大养殖对虾中单产量最高的虾种。2010年对虾的养殖成功率不尽人意,肆意蔓延的病害造成排塘率高。2011年、2012年,虾的养殖成功率比2010年还低,排塘率更严重,部分虾塘出现了空塘。近年来,在对虾养殖过程中,大量细菌性、病毒性传染病相继出现,给养虾业造成了巨大的经济损失。
气单胞菌是革兰氏阴性,杆状细菌,在分类学上被归入气单胞菌科(Aeromonadaceae)气单胞菌属(Aeromonas) [1, 2, 3]。JANDA,ABBOTT和PARKER等概括了已发表的气单胞菌属包括嗜水气单胞菌(A.hydrophila)、动物气单胞菌(A. bestiarum)、杀蛙气单胞菌(A. salmonicida)、豚鼠气单胞菌(A.caviae)(同义名斑点气单胞菌A. punctata )、中间气单胞菌( A.media)、嗜泉气单胞菌( A.eucrenophila)、温和气单胞菌(A.sobria)、凡隆气单胞菌( A.veronii) (synonymsare A.sichthiosmia and A.culicicola)、简达气单胞菌(A.jandaei)、舒伯特气单胞菌(A. schubertii)、易损气单胞菌(A.trota) (synonym A. enteropelogenes)、 异常嗜糖气单胞菌(A. allosaccharophila)、鳗气单胞菌(A.encheleia)、波氏气单胞菌(A.popoffii)、猴气单胞菌(A. simiae)、软体动物气单胞菌(A. molluscorum)、双壳气单胞菌(A.bivalvium)、水族箱气单胞菌(A.aquariorum)、棱背龟气单胞菌(A. tecta)、鱼蛭气单胞菌(A.piscicola)和沙曼气单胞菌(A. sharmana)等共 21个种[4, 5]。其后,又有多样气单胞菌(A. diversa)、河流气单胞菌(A.fluvialis)、台湾气单胞菌(A. taiwanensis)、圣雷利气单胞菌(A.sanarellii)、水生气单胞菌 (A. aquatic)、湖泊气单胞(A.lacus)、芬兰气单胞菌(A. finlandiensis)等7个新种被报道[6, 7, 8, 9, 10],到目前为止,已报道的气单胞菌达28种,在这些种中,研究深入、报道最多的是嗜水气单胞菌,其全基因组测序已完成,且引起多种动物发生多种疾病[11, 12]。
2012年,广东省某养殖场南美白对虾发生传染病,虾体、特别是足须发红,肝胰腺肿大,对虾大批量死亡。为了对该病进行确诊和有效防控,我们对病原进行了分离和鉴定,从发病南美白对虾分离纯化到优势菌豚鼠气单胞菌,且对该菌的致病性和药物敏感性进行了研究。本文结果对由该菌引起的疾病的有效防控有一定的指导作用,为进一步从病原学角度进行深入研究奠定了一定的理论基础。
1 材料与方法 1.1 实验动物及主要试剂发病南美白对虾(2012年12月)采自广东省某虾养殖场;健康南美白对虾购自广东中山市某市场。
DNA Marker、Taq DNA 聚合酶、dNTP等分子生物学试剂购自中山卫冕生物科技有限公司;药敏片购自杭州微生物试剂有限公司;TCBS琼脂和生理生化鉴定管购自广东环凯微生物科技有限公司。
1.2 细菌的分离和纯化无菌条件下,用接种环挑取发病南美白对虾发红体表、肝胰腺、溃烂体表等,划线接种于TCBS琼脂平板,37 ℃培养24 h,挑取形态一致的优势单菌落进行纯化分离;直至获得纯培养物,记录菌落形态;挑取单菌落进行革兰氏染色,并在显微镜下观察细菌形态。
1.3 分离菌株生理生化实验用生化反应管对分离菌株进行生理生化实验,测定指标为:分解半乳糖、蔗糖、甘露醇实验;精氨酸双水解和赖氨酸脱羧反应;葡萄糖产气和葡萄糖酸盐反应;硫化氢反应等。
1.4 细菌16S rDNA序列的PCR扩增 1.4.1 细菌基因组DNA的提取将细菌于37 ℃液体培养基中培养24 h,酚-氯仿抽提法提取基因组DNA。
1.4.2 细菌16S rDNA序列的PCR扩增及测序采用细菌16S rDNA 通用引物,27F:5′-AGAGTTTGATCCATGGCTCAG-3′,1541R: 5′-A AGGAGGT GATCCAGCC-3′,扩增片段预期大小约为1 500 bp。引物由上海英骏(Invitrogen)生物技术有限公司合成。以分离株基因组DNA为模板进行PCR 扩增,反应条件为: 94 ℃预变性5 min; 94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸2 min,30个循环; 72 ℃延伸10 min。扩增产物送上海英骏(Invitrogen)生物技术有限公司进行测序。
1.5 细菌16S rDNA序列分析将所测16S rDNA序列在NCBI上进行Blast分析,下载相似性最高的10条序列进行比对,同时下载该属细菌不同种相应基因序列作为参比序列,用DNASTAR 7.1中的MegAlign软件包分析相似性,用MEGA 6.0软件包中的Neighbor-Joining法构建系统发育树,并通过自举分析进行置信度检测,自举数集为1 000。
1.6 细菌人工感染实验参考刘荭等的方法[13],用无菌生理盐水将菌稀释后加入水池,使实验池中水每毫升含有病原菌3×104 cfu/mL;加入同体积无菌生理盐水作为对照。每组分三池放入南美白对虾60尾,室温分组饲养,记录每组南美白对虾的发病情况、死亡时间及尾数。
参考张友平等的方法[14] 测定细菌LD50,将新鲜培养的菌液离心弃上清后,用无菌生理盐水稀释至1×108 、1×107、1×106、1×105、1×104、1×103、1×102 cfu/mL,每浓度1组,每组20尾虾。在靠近尾扇第3腹节处注射菌液0.1 mL/尾,对照组注射同等体积的生理盐水,控制水温(20±3)℃,每12小时记录死亡虾数,按照Reed-Muench氏法计算LD50值。
1.7 药物敏感试验将新鲜培养的分离菌株用无菌生理盐水稀释至1×106 cfu/mL,平板涂布法接种于营养琼脂平板,分别将多粘菌素、妥布霉素、痢特灵、土霉素、硫酸庆大霉素、磺胺甲恶唑、氯霉素、氟派酸、丁胺卡那、红霉素、林可霉素、麦迪霉素、呋喃唑酮、头孢拉定等14 种药敏片贴于平板上,37 ℃培养24 h。用直尺测量抑菌圈直径,根据抑菌圈直径判定病原菌对药物的敏感性。
2 结果 2.1 病虾细菌的分离、纯化及形态学观察从病虾虾体病变部位肝胰腺分离纯化到1株优势菌,命名为ZHBX12016。该细菌为革兰氏阴性菌,呈短杆状。在牛肉膏蛋白胨固体培养基37 ℃培养24 h,可见直径约为0.5 mm,圆形,表面湿润并隆起,不透明,边缘整齐的乳白色菌落。
2.2 细菌生理生化反应生理生化反应结果见表1,该菌对半乳糖、蔗糖、甘露醇;精氨酸双水解反应为阳性,赖氨酸脱羧反应、葡萄糖产气和葡萄糖酸盐反应为阴性;除硫化氢外,各反应结果与DON等[1] A.punctata(表1)和SHARON等[15] A.caviae(表1)生化反应结果一致。
| 表 1 细菌的生理生化反应 Tab. 1 Physiology and biochemistry reaction of bacteria isolated from Penaeus vannamei Boone |
以细菌基因组DNA为模板,扩增到与预期大小相符合的DNA片段(图1),将PCR产物回收纯化后测序显示,该序列片段为1 444 bp。
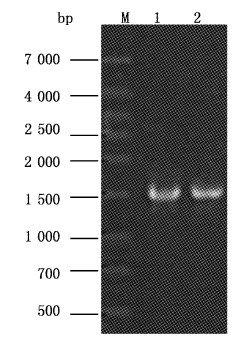
|
图 1 分离菌株16S rDNA 基因的PCR扩增 Fig.1 PCR amplification of the 16S rDNA genes of the isolate M.1kb DNA MarkerⅡ; 1,2.ZHBX12016. |
序列分析结果显示分离菌株16S rDNA与A.caviae和A.punctata相应序列相似性达97.7%以上,最高相似性均达100%,在系统发育树上与A.caviae、A. punctata亲缘关系最近,聚为一簇,属同一分支(见图2)
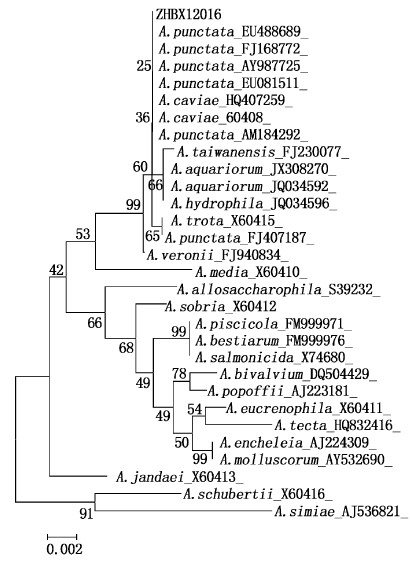
|
图 2 用Mega6软件邻接法构建的基于细菌16S rDNA序列的系统发育树 Fig.2 Unrooted neighbor-joining phylogenetic tree derived from partial 16S rRNA gene sequences. Numbers shown next to each node indicate bootstrap values (percentages of 1 000 replicates) |
将菌株ZHBX12016 回归感染健康南美白对虾后5 d 内,实验组(ZHBX12016)南美白对虾死亡率达95%,与对照组差异极显著(P<0.01)濒死南美白对虾表现出与自然感染病例相似的临床症状。
在分离菌株LD50测定过程中,注射菌株的南美白对虾12h后出现死亡,0.1 mL的1×107以上浓度菌液在三天内致所有对虾全部死亡,死亡率达100%(见表2)。分离菌株对南美白对虾的LD50为6.43×103 cfu/mL,表明该菌株对健康南美白对虾有很强的致病力。
| 表 2 分离菌株对南美白对虾LD50的测定 Tab. 2 LD50 test of the isolated bacteria on Penaeus vannamei Boone |
细菌药物敏感性结果见表3,从表中可见,分离菌株对氯霉素、土霉素,丁胺卡那、呋喃唑酮等高度敏感。对多粘菌素、妥布霉素、氟哌酸、痢特灵、林可霉素均不敏感。
| 表 3 分离菌株的药敏试验(n=3) Tab. 3 Antibiotic sensitivity of the isolated bacteria |
本研究从发病南美白对虾分离到1株优势菌,经形态学、生理生化和分子生物学等方法鉴定为A. caviae。在生理生化特性鉴定中,ZHBX12016对半乳糖、蔗糖、甘露醇、葡萄糖产气、葡萄糖酸盐、赖氨酸脱羧酶和精氨酸酸水解酶等的生化反应性与伯杰细菌鉴定手册[1]所描述相同,但硫化氢生化反应性则不同。Sharon等对气单胞菌属14个种共193株细菌进行了生化鉴定,对特定的种,有14%的菌株出现同一生化反应不一致的结果[15],本研究中所作的生化反应是气单胞菌的特征性反应,其结果与Sharon等报道的豚鼠气单胞菌A.caviae生化反应结果完全一致。
2012年,广东省某养殖场南美白对虾突发传染病,为确诊该病并对其进行有效防制,我们对虾体病变部位进行细菌的分离纯化,结果从发病部位(具体)分离到14株细菌,其中4株为乙酰微小杆菌、1株为印度微小杆菌,3株为粪肠球菌、2株为单不动杆菌、1株为松鼠葡萄球菌、1株为巴氏葡萄球菌、2株为气单胞菌。在所分离的2株气单胞菌中的明显优势菌经鉴定为A.caviae。
在所分离的这些细菌中,乙酰微小杆菌和印度微小杆菌均为微小杆菌属(Exiguobacterium spp),该属细菌是一种生态菌,在分解有机污染物,转化重金属,根际促生,工业污水处理中发挥作用[16]。粪肠球菌(Enterococcus faecalis)能在不同环境中生长存活,多是动物口腔和肠道的正常菌群,有的是动物的致病菌,还有些可引起人类感染[17]。不动杆菌为广泛分布于土壤、水及活性淤泥中,某些种群可长期存在于医院环境中,逐渐成为引起医院内感染及流行的重要条件致病菌引起院内感染及流行的重要条件致病菌[18],WANG 等报道其在虾体中是肠道区系微生物之一[19]。葡萄球菌在自然界中分布很广,多数为非致病菌,仅少数引起人和动物的化脓性感染,具有致病性的主要是金黄色葡萄球菌和条件致病性的表皮葡萄球菌。对于本文前期工作分离的松鼠葡萄球菌,仅见引起黄喉拟水龟疾病,也会引起的人尿路感染[20]。而巴氏葡萄球菌(Staphylococcus pasteuri)是一种甲胺磷高效降解菌[21]。经过综合分析后对2株气单胞菌的致病菌和药敏性进行了测定。结果发现:本文鉴定的A.caviae致病力最强,且该株细菌ZHBX12016是明显优势菌。而另一菌株ZHBX12017通过形态、生理生化及16S rDNA仅能鉴定为气单胞菌属,动物感染试验发现其致病力与对照组差异不显著(P>0.05),故将该株优势菌ZHBX12016 A.caviae的分离鉴定过程整理成文。
目前,已鉴定的气单胞菌属细菌有28个种,它们来源于人及多种动物宿主:从人伤口感染、水生动物疾病中分离,有的种类还在食物中分离纯化到[22, 23, 24]。细菌的分类鉴定方法主要有经典方法和现代方法,经典方法主要通过对细菌形态、生进生化指标等的测定进行分类,现代方法则是通过对其核酸和细胞化学成分进行分析鉴定[25]。细菌16S rRNA 基因序列分析是细菌种属鉴定最常使用的分子生物学方法。目前已有多位学者单独使用该技术或将其结合生理生化反应等鉴定气单胞菌。DANIEL 等仅用该法鉴定了从人慢性伤口感染病例的51个样品分离的93株细菌,其中包括斑点气单胞菌[26]。CONSUELO等用16S rRNA 基因序列分析结合生理生化试验鉴定了嗜水气单胞菌的亚种Aeromonas hydrophila subsp. dhakensis[27]。本文也利用该法结合生理生化和形态学特征将菌株ZHBX12016鉴定为A.caviae。因气单胞菌属部分种类16S rRNA 基因的相似性较高,利用该法有时不能将菌株鉴定到种,在本文前期工作中分离的另1菌株ZHBX12017就不能鉴定到种。近年来,有学者利用多位点序列分析MLSA(multilocus sequence analysis)技术对气单胞菌持家基因进行序列分析以鉴定气单胞菌[11, 28]。目前,我们正在利用该技术对ZHBX12017进行鉴定。
气单胞菌可引起人和水生动物发病。BEAZ-HIDALGE 等从濒死的病鱼分离到A.piscicola新种[28]。PABLOS等对从腹泻病人、饮水、和食品源的气单胞菌进行了鉴定,结果发现,人源气单胞菌与饮水源气单胞菌接近,暗示了气单胞菌可通过污水传播给人,从而引起人类疾病[29]。PRIDGEON等从发病鲶鱼分离到高毒力嗜水气单胞菌,鉴定了其独特DNA序列的存在[30]。樊海平等由发生败血病的中国对虾分离出两种气单胞菌嗜水气单胞菌和豚鼠气单胞菌[31]。目前还未见由豚鼠气单胞菌引起南美白对虾疾病的报道。南美白对虾源豚鼠气单胞菌是否能引起其它水生动物发病,它与人源气单胞菌的亲缘关系如何,是否引起人和其它动物发病,均有待研究。因此,进一步开展该菌的流行病学调查,了解其发病规律,确认危害对象,研究安全、有效的防治方法,将有助于对由该菌引起的南美白对虾疾病进行有效防控,促进虾养殖业的健康可持续发展。
| [1] | KRIEG N R, LUDWIG W, WHITMAN W B, et al. Bergey's manual of systematic bacteriology[ M]. 9th edition. Berlin: Springer, 2004: 556-557. |
| [2] | COLWELL R R, MACDONELLl M T, DE LEY J. Proposal to recognize the family Aeromonadaceae fam. nov International Journal of Systematic Bacteriology, 1986, 36(3): 473-477.. |
| [3] | MARTINEZ-MURCIA A J. Phylogenetic positions of Aeromonas encheleia, Aeromonas popoffii, Aeromonas DNA hybridization group 11 and Aeromonas group 501[J]. International Journal of Systematic Bacteriology, 1999, 49(4): 1403-1408. |
| [4] | JANDA J M, ABBOTT S L. The genus Aeromonas: taxonomy, pathogenicity, and infection[J]. Clinical Microbiology Reviews, 2010, 23(1): 35-73. |
| [5] | PARKER J L, SHAW J G, SHAW J C. Aeromonas spp. clinical microbiology and disease[J]. Journal of Infection, 2011, 62(2): 109-118. |
| [6] | MIÑANA-CALBIS D, FARFÁN M, LORÉN J G, et al. Proposal to assign Aeromonas diversa sp. nov. as a novel species designation for Aeromonas group 501[J]. Systematic and Applied Microbiology, 2010, 33(1): 15-19. |
| [7] | ALPERI A, MARTÍNEZ-MURCIA A J, MONERA A, et al. Aeromonas fluvialis sp. nov., isolated from a Spanish river[J]. International Journal of Systematic and Evolutionary Microbiology, 2010, 60(1): 72-77. |
| [8] | ALPERI A, MARTÍNEZ-MURCIA A J, KO W C M, et al. Aeromonas taiwanensis sp. nov. and Aeromonas sanarellii sp. nov., clinical species from Taiwan[J]. International Journal of Systematic and Evolutionary Microbiology, 2010, 60(9): 2048-2055. |
| [9] | HOSSAIN M J, BEAZ-HIDALGO R, FIGUERAS M J, et al. Draft genome sequences of two novel Aeromonas species recovered in association with cyanobacterial blooms[J]. Genome Announcements, 2014, 2(6): e01181-14. |
| [10] | BEAZ-HIDALGO R, LATIF-EUGENÍN F, HOSSAIN M J, et al. Aeromonas aquatica sp. nov., Aeromonas finlandiensis sp. nov. and Aeromonas lacus sp. nov. isolated from Finnish waters associated with cyanobacterial blooms[J]. Systematic and Applied Microbiology, 2015, 38(3): 161-168. |
| [11] | 李倩, 杨洪江, 何洋, 等. 天津地区气单胞菌分离株的鉴定与多位点序列分型[J]. 微生物学通报, 2013, 40(8): 1365-1374. LI Q, YANG H J, HE Y, et al. Characterization and multilocus sequence typing of Aeromonas strains isolated in Tianjin area[J]. Microbiology, 2013, 40(8): 1365-1374. |
| [12] | 李梅, 刘文利, 黄树涛, 等. 锦鲤嗜水气单胞菌的分离鉴定及生物学特性研究[J]. 中国预防兽医学报, 2010, 32(8): 591-594. LI M, LIU W L, HUANG S T, et al. Isolation and the biological characterization of Aeromonas hydrophila isolates from Ornamental carp (Cyprius carpio L)[J]. Chinese Journal of Preventive Veterinary Medicine, 2010, 32(8): 591-594. |
| [13] | 刘荭, 王侃, 彭锦新, 等. 斑节对虾"红体病"细菌性病原的初步研究[J]. 水产科技情报, 1999, 26(1): 7-9. LIU H, WANG K, PENG J X, et al. Study on bacterial pathogen of red Body disease in Penaeus monodon[J]. Fisheries Science & Technology Information, 1999, 26(1): 7-9. |
| [14] | 张友平, 王军毅, 刘问, 等. 罗氏沼虾气单胞菌MrM0602株的分离和致病性研究[J]. 水产科学, 2008, 27(1): 20-23. ZHANG Y P, WANG J Y, LIU W, et al. Isolation and pathogenicity of Aeromonas MrM0602 from giant fresh water prawn Macrobrachium rosenbergii [J]. Fisheries Science, 2008, 27(1): 20-23. |
| [15] | ABBOTT S L, CHEUNG W K W, JANDA J M. The genus Aeromonas : biochemical characteristics, atypical reactions, and phenotypic identification schemes[J]. Journal of Clinical Microbiology, 2003, 41(6): 2348-2357. |
| [16] | 张莹, 石萍, 马炯. 微小杆菌 Exiguobacterium spp. 及其环境应用研究进展[J]. 应用与环境生物学报, 2013, 19(5): 898-904. ZHANG Y, SHI P, MA J. Exiguobacterium spp. and their applications in environmental remediation[J]. Chinese Journal of Applied and Environmental Biology, 2013, 19(5): 898-904. |
| [17] | 刘燕霏, 杨建德, 赵瑞利. 粪肠球菌动物致病的研究进展[J]. 家畜生态学报, 2013, 34(11): 75-77. LIU Y F, YANG J D, ZHAO R L. Research progress of an animal diseases caused by Enterococcus faecalis [J]. Acta Ecologiae Animalis Domastici, 2013, 34(11): 75-77. |
| [18] | 牟成泉. 不动杆菌分离与鉴定的研究进展[J]. 成都医学院学报, 2012, 7(4): 655-657. MOU C Q. Research progress of Acinetobacter spp. isolation and characterization[J]. Journal of Chengdu Medical College, 2012, 7(4): 655-657. |
| [19] | WANG X H, LI H R, ZHANG X H, et al. Microbial flora in the digestive tract of adult penaeid shrimp ( Penaeus chinensis )[J]. Journal of Ocean University of Qingdao, 2000, 30(3): 493-498. |
| [20] | 黎小正, 韦信贤, 童桂香, 等. 黄喉拟水龟致病菌松鼠葡萄球菌的分离鉴定及药敏试验[J]. 大连水产学院报, 2009, 24(4): 371-374. LI X Z, WEI X X, TONG G X, et al. Isolation, identification and medicine sensitivity test of Staphylococcus sciuri in turtle Mauremys mutica [J]. Journal of Dalian Fisheries University, 2009, 24(4): 371-374. |
| [21] | 邓先余, 高健, 谭树华, 等. 一株甲胺磷高效降解菌—巴氏葡萄球菌( Staphylococcus pasteuri) 的筛选及其分子鉴定[J]. 海洋与湖沼, 2009, 40(5): 551-556. DENG X Y, GAO J, TAN S H, et al. Staphylococcus pasteuri, an efficient biodegrader to Methamidophos: isolation and molecular identification[J]. Oceanologia et Limnologia Sinica, 2009, 40(5): 551-556. |
| [22] | OSMAN K, ALY M, KHEADER A, et al. Molecular detection of the Aeromonas virulence aerolysin gene in retail meats from different animal sources in Egypt[J]. World Journal of Microbiology and Biotechnology, 2012, 28(5): 1863-1870. |
| [23] | 刘春, 李凯彬, 王庆, 等. 杂交鳢(斑鳢♀×乌鳢♂) 内脏类结节病病原菌的分离、鉴定与特性分析[J]. 水产学报, 2012, 36(7): 1119-1125. LIU C, LI K B, WANG Q, et al. Isolation, identification and characterization of Aeromonas schubertii from hybrid snakehead ( Channa maculata♀×C. argus♂ )[J]. Journal of Fisheries of China, 2012, 36(7): 1119-1125. |
| [24] | NAGAR V, SHASHIDHAR R, BANDEKAR J R, et al. Characterization of Aeromonas strains isolated from Indian foods using rpoD gene sequencing and whole cell protein analysis[J]. World Journal of Microbiology and Biotechnology, 2013, 29(4): 745-752. |
| [25] | 周德庆. 微生物学教程[M]. 3版. 北京: 高等教育出版社, 2011: 344-353. ZHOU D Q. Microbiology[M]. 3rd Edition. Beijing: Higher Education Press, 2011: 344-353. |
| [26] | RHOADS D D, COX S B, REES E J, et al. Clinical identification of bacteria in human chronic wound infections: culturing vs. 16S ribosomal DNA sequencing[J]. BMC Infectious Diseases, 2012, 12: 321-328. |
| [27] | ESTEVE C, ALCAIDE E, BLASCO M D. Aeromonas hydrophila subsp. dhakensis isolated from feces, water and fish in Mediterranean Spain[J]. Microbes and Environments, 2012, 27(4): 367-373. |
| [28] | BEAZ-HIDALGE R, ALPERI A, FIGUERAS M J, et al. Aeromonas piscicola sp. nov., isolated from diseased fish[J]. Systematic and Applied Microbiology, 2009, 32(7): 471-479. |
| [29] | PABLOS M, HUYS G, CNOCKAERT M, et al. Identification and epidemiological relationships of Aeromonas isolates from patients with diarrhea, drinking water and foods[J]. International Journal of Food Microbiology, 2011, 147(3): 203-210. |
| [30] | PRIDGEON J W, KLESIUS P H, Mu X J, et al. Identification of unique DNA sequences present in highly virulent 2009 Alabama isolates of Aeromonas hydrophila[J]. Veterinary Microbiology, 2011, 152(1-2): 117-125. |
| [31] | 樊海平, 孟庆显, 俞开康. 由二种气单胞菌引起的中国对虾败血病的研究[J]. 海洋与湖沼, 1995, 26(5): 302-308. FAN H P, MENG Q X, YU K K. Research on the septicemia of Penaeus chinensis caused by two species of Aeromonas[J]. Oceanologia et Limnologia Sinica, 1995, 26(5): 302-308. |
 2015, Vol. 24
2015, Vol. 24

