2. 上海海洋大学 大洋渔业资源可持续开发省部共建教育部重点实验室, 上海 201306;
3. 国家远洋渔业工程技术研究中心, 上海 210306;
4. 上海市远洋渔业协同创新中心, 上海 201306
金枪鱼围网渔业利用热带金枪鱼类聚集在漂流物体下方的行为学特性,制作投放了大量的漂流人工集鱼装置(fish aggregation devices,FAD)用于诱集捕捞金枪鱼[1]。鲣鱼(Katsuwonus pelamis)作为FAD集群中的主要目标鱼种[2],捕获量可占总产量的74%[3]。然而,这种随附行为被认为可能会限制鲣鱼的觅食活动空间,从而对其摄食模式造成负面影响[4]。生物的稳定同位素值反映了该生物在特定时间段的摄食特性[5, 6],因此探究FAD集群中鲣鱼的稳定同位素特征将有助于探究鲣鱼的食性特征和营养信息,对于评估FAD渔法的生态效应具有重要的参考价值。
目前研究鲣鱼食性的资料较多,但研究方法大多集中于传统的胃含物分析法(stomach content analyses,SCA),即通过分析个体被捕时消化道内未被消化的食物来确定营养关系及营养级[7, 8, 9],然而,胃含物分析法仅测量到样本被捕前的摄食饵料,不能代表或反映生物长期的食性[10]。区别于传统方法,稳定同位素分析法(stable isotope analyses,SIA)则能根据不同组织的新陈代谢速率揭示鱼类在被捕捞前数周甚至数月的营养信息,反映出鱼类在长期生活史过程中的食物来源和组成[5, 6],因此该方法能有效弥补传统胃含物分析法的缺陷。
目前稳定同位素技术已成功应用于金枪鱼的食性研究中,如SAR和SAR[11]利用稳定同位素分析地中海水域不同大小的蓝鳍金枪鱼(Thunnus thynnus)的食性和营养级变化;LOGAN等[12]利用稳定同位素技术对比了大西洋东部和西部小型蓝鳍金枪鱼的食性;GRAHAM等[13]利用稳定同位素技术研究了夏威夷水域黄鳍金枪鱼(Thunnus albacares)在个体发育过程中的食性变动。综上所示,至今应用稳定同位素技术研究金枪鱼食性的主要对象为蓝鳍金枪鱼和黄鳍金枪鱼,而利用稳定同位素技术对中西太平洋水域鲣鱼的食性研究尚未发现。因此,本研究尝试分析FAD鱼群中鲣鱼在不同叉长时的碳、氮稳定同位素特征值的变化,进而探究FAD鱼群中鲣鱼在生长发育过程中的食性变化,为实现量化评估FAD渔法对捕捞对象的生态影响提供基础资料。
1 材料与方法 1.1 样品及海域采样调查船为上海开创远洋渔业公司的金枪鱼围网渔船“金汇7号”。采样时间为2013年2月至3月。采样海域及站点见图1。鲣鱼样品取自15网次,每网次随机取5~10尾,共收集样本82尾。在海上测量叉长,按每间隔10.0 cm分组。取鲣鱼背鳍附近的白肌组织,用锡箔纸包裹放入冻库,带回实验室进一步处理,并测定其稳定同位素值。

|
图 1 中西太平洋鲣鱼采样站点 Fig. 1 Sampling stations of Katsuwonus pelamis in the Western and Central Pacific Ocean |
将冷冻的白肌组织用去离子水慢慢冲洗干净后,放入冷冻干燥机,在真空-50 ℃条件下冷冻干燥24 h,然后利用混合型球磨仪(MM400)磨碎成粉末。使用微分天平秤量1.5 mg左右的粉末样品,以铝箔纸包装后放入ISOPRIME 100稳定同位素比例分析质谱仪(Isoprime Corporation,Cheadle,UK)和vario ISOTOPE cube元素分析仪(ElementarAnalysensysteme GmbH,Hanau,Germany)测定同位素,分别获得碳、氮稳定同位素组成以及碳氮比值[14]。
碳稳定同位素组成以国际通用的标准物质PeeDee石灰岩中的碳作为参考标准,氮稳定同位素组成则以大气中的氮作为参考标准,结果以δ13C和δ15N值形式来表示。δ13C和δ15N计算公式如下[14]:
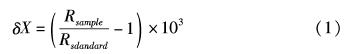
为了减少在实验过程中可能产生的误差对数据的影响,利用箱线图筛选出数据异常值,并在计算过程中剔除异常值。利用方差分析(ANOVA)检验叉长对样本氮、碳稳定同位素组成及碳氮比值是否有显著性影响,以上统计都是通过R 2.9.2 来实现。
利用SPSS 19.0统计软件,对各组数据以最小显著差数( least significant difference,LSD)进行多重比较(显著性水平α=0.05),分析各叉长组间的同位素是否有显著性差异。
2 结果 2.1 叉长分布研究认为,鲣鱼样本的叉长范围为31.0~65.0 cm,平均叉长为(44.30±7.85)cm,其中优势叉长组为40.1~50.0 cm,占样品数的45.12%。其次,叉长组为30.1~40.0 cm占总数的35.37%,叉长组为50.1~60 cm占总数的18.07%,叉长组为60.1~70.0 cm的样本数最低,占总数的2.44%(图2)。

|
图 2 叉长频次分布图 Fig. 2 Fork length frequency distribution of Katsuwonus pelamis |
由图3可知,在30.1~40.0 cm叉长组,碳稳定同位素存在一个超出δ13C值箱线图上边缘的异常值,因此将其剔除。ANOVA检验表明,鲣鱼叉长对δ13C值有显著性影响(F=10.92,P<0.05)。各叉长组间的δ13C值除30.1~40.0 cm与50.1~60.0 cm组之间的δ13C值有显著性差异外(P<0.05),其余各组间均无显著性差异(表1)。

|
图 3
不同叉长组的碳稳定同位素组成箱线图
Fig. 3
The box plots of C stable isotope composition by fork length class
“×”表示平均值。 The “×” represent the mean value. |
| 表 1 各叉长组间同位素显著性差异分析(LSD法) Tab.1 Analysis of significant difference of isotope values among fork length classes (by LSD) |
总体样本的δ13C平均值为(-15.96±0.57)‰。由图4可知,各组的δ13C平均值随叉长增加而减小。30.1~40.0 cm组时,鲣鱼δ13C出现最大值为(-15.74±0.51)‰,30.1~40.0 cm组至50.1~60.0 cm组,δ13C值逐渐减小。50.1~60.0 cm组与60.1~70.0 cm组之间的δ13C无显著差异(P>0.05),均值分别为(-16.27±0.53)‰和(-16.26±0.21)‰。

|
图 4
不同叉长组的氮稳定同位素组成箱线图
Fig. 4
The box plots of N stable isotope composition by fork length class
“×”表示平均值。 The “×” represent the mean value. |
由图4可知,30.1~40.0 cm、40.1~50.0 cm及50.1~60.0 cm叉长组分别存在一个超出δ15N值箱线图下边缘的异常值,因此将其剔除。ANOVA显示,鲣鱼叉长对其δ15N值有显著性影响(F=16.72,P<0.05)。各组间的差异显著性分析(表1)表明,30.1~40.0 cm组的δ15N分别与40.1~50.0 cm(P<0.05)和50.1~60.0 cm(P<0.05)组的δ15N之间有显著性差异,其余各组间均无显著性差异。
总体鲣鱼样本的δ15N平均值为(17.50±1.81)‰。由各组的δ15N平均值分布(图4)可知,鲣鱼的δ15N值随叉长增加呈先减小后稳定的趋势。30.1~40.0 cm组的δ15N均值最大,为(18.66±1.24)‰。在40.1~50.0 cm、50.1~60.0 cm 和60.1~70.0 cm组中,δ15N保持波动性平衡,各组间均无显著性差异,其均值依次为(16.79±1.91)‰、(17.01±1.43)‰和(16.64±0.25)‰。
2.3 碳氮比值特征ANOVA分析显示,叉长对C∶N有显著性影响(F=4.21,P<0.05)。各叉长组间的C∶N差异显著性分析(表1)表明,除30.1~40.0 cm和40.1~50.0 cm之间的C∶N无显著性差异外(P>0.05),其余各叉长组间均有显著性差异。
总体鲣鱼的碳氮比平均值为3.06±0.05。由图5可知,各组平均C∶N值随叉长的增加呈先减小后增加的趋势。在30.1~40.0 cm叉长组,C∶N有最大均值为3.09±0.58,在40.1~50.0 cm时,平均C∶N值最小为3.04±0.05,随后C∶N平均值随着叉长的增加而缓慢增大,分别为3.06±0.04和3.07±0.00。

|
图 5
不同叉长组的碳氮比值分布箱线图
Fig. 5
The box plots of distribution of C∶N ratios in different fork length classes
“×”表示平均值。 the “×” represent the mean value. |
胃含物分析法的优点是能够清晰地了解生物摄食的种类,但缺陷在于一方面仅测量到被捕前的摄食饵料,不能代表或反映生物长期的食性;另一方面,饵料分析往往偏向于较难消化的食物,因而只反映出鱼类在采样时期部分的食性和营养关系[10]。此外FAD周围的金枪鱼空胃率较高[9],缺乏准确的胃含物种类分析就无法计算其在海洋生态系统中的营养位置。
稳定同位素技术是利用生物的天然碳氮稳定同位素特性,即根据生物与其饵料相应组织中碳稳定同位素比值相近的原则[15]来判断其食物来源,根据食物网中相邻营养级生物之间的氮稳定同位素比值相差约3.4‰[16],从而确定其在食物网中的营养位置及食物贡献比例。不同组织的转化率不同,因而测定的同位素信息也不同,据此利用稳定同位素技术可根据不同组织的转化率特点获得鱼类在长期生活史过程中的食性[5, 6],这样既不受限于样本被捕捞时的摄食状态,也不用对个体进行长期连续的跟踪。稳定同位素法有效弥补了传统胃含物分析法的缺陷,为研究高空胃率且高度洄游的金枪鱼类的营养生态信息提供了更加有效的技术手段。
3.2 鲣鱼个体发育过程中的同位素变化图3显示,δ13C在30.1~40.0 cm叉长范围内有一个异常值,此δ13C对应的鲣鱼样本叉长为39 cm,假设将其划分到40.1~50.0 cm叉长组,则此值并不是异常值,因此该组异常值的出现可能是分组方法不同导致的。
本文研究结果显示,在30.0~65.0 cm叉长范围内,鲣鱼的δ13C值随叉长增加而减小,这与SAR和SAR[11]分析的地中海水域蓝鳍金枪鱼的δ13C与体重呈负相关的结论一致,说明金枪鱼在生长发育过程中,能够摄食不同来源的初始饵料。本文中所有叉长组的δ13C均值相差较小,极差为0.53‰(按照营养级富集度为1‰[15]),说明鲣鱼摄食的初始饵料来源相似。鱼类的δ13C值随其栖息水层深度的增加而增大[27],因此海洋深层的食物网比海洋表层相关食物网有较高的碳稳定同位素组成,这可能是与生物地球化学循环中二氧化碳在海洋中的溶解[28]过程有关。本文未分析δ13C随水层的分布情况,因此在今后研究中可根据不同水层鱼类的碳稳定同位素组成探究海洋相关食物网之间的关系
图4显示,δ15N值在30.1~40.0 cm、40.1~50.0 cm及50.1~60.0 cm叉长组分别有一个异常值,分析数据显示,这3个异常值对应的鲣鱼叉长分别为40.0 cm、47.0 cm和50.5 cm,均趋向于40.1~50.0 cm叉长组。假设将40.0~50.5 cm叉长组作为同一组分析,则无异常值出现,说明异常值的出现可能是分组方法不同。
本研究鲣鱼的δ15N值在30.1~40.0 cm叉长组明显较大,在30.1~50.0 cm之间出现明显下降趋势,说明鲣鱼的食性在30.1~50.0 cm之间发生一定的变化。GRAHAM等[13]研究表明,夏威夷水域FAD下方的黄鳍金枪鱼的食性发生明显变化的叉长在45.0~50.0 cm之间,BEARHOP等[17]发现金枪鱼的δ15N在45.0 cm前后发生明显变化,这些结果与本文研究结论具有一定的相似性。鱼类在生长发育过程中食性发生改变的可能原因可以从以下两个方面进行解释,一方面是生理上的变化,另一方面是由于鱼类在生长发育过程中经历不同的栖息地,使其饵料资源不同[18, 19]。本文样本来自相同水域,且δ13C分析显示所有样本的食性来源相近,因此推测鲣鱼食性的改变是生长发育过程中生理变化所致。通过分析鲣鱼性腺成熟度及50%性成熟体长可知,鲣鱼叉长40.0 cm开始性腺发育,50%性成熟叉长出现在45.4 cm,叉长50.0 cm时完全发育成熟。因此可得,叉长为30.1~50.0 cm的鲣鱼处于性腺发育的过程。成年金枪鱼与幼年金枪鱼食性有明显的不同,因为一方面成年金枪鱼较幼年同类具有较强的游泳能力及摄食能力,能够摄食较深范围水域的生物,因而摄食对象存在一定差异;另一方面GRAHAM等[13]发现成年的金枪鱼吸热能力显著增强,因此猜想吸热能力的增加可能给金枪鱼摄食范围的增加提供了便利条件,从而使得成年鲣鱼食性不同于幼年鲣鱼。
本研究发现幼年鲣鱼的δ15N较高,与SAR和SAR[11]及GRAHAM等[13]研究结论相反,可能是由于研究对象、叉长范围及水域不同所致。SAR和SAR[11]研究的是自由鱼群的蓝鳍金枪鱼,其生长发育特点不同于鲣鱼,且缺乏本文含盖的31.0~65.0 cm叉长对应的δ15N值。GRAHAM等[13]研究的虽然是FAD下的样本,但其研究水域为夏威夷水域,且研究对象为黄鳍金枪鱼,样本空胃率为19.4%。本文研究的水域为中西太平洋水域,且分析得出样本几乎是空胃(仅有一尾鲣鱼胃中含消化粘液),可见两者研究水域的饵料资源有差异。本研究水域的饵料资源状况较差,通常在饵料资源有限或者不足的情况下,成年鲣鱼在随附FAD的洄游过程中可能定期摄食到斑块状饵料[20],而幼年鲣鱼相对来说摄食能力较弱,使得空胃的时间较长。当鱼类空胃时间较长时,需要分解体内蛋白质以维持能量,而蛋白质的分解将使其组织的δ15N值显著增加[21],所以幼年鲣鱼的δ15N值偏高。
食物网基线生物氮源的时空变化能够直接影响捕食者氮的同位素值[25],因此鲣鱼摄食的位置也将影响鲣鱼的δ15N。研究发现海洋深层的饵料生物比海洋表层的相似营养级的饵料生物具有较高的δ15N值[26],同样推测其捕食者的δ15N值也有相似的特征。如果某一水域中氮源的δ15N值比较稳定,那么海洋生物的δ15N值不仅是营养位置的指标,还可以对水域中摄食栖息地的水层进行定位,因此在今后研究中应考虑不同水层的鲣鱼的δ15N值分布。
LOGAN等[12]研究发现,大西洋蓝鳍金枪鱼肌肉的C∶N值随着叉长的增加而显著增大,本研究中鲣鱼的C∶N值随着叉长的增加呈现先减小后增加的趋势,主要可能是一方面两者的研究对象不同,鲣鱼的生长速度及组织代谢速率均不同于蓝鳍金枪鱼[22, 23],因而导致其结果不同;另一方面可能是两者研究对象处于不同生长阶段使得结果有差异。本文研究的鲣鱼叉长范围为31.0~65.0 cm,而LOGAN等[12]研究的大西洋蓝鳍金枪鱼的叉长最小为60.0 cm。水生生物的C∶N不仅与C稳定同位素组成有线性关系,而且与脂质含量成线性关系[24],因此鲣鱼的C∶N值随叉长的变化可能与其在生长发育过程中脂肪含量的变化有关。在今后研究中,可利用鱼类的C∶N比值来寻求C稳定同位素组成差异及反映鱼类的身体状况。
小型金枪鱼的营养生态信息在资源评估及渔业管理中具有重要的作用,FAD鱼群的平均体长较小,小型个体的比例相对于自由鱼群较多[29, 30],因此研究FAD下小型金枪鱼的食性很有必要。本研究鲣鱼的最小叉长为31.0 cm,换算至其年龄约达到1龄[22],因而缺乏鲣鱼从0至1龄之间的食性信息。因此在今后的研究中,要加强对小叉长样本鲣鱼的收集,尤其是小于31.0 cm叉长的样本,从而能够了解鲣鱼在整个生长发育过程中的营养变化。
感谢上海开创远洋渔业公司领导对于海上调查的支持,感谢“金汇7号”全体工作人员在海上调查期间的帮助。
| [1] | FONTENEAU A, ARIZ J, GAERTNER D, et al. Observed changes in the species composition of tuna schools in the Gulf of Guinea between 1981 and 1999, in relation with the Fish Aggregating Device fishery [J]. Aquatic Living Resources, 2000, 13(4): 253-257. |
| [2] | 赵荣兴, 缪圣赐. 中西太平洋鲣鱼Katsuwonus pelamis(Linnaeus)的资源状况及产量 [J]. 现代渔业信息, 2005, 20(3): 12-14.ZHAO R X, MIU S C. Stock status and catch of skipjack Tuna Katsuwonus pelamis in the WCPO [J]. Modern Fisheries Information, 2005, 20(3): 12-14. |
| [3] | Western and Central Pacific Fisheries Commission. List of work programme of the scientific committee[C]. WCPFC-SC9-2013/GN-WP-05. Pohnpei, Federated States of Micronesia, 2013: 1-41. |
| [4] | 王少琴, 许柳雄, 王学昉, 等. 人工集鱼装置对热带金枪鱼类摄食模式的影响研究进展[J]. 生态学报, 2014, 34(13): 3490-3498.WANG S Q, XU L X, WANG X F, et al. A review of impacts of fish aggregation devices(FADs) on feeding patterns for tropical tunas [J]. Acta Ecologica Sinica, 2014, 34(13): 3490-3498. |
| [5] | 郭旭鹏, 李忠义, 金显仕, 等. 采用碳氮稳定同位素技术对黄海中南部鳀鱼食性的研究[J]. 海洋学报, 2007, 29(2): 98-104.GUO X P, LI Z Y, JIN X S, et al. Feeding habit study of Anchovy(Engraulis japonicus) in the central and southern part of the Huanghai Sea with stable isotope techniques [J]. Acta Oceanologica Sinica, 2007, 29(2): 98-104. |
| [6] | FUKUMORI K, OI M, DOI H, et al. Food sources of the pearl oyster in coastal ecosystems of Japan: evidence from diet and stable isotope analysis [J]. Estuarine, Coastal and Shelf Science, 2008, 76(3):704-709. |
| [7] | POTIER M, SABATÉ R, MÉNARD F, et al. Preliminary results of tuna diet studies in the West equatorial Indian Ocean[C]. Proceedings of the 3rd session of the IOTC working party on tropical tunas. Seychelles, 2001, 4: 273-278. |
| [8] | MÉNARD F, STÉQUERT B, RUBIN A, et al. Food consumption of tuna in the Equatorial Atlantic ocean: FAD-associated versus unassociated schools[J]. Aquatic Living Resources, 2000, 13(4): 233-240. |
| [9] | 王学昉. 漂流人工集鱼装置对中西太平洋鲣鱼生态影响的评估[D]. 上海: 上海海洋大学, 2013.Wang X F. Evaluation of Ecological Impacts of Drifting Fish Aggregation Devices(FADs) on Skipjack Katsuwonus pelamis in the Western and Central Pacific Ocean[D]. Shanghai: Shanghai Ocean University, 2013. |
| [10] | 李忠义, 金显仕, 庄志猛, 等. 稳定同位素技术在水域生态系统研究中的应用 [J]. 生态学报, 2005, 25(11): 3052-3060.LI Z Y, JIN X S, ZHUANG Z M, et al. Applications of stable isotope techniques in aquatic ecological studies [J]. Acta Ecologica Sinica, 2005, 25(11): 3052-3060. |
| [11] | SARÁ G, SARÁ R. Feeding habits and trophic levels of bluefin tuna Thunnus thynnus of different size classes in the Mediterranean Sea [J].Journal of Applied Ichthyology,2007, 23(2): 122-127. |
| [12] | LOGAN J M, RODRÍGUEZ-MARÍN E, GOŇI N, et al. Diet of young Atlantic bluefin tuna(Thunnus thynnus) in eastern and western Atlantic foraging grounds [J].Marine Biology, 2011, 158(1): 73-85. |
| [13] | GRAHAM B S, GRUBBS D, HOLLAND K, et al. A rapid ontogenetic shift in the diet of juvenile yellowfin tuna from Hawaii [J].Marine Biology,2007, 150(4): 647-658. |
| [14] | PETERSON B J, FRY B. Stable isotopes in ecosystem studies [J]. Annual Review of Ecology and Systematics, 1987,18:293-320. |
| [15] | 金波昌, 董双林, 田相利, 等. 人工饲料对刺参幼参生长贡献的碳稳定同位素法分析 [J]. 水产学报, 2013, 37(2): 269-274.JIN B C, DONG S L, TIAN X L, et al. Using carbon stable isotope ratio(δ13C) to evaluate contribution of artificial feeds to growth of pond cultured juvenile sea cucumber Apostichopus japonicas(Selenka) [J]. Journal of Fisheries of China, 2013, 37(2): 269-274. |
| [16] | 李建华, 李云凯, 陈新军, 等. 头足类硬组织的稳定同位素研究进展 [J]. 上海海洋大学学报, 2014, 23(1): 154-160.LI J H, LI Y K, CHEN X J, et al. Review on stable isotope in hard issues of cephalopods [J]. Journal of Shanghai Ocean University, 2014, 23(1): 154-160. |
| [17] | BEARHOP S, ADAMS C E, WALDRON S, et al. Determining trophic niche width: a novel approach using stable isotope analysis [J]. Journal of Animal Ecology, 2004, 73(5):1007-1012. |
| [18] | LIVINGSTON R J. Trophic organization of fishes in a coastal seagrass system[J]. Marine Ecology-Progress Series, 1982, 7: 1-12. |
| [19] | WERNER E E, GILLIAM J F. The ontogenetic niche and species interactions in size-structured populations[J]. Annual Review of Ecology and Systematics, 1984, 15: 393-425. |
| [20] | ESTRADA J A, LUTCAVAGE M, THIRROLD S R. Diet and trophic position of Atlantic bluefin tuna(Thunnus thynnus) inferred from stable carbon and nitrogen isotope analysis[J]. Marine Biology, 2005, 147(1): 37-45. |
| [21] | HOBSON K A, ALISAUSKAS R T, CLARK R G. Stable-nitrogen isotope enrichment in avian tissues due to fasting and nutritional stress: Implications for isotopic analyses of diet[J]. The Condor, 1993, 95(2): 388-394. |
| [22] | 王学昉, 许柳雄, 朱国平, 等. 中西太平洋鲣鱼的年龄鉴定和生长特性[J]. 应用生态学报, 2010, 21(3): 756-762.WANG X F, XU L X, ZHU G P, et al. Age identification and growth characteristics of Katsuwonus pelamis in western and central Pacific Ocean[J]. Chinese Journal of Applied Ecology, 2010, 21(3): 756-762. |
| [23] | MILATOU N, MEGALOFONOU P. Age structure and growth of bluefin tuna(Thunnus thynnus, L.) in the capture-based aquaculture in the Mediterranean Sea[J]. Aquaculture, 2014, 424-425: 35-44. |
| [24] | POST D M, LAYMAN C A, ARRINGTON D A, et al. Getting to the fat of the matter: models, methods and assumptions for dealing with lipids in stable isotope analyses[J]. Oecologia, 2007, 152(1): 179-189. |
| [25] | O'REILLY C M, HECKY R E, COHEN A S, et al. Interpreting stable isotopes in food webs: recognizing the role of time averaging at different trophic levels[J]. Limnology and Oceanography, 2002, 47(1): 306-309. |
| [26] | RAU G H, HEYRAUD M, CHERRY R D. 15N/14N and 13C/12C in mesopelagic shrimp from the Northeast Atlantic Ocean: evidence for differences in diet[J]. Deep Sea Research Part A: Oceanographic Research Papers, 1989, 36(7): 1103-1110. |
| [27] | 颜云榕, 张武科, 卢伙胜, 等. 应用碳、氮稳定同位素研究北部湾带鱼(Trichiurus lepturus)食性及营养级[J]. 海洋与湖沼, 2012, 43(1): 192-200.YAN Y R, ZHANG W K, LU H S, et al. Using stable isotopes to analyze feeding habits and trophic position of Hairtail(Trichiurus lepturus) from the Beibu gulf, South China Sea[J]. Oceanologia et Limnologia Sinica, 2012, 43(1): 192-200. |
| [28] | FRANCE R L. Carbon-13 enrichment in benthic compared to planktonic algae: foodweb implications[J]. Inter-Research Marine Ecology Progress Series, 1995, 124: 307-312. |
| [29] | 许柳雄, 王学昉, 朱国平, 等. 中西太平洋金枪鱼围网流木鱼群中鲣鱼种群结构分析[J]. 生态学杂志, 2009, 28(2): 293-299.XU L X, WANG X F, ZHU G P, et al. Stock structure of skipjack tuna(Katsuwonus pelamis) from the log school by purse seine in the Western and Central Pacific Ocean[J]. Chinese Journal of Ecology, 2009, 28(2): 293-299. |
| [30] | 许柳雄, 王学昉, 朱国平, 等. 中西太平洋金枪鱼围网鲣鱼起水鱼群种群结构分析[J]. 海洋湖沼通报, 2010(2): 22-28.XU L X, WANG X F, ZHU G P, et al. Analysis on stock structure of free swimming Skipjack tuna(Katsuwonus pelamis) school caught by china tuna purse seine in the Western and Central Pacific Ocean[J]. Transactions of Oceanology and Limnology, 2010(2): 22-28. |
2. Ministry of Education Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Shanghai Ocean University, Shanghai 201306, China;
3. National Engineering Research Center for Oceanic Fisheries, Ministry of Education, Shanghai 201306, China;
4. Collaborative Innovation Center for National Distant-water Fisheries of Shanghai, Shanghai 201306, China
 2015, Vol. 24
2015, Vol. 24


