2. 中国水产科学研究院黄海水产研究所 农业部海洋渔业可持续发展重点实验室, 山东 青岛 266071;
3. 中国水产科学研究院南海水产研究所 农业部水产品加工重点实验室, 广东 广州 510300
P-糖蛋白(P-glycoprotein,P-gp)是一种属于ATP依赖型(ATP-binding cassettes,ABC)转运蛋白超家族的膜蛋白,最早于1976年在中国仓鼠卵巢中发现,其主要作用是将药物或其他有害物质排出细胞,防止机体对有害物质的吸收和介导有害物质的排出[1, 2]。通过基因敲除的方法进一步证实了P-gp对药物的外排作用,P-gp基因缺失的小鼠,静脉注射及口服紫杉醇后,代表体内药物总量的曲线下面积(AUC)比野生型高出2倍和6倍[3]。
研究表明,水产动物P-gp也具有与哺乳动物P-gp类似的功能,胡鲲等[4]发现恩诺沙星在尼罗罗非鱼(Oreochomis niloticus)体内的残留量与肠道内P-gp mRNA的相对表达量存在着相关性,恩诺沙星残留量越高,P-gp的表达量越高,P-gp介导的对药物的外排作用越强;KENNEDY等[5]研究表明P-gp抑制剂环孢素A可增强虹鳟(Oncorhynchus mykiss)血脑屏障对神经毒素的渗透性,从而影响其游泳行为;孙雪峰等[6]通过添加P-gp抑制剂维拉帕米,证实虾夷马粪海胆(Strongylocentyotus internedius)胚胎P-gp可外排灭蝇胺和杀虫丹,降低其毒害程度。
然而,关于水产甲壳动物P-gp的研究还未见报道。甲壳动物P-gp在药物外排中是否也起关键的作用?目前尚未见关于甲壳动物P-gp基因序列公布,本研究将以近交系脊尾白虾(Exopalaemon carinicauda)为实验动物,通过添加P-gp抑制剂维拉帕米,研究维拉帕米对常用抗菌药物恩诺沙星及其代谢物环丙沙星外排的影响,进而探讨甲壳动物P-gp对药物的外排作用,以期为恩诺沙星在甲壳动物中的残留控制提供新的思路。
1 材料与方法 1.1 实验材料 1.1.1 实验动物健康脊尾白虾为全人工培育获得近交家系F2,饲养于黄海水产研究所水生生物实验室,无用药史,体重(2.06±0.55) g。正式实验前各处理组虾布置于200 L PVC桶内,暂养2周,水温(18.1±0.5) ℃,盐度31.2,pH 8.1,连续充气。
1.1.2 药品与试剂恩诺沙星标准品(纯度≥98.0%,批号93106-60-6),由Sigma公司生产;环丙沙星标准品(纯度≥98.0%,批号93106-60-6)由Sigma公司生产;盐酸维拉帕米(进口注册号H20030483),由Abbott Gmbh & Co. KG 公司生产;乙腈为色谱纯,正己烷、85%磷酸、三乙胺、二氯甲烷为分析纯。
1.1.3 实验仪器实验仪器包括Agilent1200型高效液相色谱仪,荧光检测器,自动进样器,Agilent TC-C18色谱柱(4.6×250 mm,5 μm),Eppendorf高速离心机,FJ-200高速分散均质机,HSC-24B水浴加热氮吹仪。
1.2 实验方法 1.2.1 分组与取样对照组投喂自制恩诺沙星药饵,每天给药剂量为10 mg/kg体重,每天分两次投喂,投喂时间为8:00和20:00,连续投喂7 d,每次摄食后30 min将剩余饵料吸除,每天更换90%新水,水质条件与暂养时相同。在最后一次投饵后开始计时,分别于1、2、3、5、7、10、15、20、25 d取样,每个时间点取15尾虾,每3尾虾作为一个样品,取每尾虾0.5 g肌肉、全部肝胰腺和鳃放入离心管,-20 ℃保存。另取未投喂药饵的虾各组织,作为空白样品。
维拉帕米组恩诺沙星药饵投喂同对照组,同时在水体中加入维拉帕米溶液,溶液浓度设置参考文献[7, 8, 9]及前期预实验确定,维持在0.4 mg/L,连续药浴7天,每天更换90%新药浴液,同时吸除残饵粪便。取样同对照组。
1.2.2 样品处理与检测条件用液氮先将每份样品磨碎,然后准确取粉末状的肌肉1.0 g、肝胰腺0.2 g和鳃0.1 g于15 mL离心管中,分别加入2 mL乙腈,用高速分散器匀浆,再用2 mL乙腈清洗刀头,合并提取液,充分振荡,5 000 r/min离心10 min,取上清液,40 ℃水浴氮气吹干。肌肉、肝胰腺和鳃残渣分别用1 mL、0.2 mL和0.1 mL流动相溶解,然后分别加1 mL正己烷以除去脂肪、色素等杂质,充分混匀,静置后去除上层含有脂肪、色素的有机层,下层溶液用0.22 μm滤膜过滤后进行高效液相色谱测定。
检测条件流动相,V(乙腈)∶V(磷酸)(0.01 mol/L,用三乙胺调至pH 3.4) =80∶20;激发波长280 nm,发射波长460 nm;柱温30 ℃;流速1.0 mL/min;自动进样,进样量10 μL。
1.2.3 标准曲线与最低检测限准确称取恩诺沙星和环丙沙星标准品各0.01 g,用适量NaOH溶液助溶,然后用流动相定容至200 mL,配成50 μg/mL的母液,再依次用流动相稀释成2.00、1.00、0.10、0.02、0.005 μg/mL的标准溶液,0.22 μm滤膜过滤后用HPLC进行检测,以峰面积为纵坐标,浓度为横坐标做标准曲线,恩诺沙星标准曲线方程为y=1086.3x-0.9343(R2=1.000 0),环丙沙星标准曲线方程为y=711.97x+0.1024(R2=0.999 8)。
取不同组织空白样品,每个样品3个重复,分别加入不同浓度的标准溶液,通过比较含已知低浓度样品与空白样品的测试信号,以3倍噪音量为最低检测限,本方法恩诺沙星和环丙沙星的最低检测限均为0.005 μg/g。
1.2.4 数据处理各组织中的恩诺沙星和环丙沙星浓度根据标准曲线方程计算,然后换算成每克组织中含药量,根据组织药物浓度用DAS 2.0软件分析统计矩参数。实验数据采用SPSS 16.0软件中单因子方差分析(one-way ANOVA)进行比较。
2 结果 2.1 脊尾白虾3种组织中恩诺沙星及其代谢物环丙沙星浓度变化 2.1.1 脊尾白虾3种组织中恩诺沙星浓度变化如图1所示,在最后一次投饵后的第1天,恩诺沙星在脊尾白虾肝胰腺、肌肉和鳃中均达到了最高浓度,且在肝胰腺中的药物浓度最高,肌肉次之,在鳃中的药物浓度最低。3种组织中的药物浓度均随时间呈规律性递减,但维拉帕米组各组织中的药物浓度始终高于对照组(P<0.05)。
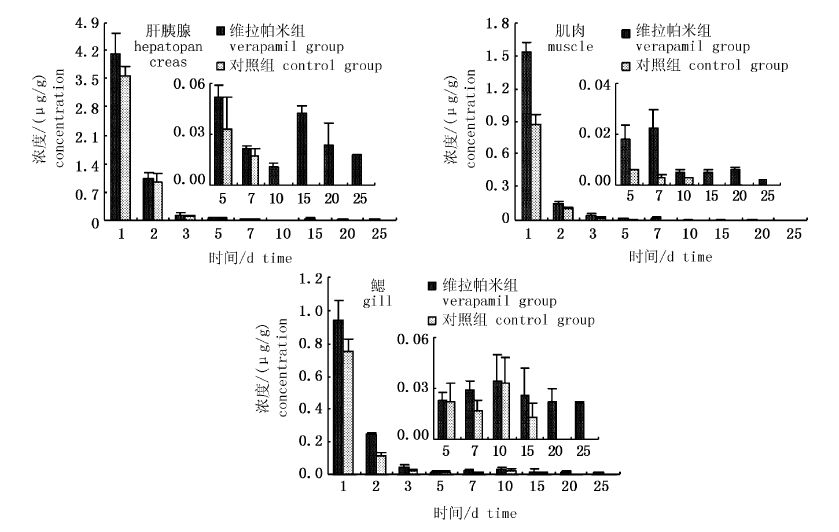
|
图1 脊尾白虾3种组织中恩诺沙星浓度变化 Fig.1 The concentration of enrofloxacin in tissues of Exopalaemon carinicauda |
在最后一次投饵后的第1天,在各组织中均检测到了恩诺沙星代谢物环丙沙星,且在肝胰腺中的浓度显著高于在肌肉和鳃中的浓度(P<0.05,图2)。同时也可看出,在肌肉和鳃中环丙沙星浓度随着时间的延长逐渐递减,且维拉帕米组的药物浓度显著低于对照组(P<0.05);在肝胰腺中,维拉帕米组和对照组环丙沙星浓度变化趋势相似,都呈多峰现象,除15和25天,在其他时间点对照组环丙沙星浓度均显著高于维拉帕米组(P<0.05)。
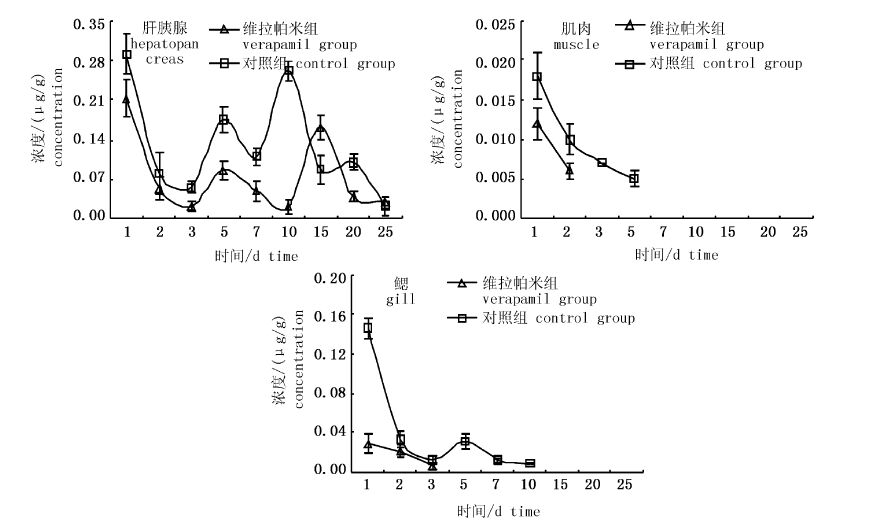
|
图2 脊尾白虾3种组织中环丙沙星浓度变化 Fig.2 The concentration of ciprofloxacin in tissues of Exopalaemon carinicauda |
如表1所示,在肝胰腺、肌肉和鳃中,维拉帕米组恩诺沙星的AUC比对照组分别增加了0.27倍、0.53倍、0.54倍,差异显著(P<0.05);而β比对照组分别减小了90.58%、74.66%、72.73%,CL比对照组分别降低了64.50%、35.17%、54.33%,差异显著(P<0.05);t1/2β比对照组分别增加了9.7倍、2.9倍、2.7倍,差异显著(P<0.05)。
| 表1 脊尾白虾3种组织中恩诺沙星及其代谢物环丙沙星统计矩参数 Tab 1. Statistical moment parameters of enrofloxacin and its metabolite ciprofloxacin in Exopalaemon carinicauda |
与对照组相比,维拉帕米组肝胰腺中环丙沙星的AUC为对照组的56.43%,恩诺沙星转化为环丙沙星的百分比仅为对照组的57.10%,肝胰腺中环丙沙星的β和CL显著小于对照组(P<0.05)。
维拉帕米组和对照组鳃中恩诺沙星及其代谢物环丙沙星的AUC最小,但CL却显著高于其他组织(P<0.05)。
3 讨论 3.1 维拉帕米对恩诺沙星在脊尾白虾体内代谢的影响药物在机体内的转化首先通过细胞色素P450 (CYP450) 混合功能氧化酶系统催化I相反应,包括环氧化反应、N-脱烷基反应、O-脱烷基反应、N-氧化反应、脱卤素反应等[10]。恩诺沙星在体内的代谢属于典型的N-脱烷基反应,主要通过肝脏细胞色素P450酶催化脱乙基后转化为环丙沙星[11]。恩诺沙星在水产动物体内代谢为环丙沙星的百分率较低,一般低于5%,如在中国对虾(Fenneropenaeus chinensis)体内恩诺沙星的转化率只有1.2%,在金头鲷(Sparus aurata)中则检测不到环丙沙星;而在陆生动物如羊、猪、马、牛等体内恩诺沙星的转化率为35%~55%[12, 13, 14]。因此,恩诺沙星在不同物种间代谢为环丙沙星的百分率差异较大,特别是水产动物易受环境变化影响,如大菱鲆(Scophthalmus maximus)在16 ℃和10 ℃水温下恩诺沙星代谢为环丙沙星的百分率分别为2.04%和1.84%[13]。本研究结果显示,在水温18.1℃条件下,恩诺沙星经药饵给药后,在脊尾白虾3种组织中均检测到了环丙沙星,且在肝胰腺中的浓度最高,说明脊尾白虾可通过肝胰腺P450酶系将恩诺沙星代谢为环丙沙星,与方星星、TANG等[12, 15]研究结果一致。同时,维拉帕米组各组织中恩诺沙星的AUC显著高于对照组而环丙沙星的浓度和AUC显著低于对照组,恩诺沙星转化为环丙沙星的百分比仅为对照组的57.10%。这是由于P-gp和P450之间相互作用密切,且底物、诱导剂和抑制剂存在交叉性,维拉帕米既是P-gp和P450的底物,同时也是二者的抑制剂[16, 17],推测维拉帕米抑制了脊尾白虾P450酶的活性,从而表现出恩诺沙星转化为环丙沙星的百分率下降。
脊尾白虾肝胰腺内环丙沙星浓度变化呈多峰现象,在罗氏沼虾(Macrobrachium rosenbergii)、中华绒螯蟹(Eriocheir sinensis)、欧洲鳗鲡(Anguilla anguilla)等[18, 19, 20]水产动物体内环丙沙星也有相似的变化趋势。这可能是由于药物进入机体以后始终处于一种动态变化,当游离的恩诺沙星浓度降低时,组织中蛋白结合药物便会解离为游离的恩诺沙星,游离的恩诺沙星在肝P450酶的催化作用下再次生成环丙沙星,因而环丙沙星浓度变化呈现出多峰现象。
3.2 维拉帕米对恩诺沙星及其代谢物环丙沙星消除的影响维拉帕米是一种钙通道阻断剂,被广泛应用于临床治疗心血管疾病,作为P-gp的底物,可竞争性地结合P-gp,使抗癌药物外排减少[21]。如维拉帕米可使人胃癌耐药细胞P-gp表达降低,细胞对丝裂霉素、替加氟等药物的敏感性明显增加[22]。当威斯塔鼠以25 mg/kg体重剂量口服维拉帕米2 h后再口服伊立替康,与单独服用伊立替康相比,AUC增加了3.4倍,Cmax增加了2.7倍,t1/2β增加了0.9倍,CL降低了84%[23]。SJÖGREN等[24]研究也表明,当给猪同时服用维拉帕米和非索非那丁后,与单独服用非索非那丁相比,血液AUC增加了0.5倍,肾脏对非索非那丁的清除率减少了61%,胆囊汁对非索非那丁的清除率减少了53%。
近年来,关于水产动物P-gp也逐渐成为研究热点,主要通过添加抑制剂研究P-gp的外排功能。孙雪峰等[6]报道,当海胆胚胎暴露在添加维拉帕米的灭蝇胺、杀虫丹溶液中,与单独暴露在灭蝇胺、杀虫丹中相比,LC50降低了40%~42%,并通过分子模拟证实灭蝇胺和杀虫丹为P-gp的底物。HUANG等[25]研究显示,当翡翠贻贝(Perna viridis)暴露在利玛原甲藻中P-gp活性显著增加,而当添加维拉帕米后活性却显著降低,说明翡翠贻贝P-gp在毒素外排中起到重要作用。在获得菲律宾蛤仔(Ruditapes philippinarum)P-gp基因部分序列的基础上,潘鲁青等[26]将菲律宾蛤仔暴露在不同浓度四溴联苯醚中,发现各处理组鳃P-gp基因表达量显著高于对照组,提示菲律宾蛤仔P-gp参与了毒物的外排过程。
许多研究证实,P-gp的底物也包括抗菌谱广的喹诺酮类药物。CORMET-BOYAKA等[27]研究发现,维拉帕米能显著提高司帕沙星在Caco-2细胞中的蓄积量。董玲玲[28]研究结果显示,当用维拉帕米处理后,能显著促进猪对恩诺沙星的吸收速度,表现为吸收速率常数、达峰时间极显著低于恩诺沙星对照组和AUC显著高于恩诺沙星对照组,并在基因表达水平证实恩诺沙星为P-gp的底物。胡鲲等[4]进一步研究显示,尼罗罗非鱼P-gp基因的表达与恩诺沙星的摄入及其代谢过程紧密相关,P-gp的表达量越高,P-gp对恩诺沙星的外排作用越强。DAUTREY等[29]用大鼠作为研究对象,结果表明,当环丙沙星与维拉帕米联合给药时,环丙沙星的AUC显著提高,胆汁和肠道清除率显著下降。本实验结果显示,维拉帕米组恩诺沙星在各组织中的AUC、Cmax和t1/2β均比对照组显著增加,同时恩诺沙星及其代谢物环丙沙星的β和CL均比对照组显著降低。说明维拉帕米可减缓脊尾白虾体内恩诺沙星及其代谢物环丙沙星的外排速率,在脊尾白虾体内,推测P-gp可主动将恩诺沙星或环丙沙星从细胞内转运到细胞外,减少药物在体内的残留。由于目前尚未获得脊尾白虾P-gp基因序列,关于脊尾白虾P-gp对恩诺沙星等药物外排的直接证明还有待进一步完善。
| [1] | BUSS D S, CALLAGHAN A. Interaction of pesticides with P-glycoprotein and other ABC proteins: A survey of the possible importance to insecticide, herbicide and fungicide resistance [J]. Pesticide Biochemistry and Physiology, 2008, 90(3): 141-153. |
| [2] | KIM J H, CHOI A R, KIM Y K, et al. Co-treatment with the anti-malarial drugs mefloquine and primaquine highly sensitizes drug-resistant cancer cells by increasing P-gp inhibition [J]. Biochemical and Biophysical Research Communications, 2013, 441(3): 655-660. |
| [3] | 苏成业. P-糖蛋白在药物代谢动力学中的作用及其临床意义[J]. 药学学报, 2005, 40(8): 673-679.SU C Y. Role of P-glycoprotein in pharmacokinetics and its clinical implications [J]. Acta Pharmaceutica Sinica, 2005, 40(8): 673-679. |
| [4] | 胡鲲, 程钢, 吕利群, 等. 基于P-糖蛋白基因表达评价尼罗罗非鱼体内恩诺沙星代谢"首过效应"[J]. 中国水产科学, 2013, 20(2): 411-418.HU K, CHENG G, LV L Q, et al. Association between permeability glycoprotein expression and enrofloxacin metabolism to evaluate the first-pass effect in Oreochomis niloticus Linn. Journal of Fishery Sciences of China, 2013, 20(2): 411-418. |
| [5] | KENNEDY C J, TIERNEY K B, MITTELSTAD T M, et al. Inhibition of P-glycoprotein in the blood-brain barrier alters avermectin neurotoxicity and swimming performance in rainbow trout [J]. Aquatic Toxicology, 2014, 146: 176-185. |
| [6] | 孙雪峰, 丁君, 黄洪辉, 等. 海胆胚胎不同发育期P-糖蛋白(P-glycoprotein)药物外排功能的研究[J]. 生态毒理学报, 2009, 4(3): 428-434.SUN X F, DING J, HUANG H H, et al. Study of drug-efflux function of p-glycoprotein in different developmental stages of sea urchin embryos [J]. Asian Journal of Ecotoxicology, 2009, 4(3): 428-434. |
| [7] | EPEL D, COLE B, HAMDOUN A, et al. The sea urchin embryo as a model for studying efflux transporters: roles and energy cost [J]. Marine Environmental Research, 2006, 62(1/2): S1-S4. |
| [8] | OVERTURF M D, OVERTURF C L, BAXTER D, et al. Early life-stage toxicity of eight pharmaceuticals to the fathead minnow, Pimephales promelas [J]. Archives of Environmental Contamination and Toxicology, 2012, 62(3): 455-464. |
| [9] | STEINBACH C, FEDOROVA G, PROKES M, et al. Toxic effects, bioconcentration and depuration of verapamil in the early life stages of common carp (Cyprinus carpio L.) [J]. Science of the Total Environment, 2013, 461: 198-206. |
| [10] | 王广基. 药物代谢动力学[M]. 北京: 化学工业出版社, 2005: 50-60.WANG G J. Pharmacokinetics [M]. Beijing: Chemical Industry Press, 2005: 50-60. |
| [11] | VANCUTSEM P M, BABISH J G, SCHWARK W S. The fluoroquinolone antimicrobials: structure, antimicrobial activity, pharmacokinetics, clinical use in domestic animals and toxicity [J]. The Cornell Veterinarian, 1990, 80(2):173-186. |
| [12] | 方星星, 王群, 李健. 恩诺沙星及其代谢物环丙沙星在中国对虾体内的药代动力学[J]. 水产学报, 2004, 28(s): 35-41.FANG X X, WANG Q, LI J. Pharmacoknetics of enroflxacin and its metabolite ciprofloxacin in Fenneropenaeus chinensis [J]. Journal of Fisheries of China, 2004, 28(s): 36-41. |
| [13] | LIANG J P, LI J, ZHAO F Z, et al. Pharmacokinetics and tissue behavior of enrofloxacin and its metabolite ciprofloxacin in turbot Scophthalmus maximus at two water temperatures [J]. Chinese Journal of Oceanology and Limnology, 2012, 30(4): 644-653. |
| [14] | ROCCA G D, SALVO A D, MALV ISI J, et al. The disposition of enrofloxacin in seabream (Sparus aurata L.) after single intravenous injection or from medicated feed administration [J]. Aquaculture, 2004, 232(1): 53-62. |
| [15] | TANG J, YANG X L, ZHENG Z L, et al. Pharmacokinetics and the active metabolite of enrofloxacin in Chinese mitten-handed crab (Eriocheir sinensis) [J]. Aquaculture, 2006, 260(1/4): 69-76. |
| [16] | WACHER V J, WU C Y, BENET L Z. Overlapping substrate specificities and tissue distribution of cytochrome P450 3A and P-glycoprotein: implications for drug delivery and activity in cancer chemotherapy [J]. Molecular Carcinogenesis, 1995, 13(3): 129-134. |
| [17] | SHUFENG Z, CHAN S Y, GOH B C, et al. Mechanism-based inhibition of cytochrome P4503A4 by therapeutic drugs [J]. Clinical Pharmacokinetics, 2005, 44(3): 279-304. |
| [18] | 钱云云, 唐俊, 郑宗林, 等. 恩诺沙星在罗氏沼虾体内的药物代谢动力学[J]. 动物学杂志, 2007, 42(5): 62-69.QIAN Y Y, TANG J, ZHENG Z L, et al. Pharmacokinetics of enrofloxacin in Macrobrachium rosenbergii [J]. Chinese Journal of Zoology, 2007, 42(5): 62-69. |
| [19] | 吴光红, 张静波, 孟勇, 等. 不同水温下恩诺沙星在中华绒螯蟹体内药物代谢动力学[J]. 南京农业大学学报, 2008, 31(2): 105-110.WU G H, ZHANG J B, MENG Y, et al. Pharmacokinetics of enrofloxacin in the Chinese mitten-handed crab, Eriocheir sinensis, at three water temperatures [J]. Journal of Nanjing Agricultural University, 2008, 31(2): 105-110. |
| [20] | 房文红,于慧娟, 蔡友琼, 等. 恩诺沙星及其代谢物环丙沙星在欧洲鳗鲡体内的代谢动力学[J]. 中国水产科学, 2007, 14(4): 622-629.FANG W H, YU H J, CAI Y Q, et al. Pharmacokinetics of enrofloxacin and its metabolite ciprofloxacin in European eel (Anguilla anguilla) after a single oral gavage [J]. Journal of Fishery Sciences of China, 2007, 14(4): 622-629. |
| [21] | 康恺, 李运曼. P-糖蛋白抑制剂的研究进展[J]. 药学进展, 2004, 28(9): 405-408.KANG K, LI Y M. Advances in Inhibitor of P-Glycoprotein [J]. Progress in Pharmaceutical Sciences, 2004, 28(9): 405-408. |
| [22] | 张敏娟, 张庆瑜, 康春生, 等. 维拉帕米逆转胃癌细胞系SGC7901/VCR 多药耐药性的研究[J]. 国际消化病杂志, 2008, 28(2): 166-168.ZHANG M J, ZHANG Q Y, KANG C S, et al. Reversal of multidrug resistance in drug-resistant human gastric cancer cell line SGC7901/VCR by verapamil [J]. International Journal of Digestive Diseases, 2008, 28(2): 166-168. |
| [23] | BANSAL T, MISHRA G, JAGGI M, et al. Effect of P-glycoprotein inhibitor, verapamil, on oral bioavailability and pharmacokinetics of irinotecan in rats [J]. European Journal of Pharmaceutical Sciences, 2009, 36(4): 580-590. |
| [24] | SJÖGREN E, HEDELAND M, BONDESSON U, et al. Effects of verapamil on the pharmacokinetics and hepatobiliary disposition of fexofenadine in pigs [J]. European Journal of Pharmaceutical Sciences, 2014, 57: 214-223. |
| [25] | HUANG L, WANG J, CHEN W C, et al. P-glycoprotein expression in Perna viridis after exposure to Prorocentrum lima, a dinoflagellate producing DSP toxins [J]. Fish & Shellfish Immunology, 2014, 39(2): 254-262. |
| [26] | 潘鲁青, 宫晓莉, 许超群, 等. 四溴联苯醚对菲律宾蛤仔组织解毒代谢基因表达的影响[J]. 中国水产科学, 2012, 19(2): 294-300.PAN L Q, GONG X L, XU C Q, et al. Effects of tetrabromodiphenyl ether (BDE-47) on the metabolic gene expression in the gills and digestive glands of Ruditapes philippinarum [J]. Journal of Fishery Sciences of China, 2012, 19(2): 294-300. |
| [27] | CORMET-BOYAKA E, HUNEAU J F, MORDRELLE A, et al. Secretion of sparfloxacin from the human intestinal Caco-2 cell line is altered by P-glycoprotein inhibitors [J]. Antimicrobial Agents and Chemotherapy, 1998, 42(10): 2607-2611. |
| [28] | 董玲玲. P-糖蛋白在猪肝脏、肾脏和肠组织中的表达及对口服恩诺沙星药动学的影响[D]. 南京:南京农业大学, 2012: 53-67.DONG L L. Expression of p-gp in liver, kidney and intestines of piglet and its role in pharmacokinetics of oral enrofloxacin in piglet [D]. Nanjing: Nanjing Agricultural University, 2012: 53-67. |
| [29] | DAUTREY S, FELICE K, PETIET A, et al. Active intestinal elimination of ciprofloxacin in rats: modulation by different substrates [J]. British Journal of Pharmacology, 1999, 127(7): 1728-1734. |
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, Shandong, China;
3. Key Laboratory of Aquatic Product Processing, Ministry of Agriculture, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, Guangdong, China
 2015, Vol. 24
2015, Vol. 24


