随着生活水平的提高,人们对水产品的消费逐年增加,水产品加工产生的下脚料也越来越多,包括鱼头、鱼皮、鱼鳍、鱼尾、鱼内脏、鱼骨、鱼胆、鱼鳔等,其重量约占原料鱼的40%~55%。这类下脚料大部分仅作为饲料原料被低值利用,甚至被废弃,不仅污染环境,还造成了资源的浪费 [1, 2, 3]。其实这类下脚料仍含有丰富的蛋白质、脂类、无机盐等成分,营养价值较高[4, 5],经过发酵之后可以将营养物质分解为植物可以吸收利用的小分子氮、碳、磷、钾等物质。
目前,用于发酵动物废弃物的菌种主要有霉菌、酵母菌、细菌3大类,常用菌种有曲霉、酵母菌、乳酸菌和芽孢菌等[6]。在生物有机肥中,肥料中含有的功能菌会促进土壤中矿物营养元素的吸收,从而促进植物生长。目前,研究比较多的功能菌主要是固氮菌、解磷菌和解钾菌。固氮菌包括共生固氮菌、联合固氮菌和自生固氮菌;解磷菌研究比较多的是假单胞菌和巨大芽胞杆菌;解钾菌有扭脱芽胞杆菌、胶质芽胞杆菌、环状芽胞杆菌等[7, 8, 9]。这3种菌相互之间没有抑制作用或只有微弱的抑制作用[10]。本文从已分离到的44株菌中,通过单一发酵、拮抗协同和解磷解钾固氮实验,筛选出能较好分解水产下脚料营养的菌株,并对其进行生理生化及分子生物学鉴定。
1 材料与方法 1.1 材料 1.1.1 菌种来源从市售微生物肥料、土壤、腐败的鱼体中分离到44株菌,保存于本实验室。
1.1.2 试验材料试验过程中需要的培养基有,营养肉汤培养基、PDA培养基、高氏一号培养基、营养琼脂培养基、有机磷培养基、无机磷培养基、阿须贝培养基和硅酸盐培养基。
发酵所用水产下脚料由岱山绿康源海洋生物技术有限公司提供。
1.1.3 主要试剂、仪器主要试剂包括:API条带(API20NE用于假单胞菌、食酸菌,API20AUX用于酵母菌)、浓硫酸、硫酸铜、硫酸钾、17%硫酸溶液、酒石酸锑钾和钼酸铵溶液。
主要仪器有:Kjeltec 8400全自动凯氏定氮仪、722G可见分光光度计和光学显微镜。
1.2 菌种筛选 1.2.1 单一发酵实验将块状下脚料与水按1∶4比例装入250 mL的锥形瓶中,每瓶10 g下脚料。121 ℃ 灭菌20 min。同时,将筛选得到的44株菌分别接种到相应的液体培养基,于30 ℃、140 r/min条件下活化24 h,将活化后的菌液按5%(体积比)分别接种到相应的液体培养基中进行扩大培养,30 ℃、140 r/min 、培养18 h制成发酵种子液。后将发酵种子液均以5%的比例分别接入各发酵底物中,于30 ℃ 静止发酵7 d(自然pH)。每天观察下脚料分解情况,发酵周期结束后对发酵效果显著的发酵液进行氮、磷、碳含量测定。
发酵液氮含量的测定方法为,将发酵液过真空泵得滤液,取5 mL滤液、15 mL浓硫酸、0.5 g硫酸铜、3.5 g硫酸钾,经240 ℃碳化、420 ℃消化、冷却得到待测样品,经全自动凯氏定氮仪直接得出总氮含量。
总磷、有机碳(有机质)的测定方法按照文献[11, 12]进行测定。
1.2.2 解磷解钾固氮实验将44种菌分别接种至有机磷、无机磷、阿须贝、硅酸盐培养基中,于30 ℃ 下培养5 d,观察菌种生长情况。
1.2.3 拮抗协同实验将上述发酵效果良好及具备解磷解钾固氮能力的菌株两两交叉划线至营养琼脂培养基,于30 ℃ 下培养5 d,观察交叉处菌种生长情况。
1.3 菌种鉴定 1.3.1 形态学鉴定细菌进行革兰氏染色观察,真菌、放线菌进行插片法观察[13]。
1.3.2 生理生化鉴定将筛选得到的菌种进行API生理生化实验,细菌、放线菌置于30 ℃条件下分别于24 h、48 h观察API条带反应情况。真菌置于30 ℃条件下分别于48 h、72 h观察API条带反应情况。
1.3.3 分子生物学鉴定细菌扩增引物为27F:5′-AGAGTTTGATCCT GGCTCAG-3′,1492R: 5′ - GGTTACCTTGTTACG ACTT-3′,反应体系(25 μL):10×Tap Buffer with KCl 2.5 μL,MgCl2(25 μmol/L)2.5 μL,dNTP(25 μmol/L)2.0 μL,TapDNA 聚合酶(5 U/mL)0.5 μL,ddH2O 14.5 μL,引物各1 μL。PCR反应条件:95 ℃预变性 5 min,94 ℃高温变性 1 min,58.5 ℃退火0.5 min,72 ℃延伸2 min,共35个循环,72 ℃延伸10 min。
真菌扩增引物为Seq Forward Primer:5′-CGCCAGGGTTTTCCCAGTCACGAC-3′,Seq Reverse Primer:5′-GAGCGGATAACAATTTCACACAGG-3′,反应体系(25 μL):10×Tap Buffer with KCl 2.5 μL,MgCl2(25 μmol/L)2.5 μL,dNTP(25 μmol/L)2.0 μL,TapDNA 聚合酶(5 U/mL)0.5μL,ddH2O 16.5 μL,引物各0.5 μL。 PCR反应条件:94 ℃预变性 5 min,94 ℃高温变性1 min,58.5 ℃ 退火0.5 min,72 ℃延伸 1 min,共38个循环,72 ℃延伸7 min。
1.4 发酵小试将筛选得到的菌株接种至水产下脚料中,发酵周期为7 d。发酵结束后,测定发酵液中的总氮、总磷、有机碳的含量;另将发酵液分别划线接种于有机磷、无机磷、阿须贝、硅酸盐培养基中,30 ℃培养3~5 d后观察菌种生长情况,初步判断复合菌株发酵液有无解磷解钾固氮能力。
2 结果与分析 2.1 发酵能力菌种的筛选单一菌株发酵结束后,观察各菌株对下脚料的分解效果,发现菌株ZP3(PDA培养基于30 ℃分离得到),在发酵周期内将下脚料分解完全,相对于其他菌株,具有良好的发酵效果。菌株ZP3发酵液与初始液组分分析结果见表1。
| 表1 ZP3发酵液组分分析 Tab. 1 Components of ZP3 fermented solution |
对各菌株进行解磷解钾固氮实验发现,GP2(高氏一号培养基于30 ℃分离得到)、GS4(高氏一号培养基于50 ℃分离得到)、 ZP1(PDA培养基于30 ℃分离得到)、ZP2(PDA培养基于30 ℃分离得到)4株菌显示了良好的特性,结果见表2。
| 表2 菌株解磷解钾固氮能力 Tab. 2 The capacity of nitrogen fixation,insoluble-potassium solubilization and insoluble-phosphate solubilization simultaneously of microbes |
由表2可知,GP2、GS4同时具有解磷解钾固氮能力,ZP1、ZP2具有解磷解钾能力。
2.3 拮抗协同实验结果将上述5株菌两两交叉划线,观察菌株交叉处发现ZP2对其他菌株有明显抑制作用,而其他菌株间无明显拮抗或协同效果,可以共生,最终确定ZP1、ZP3、GP2、GS4 4株菌适合于共同发酵水产下脚料。
2.4 菌种鉴定 2.4.1 形态学鉴定结果GP2的适宜生长温度范围为20~42 ℃,GS4的适宜生长温度为20~60 ℃,最适温度均为30 ℃。
GP2在高氏一号培养基培养72 h后,颜色为黄色、表面光滑、边缘规则、菌落为圆形,菌落易挑起,推测为假单胞菌。
GS4在高氏一号培养基中培养72 h后,颜色为乳白色,中心处产生黄色色素,菌落不易挑起,推测为假单胞菌。
ZP1、ZP3的适宜生长温度为20~40 ℃,最适生长温度为28 ℃。
ZP1在PDA培养基中培养72 h后,产生黑色孢子,显微镜下观察菌丝透明,有顶囊,可见初生小梗,推测为黑曲霉。
ZP3在PDA培养基中培养72 h后,菌落为白色,表面光滑,边缘规则 ,推测为酵母菌。
2.4.2 生理生化实验结果GP2生理生化实验结果与少动鞘氨醇单胞菌的相似性达到98.4%;GS4生理生化实验结果与少动鞘氨醇单胞菌的相似性达到99%;ZP3生理生化实验与罗伦隐球酵母的相似性达到97%(表3)。(ZP1为霉菌,目前市场暂无霉菌的API检测条带产品,故ZP1无生理生化结果。)
| 表3 菌株生理生化结果 Tab. 3 The result of physiological and biochemical experiments |
PCR扩增菌株GP2、GS4的16S rDNA基因,得到1 500 bp序列,BLAST结果表明GP2的16S rDNA序列与食酸菌的相似性达到95%。BLAST结果表明GS4的16S rDNA序列与假单胞菌的相似性达到99%,16S rDNA基因序列分析可以确定GS4为假单胞菌属。
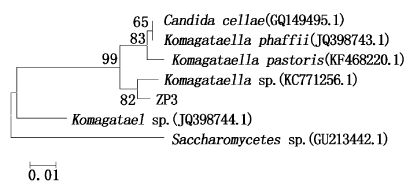
PCR扩增菌株ZP1、ZP3的18S rDNA基因,得到1 500 bp序列,BLAST结果表明ZP1的18S rDNA序列与黑曲霉的相似性达到100%,18S rDNA基因序列分析可以确定ZP1为黑曲霉属。BLAST结果表明ZP3的18S rDNA序列与驹型酵母的相似性达到99%,18S rDNA基因序列分析可以确定ZP3为酵母属。4株菌的聚类树见图1~图4。

|
图1
菌株GP2基于16S rDNA序列的基因同源性的聚类树
Fig.1
The cluster tree on 16S rDNA sequence data of the strains GP2
用于聚类树分析的序列全部来自于基因数据库(括号内为相应编号),分支节点处的数字是基于1 000个重新取样数据集的邻接分析法得出的自展支持度百分比。(图2至图4同)。 The sequences used in the analysis were obtained from the GenBank Database (accession numbers is given parentheses). The number at branch nodes are the percentage bootstrap support based on Neighbor-Joining analysis of 1 000 resample data sets. |

|
图2 菌株GS4基于16S rDNA序列的基因同源性聚类树 Fig.2 The cluster tree on 16S rDNA sequence data of the strains GS4 |

|
图3 菌株ZP1基于18S rDNA序列的基因同源性的聚类树 Fig.3 The cluster tree on 18S rDNA sequence data of the strains ZP1 |
|
图4 菌株ZP3基于18S rDNA序列的基因同源性的聚类树 Fig.4 The cluster tree on 18S rDNA sequence data of the strains ZP3 |
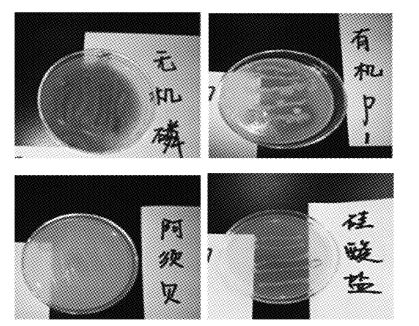
发酵液在4种培养基中菌落生长良好,如图5所示,说明此发酵液具有良好的解磷解钾固氮功能。菌株混合发酵液的组分分析结果如表4 所示,与表1结果比较可见,4株菌混合发酵产物的各组分含量均有所上升。
|
图5 发酵液解磷解钾固氮效果图 Fig.5 The result of nitrogen fixation,insoluble-potassium solubilization and insoluble-phosphate solubilization simultaneously |
| 表4 混合发酵液组分分析 Tab. 4 Components of mixed fermented solution |
长期以来鱼类下脚料的利用极为简单和粗犷,主要将其制作成鱼粉等经济价值较低的产品。鱼类下脚料中含有丰富的营养物质,但是由于无先进的工艺合理利用,使得产品经济附加值极低,造成资源的极大浪费和环境污染[14]。而目前研究较多的微生物肥料的发酵底物主要为人畜粪、植物秸秆,对微生物发酵水产下脚料的研究几乎为零,本试验着重于筛选对水产下脚料具有发酵作用的菌株。
本实验通过对下脚料的单一发酵实验、解磷解钾固氮实验筛选得到的食酸菌(Acidovorax)GP2、假单胞菌(Pseudommonas stutzeri)GS4同时具备良好的解磷、解钾、固氮能力,霉菌(Aspergillus niger)ZP1、酵母菌(Komagataella sp.)ZP3同时具备良好的解磷、解钾能力,并且酵母菌(Komagataella sp.)ZP3具备较强的分解水产下脚料能力。这4株菌具有发酵水产下脚料产生植物所需的氮、磷、钾等营养素的功能,且发酵液中的组分物质含量均已超过国家复合微生物肥料的标准。对于高脂高蛋白的水产下脚料,生理生化实验表明4株菌在利用碳源、氮源、脂肪的能力上具有互补的作用,可以充分将下脚料中的营养物质分解为可供植物直接吸收利用的无机营养盐,故本实验分离筛选得到的这4株菌可以很好地作用于水产下脚料产生植物所需的营养物质。目前报道的解磷菌分为细菌和真菌类,其中细菌包括芽孢杆菌(Bacillus)、埃希氏菌(Escherichia)、欧文氏菌(Erwinia)、假单胞杆菌(Pseudomonas sp.)等,真菌类包括青霉菌属(Penicillium)、 曲霉菌属(Aspergillus)、酵母菌属(Pichia)等;解钾菌多为芽孢杆菌;具有固氮能力的主要为固氮菌 [15]。本试验得到的菌株与上述已报道的菌种相对比,在已有的曲霉菌属(Aspergillus)、酵母菌属(Pichia)的基础上,又探索出适用于解磷解钾固氮的新菌种,食酸菌(Acidovorax)、假单胞菌(Pseudommonas stutzeri)。有资料表明,解磷解钾固氮菌可以产生多种生理活性物质,增强植物抗病性、抗逆性[16, 17];酵母菌可以降解底物中的营养物质[18]。这些菌对于分解水产下脚料具有积极作用,因此我们将进一步开展利用4株菌来发酵水产下脚料制备液体肥料的研究。
| [1] | 刘峰,刘春娥,郑昭君,等.鱼类下脚料微生物发酵饲料的初步研究[J].饲料工程,2012,33(20):37-40. LIU F, LIU C E, ZHENG Z J,et al. Studies on the processing waste of fish fermented by microbe[J]. Fodder Industry, 2012,33(20):37-40. |
| [2] | 龚钢明,顾慧,蔡宝国.鱼类加工下脚料的资源化与利用途径[J].中国资源综合利用,2003,(7):23-24. GONG G M, GU H, CAI B G. Resource recovery and utilization way for by-product of fish[J]. China Resources Comprehensive Utilization, 2003,(7):23-24. |
| [3] | 苑艳辉.水产品下脚料综合利用研究之进展[J].水产科技情报,2004,31(1):44-48. YUAN Y H. Comprehensive utilization for residues of aquatic products research progress[J]. Fisheries Science & Technology Information, 2004,31(1):44-48. |
| [4] | 赖海涛,黄志勇,涂开生,等.酶法提取烤鳗下脚料水解动物蛋白的研究[J].集美大学学报:自然科学版,2002,7(1):11-15. LAI H T,HUANG Z Y,TU K S, et al. The research of enzymatic extraction the hydrolyzed animal protein of roasted eel scraps[J]. Journal of Jimei University: Natural Science, 2002,7(1):11-15. |
| [5] | 辛建美.酶解金枪鱼碎肉制备活性肽及其分离的研究[D].舟山: 浙江海洋学院,2011. XIN J M. Enzyme Hydrolysis of Tune meat for preparation and isolation peptide[D].Zhoushan: Zhejiang Ocean University,2011. |
| [6] | 张金玉,霍光明,张李阳.微生物发酵饲料发展现状及展望[J].南京晓庄学院学报,2009(3):68-71. ZHANG J Y,HUO G M,ZHANG L Y, Research status and development of direct-fed microbial [J]. Journal of Nanjing Xiaozhuang University, 2009(3):68-71. |
| [7] | 许光辉,郑洪元.土壤微生物分析方法手册[M].北京:农业出版社,1986:135-136. XU G H,ZHENG H Y. Manual of soil microbial analysis methods[M].Beijing: Agriculture Press,1986:135-136. |
| [8] | 刘荣昌.生物钾肥在农业生产中的作用[C]//葛诚. 微生物肥料的生产应用及其发展.北京:中国农业科技出版社,1996:66-74. LIU R C. The role of biological potassium fertilizer in agricultural production[C]// GE C. Production application and development of microbial fertilizer. Beijing: China Agricultural Science and Technology Press,1996:66-74. |
| [9] | 吕学斌.微生物发酵菌群的组合及其应用研究[D].天津: 天津大学,2005. LÜ X B. The combination of a microbial fermentation community and the study of its application[D].Tianjin: Tianjin University,2005. |
| [10] | 饶正华,林启美,孙焱鑫,等.解钾菌与解磷菌及固氮菌的相互作用[J].生态学杂志,2002,21(2):71- 73. RAO Z H,LIN Q M,SUN Y X, et al. Interactions between a Bacillus mucilaginosus, Phosphobacteia and a nitrogen fixing bacterium[J]. Journal of Ecology,2002,21(2):71- 73. |
| [11] | 祝陈坚.海水分析化学实验[M].青岛:中国海洋大学出版社,2008:92-96. ZHU C J. Experiment of analytical chemistry for seawater[M].Qingdao:China Ocean University Press,2008:92-96. |
| [12] | NY525-2011有机肥料[S].北京:中国农业出版社,2011:2-4. NY525-2011 Organic fertilizer[S]. Beijing: China Agriculture Press,2011:2-4. |
| [13] | 朱旭芬.现代微生物学实验技术[M].杭州:浙江大学出版社,2011:39-41,51-60. ZHU X F. Modern microbiology experiment technology[M]. Hangzhou: Zhejiang University Press, 2011:39-41,51-60. |
| [14] | 霍健聪.带鱼下脚料蛋白酶水解物亚铁螯合修饰及其抑菌机理研究[D]. 重庆: 西南大学,2009. HUO J C. Study on ferrous chelating modification of trichiurus haumela offal hydrolysate by enzymolysis and research for antibacterial mechanism[D].Chongqing: South-Western University,2009. |
| [15] | 孙丽范.利用耐盐碱解磷、解钾、固氮菌发酵菌糠制备菌肥的研究[D].天津: 天津大学,2012. SUN L F. Convertion of spent mushroom substrate to biofertilizer using co-inoculation of salt and alkaline-tolerant phosphate-solubilizing fungus potassium solubilizing and nitrogen fixing bacteria[D]. Tianjin: Tianjin University,2012. |
| [16] | 刘健,李俊,葛诚.微生物肥料作用机理的研究新进展[J].微生物学杂志,2001,21(1):33-36. LIU J, LI J,GE C. The new progress of the mechanism of microbial fertilizer[J]. Journal of Microbiology, 2001,21(1):33-36. |
| [17] | 袁田,熊格生,刘志,等.微生物肥料的研究进展[J].湖南农业科学,2009(7):44-47. YUAN T, XIONG G S,LIU Z,et al.Study on microbiologial fertilizer[J].Hunan Agricultural Sciences, 2009(7):44-47. |
| [18] | 王进.利用复合微生物菌剂制备浒苔生物有机肥及其对作物生长影响的研究[D].青岛: 中国海洋大学,2013. WANG J. Studies on the production of Enteromorpha prolifera bio-organic fertilizer by complex microbial inoculant and its effect on the growth of crop[D]. Qingdao: China Ocean University Press,2013. |
 2015, Vol. 24
2015, Vol. 24


