1. 国家海洋局宁波海洋环境监测中心站, 浙江 宁波 315040;
2. 国家海洋局东海环境监测中心, 上海 201206;
3. 中国水产科学研究院东海水产研究所 农业部东海与远洋渔业资源开发利用重点实验室, 上海 200090
收稿日期: 2014-09-22; 修回日期: 2015-03-02
基金项目: 农业部东海与远洋渔业资源开发利用重点实验室项目(2013K05)
象山港处于浙江北部沿海,北面紧靠杭州湾,南邻三门湾,东侧为舟山群岛,位于29°24′~29°48′N,121°23′~122°03′E,是一个纵长约70 km的较为典型的半封闭狭长海湾,湾内水产资源丰富,气候条件适宜,岸线曲折,陆地岸线总长280 km,是浙江省最重要的海水增养殖基地和渔业资源产地,也是浙江省发展海洋经济重要的天然资源,因其独特的地理区位和资源优势,掀起了前所未有的海洋开发热潮[1, 2, 3],近年来象山港西周工业园、临港开发区建设的多座电厂、水泥厂等相继投入生产,再加上原有的船厂、避风锚地等海洋工程建设,对海湾生态系统构成了巨大压力。原来的岸线环境被破坏后影响栖息于其中的生物,那些依靠水流滤食浮游生物的底栖动物首先面临威胁,原来的沙质底可能变成泥质底,群落结构就将发生变化[4]。此外,作为半封闭的海湾纳潮量不足、水动力减弱、自净能力有限,长期积累的大量污染物质无法扩散出去更加重了这一压力。海湾是一个十分敏感的海陆交替的复合生态系统,承受了人类高强度的开发利用活动[5]。
底栖生物在海洋生态系统的能流和物流中占有重要位置,底栖生物中的大型种类具有浮游生活的幼体阶段,沉积食性的生物扰动和悬浮食性的生物沉降对海洋生态系统起着调节和控制作用[6],底栖动物可以利用水层沉降的有机碎屑,通过营养关系促进有机物质的分解,在水层-底栖耦合过程中使海洋生态系统连接成为一个整体。可以根据其群落结构的变化来了解周围生态环境的动态变化,因此大型底栖动物群落结构和多样性的变化常常用来评价和监测湖泊、河流、海湾等水环境的质量和污染状况,国内外在这方面的研究也较多[7, 8, 9, 10, 11, 12, 13, 14]。本研究通过2012年象山港海域大型底栖动物定量调查数据,分析象山港海域两岸海洋工程对大型底栖动物群落结构的影响,探究该群落多样性与季节及海洋工程关系特征,旨在丰富该海域大型底栖动物群落结构的理论认知,并为象山港海域海洋资源科学利用与可持续发展提供一定的现实依据和技术支撑。
1 研究方法
1.1 站位设置与采样方法
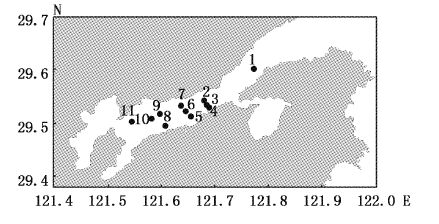
本研究所用数据来源于2012年对象山港中部海域11个大面站开展的调查采样(图1)。以春(4月)、夏(7月)、秋(9月)、冬(12月)4个季节代表月为采样时间,使用0.1 m2箱式采泥器定量取样,每站连续取样4次。泥样用孔径0.5 mm网筛现场冲洗,底栖样品用5%福尔马林现场固定。实验室中进行分拣、鉴定、称重及分析。样品的获取及实验室处理均严格按照《海洋调查规范》[15]进行。
1.2 数据处理
使用多元统计软件PRIMER 5.2.8 进行统计分析,大型底栖生物群落划分采用Bray-Curtis相似性系数,Bray-Curtis相似性系数高的站位可以认为具有相同的生态群落组成,将得到的相似矩阵分别进行CLUSTER聚类和MDS排序分析,聚类分析和多维排序尺度分析均在种类丰度数据进行平方根转换以后进行[16]。群落稳定性分析采用丰度生物量比较法进行[17, 18],为减少机会种对群落结构的干扰,本研究删除在总体中相对丰度小于1%的种,但保留其中在任一站位相对丰度大于3%的种[19]。
群落多样性是衡量群落稳定性的重要尺度。测量生物群落的多样性一般从以下两个方面来考虑,一是群落中物种的丰富性,二是群落中物种的异质性,不同的多样性指数所强调的物种丰富性和异质性的程度有所不同[20]。本研究使用Shannon-Weaver多样性指数(H′)、Margalef丰度指数(d)和Pielou均匀度指数(J′)3种指数,同样使用多元统计软件PRIMER 5.2.8进行计算。上述3项指数的空间分布等值线图使用Surfer 11.0绘制。
优势种的优势度(Y)公式:
式中: ni为第i种的个体数; fi 为该种在各站位出现的频率; N为每个种出现的总个数。当 Y 0.02时该种为优势种。
2 结果与分析
2.1 种类组成和优势种
大型底栖动物共鉴定出25种,其中多毛类7种,占总数的28%;软体动物11种,占总数的44%;甲壳类1种,占总数的4%;棘皮动物4种,占总数的16%;其他2种,占总数的8%,种类组成以沿岸低盐广布种为主。冬季(12月)20种,种类最多;夏季(7月)18种,种类次之;秋季(9月)15种,种类略低;春季(4月)11种,种类最少。
大型底栖动物优势种8种,包括多毛类2种,为不倒翁虫(Stetrnaspis sculata)和双鳃内卷齿蚕(Aglaophamus dibranchis);软体动物4种,为半褶织纹螺(Nassarius semiplicatus)、薄云母蛤(Yoldia similis)和纵肋织纹螺(Nassarius varicifeus)、马氏光螺(Melanella martinii);棘皮动物2种,为棘刺锚参(Protankyra bidentata)和金氏真蛇尾(Ophiura kinbergi)。其中,4月优势种是不倒翁虫(优势度0.17)、半褶织纹螺(优势度0.16)、薄云母蛤(优势度0.03);7月优势种是半褶织纹螺(优势度0.23)、金氏真蛇尾(优势度0.06)、棘刺锚参(优势度0.03)、马氏光螺(优势度0.02);9月优势种是不倒翁虫(优势度0.22)、半褶织纹螺(优势度0.17)、纵肋织纹螺(优势度0.03)、双鳃内卷齿蚕(优势度0.02);12月优势种是半褶织纹螺(优势度0.16)、不倒翁虫(优势度0.09)、双鳃内卷齿蚕(优势度0.04)、金氏真蛇尾(优势度0.03)、纵肋织纹螺(优势度0.03)。半褶织纹螺(Nassarius semiplicatus)在本研究调查采样中成为最主要的优势种,4季均可成为优势群体,优势度(Y)最高为0.23,出现频率以7月、12月最高,可达91%,9月次之,为82%,4月为64%。
2.2 栖息密度和生物量
4月大型底栖动物栖息密度变化范围为5~10 ind/m2,平均为7.76 ind/m2,软体动物栖息密度占总密度的44.44%;7月栖息密度变化范围为5~40 ind/m2,平均为10.55 ind/m2,软体动物栖息密度占总密度的51.72%;9月栖息密度变化范围为5~25 ind/m2,平均为9.36 ind/m2,软体动物栖息密度占总密度的47.73%;12月栖息密度变化范围为5~20 ind/m2,平均为9.17 ind/m2,软体动物栖息密度占总密度的45.45%(表1)。栖息密度季节变化为夏季>秋季>冬季>春季,软体动物栖息密度的季节变化决定了平均栖息密度的季节变化。
表1(Tab. 1)

表1 大型底栖动物栖息密度及生物量组成Tab. 1 Inhabited density and biomass of macrobenthos in the Xiangshan Bay
|
类别 species | 4月April
| | 7月July
| | 9月September
| | 12月December
|
范围
range | 平均值
average | | 范围
range | 平均值
average | | 范围
range | 平均值
average | | 范围
range | 平均值
average |
|
栖息密度/(ind/m2)density | 5~15 | 7.76 | | 5~40 | 10.55 | | 5~25 | 9.36 | | 5~20 | 9.17
| | 生物量/(g/m2)biomass | 0.05~18.35 | 2.69 | | 0.05~23.95 | 2.43 | | 0.05~9.40 | 1.34 | | 0.05~13.85 | 1.98
|
|
表1 大型底栖动物栖息密度及生物量组成
Tab. 1 Inhabited density and biomass of macrobenthos in the Xiangshan Bay |
4月大型底栖动物生物量变化范围为0.05~18.35 g/m2,平均为2.69 g/m2;7月生物量变化范围为0.05~23.95 g/m2,平均为2.43 g/m2;9月生物量变化范围为0.05~9.40 g/m2,平均为1.34 g/m2;12月生物量变化范围为0.05~13.85 g/m2,平均为1.98 g/m2。4季生物量组成均以棘皮动物为主,4月占总生物量的91.92%,7月占82.37% ,9月占58.74%,12月占62.43%,棘皮动物生物量的季节变化决定了平均生物量的季节变化,据近年监测结果显示该片海域有机营养物质极为丰富,大量代谢产物和有机碎屑的沉降为生活在底层的食沉积物动物和滤食性底栖动物提供了较佳的生长空间。高爱根等在对象山港养殖区与非养殖区大型底栖生物的研究中指出,棘皮动物在大型底栖生物生物量分布中占很高比率,该类动物在一些河口软底质区内能获得大量发展,并成为群落优势种[21]。
2.3 群落物种多样性
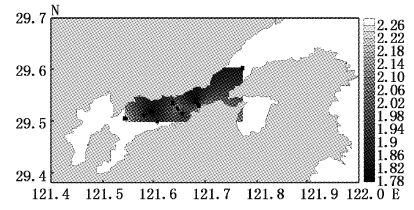
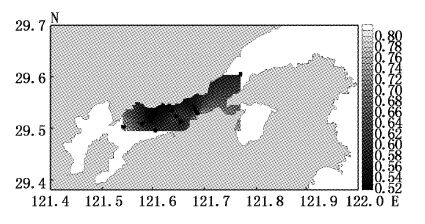
大型底栖动物多样性指数平面分布见图2~图5。4月多样性指数变化范围为0.92~1.52,平均值为1.28,高值区出现在调查海域北岸的2、7、11号站位,低值区为靠近南岸的8号站位和弯外的1号站位;7月多样性指数变化范围为1.84~2.56,平均值为2.13,高值区为调查海域中部的6号站位,低值区为靠近内弯的10、11号站位;9月多样性指数变化范围为1.79~2.25,平均值为1.97,高值区为靠近北岸的11号站位,低值区靠近南岸的3、5号站位;12月多样性指数变化范围为1.79~2.48,平均值为2.20,高值区为靠近北岸11号站位,低值区为靠近南岸的3、8号站位。
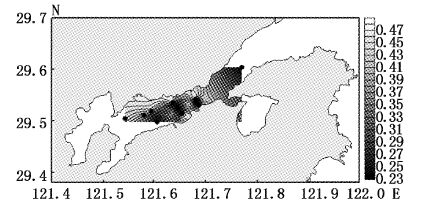
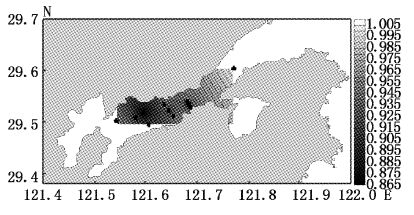
大型底栖动物4月丰度指数变化范围为0.23~0.46,平均值为0.37,高值区出现在调查海域北岸的2、7号站位,低值区为靠近弯外的1号站位(图6);7月丰度指数变化范围为0.52~1.07,平均值为0.7,高值区为调查海域中部的6号站位,低值区为靠近南岸的8号站位和靠近内弯的10、11号站位(图7);9月丰度指数变化范围为0.52~0.82,平均值为0.62,高值区为靠近北岸的11号站位,低值区为靠近南岸的3、5号站位和靠近象山港湾外的1号站位(图8);12月丰度指数变化范围为0.61~0.86,平均值为0.72,高值区为靠近北岸11号站位,低值区为靠近南岸的8号站位(图9)。Margalef丰度指数的平面分布与Shannon-Weaver多样性指数平面分布大体一致。
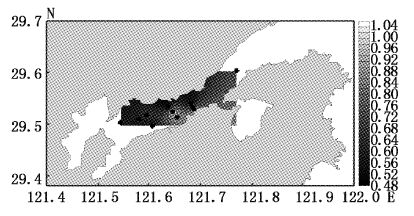
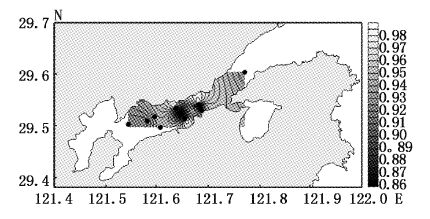
大型底栖动物4月均匀度指数变化范围为0.86~1,平均值为0.93,高值区出现在调查海域北岸的11号站位,低值区为中部的9号站位(图10);7月均匀度指数变化范围为0.85~0.99,平均值为0.93,高值区为靠近北岸的的2号站位,低值区为靠近南岸的3号站位(图11);9月均匀度指数变化范围为0.89~0.99,平均值为0.94,高值区为靠近北岸的7号站位,低值区为中部的9号站位和靠近南岸的3、5号站位和弯外的1号站位(图12);12月均匀度指数变化范围为0.90~0.99,平均值为0.96,高值区为中部的2号站位,低值区为靠近南岸的8号站位(图13)。Pielou均匀度指数的空间变化相较于Margalef丰度指数与Shannon-Weaver多样性指数变化不大,说明每站种类组成的差异较小,站间分布均匀。
2.4 群落结构分析
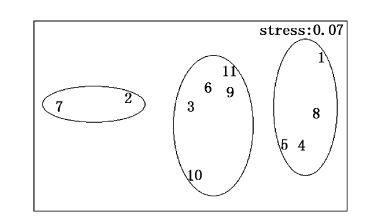
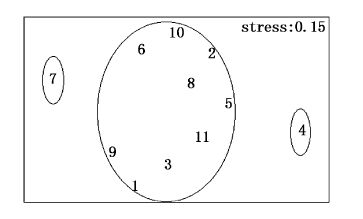
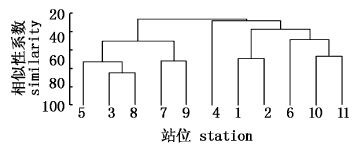
4月大型底栖动物群落CLUSTER聚类及MDS排序分析见图14、图15。根据群落Bray-Curtis相似性系数聚类分析,在相似性系数为40%的水平上,将11个站位大型底栖动物划分为3个群落。Ⅰ为金氏真蛇尾-纵肋织纹螺群落,包括2、7站位,靠近调查海域北部;Ⅱ为半褶织纹螺-薄云母蛤-棘刺锚参群落,包括1、4、5、8站位,靠近调查海域南岸;Ⅲ为不倒翁虫-半褶织纹螺-棘刺锚参群落,包括3、6、9、10、11站位,主要是调查海域中部站位。群落结构的二维MDS分析压力系数(stress)小于0.1,则认为所得到的MDS图形可以正确解释样本间的相似关系;当其值小于0.2,认为其图形有一定的解释意义;当其值大于0.2,则认为其图形不能正确解释群落结构间的关系[22, 23, 24],本研究压力系数为0.07,说明可以正确解释样本间相似关系,为了更好地解释样本间群落组成相似关系,在MDS图上相应勾划了聚类分析的聚类组,MDS排序分析结果与聚类分析结果一致,表明该图形很好地反映了群落间的相似性程度,同时也进一步验证了聚类分析的结果。
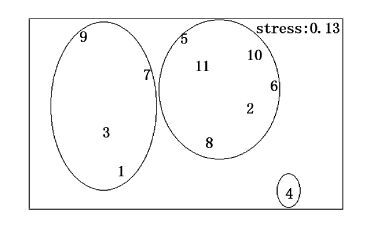
7月大型底栖动物群落CLUSTER聚类及MDS排序分析见图16、图17。根据群落Bray-Curtis相似性系数聚类分析,在相似性系数为40%的水平上,将11个站位大型底栖动物划分为3个群落。Ⅰ为金氏真蛇尾-不倒翁虫群落,为7站位,靠近调查海域北部;Ⅱ为半褶织纹螺-棘刺锚参群落,为4站位,靠近调查海域南岸;Ⅲ为半褶织纹螺-金氏真蛇尾-棘刺锚参-马氏光螺群落,包括1、2、3、5、6、8、9、10、11站位,站位比较分散,压力系数为0.15,说明可以正确解释样本间相似关系。
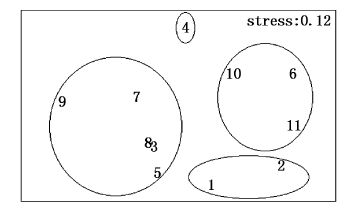
9月大型底栖动物群落CLUSTER聚类及MDS排序分析见图18、图19。据群落Bray-Curtis相似性系数聚类分析,在相似性系数为40%的水平上,将11个站位大型底栖动物划分为3个群落。Ⅰ为半褶织纹螺-棘刺锚参群落,为4站位,靠近调查海域南岸;Ⅱ为不倒翁虫-半褶织纹螺-双鳃内卷齿蚕群落,包括2、5、6、8、10、11站位,靠近调查海域中部和南岸;Ⅲ为不倒翁虫-半褶织纹螺-纵肋织纹螺群落,包括1、3、7、9站位,靠近调查海域中部和弯外,压力系数为0.13,可以正确解释样本间相似关系。
12月大型底栖动物群落CLUSTER聚类及MDS排序分析见图20、图21。据群落Bray-Curtis相似性系数聚类分析,在相似性系数为40%的水平上,将11个站位大型底栖动物划分为4个群落。Ⅰ为半褶织纹螺-不倒翁虫-纵肋织纹螺群落,包括3、5、7、8、9站位,靠近调查海域南岸和中部;Ⅱ为半褶织纹螺-棘刺锚参群落,为4站位,靠近调查海域南岸;Ⅲ为半褶织纹螺-不倒翁虫-双鳃内卷齿蚕-金氏真蛇尾群落,包括1、2站位,靠近调查海域中部和弯外;Ⅳ为半褶织纹螺-双鳃内卷齿蚕-金氏真蛇尾-纵肋织纹螺群落,包括6、10、11站位,靠近调查海域中部,压力系数为0.12,可以正确解释样本间相似关系。四季调查结果相比较,大型底栖动物群落结构发生了一定的季节性变化,但变化不大,主要分布为靠近调查海域北岸和中部的1、2、6、7、9、10、11站位和靠近调查海域南岸的3、4、5、8站位,软体动物为主要代表种的群落保持了一定的稳定性,其中半褶织纹螺分布量尤为丰富,其大量出现可能与该片海域沉积物特征有很大关系,该片海域的沉积物主要是以较细颗粒的粘土质粉砂和粉砂质粘土为主,利于生长与繁衍;并且该种生物喜食其他动物尸体,大量残饵和养殖生物代谢产物等有机营养物沉积海底,为其提供了丰富的食物,在底层环境中起着“清道夫”的作用。
2.5 群落稳定性
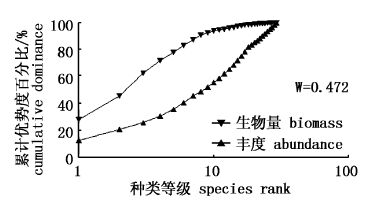
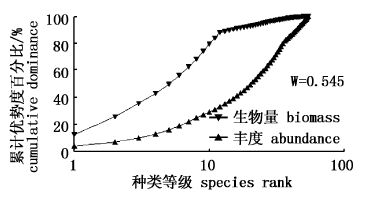
大型底栖动物ABC曲线见图22~图25。ABC法能较客观地反映出海洋环境污染对底栖生物群落结构的影响,在稳定的海洋环境中,底栖生物群落近似平衡,群落的生物量由1个或几个大型的种占优势,且每个种有几个个体;当群落失去平衡时,在数量上占优势的种是随机的较小的种。对于未污染的群落,整条生物量曲线位于丰度曲线上方,说明丰度比生物量具更高的多样性;中度污染时,大个体的竞争优势种消失且丰度与生物量优势度间不平衡降低,生物量和丰度曲线间的差异不存在,或相互交叉,或重叠在一起;当严重污染时,底栖生物群落的个体数由1个或几个个体非常小的种占优势,丰度曲线整条位于生物量上方,生物量比丰度具有更高的多样性[25, 26, 27, 28]。图22、图23可以看出4月、7月生物量曲线始终位于丰度曲线上方,说明该海域的大型底栖动物群落未受到污染扰动,图24、图25虽然生物量曲线都高于丰度曲线,但由于生物量曲线起点明显较低,优势不明显,且起点处与丰度曲线相距较近,丰度和生物量曲线接近重合,表明9月、12月底栖动物群落已受到一定程度的轻微污染扰动。
3 讨论
3.1 与历史资料的对比
王金辉等在2001年对象山港大型底栖动物调查研究中共鉴定出底栖动物43种,平均生物量和平均栖息密度分别为15.6 g/m2和88.5 ind/m2[29];陶磊等在2006年7月至2008年8月对象山港大型底栖动物四季调查研究中乌沙山电厂站位年均栖息密度分别为45.83 ind/m2 、45.21 ind/m2,年均生物量分别为14.60 g/m2、13.81 g/m2[30],与本研究结果相比,象山港海域大型底栖动物数量发生了较大的变化,种类数量及平均栖息密度、平均生物量显著减少,呈总体下降趋势。栖息密度的减少说明底栖动物可栖息范围的缩小,生境发生了变化,底质从氧化态转变为还原态,底质环境的持续恶化将改变底栖动物的群落结构,群落中取而代之的是耐污能力强或厌氧性的生物,这些后来的定居者可以生活在较深的沉积物中,在生物量也在减少的同时,正常的能流、物流渠道受阻,生态功能逐渐衰退[4],说明两岸的海洋工程自建成到运行至今的时间里对港湾内大型底栖动物产生了较大的影响,主要影响因素与温排水、工业三废的排放,自然岸线、湿地面积的减少有关。
3.2 群落多样性分析与群落结构特征
Shannon-Weaver多样性指数平面分布与Margalef丰度指数的平面分布大体一致。基本呈现出沿岸较低,中部相对高的空间分布特征,可能与两岸海洋工程的位置息息相关。相较于多样性指数与丰度指数,Pielou均匀度指数的空间变化不大,说明每站种类组成的差异较小,站间分布均匀,这也与本次调查研究的种类偏少的实际相符合,从而造成各个站位物种组成比较单一。以上3个指数的季节变化亦不明显,除Pielou均匀度指数四季几乎无变化,都保持一个较高的水准外,Shannon-Weaver多样性指数与Margalef丰度指数的季节变化都是冬季>夏季>秋季>春季。顾晓英等研究指出,象山港的季节变化很大程度上是受温度变化的影响,各季节温度的变化导致了其他因子的一系列变化,从而影响了个体分布范围,因而使生物多样性发生变化[31];廖一波等对象山港大型底栖动物群落主要类群和环境因子进行了CCA分析,影响大型底栖动物群落主要类群的环境因子有盐度、氧化还原电位、总氮和总磷等[32]。一般而言,底栖生物群落与海底沉积和底质性质关系最为密切[4]。四季大型底栖动物群落主要分布为靠近调查海域北岸和中部的1、2、6、7、9、10、11站位和靠近调查海域南岸的3、4、5、8站位,北岸的海洋工程主要为避风锚地和船厂,南岸的海洋工程主要为电厂和水泥厂,海域环境的不同形成不同的生境,进而在群落结构分布上形成不同的类群。
3.3 群落稳定性影响评价
从本研究的ABC曲线可以看出,并没有出现生物量和丰度曲线相互交叉或丰度曲线位于生物量曲线之上的情况,9月、12月大型底栖动物群落只是受到一定程度的轻微污染扰动,这与海洋工程对大型底栖动物产生影响有关。当群落不断受到外界的扰动,并且这些扰动超过其自身的调节能力时,群落结构趋向单一,造成群落不稳定,长此以往,群落的生态演替就会朝着异源演替的方向发展;另一方面也与个体生物量较大的棘刺锚参、金氏真蛇尾等棘皮动物为优势种之一有很大关系。生物群落自身都有自然演化的特性,一些细小的环境变化,如气候、水温、水流等,都可能使群落的物种组成发生变化[17],从进化论的观点讲,这类底栖动物趋向于采取r选择对策,是对不稳定的栖息场所的一种适应,进而朝着适于栖息生境的方向进化。建议在日常监测工作中关注污染指示种的同时也注重机会种数量的增减,尤其是种群-群落的生态效应,谨防沉积物环境的持续恶化,沉积物环境得到了改善,底栖环境物质循环功能逐渐恢复,群落才能趋向稳定。
Community structure and biodiversity characteristics of macrobenthos in the middle of Xiangshan Bay
1. Marine Environmental Monitoring Center of Ningbo, SOA, Ningbo 315040, Zhejiang, China;
2. East China Sea Environmental Monitoring Center, SOA, Shanghai 201206, China;
3. Key Laboratory of East China Sea & Oceanic Fishery Resources Exploitation and Utilization, Ministry of Agriculture, Shanghai 200090, China












 2015, Vol. 24
2015, Vol. 24


