2. 浙江万里学院 生物与环境学院, 浙江 宁波 315100;
3. 余姚市明凤淡水养殖场, 浙江 宁波 315100
染色体是遗传物质的主要载体,有储存和传递遗传信息的功能,其数目、形态、结构及分带在世代传承过程中保持稳定,具有种的特性。染色体的形态及分类是细胞遗传学研究的核心内容,而染色体的组型、带型研究是最为重要的切入点。目前,对中华鳖染色体核型的研究已有相关报导,一般认为,中华鳖体细胞染色体数为2n=66[1, 2, 3, 4],其中12条大型染色体,54条中小型染色体,核型公式为2n=4M+6SM+2T+54m[1, 2]或2n=4M+8SM+16T+38m[3, 5],臂数为76[2, 4]或78[3, 5],不同地方群体间中华鳖染色体的绝对长度及相对长度均有差异[3]。但这些研究均未发现形态异配的性染色体存在,且核型公式等资料因对中小型染色体测量的准确程度而出现不同的报道。在G带分析中,仅有王军花等[5]对6对大型染色体有过报道。本文旨在通过比较研究中华鳖染色体标本的制备方法,应用高分辨率的显微摄像系统及Photoshop CS3分析软件,提高染色体标本的区分度,以利于更清晰地观察中华鳖的核型与异型性染色体,以证明中华鳖性染色体的存在。同时研究染色体G带,丰富和完善了中华鳖的染色体资料,为中华鳖育种和性别决定机制的研究提供理论依据。
1 材料与方法 1.1 中华鳖材料中华鳖采自浙江省余姚市明凤淡水养殖场,为姚江水系中华鳖。鳖体椭圆,背部呈墨绿色并散布块状黑点,腹部为玉白色,有块明显的特征花斑。选择雌雄各15只,体重600~800 g。
1.2 仪器与试剂仪器和试剂包括Nikon H1荧光显微摄像装置(Nikon公司,Japan)、秋水仙素(Sigma公司,USA)、植物血球凝集素(PHA,Sigma公司,USA)、0.25%胰蛋白酶液(Thermo公司,USA)和Hank’s液(自配)等。
1.3 骨髓细胞染色体标本制备与秋水仙素处理设计染色体标本制备方法参考吴萍和楼允东[3]与王军花等[5]的方法,并进行改进。取受试中华鳖,于后肢基部向腹腔注射PHA 10 μg/g(体重),18 h后重复注射一次。1 h后按1 μg/g(体重)腹腔注射秋水仙素(表1);颈部放血处死,解剖,迅速取出前后肢股骨和肱骨,剃净骨表面肌肉及结缔组织,剪开骨两端,用注射器吸取0.85%的生理盐水插入骨髓腔中,缓慢反复冲洗骨髓腔,收集骨髓细胞于50 mL离心管中,直至骨髓腔被冲洗成无血色状。用吸管轻轻吹打使细胞团块分散,1 500 r/min离心10 min,弃上清,收集细胞备用。向细胞中加入6~8 mL 0.075 mol/L KCl,搅匀,37 ℃低渗40 min,1 500 r/min离心10 min弃上清,加入6~8 mL Carnoy固定液[V(甲醇)∶V(冰醋酸)=3∶1],用吸管反复轻吹混匀细胞,置于4 ℃冰箱中固定1 h,期间每20 min更换一次固定液并离心(1 500 r/min ,10 min),最后一次离心后弃上清。加2~4 mL新鲜固定液[V(甲醇)∶V(冰醋酸)=1∶1]制成适当的细胞悬液,4 ℃保存备用。
| 表1 秋水仙素注射量及处理时间设计 Tab 1. Different design of colchicine injection quantity and processing time |
取-20 ℃预冷1 h以上洁净载玻片,于中心位置滴1滴45%醋酸,然后于正上方40 cm处垂直滴加1滴上述细胞悬液,空气干燥。将制片插入Giemsa染液(pH 6.8)中染色约30 min,蒸馏水漂洗,空气干燥,中性树胶封片。
1.4 G带显带按上述制片方法,将制片放入洁净玻片盒,自然老化4 d,65 ℃烘箱中烤片4 h,取出冷却至室温,浸入0.025%的胰蛋白酶液(Hank’s液稀释)中,37.5 ℃水浴消化5 min。迅速用0.85%生理盐水轻轻冲洗2次,最后蒸馏水冲洗一次,空气干燥,Giemsa染液(pH 6.8)染色10 min,蒸馏水从反面冲洗玻片30 s,自然干燥,中性树胶封片。
1.5 染色体分析将上述制片于Nikon H1荧光显微镜下观察,选取铺展良好,染色体与周边清晰的中期分裂相雌雄各100个进行显微摄像,参考文献[7, 8, 9, 10],运用Photoshop CS3软件对染色体进行测量,计算染色体总数及拍照,并进行核型分析及G带模式绘制。染色体分类按LEVAN等[11]的标准确定,即臂比指数为1.00~1.70的染色体为中部着丝粒染色体(m),臂比指数为1.70~3.00的染色体为亚中部着丝粒染色体(sm),臂比指数为3.00~7.00的染色体为亚端部着丝粒染色体(st),臂比指数>7.00的染色体为端部着丝粒染色体(T);臂数的统计参考GORMAN[12]的方法,即m、sm型染色体的臂数记为2,st、T型染色体臂数记为1。
2 结果 2.1 最佳染色体形状的秋水仙素处理方法5组不同的秋水仙素注射量及作用时间的染色体标本制备结果比较,发现腹腔注射1 μg/g(体重)的秋水仙素,作用时间为1 h,获得的骨髓细胞中期分裂相中染色体相对狭长,中小型染色体长短臂轮廓清晰,着丝点位置易辨,有利于更加准确的同源配对。
2.2 染色体数目选取分散良好的染色体中期分裂相雌雄个体各100个分别计数统计,结果如表2、图版Ⅰ所示。中华鳖腹腔PHA、秋水仙素注射处理制片效果良好,骨髓细胞中期分裂相较多,且染色体纵长,边缘清晰,染色体总数多为66条,占统计细胞的75%,据此确定中华鳖的染色体数为2n=66。
| 表2 中华鳖染色体数目统计结果 Tab 2. The statistics of the diploid chromosome number of Pelodiscus sinensis |
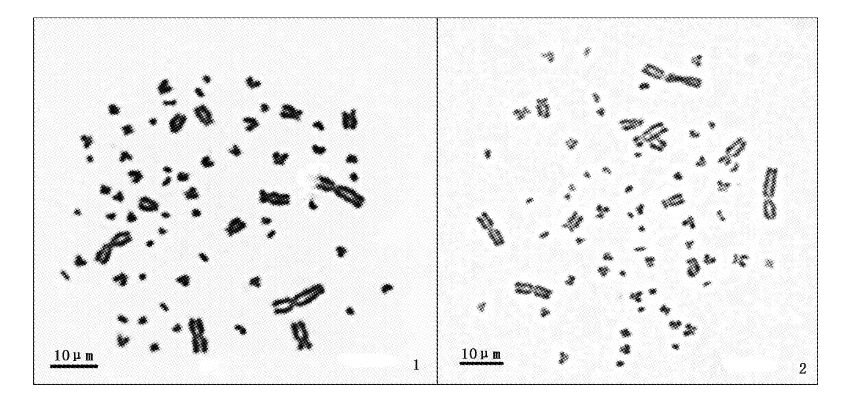
|
图3 中华鳖雄(1)、雌(2)染色体中期分裂相 Fig.3 The metaphases of male(1) and female(2) of Pelodiscus sinensis |
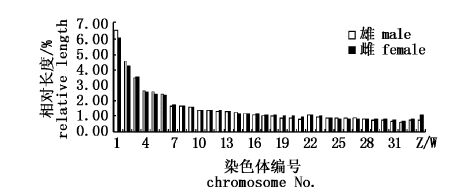
分别选取染色体数目完整,分散良好,形态清晰,着丝点易辨的中期分裂相雌雄各10个,运用Photoshop CS3软件对中期分裂相进行抠图,结合染色体带型配对,绘制姚江水系中华鳖的染色体核型图(图版Ⅱ),其中图版Ⅱ-1,2分别为雄性染色体中期分裂相及核型图,图版Ⅱ-3,4为雌雄染色体中期分裂相及核型图。同时,运用Photoshop CS3软件自带的测量工具对配对好的所有染色体放大相同倍数后测量,统计染色体平均相对长度、着丝粒位置、臂比、臂数等,并依据测量结果,对核型图做适当调整。根据各染色体的相对长度、臂比值,对染色体进行编号、排列和分类,结果见表3,并据表3测得的染色体相对长度,绘制了雌雄中华鳖染色体相对长度比较柱形图(图1)。
| 表3 中华鳖染色体数据统计表 Tab 3. The karyotypic data of Pelodiscus sinensis |
|
图1
中华鳖雄雌染色体相对长度比较图
Fig.1
The comparison of relative length ofthe chromosomes of Pelodiscus sinensis
1-32为常染色体,33为Z/Z,34为Z/W。 No. 1-32 for euchromosomes,33 for Z/Z,34 for Z/W. |
由图版Ⅱ-2,4可知,雌雄中华鳖染色体存在形态上具有显著差别的性染色体(ZZ/ZW)。常染色体中,1-6号为大型染色体,其余染色体形态相对较小,为小型染色体。
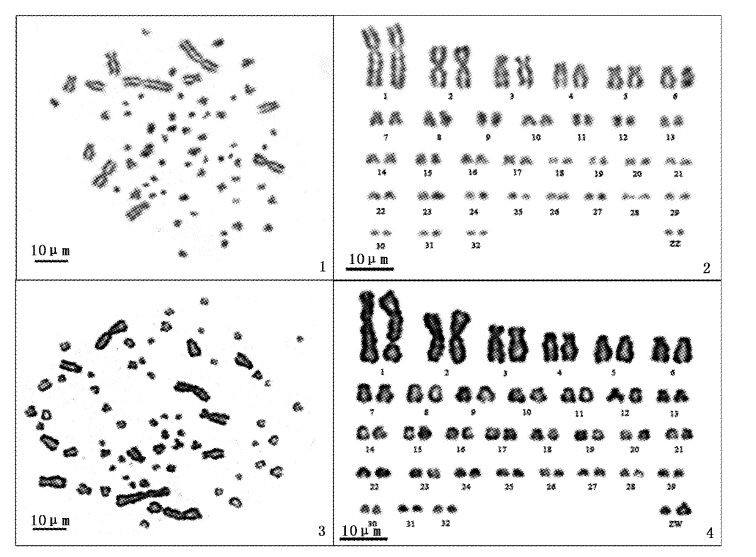
|
图4 中华鳖雄(1,2)、雌(3,4)染色体中期分裂相及核型图 Fig.4 The metaphases and karyotypes of male(1,2) and female(3,4) of Pelodiscus sinensis |
由表3可知,雌雄中华鳖1-6号大型染色体中,1、2号染色体为中部着丝粒染色体(m),4、5号为亚端部着丝粒染色体(st),3、6号为亚中部着丝粒染色体(sm)。中小型染色体中,7-21号为亚中部染色体(sm),22-32号因臂比值无穷大,属于端部着丝粒染色体(T)。性染色体中,雄性ZZ染色体均为端部着丝粒染色体(T),雌性的Z染色体为端部着丝粒染色体(T),W为亚中部着丝粒染色体(sm)。由表2和图1可看出,雌雄染色体的相对长度差异不大。由此可以确定姚江水系中华鳖的核型公式为2n=66=4m+4st+34sm+22T+ZZ/ZW,雄性的臂数(NF)为104,雌性为105。
2.4 姚江水系中华鳖 G带实验分析了20个中期细胞1-6号染色体的G带图像,发现染色体绝对长度相近的相同编号的雌雄染色体的带纹基本一致,同一分裂相中,同源染色体的带纹特点也基本相同。由此,绘制了姚江水系中华鳖1-6号染色体G带模式图。由图2可知,1号染色体显示出14条明暗相间的带纹,其中长臂亮带4条,短臂两条;2号染色体总共12条带,长臂亮带为4条,短臂为两条;3、4号染色体均共8条带,长臂亮带为2条,短臂为1条;5号染色体共5条带,长臂亮带两条,短臂不显示亮带;6号染色体长臂仅显示出一条亮带。其余染色体较小,呈现带纹不清晰。
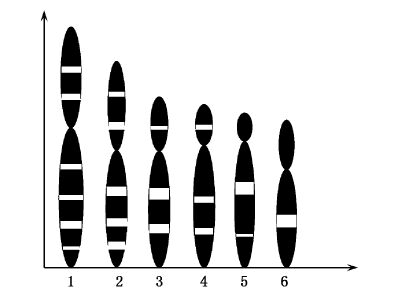
|
图2 中华鳖1-6号染色体G带模型图 Fig.2 The 1-6 chromosome G-banding schema chart of Pelodiscus sinensis |
鳖科动物与其他爬行类和鸟类一样,含有数目众多的点状染色体。因此,若要对其染色体核型做准确、完整的分析,必须要通过改进染色体制备方法,将其小型染色体的形态准确、清晰地呈现出来。秋水仙素浓度和作用时间两种因素均会使染色体产生不同程度的收缩,从而导致研究结果的偏差[13]。笔者前期用常规的秋水仙素处理方法[3, 5],均未能获得异型的性染色体,这也是相关报道都未能发现性染色体的原因。为了掌握最佳染色体形态的秋水仙素的处理方法,我们对注射量及作用时间进行了比较实验,发现当秋水仙素注射量为4 μg/g体重,4 h后宰杀迅速取骨髓细胞,能获得大量的染色体中期分裂相,但染色体臂收缩严重,除6对大型染色体长短臂形态较为清晰外,中小型染色体着丝粒位置基本不易辨认,直观上看不出染色体典型的长短臂结构,致使配对过程中存在很大的主观误差。当腹腔注射1 μg/g体重的秋水仙素,作用时间为1 h,获得的骨髓细胞中期分裂相中染色体相对狭长,中小型染色体长短臂轮廓清晰,着丝点位置易辨,有利于更加准确地同源配对。由此发现了异型性染色体的存在,此结果与DALEEN等[14]的报道一致。此外,本实验采用高分辨率的Nikon H1荧光显微镜成像系统,能够将细胞分裂相清晰地拍摄下来,并运用图像处理软件Photoshop CS3对所得染色体图片进行分析,可有效提高核型配对、测量的准确性。
3.2 核型及G带分析姚江水系中华鳖染色体的总数为2n=66,33对染色体中,1-6号染色体形态较大,着丝点位置较为清晰易辨,为大型染色体,从第7号染色体开始,其形态依次减小,直至成点状存在,为中小型染色体。核型模式上,1-6号染色体中,1、2号为m型染色体,与吴萍[1, 2, 3, 4, 5]等的报道一致;3、6号染色体为sm型染色体,4、5号为st型染色体,与华蕾等[2]的3-5号染色体为sm型,6号染色体为T型结果有差异。通过对多幅核型图测量对比发现中小型染色体中,7-21号染色体存在长短臂,均为sm型染色体;22-32号染色体因不存在染色体的典型长短臂结构,视短臂无穷小,故臂比为正无穷,均为T型染色体;性染色体中,Z染色体为T型,W染色体为sm型,之前的文献报道[1, 2, 3, 4, 5]中因未发现其异形态而被统归为T型染色体。在臂数上,发现雄性臂数为104,雌性为105,之前的报道[3, 4]中,因其未发现雌雄异配性染色体差异,雌雄臂数均为76。这与染色体类型的确定直接相关,主要体现在中小型染色体类型的判断上有误。本研究条件下获得的染色体标本中,中小型染色体轮廓及着丝粒位置均清晰可辨,因而姚江水系中华鳖核型公式确定为2n=66=4m+4st+34sm+22T+ZZ/ZW。
在G带分析中,一般认为,每条染色体均有其特定的带型特征,G带暗纹区富含A-T碱基对,亮带区则富含G-C碱基对,深浅条纹交替排列在染色体上[15]。对姚江水系中华鳖G显带研究发现,1号及4-6号染色体带纹位置及大小与王军花等[5]的相近,2、3号染色体中,2号的长臂表现出3条亮带,3号为两条,与王军花等[5]的恰恰相反,这可能是中华鳖不同地理群体表现出的特异性差异。此外,我们还发现,中华鳖G带的带纹与染色体的绝对长度成正相关性,同一编号染色体,绝对长度越长,表现出越多的带纹,越短,带纹越少甚至不显带;长度相近的同编号染色体,表现出的带纹基本相同,同源染色体所呈现出的带纹完全一致。故根据带纹来对染色体进行配对及组型分析具有更高的准确度。中华鳖小型染色体较多,若要获得中华鳖高清晰度的G带核型还需要对实验条件进行更进一步的探索。
3.3 性染色体的研究本研究在对姚江水系中华鳖的核型配对中,发现了异形态性染色体的存在,性染色体类型雄性为ZZ型,雌性为ZW型,均属于微小型染色体。本文的研究结果与KAWAI等[16] 和KAWAGOSHI等[17]运用荧光原位杂交(FISH)定位技术及DALEEN等[14]通过同源染色体配对,所证明中华鳖和刺鳖(Apalone spinifera)存在异配性染色体(ZZ/ZW)的报道相一致。上述报道,均使用细胞培养的方法获得染色体分裂相,其中微小染色体形态较为清晰易辨,性染色体均属于微小型染色体。我们的发现与吴萍和楼允东[3]、刘丕基等[18]的报道有异。此前,国内报道普遍认为中华鳖不存在性染色体[1, 2, 3, 4, 5],其性别由温度控制[19]。这些研究均未发现中华鳖异配染色体,可能是由于秋水仙素处理强度过大,染色体臂收缩严重,染色体微小差异不明显而错配所致,这与我们表1中组1的研究结果相似。本文对中华鳖性染色体的研究结果,修正了国内对这一种群性别机制研究的误区,补充了细胞遗传学研究的核型资料,将为今后中华鳖性别研究提供有力的理论依据。
| [1] | 薛妹朗,朱玉芳,张锡然,等.中华鳖精母细胞联会复合体的研究[J].遗传,1999,21(1):6-8.XUE L M, ZHU Y F, ZHANG X R, et al. Observation of synaptonemal complexes in Trionyx sinensis spermatocytes by electron mycoscopy [J]. Hereditas, 1999, 21(1): 6-8. |
| [2] | 华蕾,聂刘旺,张锡然,等.中华鳖的染色体带型研究[J].遗传,1997,19(s1):93.HUA L, NIE L W, ZHANG X R, et al. Research on chromosome banding of Trionyx sinensis [J]. Hereditas, 1997, 19(s1): 93. |
| [3] | 吴萍,楼允东.两不同地域中华鳖的核型[J].上海水产大学学报,1999,8(1):6-11.WU P, LOU Y D. The Karyotypes of Trionyx sinensis from the two different areas [J]. Journal of Shanghai Fisheries University, 1999, 8(1): 6-11. |
| [4] | 容寿柏,李新旺.鳖(Amyda sinense)的染色体组型[J].动物学研究,1984,5(s3):29-32,87.RONG S B, LI X W. The karyotypes of Amyda sinense [J]. Zoological Research, 1984, 5(s3): 29-32, 87. |
| [5] | 王军花,饶友生,龚贵如,等.鄱阳湖中华鳖染色体核型、G带和Ag-NORs的分析[J].南昌大学学报:理科版,2010,34(5):495-497.WANG J H, RAO Y S, GONG G R, et al. Analysis on karyotype, G-band and Ag- NORs of chromosome of turtle, Trionyxs sinensis, from Poyang Lake [J]. Journal of Nanchang University :Natural Science, 2010, 34(5): 495-497. |
| [6] | 河姆渡遗址动植物遗存的鉴定研究[J].考古学报,1978(1):95-107,156-159.A study of the animal and plant remains unearthed at HO-MU-TU [J]. Acta Archaeologica Sinica, 1978(1): 95-107, 156-159. |
| [7] | 周友泉,王厚照.PHOTOSHOP在染色体参数测量中的应用[J].江西医学检验,2003,21(1):43-44.ZHOU Y Q, WANG H Z. The application of Photoshop in chromosome parameter measurement [J]. Jiangxi Journal of Medical Laboratory Sciences, 2003, 21(1): 43-44. |
| [8] | 周洲,顾曙余.核型分析实验中的图像处理[J].生物学杂志,2010,27(6):95-96.ZHOU Z, GU S Y. Image processing of karyotype analysis [J]. Journal of Biology, 2010, 27(6): 95-96. |
| [9] | 周劲松,苏小波,汤泳萍,等.利用Photoshop进行芦笋核型分析的研究[J].江西农业学报,2009,21(2):73-75.ZHOU J S, SU X B, TANG Y P, et al. Analysis of chromosomal karyotype of a sparagus by use of software Photoshop [J]. Acta Agriculturae Jiangxi, 2009, 21(2): 73-75. |
| [10] | 卢玉飞,蒋建雄,易自力.利用Photoshop软件处理芒属植物染色体图像的方法探讨[J].草业科学,2013,30(6):922-926.LU Y F, JIANG J X, YI Z L. The protocol for processing of the chromosomal images of Miscanthus for karyotype analysis using Adobe Photoshop software [J]. Pratacultural Science, 2013, 30(6): 922-926. |
| [11] | LEVAN A, FREDGAK, SANDBERGA A . Nomenclature for centromeric position on chromosomes [J]. Hereditas, 1964, 52(2): 201-220. |
| [12] | GORMAN G C. The chromosomes of the reptilian, a cytotaxonomic interpretation [M]//CHIARELLI A B,CAPANNA E. Cytotaxonomy and Vertebrate Evolution, New York: Academic Press, 1973: 349-424. |
| [13] | 杨慧一.草鱼和团头鲂染色体G带带型的研究[J].动物学报,1991,37(4):431-437.YANG H Y. Chromosome G-band patterns of grass carp (Ctenopharyngodon idellus) and blunt-snout bream (Megalobrama amblycephala) [J]. Acta Zoologica Sinica, 1991, 37(4): 431-437. |
| [14] | DALEEN B, ROSCOE S, TAG E, et al. A ZZ/ZW microchromosome system in the spiny softshell turtle, Apalone spinifera, reveals an intriguing sex chromosome conservation in Trionychidae [J].Chromosome Research, 2013, 21(2): 137-147. |
| [15] | SUMNERA T, TAGGART M H, MEZZANOTTE R, et al. Patterns of digestion of human chromosomes by restriction endonucleases demonstrated by in situ nick translation [J]. Histochem, 1990, 22(12): 639-652. |
| [16] | KAWAI A, NISHIDA U C, ISHIJIMA J, et al. Different origins of bird and reptile sex chromosomes inferred from comparative mapping of chicken Z-linked genes [J]. Cytogenet Genome Research, 2007, 117(1/4): 92-102. |
| [17] | KAWAGOSHI T, UNO Y, MATSUBARA K,et al. The ZW micro-sex chromosomes of the Chinese soft-shelled turtle (Pelodiscus sinensis, Trionychidae, Testudines) have the same origin as chicken chromosome 15 [J]. Cytogenet Genome Research, 2009, 125(2): 125-131. |
| [18] | 刘丕基,刘积琛,郑双.我国爬行动物的染色体研究概况[J].大连大学学报,1998,19(2):103-108.LIU P J, LIU J C, ZHENG S. The summary on reptiles of chromosome research in China [J]. Journal of Dalian University, 1998, 19(2): 103-108. |
| [19] | 聂刘旺,郭超文,汪鸣,等.中华鳖的性别决定机制[J].应用与环境生物学报,2001,7(3):258-261.NIE L W, GUO C W, WANG M, et al. Sex determination mechanism of Trionyx sinensis [J]. Chinese Journal of Applied and Environmental Biology, 2001, 7(3): 258-261. |
2. College of Biological and Environmental Sciences, Zhejiang Wanli University, Ningbo 315100, Zhejiang, China;
3. Yuyao Mingfeng Freshwater Farm, Ningbo 315100, Zhejiang, China
 2015, Vol. 24
2015, Vol. 24


