罗非鱼(Tilapia)隶属于鲈形总目鲈亚目丽鱼科(Cichilidae)[1]。尼罗罗非鱼(Oreochromis niloticus)和萨罗罗非鱼 (Sarotherodon melanotheron) 在分类上归不同属[1],自然条件下不能杂交繁殖。李思发等[2]通过人工授精获得了杂交种(尼罗罗非鱼♀×萨罗罗非鱼♂),该杂交种表现出杂种优势,耐盐性能和生长性能兼优,但是,由于杂种胚胎在发育过程中可能存在种间差异及核质不相容性,造成上述杂交种孵化率极低[3]。多倍体鱼是指在具有通常的二倍体染色体组之外,拥有多出的几套染色体的鱼类[4, 5, 6]。通过在受精后较短的一个时间内,对罗非鱼受精卵进行冷休克,热休克或静水压处理,可以抑制第二极体的释放,得到三倍体[7, 8]。例如,在尼罗罗非鱼(O. niloticus)[9]、奥里亚罗非鱼(O. aureus)[10]、莫桑比克罗非鱼(O. mossambicus)[11]上很早成功实现诱导同源三倍体,三倍体诱导率可达100%。异源三倍体(种间杂交三倍体)仅见于莫桑比克罗非鱼×尼罗罗非鱼[12],莫桑比克罗非鱼×红罗非鱼[13]。异源三倍体后代的存活率较同源三倍体高[13]。很多研究表明,鱼类种间异源三倍体比其相应的杂交二倍体有更高的成活率和较低的畸形率,究其原因可能是异源三倍体中多出的一套染色体组可以中和杂种受精卵内父母基因组间和(或)细胞核质间的发育差异[4, 5, 6, 14, 15, 16, 17]。
本研究以尼罗罗非鱼为母本,萨罗罗非鱼为父本进行人工授精,用冷休克抑制第二极体释放的方法获得异源三倍体。对人工授精后处理起始时间、温度、处理持续时间这3个参数进行单因素实验,统计和比较不同实验组的胚胎孵化率和倍性,确定诱导异源三倍体最适宜条件,期待利用异源三倍体技术克服相应杂交二倍体孵化率低的问题。
1 材料与方法 1.1 亲鱼来源性腺成熟的尼罗罗非鱼(新吉富罗非鱼,上海海洋大学的选育品种GS01-001-2005,2龄,体重500~800 g)和萨罗罗非鱼(上海海洋大学2002年引进保种,3~4龄,体重150~250 g)均取自上海海洋大学鱼类种质资源实验站。
1.2 精卵收集和人工授精2014年6月20日至8月20日期间,选择生殖孔突起、发红,腹部松软膨大的雌性个体,用毛巾擦干后,轻轻挤压亲鱼腹部,卵子从生殖孔流出。罗非鱼未成熟期卵细胞呈卵圆形或椭圆形,卵细胞表面布满细小血管,卵黄颗粒处于沉积过程中;成熟期卵细胞呈梨形,卵径约0.5~1.6 mm,呈金黄色,充满卵黄颗粒,动植物极分化明显,外层有卵膜;过熟期卵发白,形状极不规则,轻压即破碎[18]。本实验中,根据这套评价指标选取质量好的卵可以有效提高受精成功率。挤压雄鱼腹部取得精液。
预先用20目的筛网制作成若干锥形网兜,分别放置在盛有1 000 mL水的烧杯中(水温为23~26 ℃)。将卵和精液挤入小塑料盆中,用羽毛搅动混匀,再加入适量0.7%生理盐水,静止放置数十秒,倒去生理盐水,将受精卵放于网兜中孵化,微充气,使受精卵充分翻滚。每组约100粒受精卵。实验用水均为经过曝气的自来水。
1.3 三倍体诱导冷休克诱导采取单因素实验方案进行,根据之前的研究结果[7, 8],在处理温度为9 ℃,处理持续时间为30 min条件下,人工授精后处理起始时间TA(timing after-fertilization)的筛选,并在最佳TA基础上依次进行处理温度(T)和处理持续时间(D)的筛选。受精后等待休克处理的时间即TA不计入处理持续时间。每次实验设5~6个处理组和2个对照组。对照组1为尼罗罗非鱼♀×尼罗罗非鱼♂,对照组2为尼罗罗非鱼♀×萨罗罗非鱼♂。TA从受精后5~10 min每隔1 min设置一个梯度,共6个梯度。处理温度设置5、7、8、9、10、12 ℃共6个梯度。持续时间从20~60 min每隔10 min设置一个梯度,共5个梯度。单因素实验下使用同样的亲本组合作对照。
本实验预先在泡沫保温盒内用冰和常温水混合调节至指定温度,加盖密封,仅留一个小孔用来充气。休克处理时,先将保温盒打开,再把要处理的网兜迅速地从烧杯中取出,抖掉水珠,立即放入保温盒中,微充气,使受精卵充分翻滚。处理结束后,迅速地将网兜取出并放回孵化器中继续孵化(水温为23~26 ℃)。对照组在受精后直接放入孵化器。实验中及时去除死卵,实验重复3次。
1.4 孵化率统计以各组出苗数除以总胚胎数计算孵化率。
1.5 倍性鉴定及三倍体率参照赵岩等[19]的方法用流式细胞仪测定亲鱼和出膜后仔鱼个体的相对DNA量。具体操作如下:一个1.5 mL离心管放入一小块亲鱼鳍条或一个仔鱼胚胎,加入200 μL Partec公司两步法测定DNA含量试剂套装的萃取缓冲液(CyStain DNA 2 Step,Partec,Münster,Germany),室温静置20 min,中间适当摇动破碎鳍条或胚胎,然后用50 μm滤网 (Cell Trics,Partec GmbH)过滤样本,弃掉不能通过滤网的组织,在滤液中加入1 mL试剂套装的染色液,该染色液主要含有DAPI(4-6-diamino-2-phenylindole dihydrochloride),室温避光静置10 min。之后用流式细胞仪(Ploidy Analyzer,Partec,Münster,Germany)对样本进行测定,主峰为G0/G1细胞期DNA含量,计算机自动计算变异系数(coefficient of variation)。用正常二倍体尼罗罗非鱼和萨罗罗非鱼为对照组(记做2C)。检测处理组出苗后存活的全部仔鱼DNA的相对含量,将各处理组的三倍体数除以出苗数计算出每组的三倍体率。
1.6 单个胚胎染色体制片随机选取10个体节期的胚胎,参照洪云汉[20]鱼类单个胚胎染色体标本制备法,稍加改进制片,Giemsa染色,镜检。
1.7 数据分析运用 SPSS 17.0 统计各组诱导鱼苗的孵化率和三倍体率的平均值。
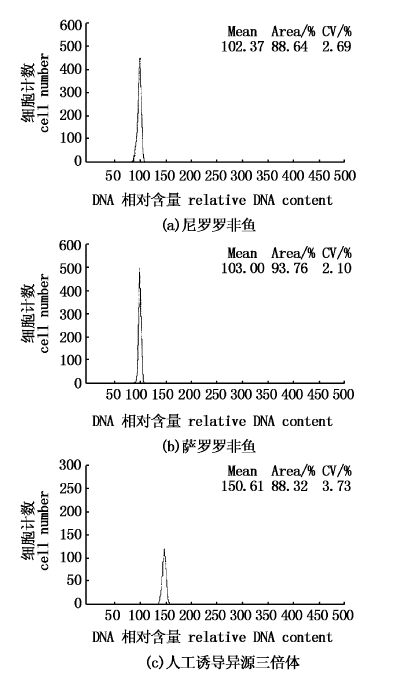
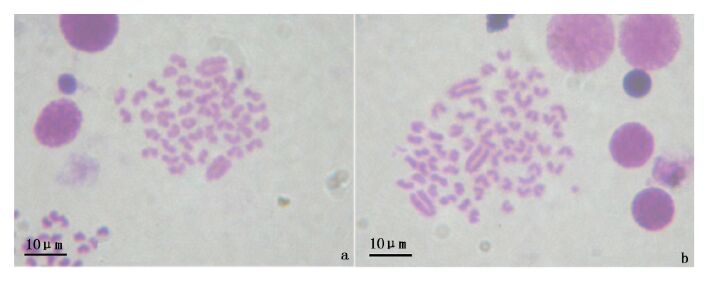
2 结果采用倍性分析仪检测亲本和实验组仔鱼的 DNA 相对含量。经检测,尼罗罗非鱼和萨罗罗非鱼的DNA相对含量一致,设为 100(图1a,b)。实验组中异源三倍体杂交种 DNA 的相对含量在 150 左右(图1c)。亲本、二倍体尼萨杂交种染色体数均为2n=44 (图2a),诱导产生的异源三倍体染色体数目为3n=66 (图2b)。
|
图1 尼罗罗非鱼,萨罗罗非鱼和人工诱导异源三倍体罗非鱼DNA相对含量 Fig.1 Flow-cytometric histograms (X-axis: channel number,Y-axis: cell number) of diploid (a,b),and induced allotriploid (c) tilapia |
|
图2
罗非鱼杂交二倍体、人工诱导异源三倍体染色体图
Fig.2
Metaphase chromosomes of the tilapia
(a)杂交二倍体2n=22; (b)异源三倍体3n=66。 (a)diploid hybrid 2n=22,(b)allotriploid 3n=66. |
当对照组1(尼罗罗非鱼♀×尼罗罗非鱼♂)的孵化率达到90%以上,对照组2(尼罗罗非鱼♀×萨罗罗非鱼♂)的孵化率为7.6%~8.5%时,在获得100%三倍体的处理组中,除去TA=7min、T=9 ℃、D=50 min处理组外,其他各组的孵化率为9.6%~19.1%(表1)。
| 表1 冷休克诱导罗非鱼三倍体单因素实验结果 Tab 1. The results of the single factor experimental design by cold-shock in tilapias |
在设定条件 (T为9 ℃,D为30 min) 下,随着起始时间的延后,孵化率和三倍体诱导率都表现出先升高后降低的趋势。三倍体诱导率以受精后7 min处理组为最高,达到100%,之前之后都有下降,且之后的下降更为显著。受精后9 min处理组,三倍体诱导率已不足30%,受精后10 min处理组已检测不到三倍体,说明受精10 min后冷休克处理对抑制第二极体的外排己经失去作用(表1)。
2.3 冷休克的处理温度在设定条件 (TA为7 min,D为30 min) 下,5 ℃到9 ℃能得到97.2%~100%的三倍体诱导率,10 ℃以后开始下降。在超过最适宜温度(9 ℃)之后,孵化率并没有随温度的升高而升高,却由于三倍体诱导率的下降而有所下降(表1)。
2.4 冷休克的持续时间在设定条件 (TA为7 min,T为9 ℃) 下,处理时间低于20 min时,三倍体诱导率明显下降,超过50 min孵化率明显下降,但仍能诱导出三倍体,超过60 min孵化率为0(表1)。
3 讨论国内外很早就开展罗非鱼三倍体诱导的研究工作。通常认为在28 ℃的水温下,在受精8~10 min后的2 min内,罗非鱼受精卵的第二极体就会释放,完成第二次减数分裂,也只有在这个时间段内,通过抑制第二极体释放诱导三倍体的方法是有效的[9]。罗非鱼种类较多,不同种的鱼也会有所差异,需要找到最适宜的诱导三倍体条件。本实验首次以尼罗罗非鱼♀和萨罗罗非鱼♂为亲本,利用冷休克的方法成功获得三倍体罗非鱼。本研究以获得100%异源三倍体和较高出苗率为标准确定的适宜诱导条件(TA=7 min、T=9 ℃、D=30 min)和之前诱导同源三倍体尼罗罗非鱼的结果较为相似[7, 8, 9]。尽管同样是抑制第二极体释放,和已报道的热休克诱导三倍体的最佳起始时刻相比,本实验中冷休克法要晚约l min。这是因为,在一定范围内提高温度会加速生物个体发育,热休克的处理起始时间较冷休克和静水压休克的处理起始时间要早,且最适宜的处理时间范围也较短,降低温度则相反[21]。
尽管休克处理会一定程度上影响卵的发育,但是很多研究表明,人工诱导的三倍体鱼类具有正常的成活率和孵化率。例如:三倍体泥鳅[5]、奥利亚罗非鱼[10]、鲽与川鲽杂种[22]、鲤[23]等。不仅如此,人工诱导的三倍体还可以提高种间杂种的成活率和孵化率。SCHEERER和THORGAARD[17]详细描述了溪红点鲑 (Salvelinus fontinalis) × 褐鳟 (Salmo trutta) 杂交组合20 d后,热休克诱导的异源三倍体的成活率(65.1%)高于对照杂交二倍体的成活率(37.6%),67 d后,异源三倍体成活率(6.1%)高于杂交二倍体成活率(0%)[17]。此外,草鱼与鲤[16]、虹鳟与溪红点鲑鱼、以及草鱼与鳙杂交后会出现高频率的异源三倍体,这也反映出种间杂交产生的三倍体杂种比二倍体杂种有更高的成活率[4]。且当草鱼与鳙杂交时,三倍体杂种的畸形率(5.1 %)也远远低于二倍体杂种的畸形率(35.1%)[24]。异源三倍体成活率和孵化率的提高可能是由于物种之间双亲染色体组比例从1∶1变为2∶1而起到 “缓冲作用”,该作用一定程度上中和了杂种受精卵内父母基因组间和(或)细胞核质间的发育差异[4, 5, 6]。本实验中,在绝大多数三倍体诱导率达到100%的处理组中,孵化率(9.6%~19.1%)均高于相应的杂交二倍体对照组(7.6%~8.5%)。设定条件为TA=7 min,T=9 ℃,D=50 min的处理组中尽管也获得了100%的三倍体,但孵化率仅为5.4%,推测是由于处理时间较长降低了孵化率。此外,在单因素冷休克处理温度(设定条件为TA=7 min,D=30 min)实验中,高于最适宜处理温度9 ℃后,随温度的升高,三倍体诱导率下降,孵化率也随之下降。这些现象说明尼罗罗非鱼和萨罗罗非鱼之间的异源三倍体比其相应的杂交二倍体有更高的成活率。究其原因,尼罗罗非鱼和萨罗罗非鱼形态上差异明显,分类上归不同属,其杂种发育过程中很可能出现遗传的不调和性,导致二倍体杂交种的死亡,推测在人工诱导异源三倍体的过程中,前文提到的“缓冲作用”提高了异源三倍体罗非鱼相对于杂交二倍体的成活率和孵化率。
本研究表明,通过抑制第二极体释放诱导三倍体罗非鱼是行之有效的,且异源三倍体比相应的杂交二倍体有更高的成活率,具有一定的生产应用前景。由于罗非鱼雌鱼不同个体成熟的同步性差,每次获得卵子量少(约1 000个),成熟卵的数量和质量直接限制罗非鱼染色体组操作的效果。今后,三倍体诱导可选择在亲鱼越冬后首批产卵阶段开展,以提高尼萨杂种的制种效率。
| [1] | TREWAVAS E. Tilapiine fishes of the genera Sarotherodon, Oreochromis and Danakilia [M].Lodon:BritMus(Nat Hist),1983:583. |
| [2] | 李思发,颜标,蔡完其,等.尼罗罗非鱼与萨罗罗非鱼正反杂交后代耐盐性能的杂种优势及其与遗传的相关性的SSR分析明[J].中国水产科学, 2008,15(2):189-197.LI S F,YAN B,CAI W Q, et al. Heterosis and related genetic analysis by SSR for the salt tolerance of reciplrocal hybrids between Nile tilapia ( Oreochromis niloticus) and blackchin tilapia ( Sarotherodon melanotheron)[J]. Journal of Fishery Sciences of China, 2008,15(2): 189-197. |
| [3] | LI S F, ZHAO Y, FAN W J, et al. Possible genetic reproductive isolation between two tilapiine genera and species: Oreochromis niloticus and Sarotherodon melanotheron [J]. Zoological Research, 2011,32(5):521-527. |
| [4] | 楼允东. 国外对鱼类多倍体育种的研究[J].水产学报,1984,8(4): 343-356.LOU Y D. Studies on fish polyploid breeding abroad[J]. Journal of Fisheries of China, 1984, 8(4): 343-356. |
| [5] | ARAI K. Genetic improvement of aquaculture finfish species by chromosome manipulation techniques in Japan[J]. Aquaculture, 2001, 197: 205-228. |
| [6] | PIFERRER F, BEAUMONT A, FALGUIÈRE J, et al. Polyploid fish and shellfish: production, biology and applications to aquaculture for performance improvement and genetic containment[J]. Aquaculture, 2009, 293: 125-156. |
| [7] | 邹曙明,李思发.罗非鱼染色体组操作研究现状与展望[J].上海水产大学学报, 2005,14(4):437-443.ZOU S M,LI S F. Current situation and prospects of chromosomal manipulation in tilapias [J]. Journal of Shanghai Fisheries University, 2005,14(4):437-443. |
| [8] | DON J, AVITALION R R. Comparative study on the induction of triploidy in tilapias, using cold-and heat-shock techniques[J]. Journal of Fish Biology, 1988, 32(5): 665-672. |
| [9] | HUSSAIN M G, CHATTERJI A, MCANDREW B J, et al. Triploidy induction in Nile tilapia, Orechromis niloticus L. Using pressure, heat and cold shocks[J]. Theoretical and Applied Genetics, 1991,81:6-12. |
| [10] | VALENTI R J. Induced polyploidy in Tilapia aurea (steindachner) by means of temperature shock treatment[J]. Journal of Fish Biology, 1975, 7(4): 519-528. |
| [11] | VARADARAJ K, PANDIAN T J. Induction of triploids in Oreochromis mossambicus by thermal, hydrostatic pressure and chemical shocks[J]. Proceedings of Aquaculture International Congress and Expo, 1988, 98:531-535. |
| [12] | PRADEEP P J, SRIJAYA T C, PAPINI A, et al. Effects of triploidy induction on growth and masculinization of red tilapia [Oreochromis mossambicus (Peters, 1852) × Oreochromis niloticus (Linnaeus, 1758)][J]. Aquaculture, 2012, 344-349: 181-187. |
| [13] | VARADARAJ K, PANDIAN T J. Induction of allotriploids in the hybrids of Oreochromis mossambicus female and red tilapia male[J]. Proceedings of the Indian Academy of Science (Animal Science), 1989, 98(5): 351-358. |
| [14] | ARAI K. Effect of allotriploidization on development of the hybrids between female chum salmon and male brook trout[J]. Japanese Society of Scientific Fisheries, 1986, 52(5):823-829. |
| [15] | DENG Y, OSHIRO T, HIGAKI S, et al. Survival, growth and morphometric characteristics in diploid and triploid hybrids of rainbow trout, Oncorhynchus mykiss[J]. Suisan Zoshoku, 1992, 40:121-129. |
| [16] | VASILEV VPAP, MAKEEVA, RYABOV IN. On the triploidy of remote hybrids of carp, Cyprlnus carpis L., with other representatives of Cyprinidae[J]. Genetika, 1975, 11(8): 49-56. |
| [17] | SCHEERER P D, THORGAARD G H. Increased survival in salmonid hybrids by induced triploidy[J]. Canadian Journal of Fisheries and Aquatic Sciences,1983, 40(11): 2040-2044. |
| [18] | 罗明坤,赵金良,赵岩,等. 尼罗罗非鱼♀×萨罗罗非鱼♂人工杂交中卵子、精子形态观察[J]. 广东农业科学, 2014,41(3):127-130LUO M K, ZHAO J L, ZHAO Y, et al. Morphological observation on eggs, sperms in artificial hybridization of Oreochromis niloticus♀×Sarotherodon melanotheron♂[J].Guangdong Agricultural Sciences, 2014,41(3):127-130. |
| [19] | ZHAO Y, TODA M, HOU J L, et al. The occurrence of hypertetraploid and other unusual polyploidy loaches Misgurnus anguillicaudatus among market specimens in Japan[J]. Fisheries Science, 2012, 78(6): 1219-1227. |
| [20] | 洪云汉.鱼类单个胚胎染色体标本的快速制备法[J]. 淡水渔业,1987(1): 35-36.HONG Y H. Preparation of chromosomes from single Embryo of Fish[J].Freshwater Fisheries, 1987(1): 35-36. |
| [21] | ROUGEOT C, MINET L, PRIGNON C, et al. Induce triploidy by heat shok in Eurasian Pereh,Perca fluviatilis[J]. Aquatic Living Resources, 2003, 16(2):90-94. |
| [22] | PURDOM C E. Induced polyploidy in plaice (Pleuromectes platessa) and its hybrid with the flounder ( Platichthys flesus) [J]. Heredity,1972, 29(1):11-24. |
| [23] | GERVAL J, PCTER S, et al. Induced triploidy in carp, Cyprinus carpio L[J]. Journal of Fish Biology,1980, 17(6):667-671. |
| [24] | BECK M L, BIGGERS C J. Chromosomal investigation of Ctenopharyngodon idella & Aristichthys nobilis hybrid[J]. Experientia, 1982, 38:319. |
 2015, Vol. 24
2015, Vol. 24


