2. 上海海洋大学 大洋渔业资源可持续开发省部共建教育部重点实验室, 上海 201306
鲨鱼属于软骨鱼类,处于海洋生态系统的高营养级位置,对海洋食物网稳定性和生态系统多样性的维持有着不可替代的作用[1]。大青鲨(Prionace glauca)隶属于真鲨目(Carcharhiniformes),真鲨科(Carcharhinoidei),青鲨属(Prionace),是资源最为丰富的大洋性鲨鱼之一,也是分布最广的鲨鱼种类之一,其分布范围主要为三大洋热带及温带海域60°N-50°S之间,垂直分布深度最少可达600 m[1]。大青鲨是金枪鱼延绳钓渔业主要的兼捕鱼种,长期的商业性金枪鱼渔业开发对大青鲨资源的影响,已经受到了广泛的关注[2, 3]。 摄食、生长、繁殖等生物学特征是鲨鱼种群资源研究的基础信息[4]。20世纪70年代开始,各国学者对大西洋大青鲨的年龄与生长[5]、繁殖生物学[6]、洄游与行为[7]进行了比较多的研究,为种群动力学研究提供了很好的基础。但摄食和营养结构,作为食物网和生态系统动力学研究的一部分,往往不是单鱼种资源动态研究关注的重点,表现在现有的资源评估方法中一般不直接包含摄食参数。然而,摄食生态学却是多鱼种资源研究和基于生态系统渔业管理的重要基础[8],例如大青鲨可捕食金枪鱼类,这提示着可据此提高金枪鱼类死亡率估算的准确性[9]。 国外学者曾对大西洋大青鲨的摄食开展过一些研究,但采用的样品均来自近海或沿岸,如 STEVENS[10]、MACNAUGHTON等[11]分别报道了东北大西洋英格兰和爱尔兰沿海大青鲨的胃含物特征,MOCORD和STEVEN [12]对西北大西洋加拿大沿海大青鲨的摄食习性进行了量化分析,JUNIOR等[13]报道了巴西沿海延绳钓捕获的大青鲨的胃含物组成。作为大洋性种类,我们对大青鲨在大洋区的摄食情况却认识得很少,仅有的一项研究为HAZIN 等[14]对西南大西洋赤道以南水域90尾延绳钓捕获的大青鲨的胃含物分析。本文根据我国远洋金枪鱼渔业科学观察员采集的样品,对热带大西洋中部、赤道以北海域大青鲨的摄食特点进行分析,并结合个体长度、成熟度,分析摄食与个体长度和成熟度的关系。通过本文并结合以往研究,可以更加全面地认识大青鲨在大西洋海域的摄食特点,这也是国内首次对大洋性鲨鱼摄食的研究。
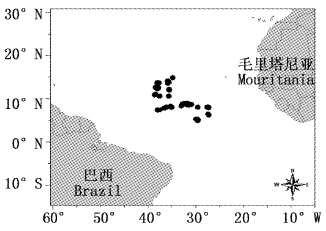
1 材料与方法 1.1 采样时间与区域大青鲨样品由我国金枪鱼延绳钓科学观察员于2010年10月-2011年2月、2011年10月-2012年3月随生产渔船随机采集。样品共112尾,其中雌性52尾,雄性59尾,未知性别1尾。样品采集区域为热带大西洋中部、赤道以北的海域(5°N~15°N,25°W~40°W,图 1)。
|
图 1 大青鲨采样区域及站点 Fig. 1 Sampling stations for Prionace glauca |
观察员对随机采集的大青鲨测定叉长(cm)、观察性别(雄性具鳍脚)后,解剖观测摄食强度、胃含物种类和数量、性腺发育状况。胃含物种类大部分在海上现场鉴定,少部分带回实验室(或拍摄照片后带回)作鉴定。摄食强度分为0-4级[15],但0级(空胃)样品未作统计,即本研究只观测有胃含物的样品。根据PRATT[6]提出的标准,雌性鲨鱼成熟度分为4个等级:幼鲨、成熟中、排卵中、已怀孕;雄性鲨鱼成熟度仅分为两个等级:未成熟与成熟。
1.3 数据分析方法 1.3.1 胃含物组成分析胃含物组成采用饵料物种数及其百分比、饵料物种出现频率表示,根据相对多度(relative density,RD)对胃含物的种类组成进行划分,RD 达10%以上为优势种,1%~10%为常见种,1%以下为稀有种[16]。胃含物种类组成的多样性采用Shannon-Wiener指数(H)描述,指数越高,多样性越高[16, 17];并用Simpson指数(C)表示种类组成集中度,指数越高,胃含物种类多样性越低[16, 17]。计算方法如下:
相对多度(即数量百分比):

Shannon-Wiener物种多样性指数:

Simpson优势度集中指数:

为了分析摄食特征与个体长度的关系,以 20 cm为间隔将样品划分为7个叉长组: <118、119~138、139~158、159~178、179~198、199~218、>219 cm,对其饵料组成进行比较分析,重点分析大青鲨对优势种饵料的摄食频率随其个体长度的变化。
为了分析摄食特征与成熟度的关系,将雌性鲨鱼也按未成熟(幼鲨)、成熟两种状态进行统计,即将成熟中、排卵中、已怀孕这3种状态的样品进行合并,以免样本量过小而影响结果。不同成熟度、不同性别摄食强度的差异比较均采用卡方(χ2)检验。
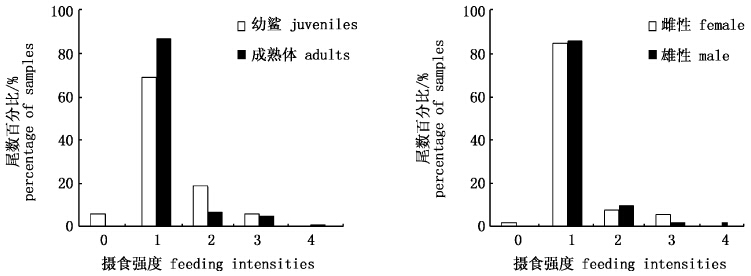
2 结果 2.1 摄食强度观测到摄食强度的大青鲨样品共102尾,其中,摄食强度1级88尾,2级9尾,3级4尾,4级1尾。卡方检验表明,幼鲨与成熟鲨鱼的摄食强度组成有显著差异(P<0.1),但雌性与雄性摄食强度组成无显著差异(P>0.1)。幼鲨和成熟鲨鱼的摄食强度均是以1级占绝大多数(图 2)。
|
图 2 大青鲨不同性别、成熟度的摄食强度组成(百分比) Fig. 2 Feeding intensity distribution by sex and maturity stage for blue shark Prionace glauca |
大青鲨的摄食饵料共有13种(类),见表 1,硬骨鱼类是最主要的饵料种类,头足类次之,其中鱿鱼占到了头足类总个体数的90.5%。鱿鱼和沙丁鱼是优势种类(未分到种),其次是帆蜥鱼,占饵料总个体数的16%,出现频率为13.56%。此外,两尾大青鲨胃中出现了海鸟,一尾雄性大青鲨的胃中发现了一尾雄性大青鲨(即同种相食,表 2)。
| 表 1 大青鲨胃含物组成表 Tab.1 Diet composition of blue shark Prionace glauca |
| 表 2 雌、雄大青鲨摄食种类相对多度比较 Tab.2 Comparison of prey relative density |
胃含物种类组成结构上,雌、雄大青鲨差异不明显,雄性摄食种类稍多些。根据相对多度,雌、雄大青鲨摄食的优势种类相同,均为鱿鱼、沙丁鱼、帆蜥鱼和福氏粗鳍鱼(表 2)。
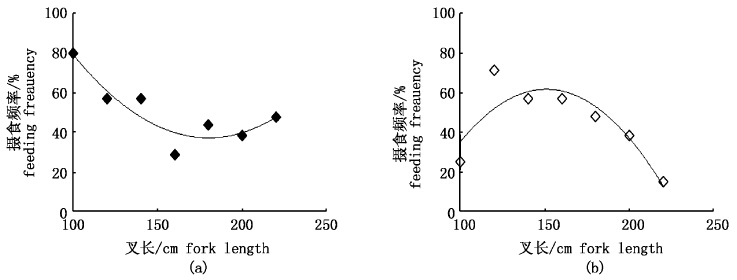
2.2.2 摄食随个体长度变化随着大青鲨长度的增加,饵料中头足类的个体数比率和出现频率总体呈下降趋势,硬骨鱼类的个体数比率和出现频率大多呈上升趋势,但这些变化因种而异。最明显的是帆蜥鱼个体数比率从幼鲨的0%上升到成体鲨鱼的25.37%。从鱿鱼和沙丁鱼两大优势饵料种类看,随着大青鲨长度的增加,对鱿鱼的摄食频率呈先降低、后略有增加的趋势(图 3a);而对沙丁鱼类的摄食频率呈非线性的下降趋势(图 3b),因99~118 cm分组中,大青鲨样品仅4尾,且叉长小于114 cm的个体中几乎未见有捕食沙丁鱼,故该组舍去。
|
图 3 大青鲨叉长与鱿鱼(a)和沙丁鱼(b)摄食频率的关系(曲线为多项式拟合) Fig. 3 Relationships between blue shark size and feeding frequency for squid (a), and between blue shark size and feeding frequency for sardine (b) |
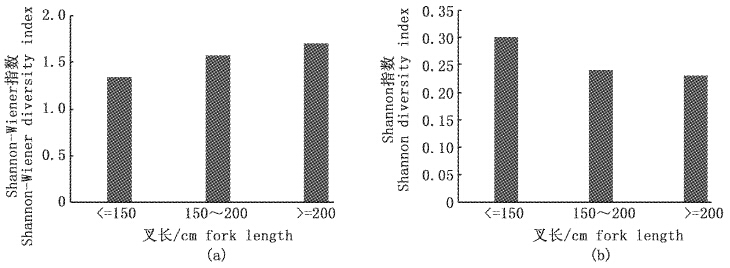
大青鲨饵料种类数随长度的增加而呈上升趋势。大青鲨饵料组成的总体Shannon-Weiner多样性指数H=1.70,Simpson优势度集中指数C=0.23。雌性大青鲨的Shannon-Weiner多样性指数Hfemale=1.61,雄性大青鲨的Hmale=1.72,雄性略高于雌性。从个体看,Shannon-Weiner指数有随着长度增加而升高的趋势(图 4a),Simpson指数则呈相反的下降趋势(图 4b)。
|
图 4 大青鲨长度(叉长)与其饵料组成多样性指数关系 Fig. 4 Prey diversity indices for blue shark by size class (fork length) |
本次研究中,大青鲨幼鲨摄食强度稍高于成年鲨鱼,符合一般鱼类幼鱼期摄食强度较大的特点[18],也符合TSUNEMI [19]的观点,即不同性腺发育阶段的摄食强度存在显著差异。本文观测的大青鲨大部分摄食强度为1级,关于摄食强度低的原因,一种观点认为饥饿的鲨鱼更容易被捕获[20],另一种观点是延绳钓的作业方式使得鲨鱼大多是在夜间被捕获,而鲨鱼高浓度的胃酸使得食物快速消化,次日捕捞上船时,大部分胃含物已消化[21]。此外,也可能是大青鲨的捕食对象的种群数量减少,或者分布区域产生变化,导致大青鲨难以获得充足的食物。例如,帆蜥鱼作为大青鲨的主要摄食对象,也是金枪鱼延绳钓最常见的兼捕鱼种之一[22]。
3.2 食物组成结构大青鲨是一种食性广泛的中上层大型鱼类,因为其摄食投机性的特点,在一定程度上能很好地反映该区域的渔业资源结构和状况[10, 23]。此次分析中,大青鲨最主要的捕食对象是大洋性硬骨鱼类,其次是以鱿鱼为主的头足类(出现频率43.22%)。加拿大科学家在新斯科舍省海域发现的大青鲨胃含物以硬骨鱼和底栖生物为主要食物来源[12],他们的研究中头足类的出现频率仅为4.2%。而日本研究者在白令海发现的大青鲨胃含物中,头足类出现频率高达74.5%[19]。西南大西洋热带水域大青鲨对头足类和小型硬骨鱼类的摄食频率分别为56% 和36%[14]。在其他研究中经常出现的甲壳类,也未在此次大青鲨胃含物中出现。因此,大青鲨对不同种类的摄食频率与其栖息海域有关。近岸大青鲨胃含物中常出现的短尾和长尾类,本文中仅在一尾刚成熟的雄鲨胃中发现(因无法分辨数目,未作统计),另有一怀孕雌鲨胃中出现海藻。
饵料多样性分析中,物种多样性指数和集中性指数随大青鲨个体长度分别呈上升和下降趋势。造成这一现象的原因,很可能是因为口裂大小,个体较小的大青鲨不便于捕食大个体的饵料,导致胃含物的物种多样性指数偏低,集中指数偏高。本研究Shannon-Weiner指数H=1.70,Simpson指数C=0.23,其中Simpson指数高于ANTONELLA等[24]发现的加利福利亚海域大青鲨的多样性指数(C=0.16)。由于处在食物链的高层,大青鲨胃含物的物种多样性指数在一定程度上是其栖息海域生物多样性的潜在指标,下一步的研究需要提高取样和研究方法的连贯性和标准化,从而研究大洋鱼类群落多样性的时空变化。
3.3 摄食种类随个体大小的变化研究表明,由于口裂大小不同,鲨鱼摄食的种类与其个体大小有重要的关系[25],尤其是对幼鲨而言,头足类和沙丁鱼类是大青鲨最主要的食物来源之一。与大青鲨同为大洋性鲨鱼的鼠鲨就有随体长变化、头足类饵料所占比率逐步下降的趋势[20]。本文得出的结果中,叉长为200 cm以上大青鲨摄食头足类的频率又有回升,这一现象需要作进一步的研究。除叉长小于114 cm的大青鲨以外,该区域的大青鲨有很明显的随着个体大小增加、对沙丁鱼的摄食频率逐渐下降的趋势(图 3)。由于样品量所限,本文未能就全部摄食种类的个体尺寸变化做更多的分析,这是在今后的研究中采样时需要改进的方面。
头足类在大青鲨食物组成中占优势地位,可能有两个方面的原因:一是头足类的体型大小基本可以满足所有大青鲨的摄食,而红棱鲂等饵料物种仅适合较大的鲨鱼捕食。大青鲨有随着体长的变化而改变摄食对象的习惯,这一特点对于其他鲨鱼如大白鲨也是如此[26]。二是与其他硬骨鱼类相比,头足类的角质鄂更难被消化。在鲨鱼被捕获后切除胃之前,胃含物消化仍在快速进行,但许多硬骨鱼类的外形已难以辨认,故头足类的出现频率和个体数估算会偏高[21]。以头足类为捕捞对象的鱿钓渔业,也是重要的大洋性渔业,头足类作为饵料生物在高营养级中上层鱼类中的重要地位,提示我们研究高营养级种类的种群动态时,需要紧密结合头足类这类较低营养级种类的生物量变化。
| [1] | CAMHI M D, PIKITCH E K, BABCOCK E A. Sharks of the Open Ocean [M]. America: Blackwell, 2008: 1-5. |
| [2] | MEJUTO J, GARCIA-CORTES B. Reproductive and distri-bution parameters of blue shark (Prionace glauca) on the Atlantic Indian and Pacific Ocean [J]. Collective Volume of Scientific Papers of ICCAT, 2005, 58(3): 951-973. |
| [3] | 吴峰, 戴小杰, 姜润林. 热带中东大西洋海域大青鲨繁殖生物学研究[J]. 海洋湖沼通报, 2012(3): 29-36. WU F, DAI X J, JIANG R L. Reproductive biology of blue shark in the tropical eastern central Atlantic Ocean [J]. Transaction of Oceanology and Limnology, 2012(3): 29-36. |
| [4] | CORTES E. Demographic analysis as an aid in shark stock assessment and management [J]. Fisheries Research, 1998, 39(2): 199-208. |
| [5] | SKOMAL G B, NATANSON L J. Age and growth of the blue shark (Prionace glauca) in the North Atlantic Ocean [J]. Fishery Bulletin, 2003, 11(3): 627-639. |
| [6] | PRATT H L. Reproduction in the blue shark (Prionace glauca) [J]. Fishery Bulletin, 1979, 77(2): 445-470. |
| [7] | CAREY F G, SCHAROLD J. Movements of blue sharks (Prionace glauca) in depth and course [J]. Marine Biology, 1990, 106(3): 329-342. |
| [8] | GAICHAS S K, AYDIN K Y, FRANCIS R C. Using food web model results to inform stock assessment estimates of mortality and production for ecosystem-based fisheries management[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2010, 67(9): 1490-1506. |
| [9] | LOPEZ S,MELENDEZ R, BARRIA P, et al. Preliminary diet analysis of the blue shark Prionace glauca in the eastern South Pacific[J]. Revista de Biología Marinay Oceanografía, 2010, 45(s1): 745-749. |
| [10] | STEVENS J D. Stomach contents of the blue shark (Prionace glauca) off south-west England [J]. Journal of the Marine Biological Association of the United Kingdom, 1973, 53(2): 357-361. |
| [11] | MACNAUGHTON R, ROGAN E, HERNANDES G. The importance of cephalopods in the diet of blue sharks (Prionace glauca) south and west of Ireland [J]. International Council for the Exploration of the Sea-Council Meeting, 1998, 7: 1-12. |
| [12] | MOCORD M E, STEVEN E C. A quantitative assessment of the diet of the blue shark (Prionace glauca) off Nova Scotia Canada [J]. Journal of Northwest Atlantic Fishery Science, 2003, 32: 57-63. |
| [13] | JUNIOR T V, LESSA R P, GADIG O B F. Feeding habits of the blue shark (Prionace glauca) off the coast of Brazil [J]. Biota Neotrop, 2009, 9(3): 55-60. |
| [14] | HAZIN F H V, LESSA R P, CHAMMAS M. First observations on stomach contents of the blue shark, Prionace glauca, from southwestern equatorial Atlantic [J]. Revista Brasileira De Biologia,1994, 54(2): 195-198. |
| [15] | 陈新军. 渔业资源与渔场学[M]. 北京: 海洋出版社, 2004: 78.CHEN X J. Fisheries resources and oceanography [M]. Beijing: China Ocean Press, 2004: 78. |
| [16] | 郑颖, 戴小杰, 朱江峰. 长江河口定置张网渔获物组成及其多样性分析[J]. 安徽农业科学, 2009, 7(20): 950-951.ZHENG Y, DAI X J, ZHU J F. Catch composition and diversity analysis of set net in Yangze Estuary [J]. Journal of Anhui Agriculture Science, 2009, 7(20): 950-951. |
| [17] | 覃林. 统计生态学[M]. 北京:中国林业出版社, 2009:72-74.TAN L. Biology Statistics [M]. Beijing: Chinese Forestry Press, 2009: 72-74. |
| [18] | 王军, 丘书院, 贺玉玲, 等. 福建南部沿岸水域尖头斜齿鲨的食性[J]. 台湾海峡, 1996, 15(4): 400-406.WANG J, QIU S Y, HE Y L, et al. Feeding habits of spadenose shark, Scoliodon laticaudus from southern coast of Fujian[J]. Journal of Oceanography in Taiwan Strait, 1996, 15(4): 400-406. |
| [19] | TSUNEMI K, WATANABE H, ICHII T. Feeding habits of the blue shark (Prionace glauca) and salmon shark (Lamna ditropis) in the transition region of the Western North Pacific [J]. Reviews in Fish Biology and Fisheries, 2007, 17(2): 111-124. |
| [20] | JOYCE W N, CAMPANA S E, NATANSON L J. Analysis of stomach contents of the porbeagle shark(Lamnanasus Bonnaterre) in the northwest Atlantic[J]. ICES Journal of Marine Science, 2002, 59(6): 1263-1269. |
| [21] | LABORATORIO E P, CENTRO I, CIENTFCAY E, et al. Food and feeding habits of the blue shark Prionace glauca caught off Ensenada, Baja California, Mexico, with a review on its feeding [J]. Journal of the Marine Biological Association of the United Kingdom, 2010, 90(5), 977-994. |
| [22] | ZHU J F, DAI X J, CHEN Y. Species composition and diversity of pelagic fishes based on a longline fishery catch in the North Pacific Ocean[J]. Chinese Journal of Oceanology and Limnology, 2009, 29(2): 261-269. |
| [23] | LOBNASSEUR R J. Stomach contents of blue shark (Prionace glauca) taken in the gulf of Alaska [J]. Journal Fisheries Research Board of Canada, 1964, 21(4): 861-862. |
| [24] | ANTONELLA P, CANDAN U S, HEIDI D. Comparative feeding ecology of shortfin mako, blue and thresher sharks in the California Current [J]. Environmental Biology of Fishes, 2012, 95(1): 127-146. |
| [25] | LUIS O L, VERO'NICA B G, ROBERTO C M. Effects of body size, age and maturity stage on diet in a large shark: ecological and applied implications [J]. Ecological Research, 2009, 24(1): 109-118. |
| [26] | BRUCE B D. Preliminary observations on the biology of the white shark, Carcharodon carcharias, in south Australian waters [J]. Australian Journal of Marine and Freshwater Research, 1992, 43(1): 1-11. |
2. The Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources Ministry of Education, Shanghai Ocean University, Shanghai 201306, China
 2015, Vol. 24
2015, Vol. 24


