2. 上海海洋大学 水产与生命学院, 上海 201306
罗非鱼(Tilapias)隶属于鲈形目(Perciformes)、丽鱼科(Cichlaidae),包括3个属,约70多个种[1]。罗非鱼为广盐性种类,既能够在淡水中养殖,也可以在咸水中养殖[2]。目前,衡量罗非鱼耐盐性的指标主要有 96 h半致死盐度(Median Lethal Salinity-96 h,MLS-96)、平均成活时间(Mean Survival Time,MST)和50%成活时间(Median Survival Time,ST50)[3]。这些耐盐指标具有一定的局限性,对于尼罗罗非鱼(Oreochromis niloticus)等耐盐性较差的种类,转入海水中可能短时间内大量死亡,无法获得MLS-96;而对于萨罗罗非鱼(Sarotherodon melanotheron)等耐盐性极强的种类,在高盐度的咸水中能够正常生存,其MST和ST50为无穷大[4]。罗非鱼的耐盐性非常复杂,它不仅与种类有关,还与个体大小、生理状态、驯化方式、水温、水质和营养状况等因素有关[4, 5]。所以,耐盐性能的科学评价对于罗非鱼耐盐品种的选育至关重要。
热休克蛋白(heat shock proteins,HSPs)又称应激蛋白或分子伴侣,广泛存在于从低等原核生物到高等哺乳动物的整个生物界,是进化上高度保守、功能上至关重要的蛋白。根据 HSPs分子量及等电点不同,将其分为6个家族:小分子 HSPs、HSP40、HSP60、HSP70、HSP90和 HSP110[6]。HSP70是HSPs家族中的重要成员之一,它在正常情况呈低水平的本底表达,在应激条件下(温度、渗透压、炎症、微生物感染、重金属、饥饿和缺氧等)可诱导上调表达,它作为分子伴侣参与蛋白质合成、折叠、装配和运输,可以修复和降解部分变性或已损坏的蛋白,从而增强机体的抗应激能力[7, 8, 9]。HSP70作为生物体抗逆的重要分子,它在鱼类中的调控作用由遗传特性和环境条件共同决定,且其表达水平的高低可以作为评价机体应激程度和应激能力的重要指标[10, 11]。本课题组2001年从国外引进橙色莫桑比克罗非鱼(O. mossambicus)和荷那龙罗非鱼(O. hornorum),通过杂交育种及家系选育获得了耐盐性较强、雄性率高、且生长性能较好的莫荷罗非鱼(O. mossambicus♀×O. hornorum♂)[12]。为了从分子水平评估莫桑比克罗非鱼、荷那龙罗非鱼及其正反交子代的耐盐性能,本研究比较分析了盐胁迫下4种罗非鱼的不同组织中HSP70基因的表达规律,为HSP70基因作为罗非鱼耐盐性指标的应用提供了基础资料。
1 材料与方法 1.1 材料 1.1.1 实验用鱼4种实验用鱼包括橙色莫桑比克罗非鱼、荷那龙罗非鱼、正交子代(O. mossambicus♀×O. hornorum♂)和反交子代(O. hornorum♀×O. mossambicus♂,由珠江水产研究所高要水产种质工程中心提供,鱼体体长9.2 ~ 10.8 cm,体重为30.8 ~ 49.4 g,实验前于室内条件下暂养驯化两周。驯化和实验期隔天换水约1/3,溶氧保持在7.0 mg/L以上,pH 7.0 ~8.0,水温(28 ± 2) ℃,每天饲喂量约为鱼体重的3%。
1.1.2 试剂RNA提取试剂盒购自百泰克生物技术有限公司;PrimeScriptTMⅡ试剂盒、pMD19-T Vector、 DNaseⅠ和DNA Marker均购自TaKaRa公司;SYBR Green PCR Master Mix购自Life Technologies公司。
1.2 方法 1.2.1 盐胁迫实验及取材盐胁迫实验在体积为100 L的循环水族箱中进行,每种罗非鱼设置实验组与对照组,各3个平行组,每个平行20尾鱼。实验组罗非鱼在0 h从淡水中直接转入盐度为22的咸水中,48 h后将盐度直接调高至35;对照组罗非鱼始终养殖于淡水中。在0 h、24 h、48 h和96 h分别从实验组和对照组的3个平行组中各取3尾罗非鱼,无菌解剖取鳃、肾、垂体和肌肉4种组织速冻于液氮中,备用。
1.2.2 RNA提取及cDNA的合成冻存组织的总RNA抽提采用动物组织RNA小量提取试剂盒,步骤参照该试剂盒说明书。采用DNaseⅠ去除RNA中残留的基因组DNA,1 % 琼脂糖电泳检测总RNA质量,并通过核酸蛋白定量仪(Eppendorf)检测总RNA浓度。采用PrimeScriptTMⅡ试剂盒合成单链cDNA,步骤详见该试剂盒说明书。
1.2.3 罗非鱼HSP70 mRNA RT-PCR检测方法的建立为了筛选在实验条件下稳定表达的内参基因,本实验设计了4个内参基因(核糖体18S亚基(18S rRNA)、甘油醛-3-磷酸脱氢酶(GAPDH)、肌动蛋白(β-actin)和翻译延伸因子1α亚基(EF1-α)及目的基因HSP70的荧光定量PCR引物,引物序列见表1。通过绝对荧光定量方法检测两次盐胁迫下4种罗非鱼的不同组织(鳃、肾、垂体和肌肉)在不同时间点(0 h、24 h、48 h和96 h)上述4种内参基因的拷贝数,利用在线软件RefFinder (http://www.leonxie.com/referencegene.php) 进行内参基因稳定性分析,筛选稳定性最佳的内参基因用于盐胁迫下HSP70 基因的表达分析。
| 表1 荧光定量PCR引物序列 Tab 1. The primers for RT-PCR |
RT-PCR采用SYBR Green PCR Master Mix (Life Technologies) 试剂盒,实验步骤参照说明书进行,在ABI 7300荧光定量PCR仪上进行反应,总反应体系为20 μL,内含cDNA模板1 μL,上下游引物各0.4 μL(浓度为10 μmol/L),SYBR Green PCR Master Mix 10 μL和ddH2O 8.2 μL。反应条件为95 ℃ 2 min;95 ℃ 15 s,57 ℃ 15 s,72 ℃ 1 min,共40个循环,65~ 95 ℃进行熔解曲线分析。每个样品做3个重复以减少误差。
1.2.4 数据分析盐胁迫下不同时间点HSP70 基因的表达量分析采用2-ΔΔCt法[13],ΔΔCt = ΔCt (test)-ΔCt (control),其中ΔCt (test)=Ct (test,target)-Ct (test,reference),ΔCt (control)=Ct (control,target)-Ct (control,reference)。 应用SPSS 17.0统计软件中单因素方差分析对数据进行统计学分析,以P<0.05为显著差异水平。
2 结果 2.1 盐胁迫条件下4种罗非鱼的存活情况4种罗非鱼从淡水直接转入盐度22的咸水中,在0~24 h时间段内均未出现死亡情况,但4种罗非鱼的体色都明显变暗,抢食不积极;48 h时,除了正交子代中没有发现死亡现象,其他3种罗非鱼均出现死亡。48 h后盐度调高至35,4种罗非鱼的体色发黑,游动缓慢,且接近水面独游,96 h时4种罗非鱼均有死亡(表2)。4种罗非鱼中父母本(莫桑比克罗非鱼和荷那龙罗非鱼)的累计死亡数均大于正反交子代的累计死亡数。
| 表2 盐胁迫实验中4种罗非鱼的死亡情况 Tab 2. The deaths of four kinds of tilapia under salt stress |
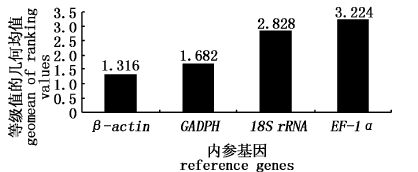
通过绝对荧光定量PCR方法检测了两次盐胁迫下(0~24 h为盐度22,48 h后将盐度调至35)不同时间点(0 h、24 h、48 h和96 h)4种罗非鱼的鳃、肾、垂体和肌肉等4种不同组织中18S rRNA、GAPDH、β-actin和EF1-α 4个内参基因的拷贝数,在线软件RefFinder对内参基因稳定性分析结果见图1,等级值的几何均值越低的内参基因综合稳定性越好,4种罗非鱼中内参基因的综合稳定性的排序为β-actin>GAPDH>18S rRNA> EF1-α。
|
图1 盐胁迫下4个内参基因在4种罗非鱼中的综合稳定性 Fig.1 The comprehensive stability of 4 reference genes in 4 kinds of tilapia |
4种罗非鱼受到盐胁迫后各组织中HSP70基因表达量的变化规律存在差异。盐度22条件胁迫下0~48 h内,4种罗非鱼鳃组织中HSP70 表达量总体上都呈现随时间先增加后减少的变化趋势,24 h时达最大值。其中反交子代在24 h时,HSP70 表达量与0 h时无显著差异(P>0.05),而其他3种罗非鱼则与0 h时差异显著(P<0.05);48 h时莫桑比克罗非鱼和正交子代鳃中HSP70基因的表达量下降到初始水平(0 h),而荷那龙罗非鱼和反交子代鳃中HSP70基因的表达量显著低于初始水平。48 h后将盐度上调至35,96 h 时4种罗非鱼鳃中HSP70基因的表达量与48 h时无显著差异(图2)。

|
图2
盐胁迫下罗非鱼鳃中HSP70表达水平变化规律
Fig.2
The expression level of HSP70 gene in the gill of tilapia under salt stress
结果以平均值±标准差形式表示,相同类型柱子上方不同字母表示HSP70基因相对表达量间差异显著(P<0.05),相同字母则表示差异不显著(P>0.05),下图同。 The values showed as mean ± S.D,Different letters above the same type of bars indicate there was a significantly difference in the relative expression of HSP70 (P<0.05),while the same letters indicate there was not a significantly difference (P>0.05).The following figures are the same. |
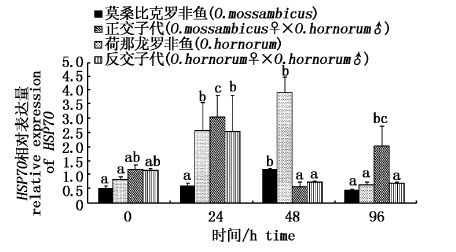
盐度为22条件胁迫下,正反交子代肾组织中 HSP70基因表达量在0~48 h内先增加后降低,24 h时达到峰值;莫桑比克罗非鱼和荷那龙罗非鱼肾中HSP70表达量在0~48 h内持续增加,48 h达最大值,其中荷那龙罗非鱼肾中 HSP70表达量在24 h已显著高于0 h。盐度上调至35后,正交子代罗非鱼肾中 HSP70表达量在96 h时较48 h急剧增加,莫桑比克罗非鱼和荷那龙罗非鱼肾中 HSP70表达量在96 h时较48 h显著下降,而反交子代则无显著变化(图3)。
|
图3 盐胁迫下罗非鱼肾中HSP70表达水平变化规律 Fig.3 The expression level of HSP70gene in the kidney of tilapia under salt stress |
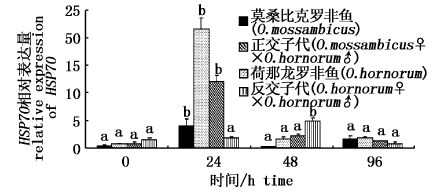
盐度为22条件胁迫下,莫桑比克罗非鱼、荷那龙罗非鱼和正交子代垂体中 HSP70基因表达量在0~48 h内先增加后降低,24 h时达到峰值,48 h时降至初始水平(0 h)。反交子代垂体中HSP70表达量在0~48 h内持续缓慢增加,48 h达最大值。盐度上调至35后,莫桑比克罗非鱼、荷那龙罗非鱼和正交子代垂体中 HSP70基因表达量在96 h时与48 h之间无显著变化,而反交子代垂体中 HSP70表达量在96 h较48 h显著降低(图4)。
|
图4 盐胁迫下罗非鱼垂体中HSP70表达水平变化规律 Fig.4 The expression level of HSP70gene in the pituitary of tilapia under salt stress |
盐度为22条件胁迫下,荷那龙罗非鱼和正反交子代肌肉中 HSP70基因表达量在0~48 h内先增加后降低,24 h时达到峰值,48 h时降至初始水平(0 h)。莫桑比克罗非鱼肌肉中HSP70表达量在24 h达最大值,且持续至96 h。盐度上调至35后,4种罗非鱼肌肉中 HSP70基因表达量在96 h时与48 h之间都无显著变化(图5)。

|
图5 盐度胁迫下罗非鱼肌肉中HSP70表达水平变化规律 Fig.5 The expression level of HSP70gene in the muscle of tilapias under salt stress |
利用实时荧光定量RT-PCR方法检测基因表达量具有准确、特异和简便等特点,它广泛应用于动植物及微生物功能基因表达水平及其变化规律的研究。利用相对荧光定量PCR方法进行研究时,其结果需用内参基因进行校正和标准化。通常选用管家基因作为内参基因,因其具有分布广泛、组成型表达和稳定性好等特点[14]。目前鱼类中常用作内参的管家基因主要有:β-actin、EF1-α、GAPDH和18S rRNA[15, 16]。但这些管家基因的稳定性受到物种、细胞、组织差异、细胞周期、发育阶段和实验条件的影响,目前尚无适用于所有组织、细胞和实验条件的内参基因[15, 16, 17, 18]。所以利用RT-PCR对功能基因进行定量分析时,筛选在特定实验条件和组织材料中稳定表达的内参基因显得至关重要。目前用于分析内参基因稳定性的软件主要有BestKeeper、geNorm和NormFinder[19],本实验采用的在线软件RefFinder综合了以上3个软件及△Ct 值比较法来对内参基因进行比较和排序。本实验比较了在盐胁迫时,4种罗非鱼不同组织中18S rRNA、GAPDH、β-actin和EF1-α基因的稳定性,结果表明β-actin综合稳定性最好,因而在分析盐胁迫下4种罗非鱼中HSP70基因表达水平时,选用β-actin作为内参基因。
盐度是水生生物养殖环境中的重要理化因子,它通过影响生物的生理代谢来影响其生存和分布。盐度剧烈变化会对细胞内离子调控产生不利的影响,细胞内蛋白质肽链伸展后失去了原有的折叠结构,导致其空间构型改变,从而失去原有的功能。这可诱导机体大量表达热休克蛋白(HSPs)来修复或降解细胞内变性蛋白质以减少其累积,或协助未成熟的蛋白质运送至目标细胞器以完成最后的折叠、装配或代谢,从而提高细胞对渗透压剧烈变化的适应能力[20]。
本研究结果表明在盐度22条件胁迫下24 h时莫桑比克罗非鱼、荷那龙罗非鱼及其正交子代鳃中HSP70 mRNA含量显著高于0 h时的含量;到48 h时,鳃组织中HSP70基因的表达量都下降至初始水平(0 h)或低于初始水平。鳃是鱼类重要的渗透压调节器官,鳃上皮分布的氯细胞在淡水中可以吸收盐分,在海水中则排出盐以适应水体环境盐度变化。当鱼从低盐度水体转入较高盐度水体中时,氯细胞的数量和形态会发生改变以适应高盐环境[21]。但这种适应需要一定的调节过程和时间,AL-AMOUDI [22]研究表明罗非鱼每胁迫到一个较高的盐度需要48 h的适应时间。在0~24 h,由于外界盐度的剧烈变化影响罗非鱼鳃细胞中离子调节,使细胞内部分蛋白质失去正常空间构象而失活,这时鳃中HSP70的上调表达有利于修复变性蛋白,维持鳃细胞的正常功能;到48 h时,罗非鱼已通过增加鳃中氯细胞数目、改变氯细胞类型等生理调节适应盐度为22的环境,HSP70表达受到抑制。反交子代鳃中HSP70在盐度22条件胁迫下并未上调表达,这可能与其鳃组织的离子调节作用较强有关,通过加快其泌盐作用适应盐度胁迫。本研究结果还表明,48 h后将盐度上调至35,到96 h 时4种罗非鱼均出现死亡现象,且鱼体色发黑,游动缓慢,这说明4种罗非鱼在96 h时的盐胁迫已经超过其耐受能力,导致内环境渗透压失衡,新陈代谢受到抑制,细胞结构遭到破坏,最终导致死亡;96 h时4种罗非鱼鳃中HSP70基因都未再次上调表达,这不仅与极端盐度下,氯细胞渗透压调节能力下降,各种酶和其他细胞结构无法转移多余盐分,从而影响机体生理生化反应,使其代谢率降低,热休克蛋白的合成受阻有关[23],也与细胞保护耐受性的获得有关。研究表明,应激后合成的 HSP70 蛋白可以使细胞对下一次热休克刺激的抗性增强,这种对再次出现的应激有保护耐受性的获得主要通过分子伴侣作用、抗氧化作用、协同免疫作用和抗细胞凋亡作用来实现[24]。
淡水硬骨鱼类肾脏中肾小球数目多,通过肾小球的泌尿作用和肾小管的重吸收作用,形成浓度极低的大量尿液,从而对保持机体水盐平衡具有重要作用[25]。本研究表明在盐度22条件胁迫下,正反交子代肾组织中 HSP70基因表达量在24 h时达最大值,而两个亲本肾组织中HSP70表达量到48 h才达到最大值。这可能是由于正反交子代肾细胞对渗透压变化比亲本肾细胞更敏感,诱导HSP70的快速高表达有利于维持肾细胞的正常生理功能,从而获得较强的耐盐能力。杨淞等[26]研究结果表明,莫桑比克罗非鱼和荷那龙罗非鱼的MLS-96分别为22.29和21.56,刘玉姣[27]的研究表明莫桑比克罗非鱼与荷那龙罗非鱼正交子代和反交子代的MLS-96分别为29.80和29.38,由此可见两个亲本的耐盐能力相当,而正反交子代的耐盐性要显著高于亲本,表现出明显杂种优势。当盐度调高至35后,在96 h时只有正交子代肾中HSP70基因再次上调表达,这表明虽然正反交子代的MLS-96相近,但单个耐盐指标并不能准确反映机体的耐盐性能,正交子代肾细胞的耐盐性要高于反交子代肾细胞,其在高盐条件下仍可维持其细胞正常生理功能,合成抗逆所需蛋白质。
垂体是鱼类重要的内分泌器官,参与鱼类的生长、发育、生殖和渗透压调节等生命活动,例如垂体分泌的催乳素(Prolactin,PRL)参与胚胎和仔鱼渗透压调节[28, 29]。本研究结果表明,反交子代垂体中HSP70表达量在0~48 h内持续缓慢增加,48 h时达最大值,而其他3种罗非鱼垂体中HSP70表达量在24 h达到峰值,48 h 时下降至初始水平(0 h),这表明反交子代垂体细胞对渗透压变化相对不敏感,持续缓慢地增加热休克蛋白水平以维持其正常机能,而其他3种罗非鱼的垂体对盐度变化敏感度较高。肌肉虽然不是鱼类渗透压调节器官,但盐度能够影响肌肉含水量、粗蛋白和粗灰分等常规成分[30],因此肌肉中HSP70的表达水平可以反映盐度对其影响大小。在盐度22条件胁迫下,荷那龙罗非鱼及正反交子代肌肉中HSP70表达量均先上升后下降,在24 h时达到峰值,盐度升高至35后,HSP70表达量未再次增加;而莫桑比克罗非鱼肌肉中HSP70基因在盐度22条件胁迫后表达量迅速升高,且一直持续到第二次高盐胁迫之后,这说明盐度变化对莫桑比克罗非鱼肌肉影响程度较大,持续高表达HSP70有利于其修护和降解细胞内氧化损伤蛋白,维持细胞正常生理活性。
综上所述,盐胁迫可以引起莫桑比克罗非鱼、荷那龙罗非鱼及其正反交子代各组织中HSP70表达水平的变化,不同品种和组织之间存在差异。HSP70在应激前呈本底表达,而在应激后其表达量显著增加,因此其表达水平的高低可以作为评价不同罗非鱼耐盐能力和应激程度的指标。其中,盐胁迫下肾组织中HSP70的表达规律与罗非鱼耐盐能力之间相关性较强,可以作为评价以上4种罗非鱼耐盐能力的潜在分子指标。但HSP70的表达易受胁迫盐度高低和处理时间长短的影响,HSP70表达水平作为罗非鱼耐盐性分子指标的应用还需从以上方面进一步深入研究。
| [1] | TREWAVAS E. Tilapia and sarotherodon[J]. Buntbarsche Bull, 1980, 81(1): 1-6. |
| [2] | AL-AMOUDI M M. The effect of high salt diet on the direct transfer of Oreochromis mossambicus, O. spilurus and O. aureus, O. niloticus hybrids to sea water[J]. Aquaculture, 1987, 64: 333-338. |
| [3] | VILLEGAS C T. Evaluation of the salinity tolerance of Oreochromis mossambicus, O. niloticus and their F1 hybrids[J]. Aquaculture, 1990, 85: 281-292. |
| [4] | 范武江, 李思发, 孟庆辉, 等. 4种遗传型罗非鱼的耐盐慢性驯化表现[J]. 中国水产科学, 2012, 19(3): 430-435.FAN W J, LI S F, MENG Q H, et al. Saltwater tolerance of Oreochromis niloticus (NEW GIFTS), Sarotherodon melanotheron, and their F1 and F2 hybrids[J]. Journal of Fishery Sciences of China, 2012, 19(3): 430-435. |
| [5] | LEMARIE G, BAROILLER J F, CLOTA F, et al. A simple test to estimate the salinity resistance of fish with specific application to O. niloticus and S. melanotheron[J]. Aquaculture, 2004, 240 (1/4): 575-587. |
| [6] | HIGHTOWER L E. Heat shock, stress proteins, chaperones, and proteotoxicity[J]. Cell, 1991, 66(2): 191-197. |
| [7] | ELLIS R J. Molecular chaperones: Plugging the transport gap[J]. Nature, 2003, 421 (6925): 801-802. |
| [8] | DAS P, GUPTA A, MANNA S K. Heat shock protein 70 expression in different tissues of Cirrhinus mrigala (Ham.) following heat stress[J]. Aquaculture Research, 2005, 36(6): 525-529. |
| [9] | BASU N, TODGHAM A E, ACKERMAN P A, et al. Heat shock protein genes and their functional significance in fish[J]. Gene, 2002, 295(2): 173-183. |
| [10] | KAYHAN F E, DUMAN B S. Heat shock protein genes in fish[J]. Turkish Journal of Fisheries and Aquatic Sciences, 2010, 10: 287-293. |
| [11] | 李莉萍, 陈明, 唐章生, 等. 5个品系罗非鱼热休克蛋白Hsp70 基因序列比对分析[J]. 西南农业学报, 2009, 22(3): 828-833.LI L P, CHEN M, TANG Z S, et al. Sequence comparison of heat shock protein 70 gene from five strains of tilapia[J]. Southwest China Journal of Agricultural Sciences, 2009, 22(3): 828-833. |
| [12] | 杨淞, 汪开毓, 黄樟翰, 等.两种罗非鱼主要生物学性状及杂交F1代生长性能的研究[J]. 四川农业大学学报, 2008, 26(1): 93-98.YANG S, WANG K Y, HUANG Z H, et al. Studies on the principal biological characteristics of Oreochromis hornorum, Oreochromis mossambicus and the growth performance of hybrid F1[J]. Journal of Sichuan Agricultural University, 2008, 26(1): 93-98. |
| [13] | LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CT method[J]. Methods, 2001, 25(4): 402-408. |
| [14] | 陈凤花, 王琳. 实时荧光定量RT-PCR内参基因的选择[J]. 临床检验杂志, 2005, 23(5): 393-395.CHEN F H, WANG L. Reference genes select for real-time fluorescent quantitative reverse transcription-polyerase chain reaction(RT-PCR)[J]. Chinese Journal of Clinical Laboratory Sience, 2005, 23(5): 393-395. |
| [15] | OLSVIK P A, LIE K K, JORDAL A E O, et al. Evaluation of potential reference genes in real-time RT-PCR studies of Atlantic salmon[J]. BMC Molecular Biology, 2005, 6(1): 21. |
| [16] | PANG J C, GAO F Y, LU M X, et al. Major histocompatibility complex class ⅡA and ⅡB genes of Nile tilapia Oreochromis niloticus: Genomic structure, molecular polymorphism and expression patterns[J]. Fish & Shellfish Immunology, 2013, 34: 486-496. |
| [17] | 董捷. 草鱼四个候选内参基因稳定性比较及两个免疫相关基因的克隆与表达研究[D]. 陕西: 西北农林科技大学, 2010.DONG J. Studies on the stability of four candidate internal reference genes and molecular cloning and expression of two immunization-associated genes in grass carp, Ctenopharyngodon idellus[D]. Shanxi: Northwest Agriculture & Forestry University, 2010. |
| [18] | RADONIC A, THULKE S, MACKAY I M. Guideline to reference gene selection for quantitative real-time PCR[J]. Biochemical and Biophysical Research Communications, 2004, 313(4): 856-862. |
| [19] | FERNANDES J M O, MOMMENS M, HAGEN O, et al. Selection of suitable reference genes for real-time PCR studies of Atlantic halibut development[J]. Comparative Biochemistry and Physiology. Part B, Biochemistry﹠Molecular biology, 2008, 150(1): 23-32. |
| [20] | YANG X D, FEIGE U. Heat shock proteins in autoimmune disease. From causative antigen to specific therapy? [J]. Cellular and Molecular Life Sciences: CMLS, 1992, 48(7): 650-656. |
| [21] | AVELLA M, BERHAUT J, BORNANCIN M. Salinity tolerance of two tropical fishes, Oreochromis aureus and O. niloticus. I. Biochemical and morphological changes in the gill epithelium[J]. Journal of Fish Biology, 1993, 42(2): 243-254. |
| [22] | AL-AMOUDI M M. Acclimation of commercially cultured Oreochromis species to sea water-an experimental study[J]. Aquaculture, 1987, 65: 333-342. |
| [23] | JONNASSEN T M, PITTMAN K, IMSLAND A K. Seawater acclimation of tilapia, Oreochromis spilurus Günter, fry and fingerlings[J]. Aquaculture Research, 1997, 28(3): 205-214. |
| [24] | RIABOWOL K T, MIZZEN L A, WELCH W J. Heat shock is lethal to fibroblasts microinjected with antibodies against hsp70[J]. Science, 1988, 242(4877) : 433-436. |
| [25] | 林浩然. 鱼类生理学[M]. 广州:广东高等教育出版社, 1999: 109-139.LIN H R. Fish Physiology[M]. Guangzhou:Guangdong Higher Education Press, 1999: 109-139. |
| [26] | 杨淞, 卢迈新, 黄樟翰, 等. 莫桑比克罗非鱼和荷那龙罗非鱼耐盐性的初步研究 [J]. 齐鲁渔业, 2006, 23(5): 7-9.YANG S, LU M X, HUANG Z H, et al. Preliminary study on salinity tolerance of Oreochromis mossambicus and Oreochomis hornorum[J]. Shandong Fisheries, 2006, 23(5): 7-9. |
| [27] | 刘玉姣. 橙色莫桑比克罗非鱼、荷那龙罗非鱼及其正反交子代耐盐性及耐盐相关基因的研究[D]. 上海: 上海海洋大学, 2014.LIU Y J. A Study on salinity and genes correlated to salt-tolerance of Oreochromis mossambicus, O.hornorum and their hybrids[D]. Shanghai: Shanghai Ocean University, 2014. |
| [28] | 谢碧文,王志坚,张耀光. 鱼类垂体发育研究进展[J]. 水生生物学报, 2008, 32(1): 102-108.XIE B W, WANG Z J, ZHANG Y G. The review of the studies on the development of the pituitary in fish[J]. Acta Hydrobiology Sinica, 2008, 32(1): 102-108. |
| [29] | KIMURA R, TANAKA M. Prolactin production during larval and early juvenile periods of euryhaline marine fish, black sea bream Acanthopagrus schlegeli[J]. Nippon Suisan Gakkaishi, 1991, 57: 1833-1837. |
| [30] | 冯连华. 低盐环境对斜带石斑鱼幼鱼生长、生理的影响[D]. 广东: 广东海洋大学, 2012.FENG L H. Effects of low salinity on growth and physiology of juvenile orange-spotted grouper (Epinephelus coioided)[D]. Guangdong: Guangdong Ocean University, 2012. |
2. College of Fisheries & Life, Shanghai Ocean University, Shanghai 201306, China
 2015, Vol. 24
2015, Vol. 24


