2. 中国水产科学研究院黄海水产研究所, 山东 青岛 266071
贝类的壳色既受遗传基因的控制,又受环境因素、饵料等的影响[1],在遗传方面,不同壳色之间存在显隐性关系[2, 3, 4],并符合孟德尔遗传规律,同时某些贝类壳色还与存活、生长、发育及抗病力等数量性状存在关系[2, 5, 6],壳色可以作为优良性状的标记色用于选育研究[7, 8, 9, 10],通过壳色定向选育及杂交、家系育种等手段,培育出生长快、抗逆性强的新品系[11, 12],提高养殖成活率和产量,通过壳色遗传研究推进贝类养殖良种化具有重要意义。对贝类壳色遗传机制的研究,目前主要通过开展家系培育等手段制备纯合子或在实践中挑选壳色稳定遗传的个体,然后通过杂交、测交等方法对其后代的壳色分离状况进行统计学分析,研究其遗传规律[2, 3, 4, 13, 14, 15, 16];同时开展壳色与生长、存活和发育等生产性状的关联性研究,进行定向选择,培育优良新品系或品种。
青蛤(Cyclina sinensis)从滩涂中挖出时呈现比较光亮的青黑色,只有边缘呈现白色或紫色,当壳面表层物质被氧化后显现其本色,一般为白色、紫色和白紫混合色,只有极少数为棕黄色。青蛤自然种群中紫壳个体时多时少、时有时无,紫色时深时浅,渔民认为与其生活的底质有关,与遗传没有关系。青蛤贝壳颜色不但有白壳与紫壳的区别,属于质量性状的特点,而且紫壳个体的紫色区域有大有小,是一个连续的变化过程,又有数量性状的特点。目前尚未见关于青蛤壳色遗传性的研究报道,仅见青蛤家系建立及早期生长发育的研究[17]。青蛤的繁殖存在群体效应,单独或配对不产卵或排精,而且产卵量少,卵径小,家系后期保留比较困难[17],增加了通过家系进行壳色遗传研究的难度。
在不确定青蛤壳色能否遗传,不知如何取得纯合子,家系培育困难的情况下,本研究将自然种群亲贝中的白壳、紫壳个体分离进行群体繁育和养成,通过分析F1壳色分离状况初步研究了青蛤壳色的遗传性,通过F1幼贝在不同底质中养成后的壳色表现研究了底质对壳色的影响,为青蛤壳色遗传性的深入研究和利用打下了基础。
1 材料与方法 1.1 实验材料实验材料包括壳长30~40 mm的青蛤自然种群;25 m2 的工厂化苗种培育池10 个及相关附属设施,20 m2 的室内单胞藻培养池10 个及相关附属设施,各类工具、网具;室外池塘围网0.33 hm2,宽40 cm×长60 cm×深10 cm的塑料盘48个,海泥(粒径10~90 μm,平均小于20 μm)、粉沙(粒径50~800 μm,平均178 μm)、细沙(粒径110~1 300 μm,平均350 μm)若干,浮子48个;尺子,小电子天平等。
1.2 实验方法青蛤自然种群壳色特征观察:青蛤自然种群采自渤海莱州湾潍河口附近滩涂,放入不放底质的水箱中培养5 d,使贝壳上的黑色沉积物在海水中被氧化,显其本色,观察其壳色一般外观特征。
实验一:白壳群体F1(以下简称“白群F1”)与紫壳群体F1(以下简称“紫群F1”)壳色分离对比实验。将发育成熟的自然种群亲贝中的白壳个体和紫壳个体分离组成紫壳群体和白壳群体,分别进行人工催产、幼体培育、稚幼贝培育,培育路线同青蛤工厂化苗种培育[18]。每个群体F1分别在3个水泥池中培育,即设3个平行。实验中,除催产时间相差几天外,其他设施条件和管理措施,如育苗池、水质调节、饵料、附着基、倒池、光照调节等一系列管理措施上力求相同,基本排除了环境和人为因素的影响,两者之间可能出现的壳色分离差异只能来自遗传因素。经三个多月的人工培育,壳长达到3~7 mm,壳色明显分离,此时从每池中随机取样,按壳色出现紫色与否,紫色区域位置与大小和个体数量与所占百分率进行统计和分析。如果两个群体F1在壳色分离上完全相同,说明白、紫壳色与遗传无关;如果发生显著差异,并强化了亲本壳色表现则说明白、紫壳色能够真实遗传。
实验二:不同底质对F1壳色影响对比实验。取越冬成活的实验一所得的F1个体,放入铺设5 cm厚不同底质的塑料实验盘中,沉于池塘中养成,作对比实验。实验个体为:白群F1(壳长4~7 mm)、紫群F1(壳长4~7 mm)、紫群F1中选择的纯紫个体(以下简称“紫选纯紫F1”,壳长5~7 mm)、混合群体(指未按壳色分离的自然群体)F1中选择的纯紫个体(以下简称“混选纯紫F1”,壳长4~6 mm),每个群体设3个平行,每个平行设海泥、粉沙、细沙3种底质和无底质4种类型。至2013年底,所有个体均应长至壳长10 mm以上,壳色初步定型,此时对各平行壳色分离情况进行统计分析。如果3种底质间壳色分离出现显著差异,则说明生活底质对青蛤壳色表现有显著性影响。
1.3 数据处理实验中的百分率数据主要用“平均值±标准差”表示。对实验中出现的壳色及其他分离情况的比较,包括紫群F1与白群F1之间及它们与亲贝之间,同一群体F1不同底质之间,不作说明时均用Excel 2010 软件中的t-检验法进行差异显著性检验,对个别实验数据采用百分率u-检验法检验,P>0.05 表示差异不显著,P﹤0.05表示存在显著差异,P﹤0.01表示存在极显著差异。
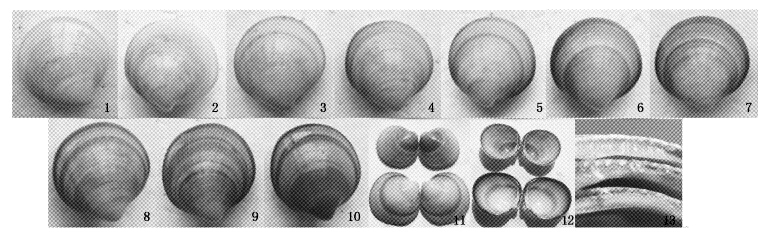
2 结果与分析 2.1 自然群体青蛤壳色的特点显示本色的青蛤成体15 kg,壳长30~35 mm,平均102 粒/kg,共1 530粒。其中白壳个体约1 068粒,占总数的69.80%,紫壳个体462 粒(包括所有带紫色的个体)占30.20%,为多次调查中最多的一次。图版Ⅰ-1~10为青蛤的整体壳色表现,包括纯白个体(图版Ⅰ-1)、白紫混合个体(图版Ⅰ-2~9)和纯紫个体(图版Ⅰ-10)。其中图版Ⅰ-2~9各类型之间还有过渡类型,图版Ⅰ-9与图版Ⅰ-10之间无过渡类型。对于白紫混合个体,壳顶处有近圆形的白色区域,边缘比较清晰并与生长线平行。
|
图版Ⅰ 青蛤自然种群壳色特征 1. 纯白个体; 2~9. 白紫混合个体; 10. 纯紫个体; 11. 外壳面; 12. 内壳面; 13. 紫壳断面。 1. pure white individual; 2-9. white and purple double-color individuals; 10. pure purple individual; 11. outer surface of purple shell; 12. inner surface of purple shell; 13. section of purple sheel. PlateⅠ Shell color characteristics of natural population Cyclina sinensis (Gmelin) |
青蛤紫壳个体的紫色分布有明显的规律性,增强了遗传的可能性。(1)所有紫壳个体的紫色区域无论形状、大小、位置还是颜色深浅,在左右两壳是完全对称的(图版Ⅰ-11,12),而且不仅外壳面为紫色,其内壳面和断面也呈紫色(图版Ⅰ-12,13)。(2)从壳顶两侧紫色区域与生长线判断,所有紫壳个体的紫色区域最早出现于壳顶两侧的壳缘,随着生长逐渐向中部延伸并相连,紫色出现得越早则相连得越早,壳顶处白色区域就越小。
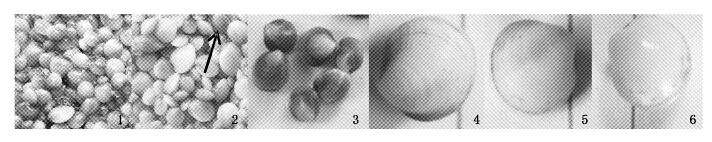
2.2 实验一结果与分析2012年7月13日和17日,分别对20 kg紫壳个体和40 kg白壳个体进行人工催产(亲贝采自粉沙质滩涂),幼体伏底后,取部分F1稚贝放入3 个25 m2的实验育苗池中培养(各约100 万粒)。紫群F1中出现的紫壳个体随着生长逐渐增多,10月20日F1壳长达到3~7 mm,壳色出现明显分离,此时进行分类统计。紫群F1的3 个平行总存活量约120万粒,存活率约40%;白群总存活量约110万粒,存活率约34%。整体观察,紫群F1中出现了很多的紫壳个体(图版Ⅱ-1),而白群F1中则很少(图版Ⅱ-2)。
|
图版Ⅱ 紫群F1和白群F1在实验一后的壳色表现(壳长3~7 mm) 1. 紫群F1整体表现; 2. 白群F1整体表现,箭头所指为纯紫个体; 3. 纯紫个体; 4. 壳缘紫个体; 5. 紫色带个体; 6. 纯白个体。 1. entire shell color expression of purple group group F1; 2. entire shell color expression of while group F1,individual that the arrow pointing to is pure purple; 3. pure purple individuals; 4. purple edge individual; 5. purple stripe individual; 6. pure white individual. PlateⅡ Shell color expression of purple group F1 and white group F1 after 1st expt. (shell length 3~7 mm) |
两个群体F1在壳长3~7 mm时出现了4种壳色类型。一是除壳顶处有直径2 mm的白色区域外全为紫色的“纯紫个体”(图版Ⅱ-3),但颜色深浅不一;二是壳顶两侧壳缘为紫色的“壳缘紫个体”(图版Ⅱ-4);三是壳面出现不同深浅紫色带的“紫色带个体”(壳缘紫个体中出现紫色带的不包括在内,图版Ⅱ-5);四是贝壳全为白色的“纯白个体”(图版Ⅱ-6)。
2.2.2 两个群体F1不同壳色类型的百分率对白群F1和紫群F1按4种壳色类型(图版Ⅱ-3~6)进行百分率统计(表 1)。同时,为便于两个群体F1与未分离种群亲贝壳色情况的比较,将纯紫和壳缘紫个体合并为紫壳个体;亲贝中未见紫色带个体,可能因活动磨去而表现为纯白个体,因此将紫色带和纯白个体合并为白壳个体,然后再进行百分率统计(表 2)。
| 表 1 白群F1和紫群F1在实验一后的壳色分离对比 Tab. 1 Shell color segregation contrast of purple group F1 and white group F1 after 1st expt. |
| 表 2 白群F1和紫群F1在实验一后与亲贝壳色分离对比 Tab. 2 Shell color segregation contrast of purple group F1,white group F1 and parent group after 1st expt. |
从表 1可以看出,无论白群F1还是紫群F1,不同壳色个体百分率的标准差很小,说明了本实验阶段壳色分离的稳定性。经检验,紫群F1中的纯紫个体百分率和壳缘紫个体百分率均显著高于白群F1(P﹤0.01);而紫色带个体百分率和纯白个体百分率均显著低于后者(P﹤0.01)。同时根据表 2 检验,紫群F1 中的紫壳个体百分率显著高于亲贝(P﹤0.01),而亲贝显著高于白群F1(P﹤0.01);同理,白群F1中的白壳个体百分率显著高于亲贝(P﹤0.01,需在实验二中重新检验),而亲贝显著高于紫群F1(P﹤0.01,差异显著性还将随着生长进一步扩大)。以上结果说明,通过将自然种群亲贝白、紫壳色个体的分离繁育,使其F1在壳色上出现了稳定的分离,并得到了相同于亲本壳色的显著纯化,这就说明白、紫壳色能够真实遗传。
2.3 实验二结果与分析实验于2013年5-11月实施,各组每盘中放入苗种数量与壳色情况见表 3。每组每个平行按顺序依次放入盘中,待幼贝钻入底质后,将其拖入池塘深处,离岸5 m,水深0.8 m。
在实验过程中发现,未铺底质的实验盘中幼贝均大量死亡,少数成活个体生长缓慢,可见底质是青蛤存活和生长的必要条件,因其状况已失去实验价值,不再做继续实验和分析。另外,实验过程中相邻围网中养殖的梭子蟹通过破损的网衣混入了实验区,致使部分实验盘中的青蛤F1遭到不同程度的捕食(可见大量碎壳),剩余数量较少,增大了实验误差,分析时需加以考虑。
| 表 3 4个组每盘中放入的F1数量 Tab. 3 F1 amount of four series put into one plate |
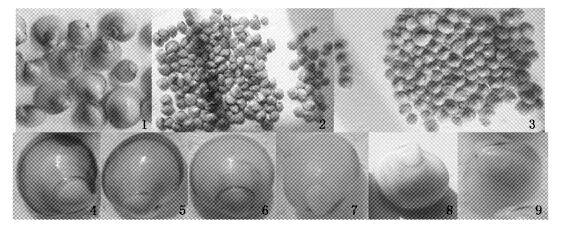
紫选纯紫F1(壳长12~14 mm)和混选纯紫F1(壳长11~13 mm)壳色在3种底质中都出现了相同的变化情况,一是延续原来的纯紫色,其紫色深浅与放入时的深浅无关;二是由纯紫色变为壳顶及两侧壳缘为紫色、壳缘中部为白色的“紫顶白边个体”(图版Ⅲ-1),转为此类个体与否也与原来的紫色深浅无关。紫选纯紫F1和混选纯紫F1在3种底质中壳色分离百分率见表 4、5。经检验,在泥质中有更多的纯紫个体转为“紫顶白边个体”,与粉沙质和细沙质差异显著(P﹤0.01),而粉沙质与细沙质差异不显著(P﹥0.05)。可见沙质底利于紫色壳色的继续表达。
|
图版Ⅲ 4个实验群体F1在实验二后的壳色表现(壳长11~14 mm) 1. 紫选纯紫F1和混选纯紫F1中部分个体变为紫顶白边个体; 2. 紫群F1壳色整体表现(左:紫壳个体,右:白壳个体); 3. 白群F1壳色表现(左:紫壳个体,右:白壳个体); 4. 紫群F1中的壳缘紫个体边缘紫色相连; 5、6. 紫群F1中的纯白个体边缘出现紫色并相连; 7. 紫群F1中的纯白个体边缘出现紫色但未相连; 8. 白群F1中的紫色带个体仍有微弱表现; 9. 白群F1中的少数纯白个体在壳缘出现微弱紫色。 1. part of pure purple individuals developed into purple-top white-edge individuals; 2. entire expression of purple group F1 ( left: purple shell individuals, right: white shell individuals); 3. entire expression of white group F1 (left: purple shell individuals, right: white shell individuals); 4. the inconsecutive purple area of purple edge individual developed into consecutive (purple group F1); 5~6. white edge of pure white individual developed into consecutive purple edge (purple group F1); 7. white edge of pure white individual developed into inconsecutive purple edge (purple group F1); 8. weak purple color expression of purple stripe individual (white group F1); 9. few pure white individuals expressed weak purple color at shell edge(white group F1). PlateⅢ Shell color expression of four groups F1 after 2nd expt. (shell length 11~14 mm) |
| 表 4 紫选纯紫F1在实验二后的壳色百分率 Tab. 4 Shell color percentages of purple shell individuals selected from purple group F1 after 2nd expt. |
| 表 5 混选纯紫F1在实验二后的壳色百分率 Tab. 5 Shell color percentages of purple shell individuals selected from natural group F1 after 2nd expt. |
随着生长,紫群F1(壳长11~14 mm)中的紫壳个体数量继续增多,并大大超过白壳个体数量(图版Ⅲ-2)。在具体表现上,一是部分壳缘紫个体转为壳顶处白色区域较大而壳缘处相连的个体(图版Ⅲ-4),将来长成为图版Ⅰ-8、9型个体;二是部分纯白个体转为壳顶处白色区域较大而壳缘处相连的紫色个体(图版Ⅲ-5、6),将来长成为图版Ⅰ-7、8型个体;三是部分纯白个体在壳顶两侧壳缘出现紫色,中部紫色很淡似连非连的个体(图版Ⅲ-7),将来长成为图版Ⅰ-3、4型个体;四是部分纯白个体一侧或两侧出现淡淡的紫色而中部不相连的个体(图版Ⅲ-7),将来长成为图版Ⅰ-2、3型个体。图版Ⅲ-4~7与图版Ⅰ-2~10对比可以看出,F1紫色壳色的表现很好的符合了成体青蛤紫色壳色的特点,进一步说明了紫色壳色的真实遗传性。
为便于分析,将本实验阶段紫群F1分为紫壳个体和白壳个体进行数量统计(表 6)。可见细沙质和粉沙质中的紫壳个体百分率均高于泥质中,白壳个体百分率则相反,但经检验,3种底质之间差异均不显著(P﹥0.05),说明遗传是决定F1壳色的决定性因素。不过从表 7 中可以看出,粉沙质和细沙质的标准差很大,这是因为有2个平行因梭子蟹捕食造成存活数量较少,其存活数量之和也只有未受捕食一个平行的1/2左右,增大了实验误差,因此只有加大未捕食平行的权重才能提高分析的准确性,t-检验法未能充分显示3种底质间的差异显著性。本实验是百分率的比较,在不能将2个被捕食平行数据都舍弃的情况下,以3个平行的总体用百分率u-检验法可相对减少分析误差。从表 7可以看出,细沙质和粉沙质中,紫壳个体总体百分率为77.05 % 和73.79 %,均高于泥质68.26%,经检验粉细沙质与泥质差异显著(P﹤0.05),粉沙质与泥质差异未达显著性水平(P﹥0.05),粉沙质与细沙质差异不显著(P﹥0.05),即在本实验阶段,泥质抑制了紫色壳色的表达,并且与细沙质比较差异达到显著性水平。因此底质不但影响了紫壳个体紫色的深浅,而且显著影响到了紫壳个体百分率。
| 表 6 紫群F1在实验二后的壳色百分率 Tab. 6 Shell color percentages of purple group F1 after 2nd expt. |
| 表 7 白群F1在实验二后的壳色百分率 Tab. 7 Shell color percentages of purple group F1 after 2nd expt. |
本实验阶段,紫壳基因的最低表达力可用泥质中的紫壳个体总体百分率减去放入前的紫壳个体百分率(根据表 3数据计算)近似表示,68.26%-30.30%=37.96%,而底质的最大影响力可用细沙质中的总体百分率减去泥质中的总体百分率近似表示,77.05 %-68.26 %=8.79%。以上两个数据的对比可以比较基因遗传性与底质对青蛤紫色壳色表达影响力的大小,37.96 %∶8.79 %=4.32,可见,青蛤紫色壳色表达虽然受底质显著性影响,但影响力不到遗传表达能力的1/4,即壳色主要决定于自身基因的表达。
2.3.3 3种底质对白群F1壳色的影响3种底质中白群F1(壳长12~13 mm)整体观察全为白壳个体(图版Ⅲ-3)。仔细观察则发现,原来的紫色带个体仍有部分继续表现(图版Ⅲ-8),但非常微弱;另有极少数个体壳缘出现少许紫色,需仔细观察才能发现(图版Ⅲ-9),将来发育为图版Ⅰ-2~4型个体。实验二结果中没有纯紫个体,原因是12粒纯紫个体都放入了未放底质的盘中,由于客观因素全部死亡。综合两个实验的结果,白群F1与紫群F1一样出现了纯紫个体、壳缘紫个体、紫色带个体和纯白个体4种壳色类型,但紫壳个体数量很少。
表 7为壳色分类数量统计,可见在3种底质中出现壳缘紫个体的百分率都小于10%,白壳个体都大于90%,经检验相互之间差异不显著(P﹥0.05)。这一结果进一步说明了青蛤的白、紫壳色首先决定于遗传因素,环境因素的影响是次要的。另外,经检验,3种底质中的白壳个体总体百分率均显著高于未作壳色分离亲贝的白壳个体百分率81.29 %(P﹤0.01),这一结果补充了实验一“白群F1中的白壳个体百分率显著高于亲贝”的分析。
3 讨论 3.1 青蛤白、紫壳色的真实遗传性本文实验中,通过将青蛤自然种群中的白壳个体和紫壳个体分离,建立白壳群体和紫壳群体进行分离繁育,在实验一中,两个群体F1间相同壳色类型差异极显著,并出现了相同于亲本壳色的稳定显著的壳色分离和纯化,实验二结果进一步加强了实验一的表现;同时,在两个实验中紫壳个体F1的紫色区域形成和发展,很好地再现了成贝青蛤紫壳个体紫色区域的形成过程,这些情况充分证明了青蛤白、紫壳色的真实遗传性。
3.2 青蛤白、紫壳色的遗传规律贝类的壳色遗传规律较为复杂,但普遍为质量性状,并存在完全或非完全的显隐性关系。贝类壳色受几对基因的控制,符合哪种孟德尔遗传规律也各不相同,单一壳色往往受一对等位基因控制,同一贝类多种壳色或花纹往往受多对等位基因的控制[13, 14, 15, 16]。双壳贝类中,华贵栉孔扇贝(Chlamys nobilis)桔黄色对枣红色和紫褐色均为显性,后两种壳色个体均为隐性纯合子[4];马氏珠母贝(Pinctada martensii)黑、白、红、黄四种壳色遗传规律比较复杂,纯化后杂交结果表明,四种壳色不是一对等位基因控制的,黄、白壳色可以作为壳底色,黄色较白色表现为显性,作为放射带颜色的黑色、红色,黑色相对红色也为显性;黄、白壳色杂交时,白色存在母系遗传[19];文蛤(Meretrix meretrix linnaeus)壳色表现为不同壳面颜色和花纹,包括红色、黄色、白双、黄双、波纹,其数量分布频率不同,其中红壳色亲本的子代中出现红色∶花色=3∶1,符合孟德尔遗传模式,不同颜色和花纹之间存在不同的遗传距离关系[20];菲律宾蛤仔(Manila clam Ruditapes philippinarum)壳色亦为不同颜色和花纹,如两道白、两道红、斑马蛤、珍珠白、奶牛蛤、白蛤、橙蛤和墨蛤等[21, 22, 23],不同壳色间存在不同的遗传距离[23],其贝壳着色由至少两对基因控制,花纹的“非对称”对于“对称”是显性,由一个基因的一对等位基因控制,“非对称”个体包含纯合子和杂合子,“对称”个体均为纯合子[24]。
青蛤与文蛤、菲律宾蛤仔在分类学上都隶属于瓣鳃纲(Lam ellibranchia)、异齿亚纲(Heter-odonta)、帘蛤目(Veneroida)、帘蛤科(Veneroidae)贝类,生活方式上都属于埋栖型贝类,在亲缘上相近,在生活方式上相同,决定了青蛤的壳色遗传与文蛤、菲律宾蛤仔有必然的相似性,因此青蛤的白、紫壳色属于质量性状的可能性较大。根据实验一、实验二不同时期幼贝和自然种群成体的壳色表现,可以分为3种典型类型,一是纯白色,二是纯紫色,三是白紫混合色(在壳长3~7 mm时表现为壳顶处壳缘呈紫色,而壳缘中部不相连,壳长11~14 mm以上时相连,相连时间的早晚决定了成体紫壳面积的大小),白紫混合个体根据紫色面积大小统计呈现连续性的分布,但白紫混合个体与纯紫色个体间无过渡型个体,这一特点说明纯紫个体极可能为纯合子,而白紫混合个体可能为杂合子。在青蛤自然种群中,有些个体在壳长40~50 mm时才在壳缘出现紫色,因此壳长30 mm的纯白色个体中必然有未表现的白紫混合个体,即本文实验所用从自然群体分离出的白壳群体极可能混有尚未表现紫色的白紫混合个体,白群F1 中出现的少量纯紫个体和壳缘紫个体与此有直接关系。
本实验是群体实验,对于白、紫壳色是否为一对质量性状及其显隐性关系不能做出准确判断。为了确定青蛤白、紫壳色是否为质量性状,受几对等位基因控制,符合哪种遗传规律,下面的工作还要克服青蛤家系生长周期长、稚贝存活数量少和后期保存困难的问题,建立并保存纯白和纯紫个体家系,通过若干代定向选择分析,获得白壳和紫壳纯合子,进行杂交和测交分析。
本文实验中,白群F1和紫群F1在成活率上没有明显差异,说明基因差异未影响紫壳个体存活,这为将来通过杂交、测交等方法研究控制青蛤壳色的基因数量以及遵循的遗传规律创造了基础条件。另外,家系建立需要注意的一个重要问题是,目前家系的建立无法克服青蛤繁殖的群体效应,亲本只能从正在产卵和排精的群体中选择和配对,它们必然吸入了许多其他个体的精子和卵子,一粒青蛤体内所含海水多达2 mL,可含几万、几十万个精子,因此所选亲本不仅要将其外壳洗净,还要设法将其体内海水去净,这对建立以分析壳色为目的家系尤为重要。
3.3 青蛤壳色受环境因素的影响贝类壳色一般都受到环境因素的影响,但遗传是决定性因素[25],青蛤壳色表现也符合这一规律,青蛤白、紫壳色的表达受生活底质的显著影响,但底质影响力不超过遗传表达力的1/4。在制备白壳和紫壳纯合子,以及进行遗传规律分析时,应将其家系子代放入粒径较大的沙质底中培育,以使紫色基因充分表达,保证分析的准确性。
青蛤的生活环境除底质外,还包括温度、盐度、海水离子结构及饵料等,这些因素对壳色表达(特别是白紫混合个体紫色区域面积的连续性)有何影响还需进一步研究才能确定。
3.4 青蛤紫壳品系的选育不同种群红壳色文蛤杂交组合均比自繁组合生长快,表现出杂种优势[26]。菲律宾蛤仔不同壳色群体对低盐的耐受力显著不同[21]、免疫力存在不同程度的差异[22],生长发育也存在不同程度的差异,壳色与生长性状存在相关性[3]。通过研究壳色与生长性状的关系对于选育优良贝类新品种有重要意义。
自然种群中青蛤紫壳个体相对于白壳个体没有明显的存活优势(也无弱势),但从商业上考虑,紫壳更有优势,因为青蛤挖出时为青黑色,是群众普遍接受的颜色,但在空气中暴露一段时间后即被氧化为本色,反而不被认可,而紫壳个体褪去黑色后反而更鲜艳,为群众所喜爱,因此,紫壳个体在流通、后续加工和销售环节有明显优势。如果通过选育手段,培育生长速度快、成活率高的紫壳新品种,不但可以显著提高养殖效益,还可扩大销售市场。
贝类单一壳色小群体长期繁育会减少遗传多态位点,出现性状退化[27],单一壳色家系多代繁殖更容易出现这一问题,而通过大群体选育品系或群系,则利于保持遗传多态位点,维持优良生长、生产性状的长期稳定遗传。本文研究中通过将青蛤自然种群亲贝中的紫壳个体分离繁殖,使其F1壳色得到显著纯化,接近未分离亲贝紫壳百分率17.81 %的4倍,因此通过选择自然种群中的纯紫个体进行多代定向选择,建立优良性状稳定遗传的大群体紫壳青蛤品系或群系用于规模化生产是完全可行的。
| [1] | 张跃环,闫喜武,张澎,等.贝类壳色多态的研究概况与展望[J].水产科学,2008,27(12):680-683. ZHANG Y H,YAN X W,ZHANG P, et al. Research advances and prospects on shell color polymorphism of Mollusks [J]. Fisheries Science, 2008,27(12):680-683. |
| [2] | NEWKIRK G F. Genetics of shell color in Mytilus edulis L. and the association of growth rate with shell color [J]. Journal of Experimental Marine Biology and Ecology,1980,47(1):89-94. |
| [3] | 闫喜武,张国范,杨凤,等.菲律宾蛤仔莆田群体两个壳色品系生长发育的比较[J].大连水产学院学报,2005,20(4):266-269.YAN X W,ZHANG G F,YANG F,et al. A comparison of growth and development of Manila clam(Ruditapes philippinarum) from two pedigrees[J]. Journal of Dalian Fisheries University,2005,20(4):266-269. |
| [4] | 刘志刚,朱晓闻,王辉,等.华贵栉孔扇贝(Chlamys nobilis)壳色遗传规律的研究[J].海洋与湖沼, 2012,43(1):62-66. LIU Z G,ZHU X W,WANG H,et al. Research on the inheritance of shell color in Chlamys nobilis[J].Oceanologia et Limnologia Sinica,2012,43(1):62-66. |
| [5] | CHROMANSKI J,STILES S. Observations on self-fertilization in the bay scallop Argopecten irradians[J]. Journal of Shellfish Research,1995,14(1):268. |
| [6] | BRAND E,KIJINA A,FUJIO Y. Shell color polymorphism and growth in Japanese scallop, Patinopecten yessoensis[J].Tohoku Journal of Agricultural Research Sendai,1994(44):67-76. |
| [7] | WEN H B,GU R B,CAO Z M,et al. Variation of color and ray pattern in juvenile shells in hatchery-produced freshwater triangle pearl mussels, Hyriopsis cumingii, in China[J]. Journal of the World Aquaculture Society,2013,44(1):154-160. |
| [8] | HEDGECOCK D,GRUPE P,VOIGT M L.Mapping genes affecting shell color and shape in the Pacific Oyster Crassostrea gigas[J]. Journal of Shellfish Research,2006,25(2):738. |
| [9] | STILES S,CHOROMANSKI J. Inbreeding studies on the bay scallop, Argopecten irradians[J]. Journal of Shellfish Research,1995,14(1):278. |
| [10] | STILES S,CHOROMANSKI J,JEFFRESS D. Genetic strategies for culture and stock enhancement of bivalves[J].Journal of Shellfish Research, 2003,22(1):301. |
| [11] | 张国范,刘述锡,刘晓,等.海湾扇贝自交家系的建立和自交效应[J].中国水产科学,2003,10(6):441-445. ZHANG G F,LIU S X,LIU X,et al. Self-fertilization family establishment and its depression in bay scallop Argopecten irradians[J]. Journal of Fishery Sciences of China,2003,10(6):441-445. |
| [12] | 赵洪恩,张金世,黄丽红,等.关于玛瑙鲍的探索与研究[J].水产科学,1999,18(6):3-6. ZHAO H E,ZHANG J S,HUANG L H,et al. Explorations and studies on agate abalone[J].Fisheries Science,1999,18(6):3-6. |
| [13] | KOBAYASHI T,KAWAHARA I,HASEKURA.Genetic control of bluish shell color variation in the Pacific abalone, Haliotis discus hannai[J].Journal of Shellfish Research, 2004,23(4):1153-1156. |
| [14] | INNES D J,HALEV L E. Inheritance of a shell-color polymorphism in the mussel[J].Journal of Heredity, 1977,68(3):203-204. |
| [15] | FIQUEROA E,BRAND E,WINKLER F. Shell color polymorphism and growth in the Chilean oyster Tiostrea chilensis[J]. Journal of Shellfish Research,1992,11(1):194. |
| [16] | 郑怀平,张国范,刘晓,等.不同贝壳颜色海湾扇贝(Argopecten irradians)家系的建立及生长发育的研究[J].海洋与湖沼, 2005,36(6):632-639. ZHENG H P,ZHANG G F,LIU X,et al. Establishment of different shell color lines of Bay scallop Argopecten irradians irradians Lamarck(1819) and their development [J]. Oceanologia et Limnologia Sinica,2005,36(6):632-639. |
| [17] | 杨凤,张跃环,赵越,等.青蛤家系的建立及早期生长发育比较[J].水产科学,2008,27(8):390-396. YANG F,ZHANG Y H,ZHAO Y,et al. The establishment of families of Gmelin cyclina sinensis and its early development[J]. Fisheries Science,2008,27(8):390-396. |
| [18] | 于业绍,王慧,顾润润,等.青蛤人工育苗及养殖实用技术[M].北京:中国农业出版社,2006:44-59. YU Y S,WANG H,GU R R,et al. Artificial breeding and culture technology of Cyclina sinensis(Gmelin) [M].Beijing: China Agriculture Press,2006:44-59. |
| [19] | 张胜军.四种壳色马氏珠母贝F4、F5代的研究[D].湛江:广东海洋大学,2010:58. CHENG S J. Study on the F4,F5 generation of four colors of Pinctada martensii shell[D]. Zhanjiang: Guangdong Ocean University,2010: 58. |
| [20] | 吴杨平,姚国兴,陈爱华,等.红壳色文蛤选育子代各壳色的形态分化及养殖效果的比较[J].台湾海峡,2012,31(3):412-419,446. WU Y P,YAO G X,CHEN A H,et al. Morphological diversions in the color of Meretrix meretrix offspring and comparison of breeding effects[J].Journal of Oceanography in Taiwan Strait,2012,31(3):412-419,446. |
| [21] | 丁鉴锋,王锐,闫喜武,等.菲律宾蛤仔3种壳色群体低盐耐受能力的比较研究[J].大连海洋大学学报,2013,28(3):264-268. DING J F,WANG R,YAN X W,et al. Comparative tolerance to low salinity stress in Manila clam Ruditapes philippinarum with three shell colors[J]. Journal of Dalian Ocean University,2013,28(3):264-268. |
| [22] | 丁鉴锋,杨霏,闫喜武,等.不同壳色菲律宾蛤仔免疫机能的比较研究[J].大连海洋大学学报,2012,27(5):411-416. DING J F,YANG F,YAN X W,et al. Comparison of the immune defense functions in Manila clam Ruditapes philippinarum with different shell colors[J]. Journal of Dalian Ocean University,2012,27(5):411-416. |
| [23] | 金迪,秦艳杰,闫喜武,等.菲律宾蛤仔 SRAP标记体系的建立及不同壳色品系的遗传学分析[J].大连海洋大学学报,2013,28(4):361-366. JIN D, QIN Y J,YAN X W,et al. Establishment of SRAP reaction conditions and the genetic analysis of three strains with different shell colors in Manila clam Ruditapes philippinarum[J]. Journal of Dalian Ocean University,2013,28(4):361-366. |
| [24] | PEIGNON J M,GERAEDA,NACIRIY,et al. Analysis of shell colour determinism in the Manila clam Ruditapes philippinarum[J]. Aquatic living resources,1995,8(2):181-189. |
| [25] | WINKLER F M,ESTEVEZ B F,JOLLAN L B,et al. Inheritance of the general shell color in the Scallop Argopecten purpuratus (Bivalvia: Pectinidae)[J].Journal of Heredity,2001,92 (6):521-525. |
| [26] | 吴杨平,陈爱华,姚国兴,等.3个不同地理群体红壳色文蛤杂交的配合力分析[J].海洋渔业,2014,36(4):314-319. WU Y P,CHEN A H,YAO G X,etal. Combining ability analysis on diallel cross from three different red Meretrix meretrix populations[J]. Marine Fisheries, 2014,36(4):314-319. |
| [27] | BAKER P,ROCHA C,BOWEN B,et al. Mitochondrial genetic variability of cultured versus wild northern hard clams Mercenaria mercenaria[J].Journal of Shellfish Research,2004,23(1): 281. |
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, Shandong, China
 2015, Vol. 24
2015, Vol. 24

