2. 上海海洋大学 海洋科学研究院海洋生态环境与修复研究所, 上海 201306;
3. 国家海洋局第一海洋研究所, 山东 青岛 266061;
4. 国家海洋局东海环境监测中心, 上海 200137
绿潮是大型海洋绿藻大量繁殖引发其在潮间带和浅海区生物量累积产生的一种异常生态现象[1, 2]。2007-2013年,黄海海域连续七年暴发了大规模绿潮,特别是2008年,绿潮对北京奥运会青岛奥帆赛的进行造成严重影响[3]。绿潮主要优势种为浒苔[Enteromorpha prolifera (Müller) J.Agardh][4, 5],国际上已把浒苔属并入石莼属,称为Ulva prolifera O.F.Müller[5, 6]。
浒苔暴发与其多样的繁殖方式有关,浒苔能以包括有性生殖、无性生殖和营养生殖等7 种方式繁殖[7, 8, 9]。海区大量孢子遇到适宜条件很可能引发绿潮[10]。对黄海海域水样中显微繁殖体的研究,为绿潮的繁殖体库和溯源的研究提供了一个全新的思路[11]。有学者调查绿潮暴发前期长江口附近海域显微繁殖体的动态变化,排除微观繁殖体由长江水携带入海或来源于长江口南部海域[12]。有学者在青岛近海、江苏沿海和黄海的水样及泥样中都发现有石莼属海藻微观繁殖体存在[13, 14, 15, 16]。虽然已开展很多对绿潮溯源的研究,但其精确来源仍存在争议。本文主要通过对2012年及2013年绿潮暴发早期和末期南黄海海域显微繁殖体的分布情况以探究绿潮暴发前期种子库的存在及其生物量,并应用ITS序列与5S rDNA间隔序列分析对显微繁殖体种群种类组成及绿潮暴发早期和末期的演替规律进行分析,为阐明我国黄海绿潮暴发机制及溯源提供依据。
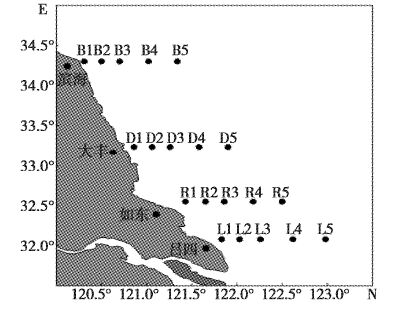
1 材料与方法 1.1 研究海域及样品采集在调查的南黄海海域(E:120.31°-123.08°;N:32.28°-34.3°)设置吕四(LS)、如东(RD)、大丰(DF)、滨海(BH)4条调查断面,每条断面设置5个站位(离岸距离分别为0 km、20 km、40 km、70 km、100 km)。2012年4月调查3条断面,分别为吕四,如东及大丰。2012年8月、2013年4月调查如东,大丰和滨海海域3条断面,2013年8月在大丰和滨海海域设置2条断面。
|
图1 南黄海海域绿潮调查站位示意图 Fig.1 Sampling transects and stations at the coast of Southern Yellow Sea |
根据水深,在每一站位的表、中、底分别采集1 L海水,经孔径160 μm的筛绢过滤后,盛装于经10 % HCl浸泡10 h并经蒸馏水充分冲洗的广口塑料瓶中,低温避光运输至实验室内。将每个站位的海水样品分装至两个经10% HCl浸泡10 h并经蒸馏水充分冲洗的500 mL烧杯中做平行样,经GeO2-VSE 加富至水体中DIN 浓度为500 μmol/L,PO4-P浓度为30 μmol/L。然后将加富过的海水样品静置培养于温度16~18 ℃、光照强度为80~100 μmol/( m2 ·s)、光照周期为12 L∶12D的光照培养箱中。静置培养7 d后,将经CuSO4 溶液过滤后的空气充进烧杯中,进行充气培养。在培养过程中,每隔7天对培养溶液进行加富。经3~4周后,在烧杯壁和烧杯底部可以看到浒苔幼苗,这些幼苗是包括不同浒苔物种的孢子、配子、合子及其不同发育阶段的显微个体形成的,此时可以统计幼苗的总数,即可以确定每升海水中浒苔类藻体显微阶段的繁殖体数。
1.3 绿潮藻基因组提取及PCR扩增将水样中培养出的藻体按照形态进行初步分类,每个断面挑选出不同形态的健康藻体。无菌海水清洗干净,用上海净信冷冻组织研磨仪(型号:JSFstgrp-24)研磨藻体,按照天根公司植物基因组小量抽提试剂盒DP305说明书提取基因组DNA[17],ITS和5S rDNA间隔序列引物设计以及扩增程序参照SHIMADA[18]。利用ITS进行PCR扩增,PCR扩增产物经琼脂糖凝胶电泳检测后,扩增产物直接送生工生物工程(上海)有限公司测序。对LPP类群(Ulva linza-procera-prolifera)进一步用5S rDNA间隔区序列扩增,扩增产物直接测序或切胶回收测序[19]。
1.4 数据分析应用Clustal X(ver 2.0)软件对样品的ITS序列及5S rDNA间隔序列进行多序列比对分析[20],然后应用Mega 4.0软件基于Kimura双参数法计算遗传距离,采用邻接法(Neighbor Joining,NJ)构建聚类树[21],以自举检验(Bootstrap test)估计系统树分支节点的置信度,自举值为1 000。
2 结果 2.1 绿潮藻显微繁殖体数量分布对2012年及2013年绿潮暴发早期4月和衰亡末期8月海区水体显微繁殖体分布调查发现,绿潮藻显微繁殖体广泛分布于南黄海海域。累计调查55个站位,共采集显微繁殖体样品454瓶,仅47瓶未培养出显微繁殖体,其中有6个站位(12-4-L3、12-8-R4、12-8-R5、13-4-B3、13-8-D2、13-8-D3)的表、中和底层均未培养出显微繁殖体。
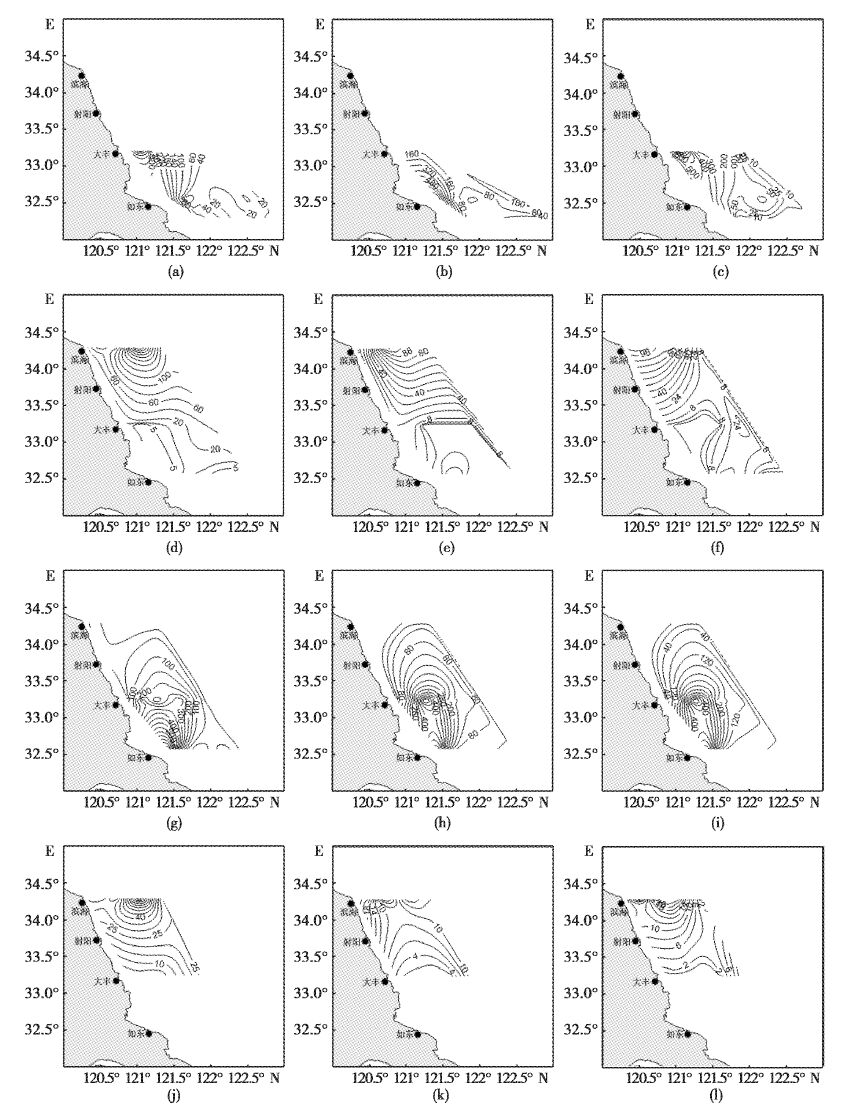
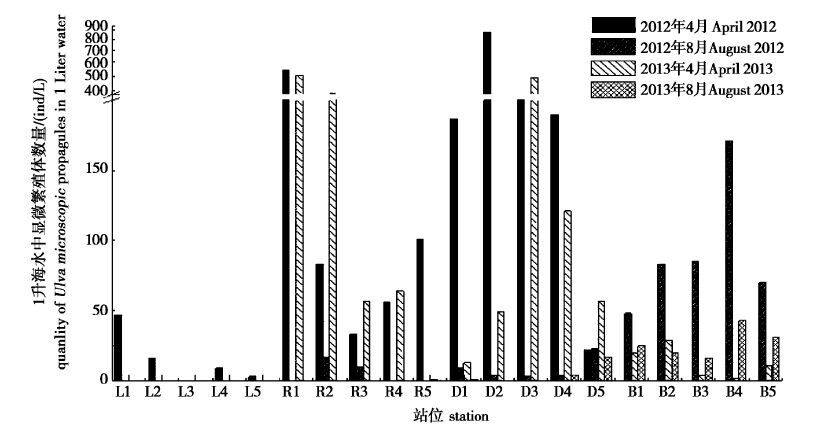
2012年和2013年的4月和8月,调查海域的显微繁殖体的分布具有明显的差别。4月份,离岸近的站位显微繁殖体密度相对较高(图2a,b,c,g,h,i)。2012年4月密度最高的为D2底层水样,达到1 312 ind/L,而2013年4月R1表层水样密度最高,达到884 ind/L。8月,南黄海北部海域显微繁殖体密度逐渐升高(图2d,e,f,j,k,l),两个年度调查的显微繁殖体的最高密度都出现在B4的表层,分别达到330 ind/ L和88 ind/ L。4月份调查海区显微繁殖体的密度显著高于8月份(图3),2012年和2013年4月调查海域显微繁殖体的密度范围分别为0~880 ind/L和1~509 ind/L,8月分别为0~171 ind/L和0~88 ind/L。
|
图2
南黄海海域绿潮藻显微繁殖体分布特征
Fig.2
Quantitative distribution properties of Ulva microscopic propagules in the Southern Yellow Sea
梯度线值表示显微繁殖体密度,单位为:ind/ L;a,b,c表示2012年4月表层,中层和底层水样数量结果;d,e,f表示2012年8月表层,中层和底层水样数量结果;g,h,i表示2013年4月表层,中层和底层水样数量结果;j,k,l表示2013年8月表层,中层和底层水样数量结果。 Gradient line value means the density of microscopic propagules,unit is ind/ L;a,b,c stand for the number in water from surface,middle and bottom in April 2012 respectively; d,e,f stand for the number in water from surface,middle and bottom in August 2012 respectively; g,h,i stand for the number in water from surface,middle and bottom in April 2013 respectively; j,k,l stand for the number in water from surface,middle and bottom in August 2013 respectively. |
|
图3 2012年4月、8月及2013年4月、8月我国南黄海海域各站位显微繁殖体平均数量 Fig.3 The average quantity of Ulva microscopic propagules in the water column at each sampling station of four surveys |
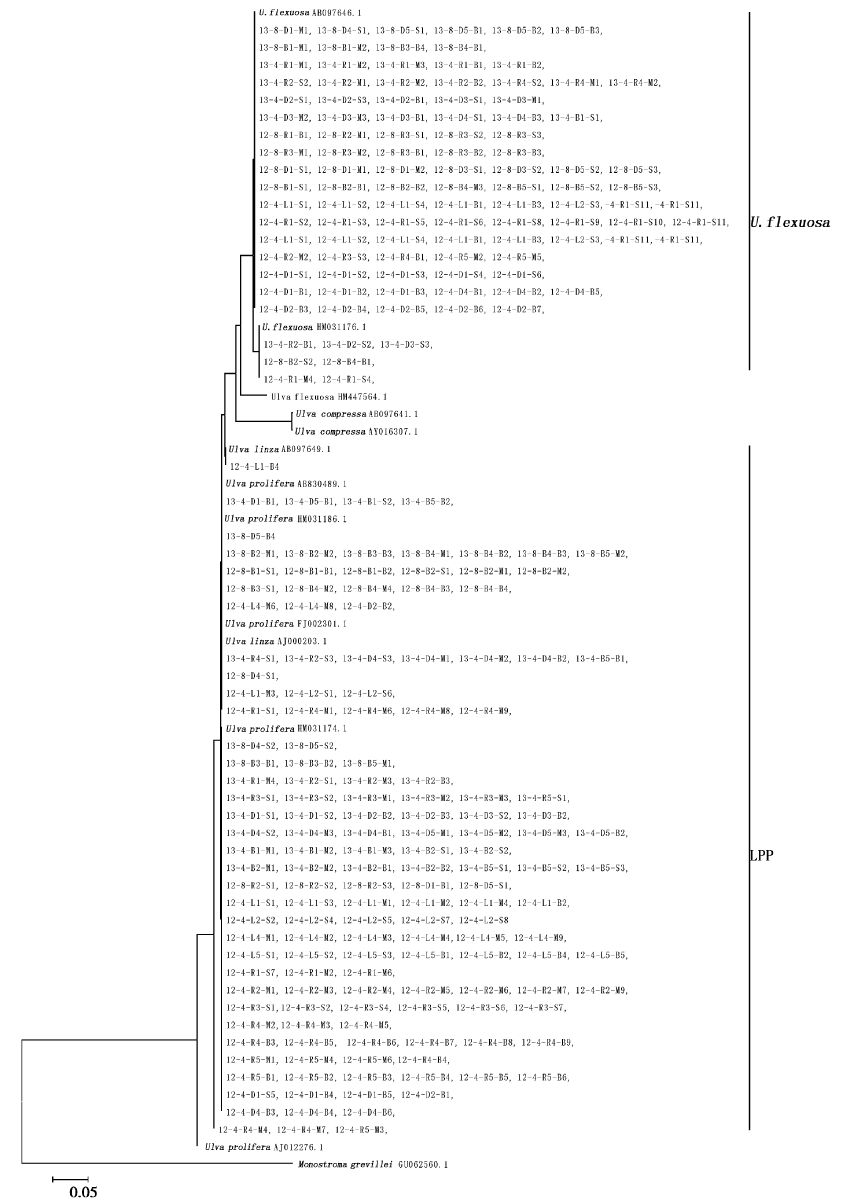
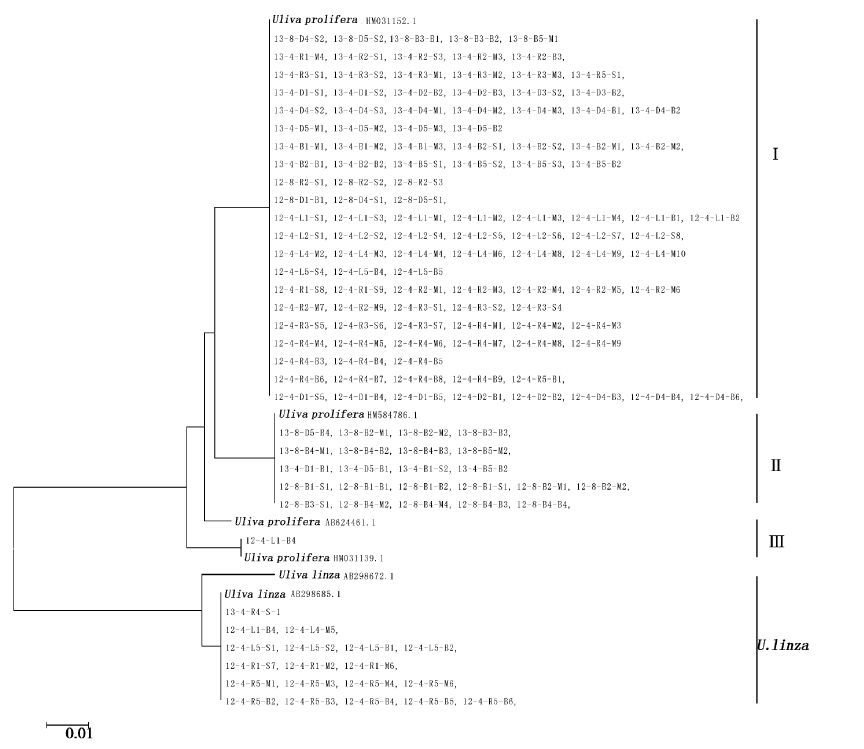
对南黄海显微繁殖体绿藻的ITS和5S rDNA间隔序列进行分子检测。从基于ITS序列建立的进化树(图4)可以看出,265个样品主要位于2个进化枝中,分别为LPP进化枝(159个)、Ulva flexuosa进化枝(105个)。通过5S rDNA间隔序列进一步对LPP类群分析,构建进化树(图5),发现主要聚为两枝,一枝为Ulva linza进化枝(19个),另一枝为 Ulva prolifera进化枝(140个)。其中Ulva prolifera进化枝分为3个亚型,117个样品5S rDNA间隔序列与Ulva prolifera(GenBank:HM031152.1)一致,23个样品与Ulva prolifera(GenBank: HM584786.1)一致。1个样品与Ulva prolifera(GenBank: HM031139.1)一致。可见南黄海绿潮藻显微繁殖体种类主要为Ulva flexuosa、Ulva linza和Ulva prolifera。
|
图4 基于南黄海显微繁殖体绿藻样品的ITS序列构建进化树 Fig.4 NJ tree constructed from the analysis based on ITS sequences of Ulva microscopic propagules samples and those downloaded from GenBank. Bootstrap values (1000 replicates) |
|
图5 基于南黄海显微繁殖体绿藻LPP类群样品的5S rDNA间隔序列构建进化树 Fig.5 NJ tree constructed from the analysis based on 5S rDNA spacer sequences of Ulva microscopic propagules samples and those downloaded from GenBank. Bootstrap values (1000 replicates) |
Ulva flexuosa和Ulva prolifera在南黄海海区均广泛分布。4月海区的显微繁殖体由Ulva flexuosa、Ulva prolifera和Ulva linza组成,8月由Ulva flexuosa和Ulva prolifera组成。并且Ulva linza种的数量呈现减少的趋势,2012年4月吕四海域检测到8株Ulva linza,如东海域检测到12株Ulva linza。而2013年4月仅在如东海域水样中发现1株Ulva linza。仅发现Ulva prolifera 4种亚型中的3种,未发现2008年绿潮暴发的优势种Ulva prolifera(GenBank: HM031149.1)。Ulva proliferaⅠ数量较多,除2012年8月滨海其他各断面均能检测到。2012年仅8月在滨海断面检测到Ulva proliferaⅡ,2013年4月和8月的大丰和滨海断面都能检测到Ulva proliferaⅡ。Ulva proliferaⅢ在南黄海很少,仅2012年4月在吕四检测到一株(表1)。
| 表1 2012年及2013年4月、8月各断面南黄海显微繁殖体绿潮藻种类 Tab. 1 Species composition of each transects in the Southern Yellow Sea |
绿潮藻显微繁殖体包括不同浒苔物种的孢子、配子、合子及其不同发育阶段的显微个体。显微繁殖体可以附着在肉眼不可见的微粒上,随洋流的运动移动,分布于沿海海域[22]。本研究发现,在2012年及2013年绿潮暴发前,绿潮藻显微繁殖体已广泛分布于南黄海海域,在离岸100 km海域均有较高的密度出现,分布密度与PANG等[23]报道的结果一致。南黄海辐射沙洲海域海水浑浊,有大量的颗粒[13],显微繁殖体可附着在这些悬浮颗粒上[15, 16],在光照,温度及营养等环境因子适宜的情况下,巨大数量的显微繁殖体迅速萌发并生长成为漂浮藻体[24, 25, 26, 27]。由此推测南黄海近岸海域大量的显微繁殖体可能导致早期绿潮形成[13, 28]。并且在自然条件下浒苔能够同时释放生殖细胞和进行营养生长[13]。张华伟在对绿潮漂浮浒苔繁殖特性的研究中发现漂浮浒苔具有强大的繁殖能力,每平方厘米藻体能够产生大约5.35×106个游孢子或1.07×107个配子;一株成熟藻体25%左右的部分能够放散生殖细胞,产生约1.15×107个游孢子或2.31×107个配子[29]。ZHANG等[30]在江苏如东海区进行围格实验得到浒苔在海区平均生长率可达23.2%~23.6%。早期绿潮形成后,由于海浪的冲击以及有大量漂浮的藻体作为附着基,多数合子也附着在漂浮藻体上在海面生长发育,成为新一代的漂浮绿潮藻[29]。因此漂浮浒苔强大的繁殖能力及生长能力是导致其生物量快速增长而引起绿潮暴发的主要原因之一[29]。
8月份绿潮末期南黄海海域漂浮绿潮藻逐渐消失,调查海域的显微繁殖体数量较4月份显著减少。HUO等[28]调查了早期绿潮暴发的过程,发现早期绿潮是在南黄海如东海域形成。漂浮绿潮藻在风场和流场作用下向北漂移,在4至8月期间分别经过大丰、射阳、滨海、连云港和日照海域到达青岛[28]。大面积藻体向北漂移过程中,漂浮绿潮藻从如东开始往北部海域依次消失。显微繁殖体数量下降的过程与海区漂浮藻体消失的过程一致。8月份如东(2012年平均5 ind/L),大丰(2012年平均9 ind/L;2013年平均4 ind/L)近岸海域显微繁殖体数量显著减少。滨海(2012年平均91 ind/L;2013年平均27 ind/L)海域相对较高,这与滨海海域漂浮藻体比如东、大丰海域晚消失有关。
3.2 关于南黄海显微繁殖体种类组成及变化2012年及2013年4月和8月调查南黄海海域绿潮藻显微繁殖体主要由Ulva flexuosa、Ulva linza和Ulva prolifera组成,与刘峰[13]报道的于2009年11月和2010年12月江苏沿海底泥与2011年1月至2012年4月在江苏辐射沙洲海域水样和泥样中检测到的显微繁殖体种类组成基本一致。但是我们在南黄海水体的显微繁殖体中未检测到扁浒苔(Ulva.compressa)。LIU等[16]在2009年5月及6月在黄海进行了两个航次的调查,水体中也未检测到U. compressa。韩渭2011年12月至2012年4月,对江苏沿岸紫菜养殖筏架固着绿藻的ITS和5S rDNA间隔序列的分析发现。仅2011年12月在如东海区检测到U.compressa,其他地区和其他时间均未发现U.compressa[31]。因此,南黄海水体未检测到U.compressa可能与紫菜养殖区U.compressa所占生物量较少有关。
研究发现,2012年如东海区早期漂浮绿潮藻种类组成研究主要为U. prolifera,U. flexuosa和U. linza的生物量很少[31]。南黄海海区显微繁殖体与早期漂浮绿潮藻种类组成相似。从南黄海海区显微繁殖体种类组成分析,近岸海域分布的大量绿潮藻显微繁殖体可能与早期绿潮有关,但仍需展开进一步的研究确定。
| [1] | SHIMADA S, HIRAOKA M, NABATA S, et al. Molecular phylogeneticanalyses of the Japanese Ulva and Enteromorpha (Ulvales, Ulvophyceae), with special reference to the free-floating Ulva[J]. Phycological Research, 2003, 51: 99-108. |
| [2] | CHARLIER R H, MORAND P, FINKL C W, et al. Green tides on the Brittany coasts[J]. Environmental Research, Engineering and Management, 2007, 3(41): 52-59. |
| [3] | 徐兆礼, 叶属峰, 徐韧. 2008年中国浒苔灾害成因条件和过程推测[J].水产科学, 2009, 33(3):430-437. XU Z L, YE S F, XU R.Possible conditions and process of themassive blooms of Enteromorpha prolifera in China during 2008[J]. Fisheries Science, 2009, 33(3):430-437. |
| [4] | 丁兰平, 栾日孝. 浒苔(Enteromorpha prolifera)的分类鉴定、生境习性及分布[J]. 海洋与湖沼, 2009, 40(1): 68-71. DING L P, LUAN R X. The Taxonomy, habit, and distribution of a green alga enteromorpha prolifera[J]. Oceanologia et Limnologia Sinica, 2009, 40(1): 68-71. |
| [5] | LELIAERT F, ZHANG X, YE N,et al.Identity of the Qingdao algal bloom[J].Phycology Research,2009,57(2):147-151. |
| [6] | 马家海, 张华伟, 张天夫. "绿潮"的研究现状及展望[M]//张惠荣.浒苔生态学研究.北京: 科学出版社, 2009: 3-10. MA J H, ZHANG H W, ZHANG T F."Green Tide" research present situation and prospects[M]//ZHANG H R. Enteromorpha Ecology Research. Beijing: Science Press, 2009: 3-10. |
| [7] | 王晓坤, 马家海, 叶道才,等. 浒苔(Enteromorpha prolifera)生活史的初步研究[J]. 海洋通报, 2007, 26(5): 112-116. WANG X K, MA J H, YE D C, et al.Preliminary Study on the Life History of Enteromorpha prolifera[J]. Marine Science Bulletin, 2007, 26(5):112-116. |
| [8] | 钱树本, 刘东艳, 孙军. 海藻学[M]. 青岛:中国海洋大学出版社, 2005. QIAN S B, LIU D Y, SUN J.Marine phycology[M]. Qingdao: China Ocean University Press, 2005. |
| [9] | LIN A, SHEN S, WANG J, et al. Reproduction diversity of Enteromorpha prolifera[J]. Journal of Integrative Plant Biology, 2008, 50(5): 622-629. |
| [10] | 马家海, 嵇嘉民, 徐韧,等. 长石莼 (缘管浒苔) 生活史的初步研究[J]. 水产学报, 2009, 33(1): 45-52. MA J H, JI J M, XU R, et al.Preliminary study on life history of Ulva linza Linnaeus[J]. Journal of Fisheries of China, 2009, 33(1): 45-52. |
| [11] | 刘峰, 逄少军, 单体锋,等. 一种新的海水中石莼属海藻显微阶段个体数定量方法及在黄海绿潮爆发过程中的应用[J]. 科学通报, 2010, 55(6): 468-473. LIU F,PANG S J,SHAN T F,et al. A novel method to quantify the microscopic stages of Ulva species in seawater and its applications in forcasting green tides of the Yellow Sea[J]. Chinese Science Bulletin, 2010, 55(6): 468-473. |
| [12] | 方松, 王宗灵, 李艳,等. 南黄海及长江口附近海域绿潮暴发前期微观繁殖体的动态变化[J]. 海洋学报, 2012, 34(4): 147-154. FANG S,WANG Z L,LI Y,et al.The dynamics of micro-propagules before the Green tide outbreak in the Southern Huanghai Sea and Changjiang River Estyary area[J]. Acta Oceanologica Sinica, 2012, 34(4): 147-154. |
| [13] | 刘峰. 黄海绿潮的成因以及绿潮浒苔的生理生态学和分子系统学研究 [D].青岛:中国科学院海洋研究所, 2010. LIU F. The causes of green tides in the Yellow Sea, and phylogenetic analysis of the bloom forming alga, Ulva prolifera[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2010. |
| [14] | LIU F, PANG S J, ZHAO X B, et al. Quantitative, molecular and growth analyses of Ulva microscopic propagules in the coastal sediment of Jiangsu province where green tides initially occurred[J]. Marine Environmental Research, 2012, 74: 56-63. |
| [15] | LIU F, PANG S J, CHOPIN T, et al. The dominant Ulva strain of the 2008 green algal bloom in the Yellow Sea was not detected in the coastal waters of Qingdao in the following winter[J]. Journal of Applied Phycology, 2010, 22(5): 531-540. |
| [16] | LIU F, PANG S J, XU N, et al. Ulva diversity in the Yellow Sea during the large-scale green algal blooms in 2008-2009[J]. Phycological Research, 2010, 58(4): 270-279. |
| [17] | ZHANG X, XU D, MAO Y, et al. Settlement of vegetative fragments of Ulva prolifera confirmed as an important seed source for succession of a large-scale green tide bloom[J]. Limnology and Oceanography, 2011, 56(1): 233. |
| [18] | SHIMADA S,YOKOYAMA N, ARAI A, et al. Phylogeography of the genus Ulva (Ulvophyceae, Chlorophyta), with special reference to the Japanese freshwater and brackish taxa[J]. Journal of Appllied Phycology, 2008, 20(5): 979-989. |
| [19] | TIAN X L, HUO Y Z, CHEN L P, et al. Molecular detection and analysis of green seaweeds from Rudong coasts in Jiangsu Province(in Chinese)[J].Chinese Sci Bull(Chinese Ver),2011,56:309-317. |
| [20] | THOMOSON J D, HIGGINS D G, GIBSON T J. CLUSTALW:improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position specific gap penalties and weight matrix choice[J]. Nucleic Acids Research, 1994, 22(22): 4673-4680 |
| [21] | TAMURA K, DUDLEY J, NEI M, et al. MEGA4: Molecular evolutionary genetics analysis (MEGA) software version 4.0[J]. Molecular Biology and Evolution, 2007, 24(8): 1596-1599. |
| [22] | RICHARD G. The role of water motionin algal reproduction [M]. Orono: University of Maine, 2001. |
| [23] | PANG S J, LIU F, SHAN T F, et al. Tracking the algal origin of the Ulva bloom in the Yellow Sea by a combination of molecular, morphological and physiological analyses [J]. Marine Environmental Research, 2010, 69(4): 207-215. |
| [24] | HOFFMANN A J, SANTELICES B. Banks of algal microscopic forms: Hypotheses on their functioning and comparisons with seed banks [J]. Marine Ecology Progress Series. Oldendorf, 1991, 79(1): 185-194. |
| [25] | SANTELICES B, HOFFMANN A J, AEDO D, et al. A bank of microscopic forms on disturbed boulders and stones in tide pools[J]. Marine Ecology Progress Series, 1995,129: 215-228 |
| [26] | WORM B, LOTZE H K, SOMMER U. Algal propagule banks modify competition, consumer and resource control on Baltic rocky shores [J]. Oecologia, 2001, 128(2): 281-293. |
| [27] | ZHANG X, WANG H, MAO Y, et al. Somatic cells serve as a potential propagule bank of Enteromorpha prolifera forming a green tide in the Yellow Sea, China[J]. Journal of Appllied Phycology, 2010, 22(2):173-180. |
| [28] | HUO Y, ZHANG J, CHEN L, et al. Green algae blooms caused by Ulva prolifera in the southern Yellow Sea: Identification of the original bloom location and evaluation of biological processes occurring during the early northward floating period[J]. Limnol Oceanogr, 2013, 58(6): 2206-2218. |
| [29] | 张华伟, 马家海, 胡翔, 等. 绿潮漂浮浒苔繁殖特性的研究[J]. 上海海洋大学学报, 2011, 20(4): 600-606. ZHANG H W,MA J H,HU X,et al. Reproductive characteristics of the floating algae in green tide[J].Journal of Shanghai Ocean University, 2011, 20(4): 600-606. |
| [30] | ZHANG J, HUO Y, YU K, et al. Growth characteristics and reproductive capability of green tide algae in Rudong coast, China[J]. Journal of Applied Phycology, 2013, 25(3): 795-803. |
| [31] | 韩渭. 江苏沿岸紫菜筏架固着绿藻与黄海早期漂浮绿潮藻的分子检测[D]. 上海:上海海洋大学, 2013. HAN W. Molecular detection of attached Ulva on Porphyra aquaculture rafts, Jiangsu Province and free-floating green tide algae at the early stage, Yellow Sea[D].Shanghai: Shanghai Ocean University, 2013. |
2. Institute of Marine Science, Shanghai Ocean University, Shanghai 201306, China;
3. The First Institute of Oceanography, State Oceanic Administration (SOA), Qingdao 266061, Shandong, China;
4. East Sea Environment Monitoring Center State Oceanic Administration, Shanghai 200137, China
 2015, Vol. 51
2015, Vol. 51


