2. 上海海洋大学 水产与生命学院, 上海 201306
中华鲟(Acipenser sinensis Gray,1835)是我国一级水生保护动物,具典型的江海洄游特性。每年5月中下旬,长江中上游繁殖的中华鲟幼鱼陆续到达长江口咸淡水水域进行索饵肥育和入海洄游前的生理适应性调整,尤其是渗透压的调节与适应;随着渗透压调节器官的发育和完善,渗透压调节能力逐渐增强,至9月上旬,幼鱼开始洄游入海[1]。由此可见,长江口中华鲟幼鱼阶段在其生活史中具有重要意义。随着天然资源的日益枯竭,中华鲟保护生物学研究引起了广泛关注,然而,对于长江口中华鲟幼鱼阶段的研究,尤其是渗透调节相关研究还较少。仅见HE等[2]、赵峰等[3, 4]和封苏娅等[5]对长江口中华鲟幼鱼的急性盐度耐受能力、盐度适应过程中血清离子、鳃丝Na+/K+-ATP酶及其α亚基mRNA的表达等变化特征进行了研究。
鳃是鱼类进行渗透压及离子调节的主要功能器官,鳃上皮中的氯细胞在离子转运过程中发挥重要作用[6, 7]。鱼鳃上的氯细胞主要位于鳃丝上皮内,少量分布在鳃小片上皮内[8]。氯细胞基底侧膜和微小管上分布着大量的NKA酶[9],大多数广盐性硬骨鱼从淡水转移到盐水中时氯细胞增大,数量增加,NKA酶活性随之升高[10, 11],促进Cl-和Na+的排出,调节细胞内渗透压平衡。已有研究证实某些鲟鱼幼鱼鳃上氯细胞随盐度升高也发生上述改变[12, 13],但未见有关中华鲟幼鱼鳃上氯细胞研究的相关报道。本研究拟通过筛选和优化鳃丝氯细胞冰冻切片免疫荧光染色技术,研究氯细胞在中华鲟幼鱼鳃上的分布特征,为中华鲟幼鱼洄游过程中渗透压调节机制研究奠定基础。
1 材料与方法 1.1 实验材料2012年8月中下旬于长江口长兴岛渔民处收集误捕的中华鲟幼鱼共5尾,其平均体长为(55.73±2.48)cm,平均体质量为(1 486.48±301.98)g,在室内用淡水暂养2周。暂养期间,淡水为经颗粒活性炭及KDF(kinetic degradation fluxion)过滤(余氯<0.01 mg/L)的自来水,水温保持在(24 ± 1)℃、溶氧 > 6 mg/L、氨氮未检出。
1.2 实验方法 1.2.1 鳃丝切片制备将5尾中华鲟幼鱼麻醉(100 mg/L MS-222)后剪取左侧第二鳃弓中部鳃丝[6],并将鳃丝剪成5~8 mm片段后分别置入4%多聚甲醛固定液(pH 7.40,4 ℃)和Bouin氏液中固定。
将在4%多聚甲醛固定液中固定2~3 h的鳃组织用0.01 mol/L PBS冲洗10 min,之后用蔗糖溶液(蔗糖溶液为0.01 mol/L PBS配制而成,浓度分别为10%、20%和30%,pH 7.40)梯度脱水,每个梯度20~60 min。最后,-20 ℃条件下将脱水后的组织包埋(Tissue-Tek,Sakura)、切片(CM-1850,Leica),切片厚度 6 μm。
将在Bouin氏液中固定24 h以上的鳃样品进行梯度乙醇脱水,二甲苯透明后浸蜡,将单个鳃丝用石蜡包埋并切片,厚度为5 μm,切片后用HE 法染色,中性树胶封片后用显微镜观察拍照。
1.2.2 抗体最佳反应浓度确定正式染色前先用棋盘法确定一抗α5(鼠抗鸟的NKA酶 α亚基的单克隆抗体[14],购自Developmental Studies Hybridoma Bank,Iowa City,IA,USA)和Alexa 488驴抗鼠荧光二抗(Alexa 488荧光染料标记的驴抗鼠二抗,购自Sigma,A21202)的最佳反应浓度,一抗的稀释浓度分别为1∶500、1∶1 000、1∶1 500和1∶2 000,二抗稀释浓度分别为1∶100、1∶250和1∶500。将不同浓度梯度的一抗和二抗对样本进行免疫荧光染色,用奥林巴斯共聚焦显微镜(OLYMPUS FV-1000)检查染色效果。设置阴性对照(用0.01 mol/L PBS替代一抗)来排除非特异性染色或背景过度染色。
1.2.3 免疫荧光染色确定一抗和二抗最佳反应浓度后,按如下步骤进行免疫荧光染色和镜检:
(1)室温下,用0.01 mol/L PBS冲洗鳃组织10 min后,用5%BSA(Sigma,0.01 mol/L PBS配制,pH 7.40)室温封闭30 min。
(2)用抗体稀释缓冲液(0.1%BSA,pH 7.40)将一抗α5稀释成抗体孵育液(最佳稀释浓度1∶1 500);倾去鳃组织上的封闭液,滴加30 μL一抗孵育液,置于湿盒中4 ℃孵育过夜(约14 h)。
(3)用0.01 mol/L PBS室温下冲洗鳃组织3次,每次10 min;用0.01 mol/L PBS将二抗Alexa 488驴抗鼠稀释成二抗孵育液(最佳稀释浓度1∶500),滴加30 μL到鳃组织上,置于湿盒中室温避光孵育2 h。
(4)用0.01 mol/L PBS室温下冲洗鳃组织5次,每次10 min;缓冲甘油封片,奥林巴斯共聚焦倒置显微镜观察拍照。
1.3 数据分析随机选取30个鳃丝(6个鳃丝/尾,共5尾)用IPP 6.0(Media Cybernetics,USA)分别对鳃丝和鳃小片上的氯细胞进行定量分析,分别统计细胞数量、平均面积和细胞因子。氯细胞数量为每100 μm鳃丝或鳃小片上的NKA免疫阳性细胞数量[19],平均面积由氯细胞的总面积除以个数求得,细胞形状因子由4πA/P2 求得(A为细胞面积,P为细胞周长),其值若接近1表明细胞是圆形的,若小于1则表明细胞是卵圆形的[15]。
用SPSS 19.0(IBM)对鳃丝和鳃小片上氯细胞数量、平均面积及形状因子进行单因素方差分析(α=0.05),实验数据均以平均值±标准误(mean ± SE)表示 。
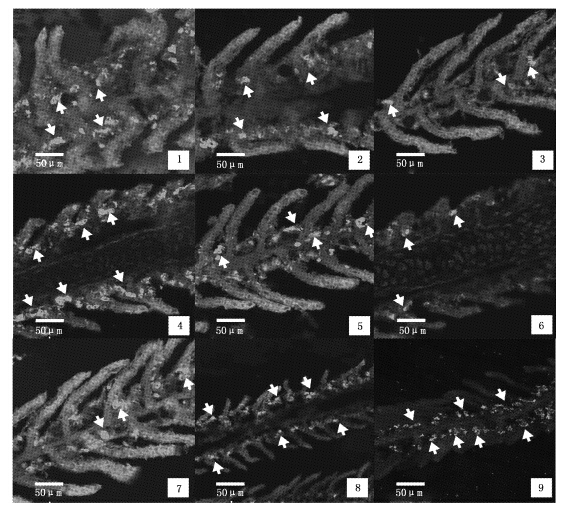
2 结果 2.1 抗体最佳稀释浓度抗体与氯细胞结合后呈亮绿色,背景荧光强度极弱或接近黑色。本研究中,一抗稀释浓度较低时,氯细胞荧光强度尽管较强,但是背景较高(图版Ⅰ-1,2,3);一抗稀释浓度过高时,背景虽低,但抗体结合率随之下降,氯细胞荧光强度弱(图版Ⅰ-4,5,6)。因此一抗浓度为1∶1 500时为最佳稀释浓度(图版Ⅰ-7,8,9);二抗稀释浓度较低时,背景浓度较高,易出现非特异性染色(图版Ⅰ-1,2,4,5,7,8),二抗稀释浓度为1∶500时,氯细胞荧光强度较强,背景较低,为较适宜稀释浓度(图版Ⅰ-3,6,9)。
|
图版Ⅰ 不同浓度抗体组合的免疫荧光反应图 箭头表示Na+/K+-ATP酶阳性(NKA-IR)细胞; 1-3. 一抗浓度均为1∶1 000,二抗浓度分别为1∶100,1∶250和1∶500; 4-6. 一抗浓度为1∶2000,二抗浓度分别为1∶100,1∶250和1∶500; 7-9. 一抗浓度为1∶1 500,二抗浓度分别为1∶100,1∶250和1∶500 。 Arrows show NKA-IR cells; 1-3. dilution ratio of the primary antibody is 1∶100,and the secondary antibody is 1∶100,1∶250 and 1∶500,respectively; 4-6. dilution ratio of the primary antibody is 1∶2000,the secondary antibody is 1∶100,1∶250 and 1∶500,respectively; 7-9. dilution ratio of the primary antibody is 1∶1 500,and the secondary antibody is 1∶100,1∶250 and 1∶500,respectively. PlateⅠ The immunofluorescence reaction in different concentration of antibodies |
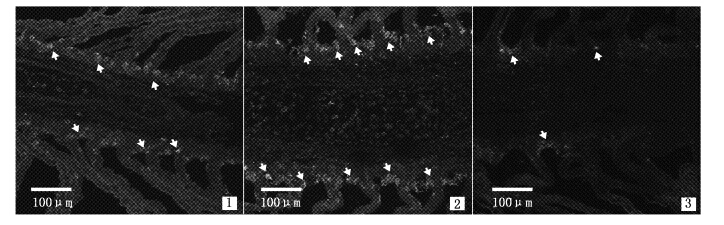
由实验可知,二抗最佳稀释浓度为预设的最高浓度1∶500,故增加1∶400和1∶600两种浓度对其进行二次验证。二抗浓度较低或较高时,氯细胞荧光强度较弱,抗体结合率低,尤其是后者,检测到的氯细胞数量极少(图版Ⅱ-1,3);当二抗浓度为1∶500时,抗体的结合率高,氯细胞荧光强度较高(图版Ⅱ-2)。
通过筛选和比较,一抗、二抗的最佳稀释浓度分别为1∶1 500和1∶500时,背景较低,氯细胞阳性强度较高(图版Ⅰ-9,表 1),为最佳稀释浓度。
|
图版Ⅱ 不同二抗浓度的免疫荧光反应图 箭头表示Na+/K+-ATP酶阳性(NKA-IR)细胞;1-3.一抗的浓度均为1∶1 500,二抗浓度分别为1∶400,1∶500和1∶600。 Arrows show NKA-IR cells. 1-3. dilution ratio of the primary antibody is 1∶1 500,and the secondary antibody is 1∶400,1∶500 and 1∶600,respectively. PlateⅡ The immunofluorescence reaction in different concentration of the secondary antibodies |
| 表 1 一抗和二抗的最佳稀释浓度 Tab. 1 The best dilution ratio of the primary and secondary antibody |
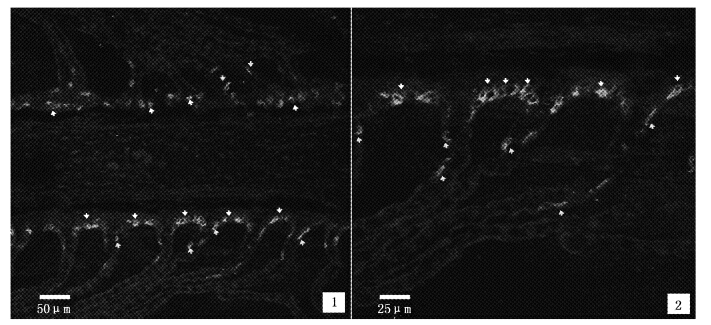
中华鲟幼鱼鳃小片并行垂直于鳃丝上,鳃上皮细胞由扁平细胞、未分化细胞、氯细胞和柱状上皮细胞等组成(图版Ⅲ)。氯细胞分布于鳃小片基部(图版Ⅲ、Ⅳ),数量较少,胞体与核均较大,胞质致密,着色较深。

|
图版Ⅲ 鳃丝和鳃小片上皮结构 CC. 氯细胞; PVC. 扁平细胞; PiC. 柱细胞; B. 血细胞; MC. 粘液细胞。 CC. chloride cells; PVC. pavement cells; PiC. pillar cells; B. blood cells; MC. mucous cells. PlateⅢ The epithelia of filament and lamellae |
经统计,鳃丝上氯细胞数量为(4.72±0.34)个/100 μm,鳃小片上氯细胞为(0.64 ± 0.19)个/100 μm,两者差异极显著(P<0.001),可见,氯细胞主要分布在鳃丝上,尤其是位于鳃小片基部的鳃丝上,少量分布于鳃小片上(图版Ⅲ和Ⅳ,表 2)。鳃丝和鳃小片上氯细胞的平均面积分别为(187.28 ± 18.30)μm2和(159.53 ± 16.72)μm2,鳃丝上氯细胞比鳃小片上的略大但无显著性差异(P>0.05);鳃丝与鳃小片上氯细胞的形状因子指数分别为0.72±0.33和0.68±0.46,两者之间无显著性差异(P>0.05),鳃丝和鳃小片上氯细胞大小基本一致,且均呈卵圆形。
|
图版Ⅳ 氯细胞(NKA-IR 细胞)在鳃上的分布 白色和黄色箭头分别指示鳃丝和鳃小片上的Na+/K+-ATP酶阳性(NKA-IR)细胞。 White and yellow arrows present NKA-IR cells on gill filament and lamella,respectively. PlateⅣ The distribution of chloride cells (NKA-IR cells) in the gill filaments and gill lamella |
| 表 2 鳃丝和鳃小片上的氯细胞数量、平均面积和形状因子(n=30) Tab. 2 Number,mean cell area and shape factor of the chloride cells on the gill filaments and gill lamella (n=30) |
免疫组化技术在研究鱼类生理中有很好的应用基础[16, 17],但对实验条件要求高,不同物种或同物种不同组织之间亦存在差异。组织固定好坏影响染色质量,一般常用4%甲醛溶液固定。研究表明,4%多聚甲醛的渗透速度会随时间延长而逐渐减慢[18],本研究中鳃组织固定时间保持在2 h左右比较适宜。一抗可特异性地与被检测蛋白结合,二抗可被荧光基团标记并特异性地与一抗结合,在激发光下,含被检测蛋白的细胞呈现出相应的荧光即可进行定位与定量分析。因此抗体的匹配度、质量、最适稀释浓度、孵育时间和温度等都直接影响到研究结果[19],故要选用适宜的高质量抗体并分装成小包装,避免反复冻融造成抗体效价下降。抗体反应过程中会产生非特异性染色,可用鸡蛋清、羊血清、牛血清白蛋白、脱脂牛奶等封闭非特异性结合位点,以降低背景着色[20],本实验用5%牛血清白蛋白进行封闭,取得较好效果。抗体孵育一般是37 ℃条件下30~60 min或4 ℃条件下过夜,尽管37 ℃时大部分抗体生物活性最强,但室温下反应温度与孵育时间很难控制[21],因此,本实验一抗孵育采取4 ℃条件下过夜,二抗则室温下孵育2 h。由于荧光抗体易淬灭性,二抗的保存、稀释、反应、冲洗及封片均要避光操作。
3.2 中华鲟幼鱼鳃上氯细胞的分布与形态特征鱼鳃上的氯细胞主要分布于鳃丝上皮细胞中[12, 13]。研究发现,纳氏鲟(A.naccarii)[12]和绿鲟(A. medirostris)[13]鳃上氯细胞主要分布在鳃丝上,位于鳃小片基部和瓣间区,少量分布于鳃小片上,这与本研究结果基本一致。氯细胞在鳃丝上的分布特征与其功能有着直接关系,鳃小片基部存在柱状毛细血管,与鳃丝瓣间区内域的中央静脉窦相连,鳃丝中央静脉窦属于静脉-淋巴血液循环,主要功能是支持氯细胞进行离子交换和渗透压调节,不参与气体交换[8]。氯细胞主要位于鳃丝传入血管附近的瓣间区域内[22, 23, 24],可以更有效地完成离子交换功能。通过测定细胞平均面积和形状因子可知,中华鲟幼鱼鳃上氯细胞呈卵圆形(细胞形状因子小于1),鳃丝上氯细胞比鳃小片上的更接近圆形,且细胞面积也略大,但无显著性差异,这与PELIS等[15]在鲑鱼(Salmo salar)的研究结果类似。氯细胞的形态特征和其细胞类型与顶膜结构有关。氯细胞分为α和β两种,α氯细胞较大,主要分布于广盐性鱼类鳃小片基部的鳃丝上,细胞质中有大量囊泡和微小管系统;而β氯细胞顶膜略平滑,线粒体和微小管系统较少,相对来说小于α氯细胞,在海水适应时可转化为α氯细胞[25]。氯细胞是鱼类离子调节的主要功能细胞,其数量和大小会随外界盐度的改变而变化[7]。中华鲟幼鱼鳃丝和鳃小片上氯细胞是否存在α和β氯细胞两种类型,还有待于进一步研究验证。研究证实,在盐度刺激下鱼类鳃上氯细胞数量与大小变化存在两种情况:一是氯细胞数量增加,体积增大[25];二是氯细胞数量不变,但体积增大[26]。在墨西哥湾鲟(A.oxyrinchusde sotoi)[27]、纳氏鲟(A. naccarii)[12]和施氏鲟(A.schrenckii)[28]的研究中,均发现环境盐度增加时其鳃上氯细胞数量和大小均呈现不同程度的增加。中华鲟幼鱼洄游过程中,鳃上氯细胞分布特征及其数量和大小变化将是下一步研究重点。
| [1] | 庄平, 刘健, 王云龙, 等. 长江口中华鲟自然保护区科学考察与综合管理[M].北京:海洋出版社, 2009:239 -240.ZHUANG P, LIU J, WANG Y L, et al. The Yangtze estuary nature reserve for Chinese sturgeon: science studies and management [M]. Beijing: Ocean Press, 2009: 239 -240. |
| [2] | HE X, ZHUANG P, ZHANG L, et al. Osmoregulation in juvenile Chinese sturgeon (Acipenser sinensis Gray) during brackish water adaptation [J]. Fish Physiology and Biochemistry, 2009, 35(2): 223-230. |
| [3] | ZHAO F, QU L, ZHUANG P, et al. Salinity tolerance as well as osmotic and ionic regulation in juvenile Chinese sturgeon (Acipenser sinensis Gray, 1835) exposed to different salinities [J]. Journal of Applied Ichthyology, 2011, 27(2): 231-234. |
| [4] | 赵峰, 张涛, 侯俊利, 等. 长江口中华鲟幼鱼血液水分渗透压及离子浓度的变化规律[J].水产学报, 2013, 37(12):1795-1800.ZHAO F, ZHANG T, HOU J L, et al. Changes in blood moisture, osmolality and ion concentration of juvenile Chinese sturgeon (Acipenser sinensis) in the Yangtze Estuary [J]. Journal of Fisheries of China, 2013, 37(12):1795-1800. |
| [5] | 封苏娅, 赵峰, 庄平, 等.中华鲟幼鱼鳃丝Na+-K+-ATPase α亚基渗透调节的分子机制初步研究[J]. 水产学报, 2012, 36(9): 1386-1391.FENG S Y, ZHAO F, ZHUANG P, et al. Preliminary studies on molecular mechanism of salinity regulation of Na+, K+-ATPase α-subunit in gills of juvenile Chinese sturgeon (Acipenser sinensis) [J]. Journal of Fisheries of China, 2012, 36(9): 1386-1391. |
| [6] | HIROSE S, KANEKO T, NAITO N, et al. Molecular biology of major components of chloride cells [J]. Comparative Biochemistry and Physiology, 2003, 136(4): 593-620. |
| [7] | HWANG P P, LEE T H. New insights into fish ion regulationand mitochondrion-rich cells [J].Comparative Biochemistry and Physiology, 2007, 148A: 479-497. |
| [8] | 林浩然.鱼类生理学[M]. 广州:中山大学出版社, 2011:205-221.LIN H R. Fish Physiology [M]. Guangzhou: Sun Yat-sen University Press, 2011: 205-221. |
| [9] | HEIJDEN A, VERBOST P M, EYGENSTEYN J, et al. Mitochondria-rich cells in gills of tilapia (Oreochromis mossambicus) adapted to fresh water or sea water: quantification by confocal laser scanning microscopy [J]. Journal of Experimental Biology, 1997, 200(1): 55-64. |
| [10] | RICHMAN N H, DIAZ S T, NISHIOKA R S, et al. Osmoregulatory and endocrine relationships with chloride cell morphology and density during smoltification in coho salmon (Onchorhynchus kisutch) [J]. Aquaculture, 1987, 60(3/4): 265-285. |
| [11] | SHIRAISHI K,KANEKO T, HASEGAWA S, et al. Development of multicellular complexes of chloride cells in the yolk-sac membrane of tilapia (Oreochromis mossambicus) embryos and larvae in seawater [J]. Cell Tissue Research, 1997, 288(3): 583-590. |
| [12] | CARMONA R, GALLEGO G M, SANZ A,et al., Chloride cells and pavement cells in gill epithelia of Acipenser naccarii: ultrastructural modifications in seawater-acclimated specimens[J].Journal of Fish Biology, 2004,64(2): 553-566. |
| [13] | ALLEN P J, CECH J J,KULTZ D. Mechanisms of seawater acclimation in a primitive, anadromous fish, the green sturgeon [J]. Journal of Comparative Physiology, 2009,179 (7): 903-920. |
| [14] | TAKEYASUK, TAMKUN M M, RENAUD K J, et al. Ouabain-sensitive Na+-K+-ATPase activity expressed in mouse L cells by transfection with DNA encoding the alpha-subunit of an avian sodium pump [J]. Journal of Biological Chemistry, 1988, 263(9): 4347-4354. |
| [15] | PELIS R M, ZYDLEWSKI J, MCCORMICK S D. Gill Na+-K+-2Cl- cotransporter abundance and location in Atlantic salmon: effects of seawater and smolting [J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2001,280 (6): 1844-1852. |
| [16] | EVANS D H, PIERMARINI P M, CHOE K P. The multifunctional fish gill: dominant site of gas exchange, osmoregulation, acid-base regulation, and excretion of nitrogenous waste [J]. Physiological Reviews, 2005, 85(1): 97-177. |
| [17] | TSE W K F, AU D W T, WONG C K C. Characterization of ion channel and transporter mRNA expressions in isolated gill chloride and pavement cells of seawater acclimating eels [J]. Biochemicaland Biophysical Research Communications, 2006, 346 (4): 1181-1190. |
| [18] | 龚志锦, 詹锫洲. 病理组织制片和染色技术[M]. 上海: 上海科学技术出版社,1994:5GONG Z J, ZHAN P Z. Preparing tissue sections and staining technology [M]. Shanghai: Shanghai Science and Technology Press, 1994: 5. |
| [19] | 郑辉, 罗红英, 颜亚辉. 免疫组织化学技术常见问题分析及对策[J].中国组织化学与细胞化学杂志, 2007, 16(1): 126-127.ZHENG H, LUO H Y, YAN Y H. Analysis and solution for normal problems in the immunohistochemistry technique [J]. Chinese Journal of Histochemistry and Cytochemistry, 2007,16(1):126-127. |
| [20] | 赵云转, 李英敏, 张英怀. 一种消除免疫组织化学非特异性染色的简易方法[J]. 河北医科大学学报, 2003, 24(4): 227-227.ZHAO Y Z, LI Y M, ZHANG Y H. A method of eliminating unspecific staining in imunohischemistry [J]. Journal of Hebei Medical University, 2003, 24(4): 227-227. |
| [21] | 何新明, 罗颖洁, 杨通, 等. 免疫组织化学染色技术常见问题的研究与探讨[J].中国免疫学杂志, 2011(s1): 1188-1190,1194.HE X M, LUO Y J, YANG T, et al. Research and analysis on normal problems in the immunohischemistry technique [J]. Chinese Journal of Immunology, 2011(s1): 1188-1190, 1194. |
| [22] | KANG C K, LIU F C, CHANG W B, et al. Effects of low environmental salinity on the cellular profiles and expression of Na+-K+-ATPase and Na+, K+, 2Cl- cotransporter 1 of branchial mitochondrion-rich cells in the juvenile marine fish Monodactylus argenteus[J]. Fish Physiology and Biochemistry, 2012,38 (3): 665-678. |
| [23] | OLSON K R, FROMM P O.A scanning electron microscopestudy of secondary lamellae and chloride cells of rainbow trout (Salmo gairdneri) [J]. Zeitschrift für Zellforschung und Mikroskopische Anatomie, 1973, 143(4): 439-449. |
| [24] | LIN Y M, CHEN C N, LEE T H .The expression of gill Na+-K+-ATPase in milkfish, Chanos chanos,acclimated to seawater, brackish water and fresh water[J]. Comparative Biochemistry and Physiological, 2003,135:489-497. |
| [25] | SHIKANO T, FUJIO Y. Immunolocalization of Na+-K+-ATPase in branchial epithelium of chum salmon fry during seawater and freshwater acclimation [J]. Journal of Experimental Biology, 1998, 201(22): 3031-3040. |
| [26] | CINOI C, MERICH D, CATALDI E, et al. Fine structure of chloride cells in freshwaterand seawater adapted Oreochromis niloticus (Linnaeus) and Oreochromis mossambicus (Peters) [J]. Journal of Fish Biology, 1991, 39(2): 197-209. |
| [27] | ALTIONOK I, GALLI S M, CHAPMAN F A. Ionic and osmotic regulation capabilities of juvenile Gulf of Mexico sturgeon,Acipenser oxyrinchusde sotoi[J].Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 1998, 120(4): 609-616. |
| [28] | ZHAO F, ZHUANG P, ZHANG L, et al. Changes in growth and osmoregulation during acclimation to saltwater in juvenile Amur sturgeon Acipenser schrenckii [J]. Chinese Journal of Oceanology and Limnology, 2010, 28(3):603-608. |
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China
 2015, Vol. 24
2015, Vol. 24


