2. 浙江大学 生命科学学院, 浙江 杭州 310058
翘嘴鲌(Culter alburnus Basilewsky)俗称白鱼、白条,分类上属于鲤形目(Cypriniformes)、鲤科(Cyprinidae)、鲌亚科(Culterinae)、鲌属(Erythroculter)。近十年来,随着人工繁殖及养殖技术的突破,翘嘴鲌在我国浙江、江苏、上海、安徽、湖北等十余个省市得到了大面积的养殖,形成了近100亿元的产值,尤其在浙江湖州地区,年繁育苗种近20亿尾,占全国40%左右。目前对翘嘴鲌的研究主要集中在营养饲料、生长、人工繁殖、池塘养殖、遗传多样性等方面[1, 2, 3, 4, 5, 6, 7, 8],虽然从养殖状况来看,翘嘴鲌未出现明显的经济性状衰退现象,但对养殖群体遗传多样性的分子研究表明,翘嘴鲌的遗传多样性处于较低水平[7, 8]。为了防止翘嘴鲌种质资源的衰退及进一步挖掘其养殖性状潜力,选育工作显得尤为重要。人工诱导雌核发育是快速固定母本性状和进行性别控制的有效手段,同时可加快鱼类尤其是世代周期较长种类的育种进程和效率,经过一次人工雌核发育诱导约相当于14世代全同胞交配选育,多数鱼类经过连续两次雌核发育就可以作为品系(种)亲本用于育种生产[9, 10, 11, 12, 13]。目前,有关翘嘴鲌雌核发育的研究未见公开报道,本实验室自2006年开始进行翘嘴鲌减数分裂雌核发育的研究,先后培育出多批次翘嘴鲌异源减数分裂雌核发育一代群体和多个减数分裂雌核发育二代家系,并应用于翘嘴鲌的选育种工作。
本研究利用微卫星(SSR)标记对获得的连续两代减数分裂雌核发育翘嘴鲌群体的遗传多样性、群体内和群体间的遗传变异及纯合度进行了研究,以太湖捕捞的野生翘嘴鲌群体作为对照,比较了连续两代雌核发育群体间的遗传差异,并以随机扩增片段多态性(RAPD)标记作为辅助标记,检测了鲤基因组对雌核发育群体的遗传污染情况,以期为后续翘嘴鲌选育及全雌育种提供理论依据。
1 材料与方法 1.1 材料来源减数分裂雌核发育一代(meio-G1)群体为2010年6月由数尾优选的太湖野生翘嘴鲌诱导培育的异源雌核发育后代,减数分裂雌核发育二代(meio-G2)群体系2012年7月用1尾性状优良的性成熟翘嘴鲌减数分裂雌核发育一代个体再次异源雌核发育诱导获得的后代。以鲤精子作为异源精子,减数分裂雌核发育诱导方法参照ZHENG等[13]的方法,并略做修改。2012年和2013年分别从meio-G1和meio-G2群体随机取30尾个体,2013年5月从太湖捕捞30尾野生群体作为对照,剪尾鳍保存在100%乙醇中,运回实验室于-20 ℃冰箱保存。
从上述每个群体中随机抽取10尾鱼,剪尾鳍用于RAPD分析。
1.2 基因组DNA提取按照OMEGA 基因组DNA提取试剂盒(美国OMEGA公司)说明书提取基因组DNA,ddH2O溶解,琼脂糖电泳和紫外分光光度计检测其完整性和浓度,并调整终浓度为50 ng/μL,-20 ℃保存待用。
1.3 微卫星引物引物来源于已发表的引物序列[14, 15, 16],由上海生工生物工程股份有限公司合成,具体序列和退火温度见表 1。
| 表 1 12对微卫星引物序列和特异退火温度 Tab. 1 Sequence and specific annealing temperature of 12 microsatellite primers |
RAPD引物购自上海生工生物工程股份有限公司,每条引物重复扩增3次,筛选出14条重复性好、图谱清晰的引物用于上述3个群体基因组扩增,引物序列及其编号见表 2。
| 表 2 14个RAPD引物分别在3个群体中扩增出的位点数和多态位点数 Tab. 2 The number of loci and number of polymorphic loci amplified within three groups with 14 RAPD primers respectively |
PCR反应体系25 μL:DNA模板1.5 μL(50 ng/μL),12.5 μL 2×Taq PCR Master Mix[Taq DNA聚合酶2.5 U,400 μmol dNTP each,20 mmol pH 8.3 Tris-HCl,100 mmol/L KCl,3 mmol/L MgCl2(天根生物公司)],上下游引物各1 μL(10 μmol/L),加灭菌去离子水至反应体积为25 μL。PCR反应程序:94 ℃预变性3 min,94 ℃变性30 s,复性30 s,72 ℃延伸30 s,共30个循环,72 ℃延伸5 min,每对微卫星引物退火温度见表 1。PCR扩增在ABI9700PCR仪(美国ABI公司)上进行。扩增产物用8%非变性聚丙烯酰胺凝胶电泳检测,上样8 μL,10 V/cm恒压电泳4 h左右,银染显色,数码相机拍照,Bio-Rad Gel Image System 4.0软件分析条带大小。
1.6 RAPD-PCR扩增及产物分离总体积25 μL,内含2.5 μL 10×Reaction Buffer,50 ng 基因组DNA,2.5 mmol/ L MgCl2,1 μmol/L引物,0.1 mmol/ L dNTPs,1 U Taq DNA聚合酶,用灭菌去离子水补足体积。反应程序参照张永正等 [7]。PCR 产物在1.5%琼脂糖电泳上进行分离,溴化乙锭染色,紫外灯下拍照。
1.7 统计指标 1.7.1 微卫星统计指标用Popgene 32[17]软件统计各微卫星位点的等位基因数(A)、观测杂合度(Ho)、期望杂合度(He)、遗传相似系数(GS)、遗传距离(D)等参数。利用MEGA软件,根据群体间的遗传距离按照UPGMA法构建3个群体的聚类图。
多态信息含量(polymorphism information content,PIC)的计算公式[18]为:
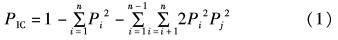
式中:PIC为多态信息含量;Pi和Pj分别为第i和第j个等位基因频率;n为等位基因数。
遗传相似系数GS计算公式[19]为:
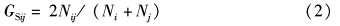
式中:GSij为个体i和j之间的遗传相似系数;Nij为个体i和j共有的基因型;Ni和Nj分别为个体i和j自有的基因型。纯合度H的计算公式[20]:

式中:H为纯合度;Ho为群体的平均观测杂合度。
1.7.2 RAPD统计指标

个体间的遗传相似度和遗传距离参照Nei’s[19]的公式计算,每个座位上相应谱带存在时记为1,缺失时记为0,将谱带转换为01矩阵。
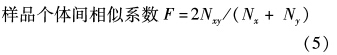
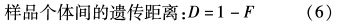
群体内遗传相似度和遗传距离通过对群体内所有个体间的遗传相似度F和遗传距离D值平均求得。
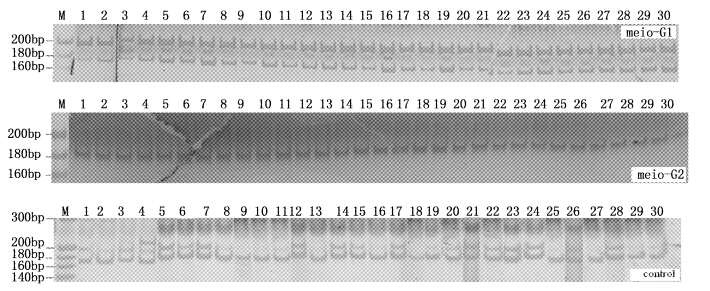
2 结果 2.1 微卫星分析结果 2.1.1 等位基因频率、平均等位基因数及多态信息含量12对引物均能在3个群体中扩增出稳定清晰的条带,其中,基因座TC14在3个群体中只扩增出一条条带。12对引物在对照组、meio-G1、meio-G2中分别扩增出47、38和16个等位基因,平均等位基因数分别为3.916 7、3.166 7和1.333 3,对照组最高,meio-G1次之,meio-G2最低;平均多态信息含量对照组最高,为0.596 9,其次为meio-G1(0.481 6),meio-G2最低(0.125 0),见表 3。图 1为引物HLJHB01在3个群体中的扩增结果。
| 表 3 3个群体在12个微卫星位点的遗传参数 Tab. 3 Genetic parameters on 12 microsatellite loci in the three groups |
|
图 1 引物HLJHB01在3个群体中的扩增结果 meio-G1代表减数分裂雌核发育一代群体;meio-G2代表减数分裂雌核发育二代群体;control代表太湖群体;M为20 bp DNA marker;1~30为个体编号。 meio-G1 represents the first generation meiosis gynogenetic group; meio-G2 represents the second generation meiosis gynogenetic group;M represents 20 bp DNA ladder marker; 1-30 represent individual numbers. Fig. 1 Amplification results of primer HLJHB01 in three groups |
利用所选的12个微卫星位点对meio-G1、meio-G2及对照组进行检测,统计了3个群体的观测杂合度(Ho)、期望杂合度(He)和纯合度,见表 4。结果显示,meio-G1、 meio-G2的Ho、He等遗传指标均低于对照组,而meio-G2低于meio-G1;meio-G1、meio-G2的纯合度分别为0.569 4、0.666 7,高于对照组的0.325 0。
| 表 4 3个群体基因杂合度和纯合度 Tab. 4 Gene heterozygosity and homozygosity of the three groups |
根据所检测的12个微卫星位点的基因型,计算了meio-G1、meio-G2和对照组3个群体内个体间的遗传相似系数(表 5)。结果表明,meio-G2的遗传相似系数为1.000 0,显著高于meio-G1(0.543 0) 和对照组(0.571 9)。
| 表 5 3个群体个体间的遗传相似系数 Tab. 5 Genetic similarity of the three groups between individuals |
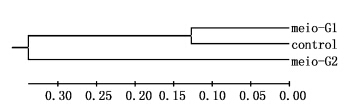
meio-G1和对照组之间的遗传相似系数最大,为0.775 7,meio-G1和meio-G2之间的遗传相似系数最小为0.471 3;与此对应,meio-G1和meio-G2之间的遗传距离最大,为0.752 4,meio-G1和对照组之间的遗传距离最小,为0.254 1(表 6)。在聚类图上,meio-G1和对照组聚为一支,而meio-G2自成距离较远的独立分支(图 2)。
| 表 6 群体间遗传相似系数(对角线上)和遗传距离(对角线下) Tab. 6 Genetic similarity (above diagonal) and genetic distance (below diagonal) among groups |
|
图 2 3个群体的亲缘关系图 Fig. 2 Dendrogram for three groups |
用14个随机引物对3个翘嘴鲌群体共30个个体的基因组DNA进行了RAPD分析,单个引物检测的位点数在2~8之间,PCR扩增片段的长度在130~2 400 bp之间。14个随机引物共检测到199个位点。其中有部分引物扩增出群体特异性条带,如引物S129在meio-G1中扩增出一条特异于meio-G2的条带(图 3a中箭头所示),在meio-G2中扩增出两条特异于meio-G1的条带(图 3b中箭头所示),且在其他RAPD图谱中未发现来自父本鲤基因组的特有条带。

|
图 3 引物S129在3个群体中的扩增图 (a)meio-G1群体; (b)meio-G2群体; (c)太湖对照群体; F为父本; M为D15000+2000 DNA marker。 (a) represents meio-G1 population; (b) represents meio-G2 population; (c) represents control population; F. represents father; M. represents D 15000+2000 DNA marker. Fig. 3 RAPD-PCR amplification profile in three groups of primer S129 |
单个引物在3个群体中扩增出的位点数、多态位点数及多态位点比例见表 2。结果表明,14个随机引物在3个群体的基因组DNA中分别扩增到74、61、64个位点,检测到的平均位点数分别为5.3、4.4、4.6个,其中多态位点数分别为47、0、33,多态位点比例的大小顺序为meio-G1(63.51%)>对照组(51.56%)>meio-G2(0)。
2.2.3 3个群体内遗传相似度和遗传距离参照Nei’s的方法对3个群体的群体内遗传相似度和遗传距离进行了计算,3个翘嘴鲌群体的群体内遗传相似度分别为0.801 8、1.000 0和0.846 0,即meio-G2群体的遗传相似度最大,对照组次之,meio-G1群体的最小;3个群体内的遗传距离大小顺序相反,meio-G1(0.198 2)>对照组(0.154 0)>meio-G2(0)。
3 讨论 3.1 人工诱导减数分裂雌核发育加快了翘嘴鲌基因座位的纯合利用人工雌核发育技术诱导了连续两代的减数分裂雌核发育翘嘴鲌家系,经RAPD标记鉴定,均未发现父本鲤基因组特有的等位基因。在检测的12个微卫星基因座位中,发现存在一些杂合位点,这是由卵母细胞减数分裂时同源染色体之间发生交换引起的[21, 22, 23]。虽然存在一定比例的杂合子,但连续两代雌核发育的诱导加快了翘嘴鲌基因座位的纯合。从群体水平分析,在12个微卫星基因座中,meio-G1群体仅有1个基因座纯合,而meio-G2有8个基因座表现纯合。从纯合度分析,meio-G1群体在所检测的12个微卫星位点上的平均纯合度为0.569 4,meio-G2的平均纯合度达到0.666 7(表 4),高于对照组和meio-G1群体,且个体间的基因型完全相同,个体间的遗传相似系数为1.000 0,个体间的遗传差异进一步缩小,这和牙鲆[24]、大黄鱼[25]、草鱼[26]等的研究结果相似。从群体间的遗传分化来看,meio-G2群体和对照组之间的遗传距离为0.600 6,与meio-G1的遗传距离也大于meio-G1与对照组之间的遗传距离(表 6),说明meio-G2群体已经与对照组和meio-G1群体产生了较为明显的遗传分化。这些结果表明,减数分裂雌核发育能加快翘嘴鲌基因座位的纯合速率,使控制优良性状的基因快速纯合化。
3.2 meio-G1和meio-G2之间遗传相似系数和遗传多样性最小本文中meio-G2由meio-G1诱导而来,但SSR结果显示,meio-G2和meio-G1之间遗传相似系数最小,在聚类图上,meio-G1和对照组聚为一支,meio-G2自成距离较远的独立分支。原因可能是meio-G1作为异质减数分裂雌核发育家系,其母本来自较早捕捞的太湖野生群体,且选用了数尾鱼作为meio-G1的母本,由不同母本的卵子诱导而来,其基因组来源复杂,基因高度杂合,导致meio-G1子代遗传性状分化显著,meio-G1个体间具有较高的遗传异质性;而meio-G2是由1尾一代减数分裂雌核发育雌鱼的卵子诱导获得,是单一家系,meio-G2在检测的12个SSR位点中,有8个位点为纯合子,纯合度相对较高,经过两次减数分裂雌核发育诱导后,meio-G2家系内个体的遗传同质性也显著提高,导致了meio-G2和meio-G1之间遗传相似系数较小。本研究中,减数分裂雌核发育群体的平均等位基因数(A)、平均观测杂合度(Ho)、平均期望杂合度(He)及平均多态信息含量均明显低于对照组,说明减数分裂雌核发育群体的遗传多样性低于对照组。从群体遗传学角度考虑,对照组群体是自然状态下多条雌、雄鱼的后代,而本研究中的减数分裂雌核发育群体为1尾或较少尾雌鱼的后代;人工诱导减数分裂雌核发育群体可视为经历了极端的遗传瓶颈,在卵子染色体二倍体化的过程中,异源精子只起到激活的作用,并非两性生殖细胞的融合,其后代的遗传物质来自母本,当选用基因组杂合度较低的雌鱼作为母本时,经过减数分裂雌核发育的诱导后,遗传多样性也较低,可见,亲本数量和雌核发育都对其遗传多样性造成了一定的影响。本研究中,meio-G1在4个位点(E156B、HLJHB01、HLJHB22、HLJHB28)有较低的杂合子比例,meio-G2在12个微卫星位点中,有8个位点杂合度为0,meio-G1在12个位点上的平均观测杂合度为0.430 6,meio-G2在12个位点上的平均观测杂合度为0.333 3,均低于对照组,这与这些位点距离着丝粒的位置远近有关。在诱导减数分裂雌核发育时,距离着丝粒近的位点,等位基因之间不易发生重组交换,使其杂合子比例较低,遗传多样性较低;距离着丝粒位置远的位点,等位基因之间容易发生重组交换,杂合子比例较高,遗传多样性也较高。在本研究的12个微卫星基因座位中,3个群体在位点TC14上都只检测到145 bp的条带,基因型完全相同,而meio-G1和对照组在位点TC01和HLJHB22中均表现杂合,且只有两个等位基因,在其他位点所检测的等位基因类型丰富,杂合度较高,可见,分子标记的选择对分析减数分裂雌核发育群体遗传多样性的结果也有较大的影响。
3.3 人工诱导减数分裂雌核发育致使翘嘴鲌部分基因位点快速丢失本研究的RAPD结果表明,meio-G1的多态位点数为47,占总位点数的63.51%,而在meio-G2群体中,多态位点数为0,经过连续两代人工诱导雌核发育后,47个多态性位点在meio-G2群体中全部丢失,说明在人工诱导雌核发育的过程中存在RAPD位点的快速丢失现象。刘正华等[27]的研究结果表明,在湘江流域普通草鱼群体中检测到的30个多态位点数,有17个在meio-G2草鱼群体中丢失。RAPD位点的快速丢失是基因纯化和人工选择双重作用造成的。当部分RAPD位点在meio-G1某些个体的基因组中缺失时,人工诱导减数分裂雌核发育过程中这些位点被纯化后,当人工选择的母本是缺失这些位点的个体时,所诱导的减数分裂雌核发育群体中所有个体就完全检测不到这些位点,造成部分等位基因的丢失。大量等位基因的丢失会导致翘嘴鲌群体适应不同生存环境的能力下降,因此,在利用人工雌核发育技术进行人工育种的同时,还应该注意保护翘嘴鲌群体种质资源的遗传多样性,为遗传育种提供更多的遗传选择性状。
3.4 人工诱导减数分裂雌核发育可快速获得翘嘴鲌基因型纯合系传统的良种选育过程是不断纯合和杂交的过程,建立一个遗传纯系或选育系一般要通过连续数代的近交来完成,不仅时间漫长,还需要大量的资金、场所和人力[28]。减数分裂雌核发育能够快速实现纯化,高效率获得高纯度的育种材料,是快速获得纯系近交系的有效途径。翘嘴鲌是我国重要的淡水经济鱼类之一,借助减数分裂雌核发育技术快速培育出优良性状稳定遗传的品系具有重要意义。本课题组利用抑制第二极体释放的方法诱导了两个不同类型的减数分裂雌核发育家系,经RAPD标记分析,未发现鲤鱼基因组特异条带。SSR结果显示,经过连续两代的减数分裂雌核发育后,meio-G2群体不仅纯合度较对照组和meio-G1有了明显的提高,且个体间的基因型完全一致,遗传相似系数已经提高到1.000 0,这些结果表明meio-G2已经是一个遗传特征高度一致的品系。根据STREINGER等[9]提出的方案,通过对连续两代雌核发育后代进行筛选,结合分子标记辅助育种,从中挑选基因型相同、纯合度高的个体和借助雄性激素转变的生理雄性个体进行交配,就可以在较少的世代数中建立高纯品系,缩短育种时间。由此可见,本研究中诱导培育的meio-G2群体为翘嘴鲌良种选育和遗传研究提供了优良材料,对快速选育生长性状优良、抗病、抗逆性强的新品种(系)具有重要意义。
| [1] | 钱曦, 王桂芹, 周洪琪, 等. 饲料蛋白水平及豆粕替代鱼粉比例对翘嘴红鲌消化酶活性的影响[J].动物营养学报, 2007,19(2):182-187. QIAN X,WANG G Q,ZHOU H Q,et al.Effect of dietary protein on the activities of digestive enzymes of topmouth culter(Erythroculter ilishaeformis Bleeker)[J].Journal of Animal Nutrition,2007,19(2):182-187. |
| [2] | 刘波, 唐永凯, 俞菊华, 等. 饲料脂肪对翘嘴红鲌生长、葡萄糖激酶和葡萄糖-6-磷酸酶活性与基因表达的影响[J].中国水产科学, 2008,15(6): 1024-1033. LIU B, TANG Y K, YU J H, et al. Effects of dietary lipids on growth, GK and G6Pase activities and mRNA levels in topmouth cutler (Erythrocutler ilishaeformis Bleeker) [J]. Journal of Fishery Sciences of China, 2008, 15(6):1024-1033. |
| [3] | 王桂芹, 周洪琪, 赵朝阳, 等. 饲料蛋白对翘嘴红鲌蛋白质周转代谢的影响[J].水产学报, 2006,30(2):246-253.WANG G Q, ZHOU H Q, ZHAO C Y, et al. The effect of dietary protein on protein turnover of Erythroculter ilishaeformis Juveniles [J]. Journal of Fisheries of China, 2006,30(2): 246-253. |
| [4] | 王伟, 陈立侨, 顾志敏, 等. 六个群体翘嘴红鲌肌肉生化组成的比较[J].水产学报, 2007, 31(s1): 92-99.WANG W, CHEN L Q, GU Z M, et al. Comparative study on muscle nutritional quality of six different geographical populations of culter alburnus [J]. Journal of Fisheries of China, 2007, 31(s1):92-99. |
| [5] | 张永正.翘嘴红鲌人工繁殖技术研究[D].杭州:浙江大学, 2005.ZHANG Y Z. Study on artificial propagation and nursing techniques of Erythroculter ilishaeformis Bleeker[D]. Hangzhou:Zhejiang University,2005. |
| [6] | 李池陶, 徐伟, 王进, 等. 池塘养殖兴凯湖翘嘴鲌的人工繁殖和胚胎发育观察[J].大连水产学院学报, 2008, 23(2): 87-91. LI C T, XU W, WANG J, et al. The artificial propagation and observation of embryonic development in Xingkai Lake Topmouth culter Erythroculter ilishaeformis farmed in a pond [J].Journal of Dalian Fisheries University, 2008, 23(2): 87-91. |
| [7] | 张永正, 张海琪, 邵庆均, 等. 翘嘴红鲌(Erythroculter ilishaeformis Bleeker)种群遗传多样性的RAPD分析[J].海洋与湖沼, 2007,38(6): 581-584.ZHANG Y Z, ZHANG H Q, SHAO Q J, et al. The Genetic diversity of germplasms of Erythroculter ilishaeformis Bleeker revealed by RAPD markers [J].Oceanologia Et Limnologia Sinica, 2007, 38(6): 581-584. |
| [8] | 王伟. 翘嘴鲌(Culter alburnus)群体遗传多样性及鲌亚科鱼类系统发生的研究[D].上海: 华东师范大学, 2007.WANG W. Study on population genetic diversity of Culter alburnus and Phylogeny of cultrinae [D].Shanghai:East China Normal University,2007. |
| [9] | STREINGER G, WALKER C, DOWER N, et al. Production of homozygous diploid zebra fish (Brachydanio rerio) [J]. Nature, 1981, 291(5813): 293-296. |
| [10] | KOMEN H, THORGAARD G H. Androgenesis, gynogenesis and the production of clones in fishes: a review [J].Aquaculture, 2007, 269(1/4): 150-173. |
| [11] | 刘静霞, 周莉, 赵振山, 等. 锦鲤4 个人工雌核发育家系的微卫星标记研究 [J].动物学研究, 2002, 23(2):97-105. LIU J X, ZHOU L, ZHAO Z S, et al. Studies on microsatellite markers of four artificially gynogenetic families in ornamental carp[J]. Zoological Research, 2002, 23(2): 97-105. |
| [12] | 刘海金, 刘永新, 王玉芬, 等. 牙鲆减数分裂与有丝分裂雌核发育的遗传差异[J].水产学报, 2010,34(6):898-904. LIU H J, LIU Y X, WANG Y F, et al. Genetic difference between meiotic gynogenesis and mitotic gynogenesis in the Japanese flounder [J]. Journal of Fisheries of China, 2010, 34 (6): 898-904. |
| [13] | ZHENG K, LIN K D, LIU Z H, et al. Comparative microsatellite analysis of grass carp genomes of two gynogenetic groups and the Xiangjiang river group [J]. Journal of Genetics and Genomics, 2007, 34(4): 321-330. |
| [14] | LI Y, THANH T, WANG W M. Development of polymorphic microsatellite markers in top mouth culter (Culter alburnus) [J]. Conservation Genet Resour, 2010(2): 43-46. |
| [15] | CHEN S Q, LIU Q G, REN S J, et al. Polymorphic microsatellite loci isolated from the top mouth culter (Culter alburnus Basilewsky) [J]. Conservation Genet Resour, 2009(1): 337-339. |
| [16] | 张义凤, 孙效文, 鲁翠云, 等. 磁珠富集法制备翘嘴红鲌微卫星分子标记[J].农业生物技术学报, 2008,16(4):610-615.ZHANG Y F, SUN X W, LU C Y, et al. Microsatellite enrichment by magnetic beads in Erythroculter ilishaeformis (Bleeker) [J]. Journal of Agricultural Biotechnology, 2008,16(4): 610-615. |
| [17] | YEH F, YANG R C, BOYLE T, et al. POPGENE: the user-friendly shareware for population genetic analysis [M]. Edmonton: Molecular and Biotechnology Center, University of Alberta,1997. |
| [18] | BOTSTEIN D, WHITE R L, SKOLNICK M, et al. Construction of a genetic linkage map in man using restriction fragment length polymorphisms [J]. American Journal of Human Genetics, 1980, 32(3): 314-331. |
| [19] | NEI M, LI W H. Mathematical model for studying genetic variation in terms of restriction endonucleases [J]. Proceedings of the National Academy of Sciences of the United States of America, 1979, 76(10): 5269 -5273. |
| [20] | FRANCESCON A, BARBARO A, BERTOTTO D, et al. Assessment of homozygosity and fertility in meiotic gynogens of the European sea bass (Dicentrachus labrax L.) [J]. Aquaculture, 2005, 243(1): 93-102. |
| [21] | 王伟, 尤锋, 高天翔, 等. 人工诱导牙鲆异质雌核发育群体的微卫星标记分析[J].高技术通讯, 2005, 15(7):107-110.WANG W, YOU F, GAO T X, et al. Microsatellite markers analysis on artificial meiogynogenetic stock of Paralichthys olivaceus [J]. High Technology Letters, 2005, 15(7): 107-110. |
| [22] | 朱晓琛, 刘海金, 孙效文,等. 微卫星评价牙鲆雌核发育二倍体纯合性[J].动物学研究, 2006, 27(1): 63-67. ZHU X C, LIU H J, SUN X W, et al. Assessment of homozygosity in gynogenetic diploid using microsatellite markers in Japanese flounder (Paralichthys olivaceus) [J]. Zoological Research, 2006, 27(1): 63-67. |
| [23] | 李冰霞, 罗琛. 热休克法抑制第一次卵裂实现草鱼雌核发育的细胞学观察[J].水生生物学报, 2003,27(2):155-160. LI B X, LUO C. Cytological observations on induction of mitogynogenesis by heat-shocking of the eggs in grass carp, Ctenopharyngodon idellus. [J]. Acta Hydrobiologica Sinica, 2003,27(2):155-160. |
| [24] | 王桂兴, 刘海金, 张晓彦, 等.牙鲆连续两代减数分裂雌核发育家系的遗传特征[J].中国水产科学, 2012,19(3): 381-389. WANG G X, LIU H J, ZHANG X Y, et al. Analysis of homozygosity and genetic similarity between two successive generations in a meiogynogenetic Japanese flounder family [J]. Journal of Fisheries Sciences of China, 2012,19(3): 381-389. |
| [25] | 叶小军, 王志勇, 刘贤德, 等.大黄鱼连续两代雌核发育群体的微卫星标记分析[J].水生生物学报,2010,34(1):144-151. YE X J, WANG Z Y, LIU X D, et al. Analysis of genetic aomozygosity and diversity of two successive generation meio-gynogenetic population in Pseudosciaena crocea using microsatellite markers [J]. Act Hydrobiologica Sinica, 2010,34(1):144-151. |
| [26] | 陈金辉, 黄明敏, 郑康, 等. 两个不同的人工雌核发育草鱼群体基因组DNA的RAPD分析[J].水生生物学报, 2004,28(5):471-477. CHEN J H, HUANG M M, ZHENG K, et al. RAPD analysis on genomic DNA of two artificial gynogenetic groups of grass carp, Ctenopharyngodon idellu [J]. Acta Hydrobiologica Sinica, 2004,28(5):471-477. |
| [27] | 刘正华, 陈金辉, 黄明敏, 等. 草鱼基因组DNA一些RAPD位点的遗传分析及分子标记筛选[J].水生生物学报, 2006,30(3):292-297. LIU Z H, CHEN J H, HUANG M M, et al. Genetic analysis on some RAPD Loci for identification of molecular markers in grass carp genomic DNA [J].Acta Hydrobiologica Sinica, 2006,30(3):292-297. |
| [28] | 张龙岗, 李娴, 付佩胜.人工诱导雌核发育技术在淡水鱼类遗传育种研究中的应用[J].湖北农业科学, 2011,50(7):1430-1434. ZHANG L G, LI X, FU P S. Application of artificially induced gynogenesis on research of freshwater Fish [J].Hubei Agricultural Sciences, 2011,50(7):1430-1434. |
2. College of Life Sciences, Zhejiang University, Hangzhou 310058, Zhejiang, China
 2015, Vol. 24
2015, Vol. 24


