扩展功能
文章信息
- 李云磊, 王昊天, 陆宇燕, 李丕鹏
- LI Yunlei, WANG Haotian, LU Yuyan, LI Pipeng
- 西藏林芝市西藏蟾蜍种群的年龄、生长及其他种群特征的研究
- Age, Growth and Other Population Characteristics of Bufo tibetanus in Nyingchi City, Tibet
- 四川动物, 2022, 41(3): 290-299
- Sichuan Journal of Zoology, 2022, 41(3): 290-299
- 10.11984/j.issn.1000-7083.20210334
-
文章历史
- 收稿日期: 2021-09-26
- 接受日期: 2022-01-21
种群的年龄结构主要是指种群中不同年龄组个体的组成情况,年龄结构的类型主要分为增长型、稳定型和衰退型(Guarino & Erismis,2008)。年龄结构不仅是种群生态学研究中的核心问题,对于两栖动物生理、生态甚至形态分类方面的研究均具有重要意义(Hasumi,2010)。
两栖类动物年龄推断的常见方法有体长计数法(Voris & Jayne,1979)、骨龄学方法(易祖盛等,2000)、标志重捕法(Wagner et al., 2011)、精巢分叶法(Sinsch,2015)等。目前,公认可靠、有效且得以广泛使用的是骨龄学方法。李云磊等:西藏林芝市西藏蟾蜍种群的年龄、生长及其他种群特征的研究
两栖类动物作为变温动物,具有冬眠的习性,其代谢功能随季节变化。这使其骨骼生长发育以及矿物质沉积在不同季节表现出明显的差异,即在生活期和冬眠期形成的骨质环密度不同。由于物质沉积量的差异,第一年冬眠期及其前后生长缓慢阶段形成的骨环(染色较深)和第二年生活期形成的骨环(染色较浅)间呈现出1个明暗交界的同心环带(毕远阁等,2009),被称为生长抑制线(line of arrested growth,LAG),LAG的数目可间接判断出个体年龄(易祖盛等,2000)。李文蓉等(2010)发现,动物的指/趾骨与其他骨块一样具有良好且清晰的LAG结构,同时剪指/趾可避免对动物的杀戮,对动物保护具有积极意义。该法在近10种两栖类中被用于种群年龄结构的鉴定和研究(Hemelaar, 1985, 1988;Bastien & Leclair,1992;Beebee & Denton,1993;Khonsue et al., 2000;Kumbar & Pancharatna,2002;李斌,2004;Liang & Lu,2006;毛敏等,2011;Bionda et al., 2018)。
西藏蟾蜍Bufo tibetanus属两栖纲Amphibia无尾目Anura蟾蜍科Bufonidae蟾蜍属,主要分布在海拔2 400~4 300 m较潮湿的高原草地或山区。目前对西藏蟾蜍的研究集中在消化系统(曾麟等,2011)、皮肤显微结构和基础组织学(高凤娟等,2016),而其种群的年龄结构未见报道。本研究以骨龄学方法,辅以生殖腺及组织学结构的观察,对分布于西藏自治区林芝市的一个西藏蟾蜍种群的年龄结构、体长、生殖腺形态和性成熟年龄等进行了探讨,旨在积累更多生物学资料,为今后该物种的保护工作奠定基础。
1 研究材料与方法 1.1 实验材料西藏蟾蜍为沈阳师范大学生命科学学院两栖爬行动物标本室福尔马林固定标本,共计63只(♀29只,♂ 34只),采自西藏自治区林芝市(94°56′~94°58′E,29°14′~29°17′N,海拔2 900 m),采集时间主要为2014年、2015年7月28日—8月2日(当地西藏蟾蜍的繁殖季节)。
1.2 实验方法标本流水冲洗过夜,利用赛多利斯电子天平(Mettler Toledo Q/OAFA02-2009,上海精密科学仪器有限公司天平仪器厂)称量体质量(精度0.001 g),称量前利用吸水纸吸干标本体表液体。利用电子数显游标卡尺(哈尔滨量具厂,GB/T 14899-94)测量体长(吻端到泄殖腔距离,SVL;精度0.01 mm)。成年个体依据是否有婚垫区分性别,对婚垫不明显个体则解剖辨别生殖腺确定性别,生殖腺称重(精度0.001 g)。
取第三指骨和生殖腺流水冲洗过夜(指骨先在5%硝酸溶液中脱钙,直至软化),常规石蜡切片,指骨切片厚度10 μm,生殖腺切片厚度7 μm,HE染色。利用Olympus BX-51显微镜观察,Olympus DP70拍照。
1.3 骨龄计数标准为了保证年龄估计的准确性,取同一指骨不同位置的8~10个切片进行LAG计数,由于所用标本均在繁殖期前后捕获,故当年的LAG还没有完全形成,因此在计数过程中将骨组织切片的最外缘(当年生活期形成的骨质环)也算作1条LAG(马小艳,2009)。为了降低误差,由2位独立观察者分别进行LAG数目的统计。
1.4 LAG间距离测量利用Image-Pro Plus 6.0测量相邻2条LAG之间的距离(Hemelaar,1985;易祖盛等,2000),同一指骨随机选取8~10个不同部位进行测量:A~G分别代表 1~2、2~3、3~4、4~5、5~6、6~7、7~8条LAG之间的距离。
1.5 数据处理利用SPSS R26.0中的t-test检验分别分析体长和年龄在雌雄个体间是否具有差异性,数据以x±s±SD表示。利用单因素ANOVA分析检验LAG之间距离的差异性。利用Spearman相关性分析雌雄体长和年龄的关系,Mann-Whitney U检验用来验证各个年龄段雌雄性之间体长差异性是否显著,两性平均年龄是否具有差异性。所有的检验均为双尾检验,显著性水平设置为α=0.05。
1.6 计算公式使用von Bertalanffy模型SVLt=SVLmax(1-e-kt+b)建立种群生长曲线,估算西藏蟾蜍的生长模式(Hemelaar,1986),生长速率R=ds/dt=k(Smax-Smean)(Lou et al., 2012)比较雌、雄性生长的快慢,其中,SVLt为年龄t时的体长,SVLmax为渐进最大体长,k为生长系数,b是常数,Smax是一个种群成体的最大体长,Smean是一个种群成体的平均体长。采用生殖腺系数=生殖腺质量/体质量×100%(刘海映等,2013)分析各个年龄段雌、雄性的生殖腺发育状况。
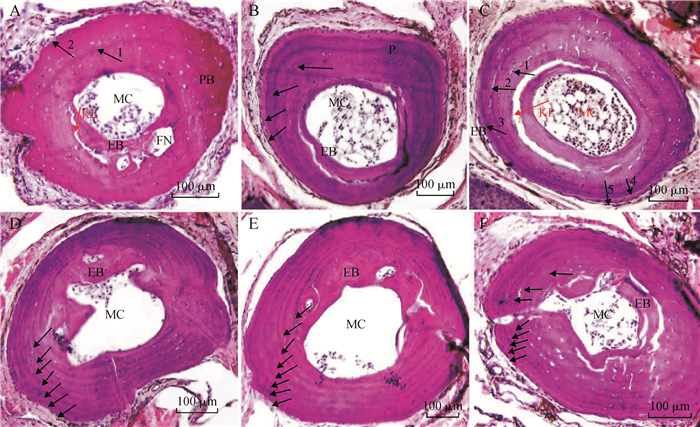
2 实验结果 2.1 年龄鉴定及种群年龄结构第三指骨切片上可观察到:中心空腔为骨髓腔,向外依次是骨质疏松的内骨板,大多呈裂开缝隙状,为Kastschenko线(指内骨板与外骨板之间有1层缺乏骨组织细胞的、均质的软骨样组织,由于制片易裂开形成缝隙),骨质致密为外骨板(图 1)。在外骨板上可见清晰的LAG,每一条代表经过了1个冬眠期,即为1龄。由于西藏蟾蜍当年完成变态,外骨板上可见LAG数目即为个体年龄。
|
| 图 1 西藏林芝西藏蟾蜍指骨组织切片 Fig. 1 Phalangeal section of Bufo tibetanus in Nyingchi City, Tibet A. 2龄雌性, B. 4龄雄性, C. 5龄雄性, D. 7龄雌性, E. 8龄雌性, F. 8龄雄性; MC. 骨髓腔, EB. 内骨板, PB. 外骨板, FN. 营养管, KL. Kastschenko线, 黑色箭头表示生长抑制线 A. 2-year-old female individual, B. 4-year-old male individual, C. 5-year-old male individual, D. 7-year-old female individual, E. 8-year-old female individual, F. 8-year-old male individual; MC. marrow cavity, EB. endosteal bone, PB. periosteal bone, FN. nutrient canal, KL. Kastschenko line, black arrows indicate the lines of arrested growth |
| |
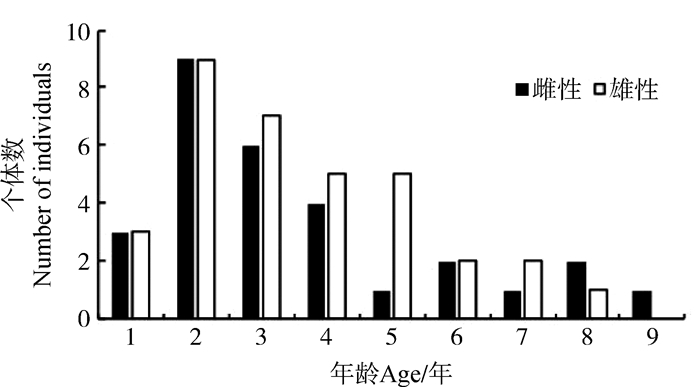
骨龄学方法可将西藏蟾蜍划分为9个年龄组,其中,雌性的最长寿命为9龄,雄性为8龄;两性的2龄组均为个体数目最多的年龄组,其次为3龄组、4龄组。雌性的平均年龄为(3.59±2.23)年,雄性为(3.56±1.83)年,两性在各年龄组的数量分布上的差异不显著(df=63,t=0.054,P>0.05)(图 2)。随着年龄增加,个体数逐渐减少,种群属于增长型。
|
| 图 2 西藏林芝一个西藏蟾蜍种群的年龄结构分布 Fig. 2 Age structure of one Bufo tibetanus population in Nyingchi City, Tibet |
| |
西藏蟾蜍雌性的平均体长为46.44 mm±15.91 mm(23.96~70.61 mm),雄性为45.06 mm±13.00 mm(23.98~64.66 mm)。各年龄组雌、雄性的平均体长基本接近(表 1),无显著差异(P﹥0.05)。其中,5~9龄组由于个体数量明显减少,甚至一个年龄组中仅有1只个体。这虽然证实了西藏蟾蜍在骨龄学上年龄组的连续性,但由于数量不符合统计学要求,后续分析中这部分数据仅作为参考。
| 年龄 Age/年 |
体长 Body length/mm | Z | P | |
| 雌性 Female | 雄性 Male | |||
| 1 | 26.46±2.17 (23.96~27.94) (n=3) |
24.40±0.38 (23.98~24.71) (n=3) |
-0.655 | ﹥0.05 |
| 2 | 34.91±8.47 (28.21~50.31) (n=9) |
33.89±8.02 (27.30~53.72) (n=9) |
-0.221 | ﹥0.05 |
| 3 | 42.28±7.49 (37.14~52.59) (n=6) |
44.43±8.47 (33.78~55.36) (n=7) |
-0.429 | ﹥0.05 |
| 4 | 57.93±8.60 (48.82~69.58) (n=4) |
53.08±5.28 (47.42~56.36) (n=5) |
-0.980 | ﹥0.05 |
| 5 | 69.20 | 55.10±4.66 (49.73~59.06) (n=5) |
-1.464 | ﹥0.05 |
| 6 | 64.08±3.78 (61.40~66.75) (n=2) |
61.98±3.79 (59.30~64.66) (n=2) |
-0.775 | ﹥0.05 |
| 7 | 62.70 | 59.63±1.39 (58.65~60.61) (n=2) |
-1.225 | ﹥0.05 |
| 8 | 68.53±0.23 (68.36~68.69) (n=2) |
58.86 | -1.225 | ﹥0.05 |
| 9 | 70.61 | — | — | — |
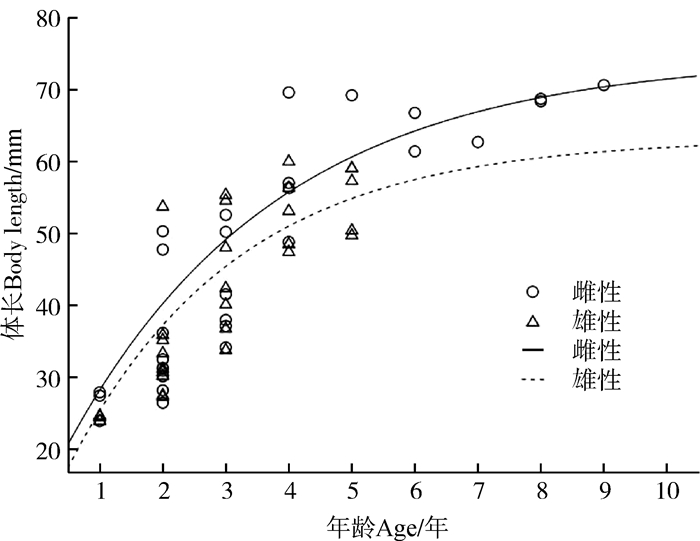
雌、雄性个体的年龄与体长均呈极显著正相关(Spearman相关性检验:雌性:r=0.900,n=29,P<0.01;雄性:r=0.878,n=34,P<0.01)。模拟两性的生长模式并建立生长曲线(图 3):雌性为SVLt=74.542 0(1-e-0.300 4t-0.176 1),雄性的为SVLt=63.210 3(1-e-0.377 5t-0.135 4);两性体长均随年龄增长而呈现增长的趋势,但雌性的生长速率(3.29)大于雄性(2.65)。5龄前雌、雄性的生长曲线均呈快速上升趋势,5龄后趋于平缓,且雄性的上升趋势明显低于雌性。
|
| 图 3 西藏林芝市西藏蟾蜍生长曲线 Fig. 3 Growth curve of Bufo tibetanus by von Bertalanffy model in Nyingchi City, Tibet |
| |
雌性个体依据卵子外部形态可划分为3类:体长62.70 mm以上为性成熟个体,体腔中可见发育良好的卵巢,左右成对,体积较大,表面可见大量黑色卵粒,为尚未进行繁殖的成熟雌性个体,还有部分个体的卵巢体积较小,卵巢呈淡黄色和黑色2个部分,在黑色部分可见饱满的黑色卵粒,淡黄色部分未见大量成熟黑色卵粒,推测这些是已经完成了繁殖过程,排出了大部分成熟卵粒的个体;体长48.82~61.40 mm为亚成体,卵巢呈淡黄色,表面可见淡黄色颗粒结构;体长48.82 mm以下为幼体,卵巢呈淡黄色,未见明显卵粒(图 4:A,B,C)。雄性个体均可见成对精巢,体长42.40 mm以上为性成熟个体,精巢体积较大,组织切片中均可见形态较为规则的生精小管;体长35.17 mm以下为亚成体,精巢尚未完全发育(图 4:D,E,F)。

|
| 图 4 西藏林芝一个西藏蟾蜍种群的雌、雄性生殖腺 Fig. 4 Male and female gonads of one Bufo tibetanus population in Nyingchi City, Tibet A~C. 雌性: A. 4龄, B. 6龄, C. 1~9龄; D~F. 雄性: D. 2龄, E. 8龄, F. 1~8龄 A-C. female: A. 4-year old, B. 6-year old, C. 1-year old-9-year old; D-F. male: D. 2-year old, E. 8-year old, F. 1-year old-8-year old |
| |
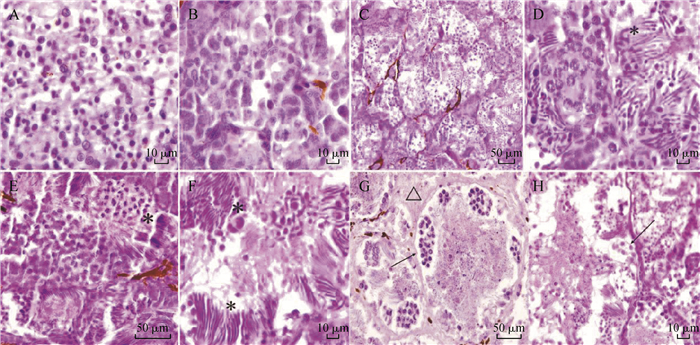
雄性生殖腺组织切片结果显示,1龄(图 5:A)精巢中可见形态相异、胞核大小及染色不同的大量细胞,排列松散,且未见成型的生精小管;2龄(图 5:B)精巢中可见各类细胞明显变大,有不太明显的区域划分,排列呈区域性的密集;3龄(图 5:C)精巢中可见明显的管状结构,即已形成的生精小管,同时可见成型的精子束,但排列不是很整齐密集(图 5:D);4龄(图 5:E,F)精巢中可见较多含有精子的生精小管,其中可见处于不同发育阶段的生精细胞和已经成型的精子;5龄(图 5:G)精巢中可见明显的生精小管、界膜和间质细胞等;6龄(图 5:H)精巢中生精小管管腔明显增大,未见正常的精子。
|
| 图 5 西藏林芝一个西藏蟾蜍种群雄性不同年龄生殖腺切片 Fig. 5 Male gonad sections of different ages of one Bufo tibetanus population in Nyingchi City, Tibet A. 1龄, B. 2龄, C、D. 3龄, E、F. 4龄, G. 5龄, H. 6龄; * 精子尾部, △间质细胞, 黑色箭头表示界膜 A. 1-year-old, B. 2-year-old, C, D. 3-year-old, E, F. 4-year-old, G. 5-year-old, H. 6-year-old; * sperm tail, △ interstitial cells, and black arrow denotes boundary membrane |
| |
C明显小于A和B,且差异显著,但与D~G之间无显著差异。全部个体的B、C之间的差异显著,少量个体(♀4只,♂ 4只)的A、B之间的差异显著(表 2)。这种现象提示:骨骼的生长存在着不均衡性,骨质环厚度在发育初期(3龄,完成变态后的第2~4个冬眠期)的增长较快,而在4龄(性成熟年龄)以及之后的增长明显减缓,但也存在个体差异。
| 年龄 Age/年 |
生长抑制线间距离 Distance between lines of arrested growth/μm | |||||||
| A | B | C | D | E | F | G | ||
| 3 | 雌性(n=6) | 17.37±3.48 | 15.47±1.06 | |||||
| 21.11±5.37 | 18.07±2.68 | |||||||
| 26.84±5.99 | 17.26±1.28** | |||||||
| 27.57±4.33 | 16.22±1.73** | |||||||
| 18.39±2.31 | 11.92±1.56** | |||||||
| 24.49±3.46 | 15.44±3.28** | |||||||
| 雄性(n=6) | 31.47±3.83 | 26.19±6.74 | ||||||
| 33.42±4.91 | 38.66±6.09 | |||||||
| 36.37±6.34 | 24.80±4.68** | |||||||
| 20.23±2.94 | 16.86±2.89* | |||||||
| 47.84±9.08 | 24.60±2.62** | |||||||
| 16.66±2.40 | 13.85±2.48* | |||||||
| 4 | 雌性(n=1) | 44.17±5.93 | 42.88±7.30 | 20.97±5.14** | ||||
| 30.15±3.08 | 33.85±5.77 | 13.84±1.99** | ||||||
| 雄性(n=3) | 30.76±3.37 | 27.45±3.64 | 11.06±2.28** | |||||
| 23.02±6.39 | 30.40±18.62 | 17.00±6.25* | ||||||
| 5 | 雌性(n=1) | 21.31±4.01 | 23.98±4.05 | 16.58±7.64** | 14.90±1.99 | |||
| 36.08±7.20 | 23.65±6.59 | 24.69±4.75** | 14.10±3.06** | |||||
| 雄性(n=3) | 24.20±6.94 | 29.43±4.29 | 20.29±6.25** | 10.21±1.66** | ||||
| 37.45±8.95 | 48.18±8.06 | 10.39±4.69** | 7.91±1.44 | |||||
| 6 | 雌性(n=2) | 22.88±5.03 | 21.27±1.92 | 15.85±4.48* | 12.37±3.55 | 12.26±3.81 | ||
| 11.62±1.90 | 11.81±2.82 | 14.70±3.00* | 7.75±0.60** | 7.92±0.92 | ||||
| 雄性(n=2) | 26.55±2.59 | 28.65±4.10 | 21.04±4.74** | 13.67±1.99** | 17.94±1.86* | |||
| 23.10±3.42 | 21.47±3.15 | 33.72±2.16** | 6.60±1.12** | 5.22±1.50 | ||||
| 7 | 雌性(n=1) | 19.04±5.36 | 15.81±3.12 | 11.53±1.43* | 14.55±2.85 | 11.97±3.16 | 8.87±1.17 | |
| 雄性(n=1) | 17.91±1.57 | 17.55±2.51 | 14.83±2.70** | 12.43±1.20** | 11.33±1.21 | 11.85±1.40 | ||
| 8 | 雌性(n=2) | 15.74±3.68 | 16.88±3.80 | 12.57±3.01* | 12.66±2.36 | 14.65±3.63 | 12.64±3.13 | 8.68±1.64* |
| 20.08±2.32 | 17.42±3.50 | 13.12±2.56** | 13.52±1.89 | 13.16±3.74 | 16.94±2.91* | 12.83±3.14* | ||
| 注 Notes: *P<0.05, **P<0.01; 下同 the same below | ||||||||
雌雄两性个体生殖腺系数均表现为3龄组和4龄组之间具有显著性差异,而其他年龄组均无显著性差异(表 3)。
| 年龄 Age/年 |
生殖腺系数 Gonad coefficient/% | |
| 雌性 Female | 雄性 Male | |
| 1 | 0.47±0.21 | 0.08±0.03 |
| 2 | 0.66±0.24 | 0.13±0.13 |
| 3 | 1.20±0.59** | 0.32±0.20* |
| 4 | 5.40±7.28 | 0.43±0.09 |
| 5 | 0.50±0.16 | |
骨龄学方法是目前鉴定两栖爬行类动物年龄广泛使用的一种方法(Vences & Jovanovic,2010;Hjernquist et al., 2012),但是也存在着一些干扰因素。最明显的是双重线,有些两栖动物以夏眠的方式度过酷热缺水的夏季,此时在长骨切面上将出现2条清晰而非常靠近的类似LAG的结构,即双重线(Liang & Lu,2006)。其次是假线,又称附加线,是由于个体受伤、或者遇到短暂的气候剧烈变化或者食物缺乏在长骨切面上的反映,一般假线仅在局部出现,未见其形成闭合环状结构,且线条结构不清晰(Castanet & Smirina,1990)。双重线和假线在一定程度上均会干扰对个体年龄的准确计数,出现高估或者低估年龄的可能(Leclair & Castanet,1987)。第三是由于骨内膜的重吸收导致1龄线被局部损坏的现象,但很少涉及到2龄线(Hemelaar,1980)。在长骨切片结构完整时,并不会影响LAG计数。
本研究中有5%的个体指骨切片存在双重线现象,仅1只个体指骨切片上观察到骨内膜的重吸收现象,但最内圈1龄线并未被完全吸收,可以清晰识别。假线或LAG模糊不清等现象均未观察到。因此,鉴定生活于高海拔地区的西藏蟾蜍种群年龄时,骨龄学方法是有效、可靠的。
3.2 西藏蟾蜍的性成熟年龄Altunişik等(2014)研究认为,当2条LAG之间距离显著变窄时,即该动物达到性成熟年龄。Licht(1975)认为生殖生长期间个体的营养投入偏重于生殖腺及其相关器官的发育和生长,此时营养生长略显滞后,进而在长骨切片上呈现出上述特征。本研究中,在3龄线和4龄线间的距离出现明显变窄的现象。生殖腺系数的统计分析结果也显示,西藏蟾蜍雌雄个体在3龄和4龄个体间呈现出显著性差异;而对雄性生殖腺切片观察可知,3龄个体生精小管仅有少量成熟精子,而4龄个体的生精小管中成熟精子极其丰富。依据上述结果综合分析,推测本研究的西藏蟾蜍种群中雌雄个体性成熟均出现在4龄。
两栖动物达到性成熟年龄的时间是影响两栖类动物种群生态学的重要因素之一,而决定性因素是动物的生长速率及性成熟时的个体大小(Ryser,1996)。研究显示高海拔地区的物种性成熟年龄高于低海拔地区(Brockleman,1975)。Licht(1975)研究的西部多斑蛙Rana pretiosa种群中,低海拔区域的雌性1~2年即可达到性成熟,高海拔区域的雌性则需要5~6年。在对华西雨蛙川西亚种Hyla annectans chuanxiensis(Liao & Lu,2010a)雄性个体和岷山蟾蜍Bufo gargarizans minshanicus(王冬丽,2017)的研究中呈现了相同的规律。但也有物种性成熟年龄与海拔变化没有明显的相关性,Liao等(2011)发现中国西南部不同海拔(310 m和880 m)的泽蛙Rana limnocharis性成熟年龄均为1龄,不随海拔变化而变化。而西藏蟾蜍性成熟年龄(4龄)符合高海拔物种需要更长时间的生长以达到满足生殖的最小体长的研究结果。
Morrison等(2004)研究发现,所有澳大利亚昆士兰州的红眼雨滨蛙Litoria chloris种群繁殖年限(2年)与生活区域海拔(110 m/800 m)、性成熟年龄(2龄/4龄)无关,这表明尽管很多物种的性成熟年龄与海拔有关,但其潜在繁殖寿命并没有显著变化。在对西藏蟾蜍精巢生精小管的观察中也发现,在初步性成熟的3龄,性成熟的4龄和5龄个体中,均存在着可见的成熟精子,但在6龄个体中未见成型的精子。由于个体数量的限制,还不足以判断西藏蟾蜍的潜在繁殖寿命是否仅有2年,需要进一步积累资料。
3.3 西藏蟾蜍寿命分布于不同海拔的两栖类在寿命上有明显的差别,表现为高海拔个体寿命长于低海拔个体(Elmberg,1991)。分布于低海拔地区的棕背蛙Rana swinhoana个体年龄为7龄,而高海拔地区个体最大年龄可达11龄(Lai et al., 2005)。在对华西雨蛙(Liao & Lu,2010a)和岷山蟾蜍(陈建斌, 2016)的研究中也显示了同样的规律。在对不同岷山蟾蜍种群研究时还发现,雌性寿命随着海拔的升高而变长,而雄性的寿命不受海拔的影响(王冬丽,2017)。在两栖动物中,雌性个体的寿命比雄性个体长的现象普遍存在,例如雌性瓦拉锄足蟾Pelobates varaldii最长寿命为10龄,而雄性为7龄(Aadreone et al., 2011);雌性四川湍蛙Amolops mantzorum最长寿命为9龄,而雄性为7龄(Liao & Lu,2010b)。本研究中,雌性西藏蟾蜍最长寿命为9龄,雄性为8龄,雌性的寿命长于雄性。可见西藏蟾蜍属于高寿群体,但由于样本量的限制,有待后续的积累。
3.4 年龄结构年龄结构作为种群生态学研究的重点问题,学者们进行了较为广泛的研究,积累了丰富的资料,研究结果显示秦岭雨蛙Hyla tsinlingensis(任桢,2015)、隆肛蛙Feirana quadranus和倭蛙Nanorana pleskei(鲜盼盼,2017)等的年龄结构属于增长型,花背蟾蜍Bufo raddei、黑斑侧褶蛙Pelophylax nigromaculata、合征姬蛙Microhyla mixtura属于稳定型,而分布在太白山地区的中国林蛙Rana chensinensis则为衰退型(鲜盼盼,2017)。本研究所涉及的林芝市西藏蟾蜍种群在被采集的2014—2015年的年龄结构属于增长型,说明该种群具有健康发展潜能。本研究结果丰富了西藏蟾蜍部分种群特征的生物学信息,为进一步全面深入了解西藏蟾蜍提供了可靠的依据。
毕远阁, 廖承林, 孙林, 等. 2009. 两栖动物年龄组划分方法的比较研究[J]. 生物学通报, 44(6): 18-19, 63. DOI:10.3969/j.issn.0006-3193.2009.06.008 |
陈建斌. 2016. 岷山蟾蜍生活史的研究[D]. 河南: 信阳师范学院.
|
高凤娟, 李丕鹏, 王译唱, 等. 2016. 西藏蟾蜍皮肤的组织学观察[J]. 四川动物, 35(3): 444-451. |
李斌. 2004. 中国林蛙生长和繁殖的研究[D]. 武汉: 武汉大学.
|
李文蓉, 宋玉成, 时磊. 2010. 基于骨龄学方法鉴定吐鲁番沙虎的年龄[J]. 动物学杂志, 45(3): 79-86. |
刘海映, 谷德贤, 姜玉声, 等. 2013. 口虾蛄繁殖周期及生殖细胞发育的研究[J]. 大连海洋大学学报, 28(3): 269-272. DOI:10.3969/j.issn.2095-1388.2013.03.010 |
马小艳. 2009. 青藏高原高山倭蛙的生活史研究[D]. 武汉: 武汉大学.
|
毛敏, 廖文波, 周材权, 等. 2011. 黑斑蛙种群的年龄、寿命、生长及体长研究[C]. 浙江: 第七届全国野生动物生态与资源保护学术研讨会.
|
任桢. 2015. 基于骨龄学分析秦岭雨蛙繁殖群体年龄结构及其种群之间的比较[D]. 西安: 陕西师范大学.
|
王冬丽. 2017. 青藏高原特有物种岷山蟾蜍身体大小的海拔变异[D]. 河南: 信阳师范学院.
|
鲜盼盼. 2017. 10种蛙蟾类的性成熟年龄、生长和寿命的骨龄学分析[D]. 西安: 陕西师范大学.
|
易祖盛, 何海晏, 陈粤英. 2000. 骨龄学方法测定中国水蛇的年龄[J]. 动物学研究, 21(1): 83-87. DOI:10.3321/j.issn:0254-5853.2000.01.016 |
曾麟, 刘绍龙, 王宁宁. 2011. 西藏蟾蜍消化系统组织学观察[J]. 四川动物, 30(2): 224-226, 230. DOI:10.3969/j.issn.1000-7083.2011.02.010 |
Aadreone F, Pous PD, Crottini A, et al. 2011. Age structure and growth in a population of Pelobates varaldii (Anura, Pelobatidae) from northwestern Morocco[J]. Amphibia-Reptilia, 32(4): 550-556. DOI:10.1163/017353711X605678 |
Altunişik A, Kalayci TE, Gül Ç, et al. 2014. A skeletochronological study of the smooth newt Lissotriton vulgaris (Amphibia: Urodela) from an island and a mainland population in Turkey[J]. Italian Journal of Zoology, 81(3): 381-388. DOI:10.1080/11250003.2014.938134 |
Bastien H, Leclair R. 1992. Aging wood frogs (Rana sylvatica) by skeletochronology[J]. Journal of Herpetology, 26(2): 222-225. DOI:10.2307/1564868 |
Beebee JC, Denton JS. 1993. Summer and winter refugia of natterjacks (Bufo calamita) and common toads (Bufo bufo) in Britain[J]. The Herpetological Journal, 3(3): 90-94. |
Bionda CDL, Babini S, Martino AL, et al. 2018. Impact assessment of agriculture and livestock over age, longevity and growth of populations of common toad Rhinella arenarum (Anura: Bufonidae), central area of Argentina[J]. Global Ecology and Conservation, 14: e00398. DOI:10.1016/j.gecco.2018.e00398 |
Castanet J, Smirina EM. 1990. Introduction to the skeletochronological method in amphibians and reptiles[J]. Annales Des Sciences Naturelles-zoologie Et Biologie Animale, 11: 191-196. |
Elmberg J. 1991. Ovarian cyclicity and fecundity in boreal common frogs Rana temporaria L. along a climatic gradient[J]. Functional Ecology, 5(3): 340-350. DOI:10.2307/2389805 |
Guarino FM, Erismis UC. 2008. Age determination and growth by skeletochronology of Rana holtzi, an endemic frog from turkey[J]. Italian Journal of Zoology, 75(3): 237-242. DOI:10.1080/11250000701883427 |
Hasumi M. 2010. Age, body size, and sexual dimorphism in size and shape in Salamandrella keyserlingii (Caudata: Hynobiidae)[J]. Evolutionary Biology, 37(1): 38-48. DOI:10.1007/s11692-010-9080-9 |
Hemelaar A. 1985. An improved method to estimate the number of year rings resorbed in phalanges of Bufo bufo (L.) and its application to populations from different latitudes and altitudes[J]. Amphibia-Reptilia, 6(4): 323-341. DOI:10.1163/156853885X00326 |
Hemelaar A. 1988. Age, growth and other population characteristics of Bufo bufo from different latitudes and altitudes[J]. Journal of Herpetology, 22(4): 369-388. DOI:10.2307/1564332 |
Hemelaar ASM. 1980. Age determination of male Bufo bufo (Amphibia, Anura) from the Netherlands, based on year rings in phalanges[J]. Amphibia-Reptilia, 1(3): 223-233. DOI:10.1163/156853881X00348 |
Hemelaar ASM. 1986. Demographic study on Bufo bufo (Anura, Amphibia) from different climates, by means of skeletochronogy[D]. Nijmegen, Netherlands: University of Nijmegen.
|
Hjernquist MB, Söderman F, Jönsson KI, et al. 2012. Seasonality determines patterns of growth and age structure over a geographic gradient in an ectothermic vertebrate[J]. Oecologia, 170(3): 641-649. DOI:10.1007/s00442-012-2338-4 |
Khonsue W, Matsui M, Misawa Y. 2000. Age determination by skeletochronology of Rana nigrovittata, a frog from tropical forest of Thailand[J]. Zoological Science, 17(2): 253-257. DOI:10.2108/zsj.17.253 |
Kumbar SM, Pancharatna K. 2002. Annual growth layers in the phalanges of the Indian skipper frog Rana cyanophlyctis (Schn.)[J]. Copeia, 2002(3): 870-872. DOI:10.1643/0045-8511(2002)002[0870:AGLITP]2.0.CO;2 |
Lai YC, Lee TH, Kam YC. 2005. A skeletochronological study on a subtropical, riparian ranid (Rana swinhoana) from different elevations in Taiwan[J]. Zoological Science, 22(6): 653-658. DOI:10.2108/zsj.22.653 |
Leclair RJ, Castanet J. 1987. A skeletochronological assessment of age and growth in the frog Rana pipiens Schreber (Amphibia, Anura) from southwestern Quebec[J]. Copeia, 1987(2): 361-369. DOI:10.2307/1445771 |
Liang JJ, Lu X. 2006. Comparative demography of a temperate anuran, Rana chensinensis, along a relatively fine elevational gradient[J]. Canadian Journal of Zoology, 84(12): 1789-1795. DOI:10.1139/z06-180 |
Liao WB, Lu X. 2010a. Age structure and body size of the Chuanxi tree frog Hyla annectans chuanxiensis from two different elevations in Sichuan (China)[J]. Zoologischer Anzeiger-A Journal of Comparative Zoology, 248(4): 255-263. DOI:10.1016/j.jcz.2009.10.002 |
Liao WB, Lu X. 2010b. Age and growth of a subtropical high-elevation torrent frog, Amolops mantzorum, in western China[J]. Journal of Herpetology, 44(1): 172-176. DOI:10.1670/08-104.1 |
Liao WB, Lu X, Shen YW, et al. 2011. Age structure and body size of two populations of the rice frog Rana limnocharis from different altitudes[J]. Italian Journal of Zoology, 78(2): 215-221. DOI:10.1080/11250001003639590 |
Licht LE. 1975. Comparative life history features of the western spotted frog, Rana pretiosa, from low- and high-elevation populations[J]. Canadian Journal of Zoology, 53(9): 1254-1257. DOI:10.1139/z75-150 |
Lou SL, Jin L, Liu YH, et al. 2012. Altitudinal variation in age and body size in Yunnan pond frog (Pelophylax pleuraden)[J]. Zoological Science, 29(8): 493-498. DOI:10.2108/zsj.29.493 |
Morrison C, Hero JM, Browning J. 2004. Altitudinal variation in the age at maturity, longevity, and reproductive lifespan of anurans in subtropical Queensland[J]. Herpetologica, 60(1): 34-44. DOI:10.1655/02-68 |
Ryser J. 1996. Comparative life histories of low- and high-elevation population of the common frog Rana temporaria[J]. Amphibia-Reptilia, 17: 183-195. DOI:10.1163/156853896X00379 |
Sinsch U. 2015. Review: skeletochronological assessment of demographic life-history traits in amphibians[J]. Herpetological Journal, 25: 5-13. |
Vences M, Jovanovic O. 2010. Skeletochronological analysis of age structure in populations of four species of Malagasy poisonous frogs, genus Mantella[J]. Amphibia-Reptilia, 31(4): 553-557. DOI:10.1163/017353710X518414 |
Voris HK, Jayne BC. 1979. Growth, reproduction and population structure of a marine snake, Enhydrina schistosa (Hydrophiidae)[J]. Copeia, 1979(2): 307-318. DOI:10.2307/1443419 |
Wagner A, Schabetsberger R, Sztatecsny M, et al. 2011. Skeletochronology of phalanges underestimates the true age of long-lived Alpine newts (Ichthyosaura alpestris)[J]. The Herpetological Journal, 21: 145-148. |
Brockleman WY. 1975. Competition, the fitness of offspring, and optimal clutch size[J]. The American Naturalist, 109(970): 677-699. DOI:10.1086/283037 |
 2022, Vol. 41
2022, Vol. 41




