扩展功能
文章信息
- 张笑颖, 邹洁建, 肖嘉杰, 陆宇燕, 李丕鹏, 古河祥, 杨光大, 侯方晖, 王雪谦
- ZHANG Xiaoying, ZOU Jiejian, XIAO Jiajie, LU Yuyan, LI Pipeng, GU Hexiang, YANG Guangda, HOU Fanghui, WANG Xueqian
- 对叶榕果实对苏卡达陆龟粪便微生物的影响
- Effect of Ficus hispida Fruit on Fecal Microorganisms of Centrochelys sulcata
- 四川动物, 2022, 41(3): 241-247
- Sichuan Journal of Zoology, 2022, 41(3): 241-247
- 10.11984/j.issn.1000-7083.20210423
-
文章历史
- 收稿日期: 2021-11-30
- 接受日期: 2022-03-30
2. 广东省野生动物监测救护中心,广州 510000;
3. 沈阳市儿童医院,沈阳 110033
2. Guangdong Wildlife Monitoring and Rescue Center, Guangzhou 510000, China;
3. Shenyang Children's Hospital, Shenyang 110033, China
肠道微生物菌群结构在对宿主的营养摄入、疾病发生、免疫力调节等方面的作用已被学术界广泛认可,并成为近10年来的研究热点(高权新等,2010;Hill & Artis, 2010;周建设等,2018)。影响肠道菌群组成结构的因素有3个:遗传、生存环境和饮食(张家超,2014)。赵佩华(2016)指出,遗传因素决定了菌群的组成成分,即有无的问题,而环境和饮食则对菌群各组成成分的数量起重要作用。肠道菌群对饮食组分变化的响应极其快速,并在饮食稳定后趋于动态平衡(David et al., 2014;张晶等,2015)。但这方面的研究目前集中在哺乳动物,尤其是人类。爬行动物肠道微生物对饮食变化的响应仅见对分布在不同饲养场鳄蜥Shinisaurus crocodilurus泄殖腔样本的研究,分别投喂蚯蚓和泥鳅的2组样本的肠道菌群存在显著差异(Jiang et al., 2017)。
苏卡达陆龟Centrochelys sulcata是中非陆龟属Centrochelys唯一种,分布于非洲中部,是世界第三大陆龟,常栖息于沙漠周边或热带草原等开阔干燥地带。杂食性,以植物为主要食物。人工饲养条件下喜食各种瓜果、蔬菜、牧草、桑叶等,可投喂少量牛肉、黄粉虫等动物性食物(周婷,周峰婷,2020)。对叶榕Ficus hispida为桑科Moraceace榕属Ficus聚果榕亚属subgen. Sycomorus植物,叶和花序内含有多种化学成分,其中花序含有β-榄香烯、β-芹子烯和α-依兰油烯等(朱兆云,韦群辉,2010)。本文对1组体长相近的苏卡达陆龟自主取食对叶榕果实前后的粪便样本进行了16S rRNA高通量测序分析,旨在探究不同饮食组成成分对粪便微生物菌群结构的影响,并对其进行了功能预测的分析。旨在为苏卡达陆龟粪便菌群多样性研究积累科学资料。
1 材料与方法 1.1 实验动物及样品采集本实验在广东省野生动物监测救护中心完成,选取在中心饲养半年以上的7只苏卡达陆龟,体长10~20 cm,日常以龟饲料(主要原料为鱼粉、植物蛋白、维生素等)和应季蔬果(番薯Ipomoea batatas藤、油麦菜Lactuca sativa var. longifoliaf、阔叶丰花草Borreria latifolia、番木瓜Carica papaya、南瓜Cucurbita moschata等)投喂。在对叶榕果实成熟高峰期,饲养区内有大量的果实落入,苏卡达陆龟会自由取食。观察粪便发现,其中含有大量对叶榕种子。在果实成熟高峰期采集含有种子的粪便样本(ZZ-A组)保存待检测。在果实成熟后期,及时清理果实,常规饲养。在停止进食果实近2个月后,再次采集粪便样本作为对照组(ZC-A组)。采样时仅选取新鲜粪便中心部分以保证样本质量。将样本快速置于灭菌离心管内,-20 ℃保存,送上海派森诺生物科技股份有限公司检测。共采集2组14份样品(表 1)。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| 取食组 | ZZ-A1 | ZZ-A2 | ZZ-A3 | ZZ-A4 | ZZ-A5 | ZZ-A6 | ZZ-A7 |
| 对照组 | ZC-A1 | ZC-A2 | ZC-A3 | ZC-A4 | ZC-A5 | ZC-A6 | ZC-A7 |
使用Illumina公司NovaSeqPE250测序平台进行16S rRNA测序。1.2%琼脂糖凝胶电泳对样品DNA进行检测与质量提取。采用Nanodrop紫外定量设备进行紫外分光光度检测。选择rRNA基因可变区V3~V4基因片段进行PCR扩增,采用NEB公司的Q5高保真DNA聚合酶。PCR引物序列为:正向引物5'-ACTCCTACGGGAGGCAGCA-3',反向引物3'-GGACTACHVGGGTWTCTAAT-5'。扩增体系25 μL:5 μL 5×反应缓冲液,5 μL 5×GC缓冲液,2 μL 2.5 mmol·L-1 dNTP,1 μL 10 μmol·L-1正向引物,1 μL 10 μmol·L-1反向引物,2 μL DNA模板,8.75 μL ddH2O和0.25 μL Q5 DNA聚合酶。扩增参数为:98 ℃ 5 min; 98 ℃ 30 s,52 ℃ 30 s,72 ℃ 45 s,25个循环; 72 ℃ 5 min,10 ℃保持。
采用QIIME2(2019.4)完成序列质控、去噪、聚类等步骤以及多样性分析。应用Alpha多样性方法,通过Chao1、Observed species、Shannon、Simpson等4个指标分析样本物种多样性和丰富度;使用Beta多样性分析,通过基于weighted UniFrac的距离生成的主坐标分析和基于bray_curtis距离生成的层次聚类分析评价样本组间差异。利用Python LEfSe包等进行LEfSe分析,寻找分组之间稳健的差异物种即标志物种。采用Excel初步整理数据,SPSS判断部分数据的方差齐性并进行差异性检验。菌群名称和分类参考生物医药大辞典(https://lpsn.dsmz.de/)。
2 结果 2.1 微生物组成和结构特征通过QIIME2对粪便样本进行了测序分析,稀疏曲线显示了ZZ-A组在测序深度为25 000时序列数基本稳定,ZC-A组在测序深度为15 000时序列数基本稳定,表明测序的数量已经饱和,可以真实反映样本菌群组成情况(图 1:A)。检测样品获得了平均长度为419.36 bp的842 940个高质量序列,以100%相似度聚类得到扩增序列变体(amplicon sequence variants,ASVs),2组样本共享1 187个ASVs,ZZ-A组独有6 974个,ZC-A组独有7 374个(图 1:B)。
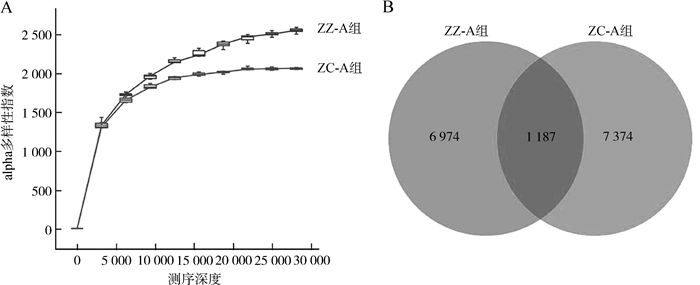
|
| 图 1 苏卡达陆龟粪便微生物的稀疏曲线图(A)和ASV韦恩图(B) Fig. 1 Rarefaction curve (A) and ASVs venn diagram (B) of Centrochelys sulcata fecal microorganisms |
| |
全部样本检测到并注释的微生物共包含39门,2组中相对丰度均>1%的菌门共有6个:拟杆菌门Bacteroidetes、厚壁菌门Firmicutes、变形菌门Proteobacteria、互养菌门Synergistetes、疣微菌门Verrucomicrobia和螺旋体门Spirochaetes,其中拟杆菌门和厚壁菌门为优势菌门,两者相对丰度之和分别为ZZ-A组89.55%、ZC-A组77.15%(图 2)。2组间6门的相对丰度均无显著性差异,ZZ-A组拟杆菌门和螺旋体门的相对丰度高于ZC-A组,其余4个菌门则反之。厚壁菌门与拟杆菌门的比值(F/B):ZZ-A组为0.42,ZC-A组为0.96,组间差异显著(P=0.047)。
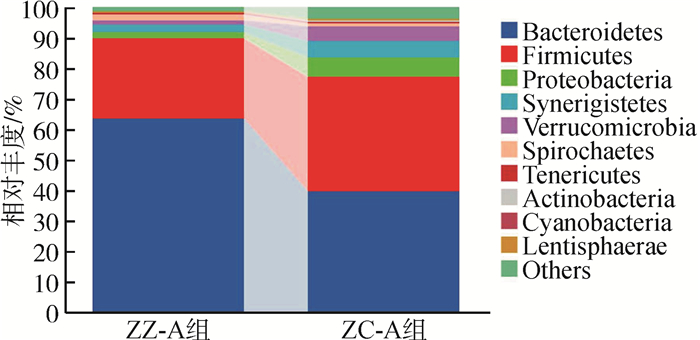
|
| 图 2 苏卡达陆龟粪便微生物门水平排名前10门的相对丰度 Fig. 2 Relative abundance of top 10 fecal microbial phylum levels in Centrochelys sulcata |
| |
属级水平分析结果显示,所检测标本中完成匹配的菌属共有409个,相对丰度排名50位以后的菌属以及未分类物种占比极高,2组均超过75%。相对丰度>1%的菌属,ZZ-A组有3个:梭菌属Clostridium、密螺旋体属Treponema和拟杆菌属Bacteroides,它们的平均相对丰度均高于ZC-A组,其中拟杆菌属的组间差异显著(P=0.03);ZC-A组有5个: 普雷沃氏菌属Prevotella、氨基酸球菌属Acidaminococcus、Bulleidia菌属、Parabacteroides菌属和密螺旋体属,前4个菌属的平均相对丰度均高于ZZ-A组,且均有显著性差异(普雷沃氏菌属:P=0.02,氨基酸球菌属: P=0.04, Bulleidia菌属: P=0.02, Parabacteroides菌属: P=0.007)。
2.2 微生物多样性分析及其差异Alpha多样性统计显示,2组样本在Chao1(P=0.064)、Observed species(P=0.570)、Shannon(P= 0.570)及Simpson(P=0.480)4个指数上均无显著性差异(图 3)。基于weighted UniFrac的距离生成的主坐标分析显示:ZZ-A组中5个样本和ZC-A组相互分离,另外有2个样本与本组相距较远,而与ZC-A组相近(图 4:A)。提示提供这2个粪便样本的龟可能由于某些原因在进食对叶榕果实的频度或数量上与其他龟存在一定的差别。基于bray_curtis距离生成的层次聚类分析显示,2组样本各自聚集在一起,呈现出良好的区分(图 4:B)。
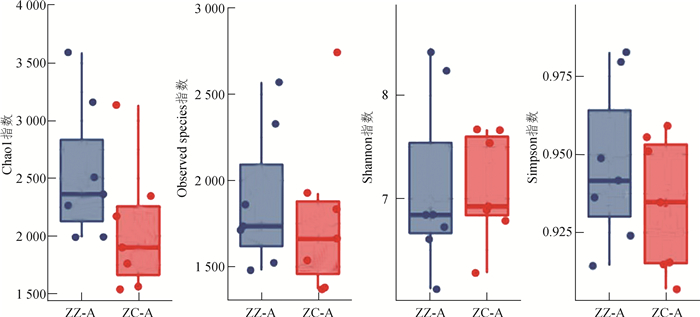
|
| 图 3 苏卡达陆龟粪便微生物Alpha多样性分析 Fig. 3 Alpha diversity analysis of Centrochelys sulcata fecal microorganisms |
| |
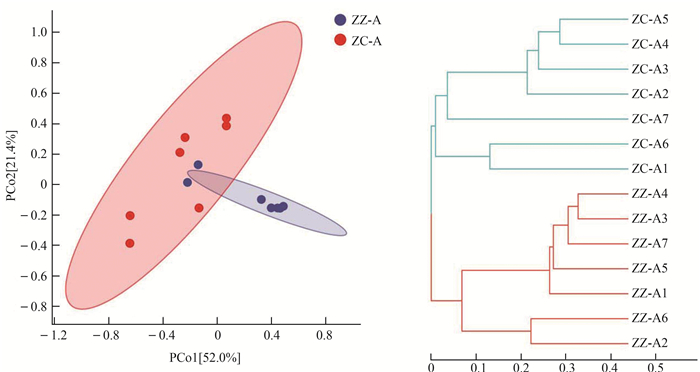
|
| 图 4 苏卡达陆龟粪便微生物的主坐标分析图(A)和层次聚类树(B) Fig. 4 Principal co-ordinate analysis (A) and hierarchical clustering tree (B) of Centrochelys sulcata fecal microorganisms |
| |
LEfSe分析结果显示,在互养菌门、疣微菌门、变形菌门中仅含有ZC-A组的标志物种,包括互养菌门的Synergistaceae菌科、疣微菌门的RFP12菌科、变形菌门的Betaproteobacteria纲;在拟杆菌门和厚壁菌门中,2组样本的标志物种不同:ZZ-A组以拟杆菌门的拟杆菌目Bacteroidales、厚壁菌门的梭菌属为标志物种,ZC-A组以拟杆菌门的理研菌科Rikenellaceae、普雷沃氏菌属和Parabacteroides菌属,厚壁菌门的Lactobacillales菌目、Mogibacteriaceae菌科、瘤胃球菌科Ruminococcaceae和Bulleidia菌属为标志物种(图 5)。
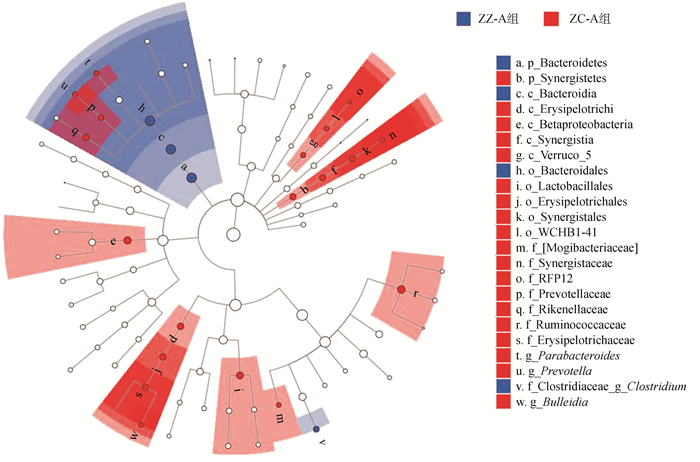
|
| 图 5 苏卡达陆龟粪便微生物LEfSe分析的分类学分支图 Fig. 5 Cladogram of Centrochelys sulcata fecal microorganisms based on LEfSe analysis 节点大小对应该分类单元的平均相对丰度, 空心节点代表组间差异不显著的分类单元, 蓝色和红色节点代表这些分类单元体现出显著的组间差异, a~w. 组间存在显著差异的分类单元 Node size corresponds to the average relative abundance of taxonomic unit, hollow nodes represent taxonomic with no significant difference between groups, blue and red nodes represent taxonomic units with significant intergroup differences, a-w. taxonomic units with significant differences between groups |
| |
将2组粪便微生物菌群的ASVs与KEGG数据库核心生物代谢通路分析数据进行对比,注释后得到的KEGG代谢通路预测结果显示:共涉及6条一级生物代谢通路、33条二级代谢通路子功能以及181条三级代谢通路。在存在显著性差异的14条三级代谢通路中,13条在相关功能的菌群相对丰度上呈现为:ZZ-A组>ZC-A组(表 2)。其中,四环素的生物合成、聚酮体糖单元的生物合成和乙基苯的降解代谢通路在ZC-A组的丰度值为0,而在ZZ-A组最高可达338.96,在双酚的降解、阿特拉津的降解和多环芳烃的降解和甜菜素的生物合成代谢通路中,ZZ-A组均高出ZC-A组5倍以上。
| 一级功能 | 二级功能 | 三级功能 | ZZ-A组 | ZC-A组 | P |
| 遗传信息处理 | 折叠、分类和降解 | 硫转移机制 | 568.31±52.91 | 479.96±38.345 | 0.023 |
| 代谢 | 能量代谢 | 硫代谢 | 393.31±44.06 | 333.72±21.51 | 0.023 |
| 萜类和聚酮类化合物的代谢 | 四环素的生物合成 | 338.96±16.60 | 0 | < 0.001 | |
| 聚酮体糖单元的生物合成 | 169.57±107.86 | 0 | 0.024 | ||
| 柠檬烯和蒎烯的降解 | 61.89±10.18 | 8.42±20.62 | < 0.001 | ||
| 氨基酸代谢 | 缬氨酸、亮氨酸和异亮氨酸的降解 | 196.68±16.63 | 180.70±19.16 | 0.045 | |
| 色氨酸的代谢 | 107.95±11.46 | 92.44±15.72 | 0.046 | ||
| 赖氨酸的降解 | 99.33±13.91 | 82.65±14.36 | 0.038 | ||
| 异生素的生物降解和代谢 | 乙基苯的降解 | 59.12±30.35 | 0 | 0.001 | |
| 双酚的降解 | 45.90±22.30 | 8.06±19.74 | 0.046 | ||
| 阿特拉津的降解 | 5.28±2.10 | 1.01±0.50 | 0.013 | ||
| 多环芳烃的降解 | 0.93±0.49 | 0.06±0.07 | < 0.001 | ||
| 其他次级代谢物的生物合成 | 甜菜素的生物合成 | 0.32±0.19 | 0.03±0.07 | 0.023 | |
| 聚糖生物合成与代谢 | 糖环脂的生物合成-乳酸和新乳酸系列 | 0 | 0.01±0.02 | 0.003 |
由于食物表面携带有未知菌群以及食物所含物质及其在机体中代谢产生的物质均对肠道菌群有着不可忽略的作用,因此食物组分的改变对肠道菌群结构的改变备受关注(韩翔宇等,2021)。观察投喂不同饲料的草鱼Ctenopharyngodon idella发现,肠道菌群在改变饲料组成的初期出现显著变化,且在11 d后菌群结构达到新的动态平衡(郝耀彤等,2015)。在以豆粕替代鱼粉喂养牛蛙Rana (Lithobates) catesbeiana和分别喂食蚯蚓和泥鳅的鳄蜥的研究表明,饮食的改变可以使肠道菌群的丰度发生变化(Jiang et al., 2017;丁李,2019)。本研究中ZZ-A组和ZC-A组的菌群结构也发生了明显变化,2组取材时间仅间隔了2个月左右,证明了苏卡达陆龟肠道菌群结构对食物组分变化具有快速调整的能力。
3.2 粪便微生物功能预测生活环境中,无论是空气、水域、土壤中,还是食物表面均有大量的菌群存在,它们随着饮水和进食进入胃肠道,并在其中生长繁殖,它们自身及其代谢产物不同程度地影响着有机体胃肠道的健康,甚至通过脑肠轴参与机体各个器官功能(赵轩等,2019)。对于进入胃肠道的菌群,按照它们对机体的影响可划分为有益菌、致病菌和条件致病菌(臧海军,张克英,2007)。一些细菌在代谢过程中可以产生短链脂肪酸,尤其是丁酸及丁酸盐类物质对保持肠道黏膜上皮细胞结构和功能有不可忽视的贡献,同时也是肠道上皮的主要能量来源之一(张家超,2014)。而更有研究证明肠道菌群的健康与人体的肥胖、心脑血管疾病甚至是中枢神经疾病均有密切的关联(李莎等,2021)。另外,由于工业和农业生产的需要,一些具有“三致”特性的物质,如乙基苯和多环芳烃,一些具有“环境类激素”的物质,如双酚类和阿特拉津等在环境中超标,严重影响了有机体的健康(王小存,2007;张海峰,2007;董静等,2021;曾超怡等,2021)。机体内部的氧化和抗氧化平衡是维护细胞健康和功能正常的关键,但由于环境污染和药物使用量的不适当以及各种生理和心理的失调,均会增加机体内部自由基,影响氧化和抗氧化平衡的维持,继而造成细胞受损和加速衰老进程(李晨等,2021)。
本研究的功能预测结果发现,主动进食了对叶榕果实的苏卡达陆龟粪便菌群在四环素的生物合成、聚酮体糖单元的生物合成、乙基苯的降解、双酚的降解、阿特拉津的降解和多环芳烃的降解以及甜菜素的生物合成等代谢通路上的富集呈现出了与对照组极显著的差异,个别甚至是从无到有(四环素的生物合成、聚酮体糖单元的生物合成、乙基苯的降解)。但是这些代谢通路的富集原因以及是否可以表达相关功能进而产生相应的生理效应还需要深入研究。
致谢: 感谢广东省野生动物监测救护中心徐锦兴、毛学群、成鉴荣和梁颖琳在动物饲养和取材中的帮助。
丁李. 2019. 豆粕替代鱼粉对牛蛙生长、肠道健康、肠道植酸酶活性及基因多样性的影响[D]. 福建: 集美大学.
|
董静, 夏龙超, 平永青, 等. 2021. 水环境中阿特拉津污染及修复研究现状[J/OL]. 应用化工, (1): 144-149 [2021-09-01]. https://doi.rog/10.16581/j.cnki.issn1671-3206.20211129.001.
|
高权新, 吴天星, 王进波. 2010. 肠道微生物与寄主的共生关系研究进展[J]. 动物营养学报, 22(3): 519-526. DOI:10.3969/j.issn.1006-267x.2010.03.002 |
韩翔宇, 孟凡, 王建忠. 2021. 肠道菌群的形成及影响因素的研究进展[J]. 新疆医学, 51(7): 836-839. |
郝耀彤, 吴山功, 王桂堂, 等. 2015. 草鱼肠道微生物对食物改变适应性变化的研究[J]. 淡水渔业, 45(3): 46-51, 101. DOI:10.3969/j.issn.1000-6907.2015.03.008 |
李晨, 张秀玲, 李凤凤, 等. 2021. 五种小浆果抗氧化活性和相关营养物质的测定及主成分分析[J/OL]. 食品与发酵工业: 1-12[2021-10-22]. https://doi.org/10.13995/j.cnki.11-1802/ts.027716.
|
李莎, 李倩, 于海威, 等. 2021. 肠道微生物与人体健康及饮食关系的研究进展[J]. 内科, 16(4): 479-484. |
王小存. 2007. 环境激素双酚A降解菌的分离、鉴定及初步应用研究[D]. 上海: 东华大学.
|
臧海军, 张克英. 2007. 动物肠道正常菌群对黏膜免疫影响的研究进展[J]. 饲料博览(技术版), (2): 35-37. DOI:10.3969/j.issn.1001-0084.2007.02.011 |
曾超怡, 徐辉, 许岩, 等. 2021. 长江重点江段水体中多环芳烃及其衍生物的分布及健康风险[J/OL]. 环境科学学报: 1-10[2021-10-29]. https://doi.org/10.13671/j.hjkxxb.2021.0201.
|
张海峰. 2007. 危险化学品安全技术全书(第二版第一卷)[M]. 北京: 化学工业出版社.
|
张家超. 2014. 蒙古族肠道核心菌群及其与饮食关联性的研究[D]. 呼和浩特: 内蒙古农业大学.
|
张晶, 覃小丽, 刘雄. 2015. 膳食主成分对肠道微生物的影响研究进展[J]. 食品科学, (5): 5. |
赵佩华. 2016. 宿主遗传信息对肠道微生物菌落成员的影响[D]. 上海: 华东师范大学.
|
赵轩, 邱胜男, 许璇, 等. 2019. 肠道微生物-肠-脑轴与猪营养代谢[J]. 饲料工业, 40(2): 60-64. |
周建设, 潘虎, 陈美群, 等. 2018. 病死黑斑原表皮和肠道微生物群落研究[J]. 安徽农业科学, 46(8): 80-85. DOI:10.3969/j.issn.0517-6611.2018.08.024 |
周婷, 周峰婷. 2020. 世界陆龟图鉴[M]. 北京: 中国农业出版社.
|
朱兆云, 韦群辉. 2010. 云南民族药志[M]. 昆明: 云南民族出版社.
|
David LA, Maurice CF, Carmody RN, et al. 2014. Diet rapidly and reproducibly alters the human gut microbiome[J]. Nature, 505: 559-563. DOI:10.1038/nature12820 |
Hill DA, Artis D. 2010. Intestinal bacteria and the regulation of immune cell homeostasis[J]. Annual Review of Immunology, 28: 623-667. DOI:10.1146/annurev-immunol-030409-101330 |
Jiang HY, Ma JE, Li J, et al. 2017. Diets alter the gut microbiome of crocodile lizards[J/OL]. Frontiers in Microbiology, 8: 2073[2021-08-10]. https://doi.org/10.3389/fmicb.2017.02073.
|
 2022, Vol. 41
2022, Vol. 41




