扩展功能
文章信息
- 钟雪, 杨楠, 张龙, 程跃红, 冯茜, 胡强, 金义国
- ZHONG Xue, YANG Nan, ZHANG Long, CHENG Yuehong, FENG Xi, HU Qiang, JIN Yiguo
- 卧龙国家级自然保护区绿尾虹雉种群分布和生境质量评价
- Population Survey and Habitat Quality Assessment of Lophophorus lhuysii in the Wolong National Nature Reserve
- 四川动物, 2021, 40(5): 509-516
- Sichuan Journal of Zoology, 2021, 40(5): 509-516
- 10.11984/j.issn.1000-7083.20210176
-
文章历史
- 收稿日期: 2021-05-21
- 接受日期: 2021-07-23
2. 西南民族大学青藏高原研究院, 成都 610041;
3. 四川卧龙国家级自然保护区管理局, 四川汶川 623006
2. Institute of Qinghai-Tibetan Plateau, Southwest Minzu University, Chengdu 610041, China;
3. Wolong National Nature Reserve Administration Bureau, Wenchuan, Sichuan Province 623006, China
全球范围内的物种快速灭绝是当今人类面临最严峻的全球性问题之一(Ceballos et al., 2017)。生境的退化、丧失和破碎化是导致野生动物种群下降和物种灭绝的关键因素,而了解受胁物种的生境状况是有效保护管理的重要前提(Fahrig,2003)。生境评价以野生动物的栖息环境为研究对象,量化物种分布区域内的各种环境变量,分析影响物种分布和生存的关键因子,从而评估研究区域内不同生境对于物种的适宜程度(唐书培等,2019)。因此,对珍稀濒危物种的重要分布区进行生境评价,有助于了解物种分布及其生境现状,对于科学的生境管理和物种保护具有重要意义。
绿尾虹雉Lophophorus lhuysii属鸡形目Galliformes雉科Phasianidae,是我国特有的高山鸟类,体型硕大、羽色鲜艳(郑光美,2015),被列为国家一级重点保护野生动物,世界自然保护联盟(IUCN)濒危物种红色名录易危(VU)物种(BirdLife International,2016)和濒危野生动植物种国际贸易公约(CITES)附录Ⅰ物种(CITES,2016)。绿尾虹雉曾因过度捕杀而导致种群急剧下降(何芬奇等,1986),并且其种群数量至今依然较小(BirdLife International,2016)。近年来,我国学者利用物种分布模型对这一珍稀濒危鸟类物种的生境开展了大量研究,如Wang等(2017)对绿尾虹雉在邛崃山系的适宜生境分布进行了研究,余翔等(2017)和钟雪等(2020)分别对小寨子沟国家级自然保护区和片口自然保护区的绿尾虹雉栖息地进行了评价,Xu等(2020)预测了气候变化对绿尾虹雉地理分布的影响。这些研究表明,绿尾虹雉对生境条件有较高要求并且对人为干扰较为敏感,其生境质量在大部分地区都不容乐观并且存在较大的地区间差异,亟需在更多地区开展相关研究以进一步了解该物种的保护现状。此外,由于物种分布模型难以明确区分物种的基础和现实生态位,也无法将扩散能力等分布限制因子纳入分析,其生境预测结果通常与物种的实际分布存在差异(李国庆等,2013;朱耿平等,2013)。因此,结合模型方法和野外实地调查,能够为绿尾虹雉的实际种群分布和生境状况提供更加可靠和有效的信息。
卧龙国家级自然保护区地处邛崃山系中部,是绿尾虹雉的重要分布区,对于该物种的保护至关重要(Wang et al., 2017)。然而,目前尚未对该地区的野外绿尾虹雉种群进行过调查,对该物种的种群分布和生境状况都缺乏了解,制约了针对性保护策略的制定。本研究于2019—2021年使用红外相机技术对保护区的绿尾虹雉分布进行了调查,基于调查结果使用物种分布模型评价其生境质量,分析影响绿尾虹雉分布的关键环境因子及潜在威胁,从而揭示保护区绿尾虹雉种群和生境现状,并为未来绿尾虹雉的保护提供科学建议。
1 材料与方法 1.1 研究区域卧龙国家级自然保护区以大熊猫Ailuropoda melanoleuca等珍稀濒危野生动物及森林生态系统为主要保护对象,位于四川省阿坝藏族羌族自治州汶川县西南部,地理坐标102°51′~103°24′E,30°45′~31°25′N,总面积2 000 km2。保护区地处邛崃山系中部的东南坡,为四川盆地向川西高原的过渡地带,地貌形态以高山深谷为主,海拔落差高达5 100 m (1 150~6 250 m)。保护区气候类型以亚热带内陆山地气候为主,年均温9.8 ℃,月均温-1.7(1月)~17 ℃(7月),年均降水量931 mm,相对湿度达80%,年均日照时数926.7 h。植被垂直带谱明显,从低到高分别为常绿阔叶林、常绿落叶阔叶混交林、针阔混交林、寒温性针叶林、灌丛、高山草甸和高山流石滩。
1.2 数据与分析方法 1.2.1 红外相机调查和分析2019年5月—2021年1月,在保护区海拔3 537~4 780 m的高山和亚高山区域共布设了118台红外相机(易安卫士L710或L710F)。布设时,保证相机间距大于300 m,将相机设置为3张连拍、触发间隔30 s、灵敏度中、24 h工作,并记录红外相机布设位点的经纬度和海拔。每隔4~6个月更换1次电池和内存卡。调查期间共有109台相机(其余9台相机故障、损坏或丢失)完成了有效监测,累计33 759个相机工作日。将单台相机连续有效工作24 h视作1个相机工作日,将1个相机位点在30 min拍摄的所有绿尾虹雉照片视作1张独立捕捉(O'Brien et al., 2003),只记录首张照片的信息用作分析。基于独立捕捉和监测强度计算每个相机位点的绿尾虹雉相对多度指数(relative abundance index,RAI)(陈立军等,2019):RAI=Ni/Trapdayi×1 000,式中,Ni为相机位点i的绿尾虹雉独立捕捉数,Trapdayi为相机位点i完成的总相机工作日。
1.2.2 绿尾虹雉出现点共在66个相机位点发现了绿尾虹雉,以此作为物种分布模型所需的出现点数据(图 1)。为避免模型的过度拟合,按照最小家域面积方法对绿尾虹雉出现点进行筛选,当2个位点的间距小于560 m时随机保留1个位点,其余删除(Wang et al., 2017;Xu et al., 2020)。最终保留47个绿尾虹雉出现点建模。
1.2.3 环境变量参考相关研究,选择可能会对绿尾虹雉生境质量产生影响的气候、植被、地形和人为干扰4类共28个环境变量构建绿尾虹雉的生境评价模型。气候变量包括从WorldClim 1.4数据库(https://www.worldclim.org/)下载的19个生物气候变量,用以反映保护区的温度和降水相关气候特征(Hijmans et al., 2005)。植被变量包括植被总初级生产力、净初级生产力和植被类型。总初级生产力和净初级生产力图层来自于MODIS卫片的MOD17A3 v5.5(https://lpdaac.usgs.gov/),反映了研究区域的植物年均初级生产力情况。植被类型图层来自《1∶ 100万中国植被图集》(http://www.resdc.cn/),将研究区域的植被类型划分为针叶林、针阔混交林、阔叶林、灌丛、草甸、高山植被和其他7类。从地理空间数据云(http://www.gscloud.cn/)下载数字高程模型ASTER GDEMV2,使用ArcGIS 10.6的空间分析工具提取海拔、坡向和坡度图层,并计算实际坡向的余弦函数,从而将坡向由圆周变量转换为取值[-1,1]的反映山坡靠近正北向阴坡程度的线性变量(Evangelista et al., 2008)。从全国地理信息资源目录服务系统(https://www.webmap.cn/)下载研究区域的河流图层,使用ArcGIS生成河流的欧式距离图层。而人为干扰变量则包括距道路距离和距居民点距离的欧式距离图层。最后,使用ArcGIS将所有环境变量重采样至30 m×30 m分辨率,并转换为ASCII格式。
1.2.4 模型构建与校验使用MaxEnt 3.4.1构建绿尾虹雉生境评价模型(Phillips et al., 2019)。已有研究表明,MaxEnt模型能够有效处理环境变量之间的共线性问题,并且模型过参数化的不利影响小于缺参数化(孔维尧等,2019),因此本研究使用全部28个环境变量进行建模。使用线性(linear)、二次项(quadratic)和线性分段(hinger)的函数组合进行建模(孔维尧等,2019),以自举法(bootstrap)重复10次,每次随机选择80%的出现点为训练集,20%为验证集,以Cloglog格式输出生境适宜性指数的预测结果,其余设置保持默认(Phillips et al., 2019)。使用MaxEnt的变量贡献性和响应曲线分析各环境变量对绿尾虹雉生境质量的影响和相对重要性。模型的拟合优度通过受试者工作特征曲线下面积(AUC值)进行评价: AUC值越大,模型精确度越高(Swets,1988)。
1.2.5 生境分析根据10次MaxEnt模型重复后输出的平均生境适宜性指数图层对保护区的绿尾虹雉生境质量进行评价。基于平衡阈值(balance training omission,predicted area and threshold value Cloglog threshold)和最大约登指数(0.057和0.351),将研究区域内的绿尾虹雉生境划分为非生境、低质量生境和高质量生境,分别计算不同质量等级生境的面积。并且进一步与保护区的功能区划叠加,计算不同区划内不同质量等级生境的面积和比例。
2 结果 2.1 种群分布经过109个相机位点累计33 759个相机工作日的监测,共在66个位点拍摄到了绿尾虹雉照片1 772张,合计603次独立捕捉(图 1)。除了海子沟以外,大部分安放了红外相机的区域都发现了绿尾虹雉。在所有拍摄到绿尾虹雉的位点中,位于梯子沟海拔4 175 m的相机位点的RAI最低,仅为2.02,而位于足木沟海拔4 205 m的位点,RAI高达194.44。整体来看,梯子沟区域拍摄到绿尾虹雉的位点较多,但RAI都不大,而足木沟和银厂沟区域的RAI较大(图 2)。
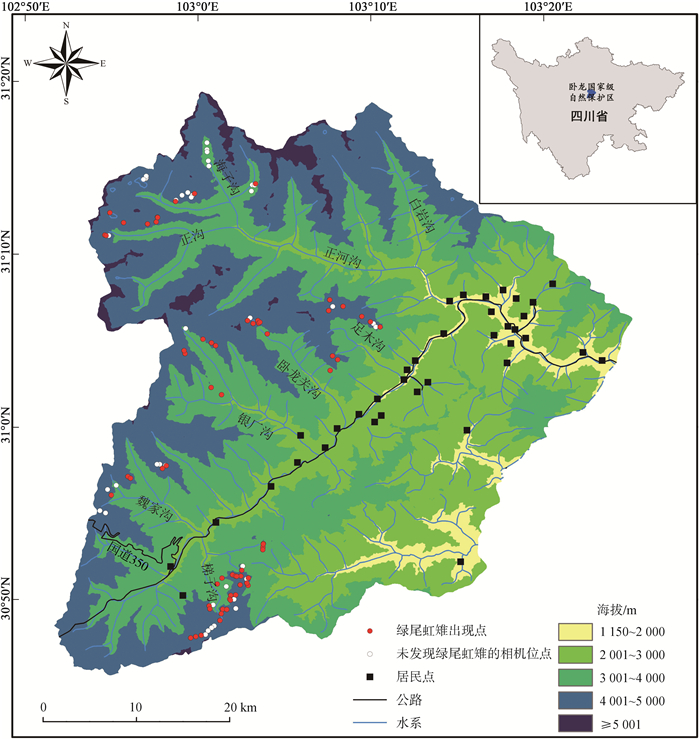
|
| 图 1 四川卧龙国家级自然保护区内的红外相机位点及绿尾虹雉出现点 Fig. 1 Infrared camera sites and occurrence points of Lophophorus lhuysii in the Wolong National Nature Reserve, Sichuan |
| |
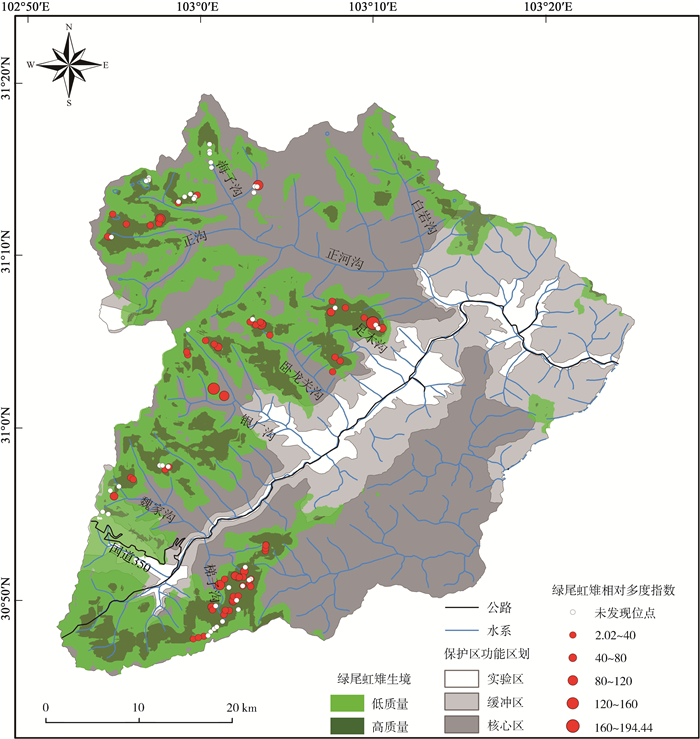
|
| 图 2 四川卧龙国家级自然保护区的绿尾虹雉生境质量及各红外相机位点的绿尾虹雉相对多度指数 Fig. 2 Habitat quality and relative abundance index of Lophophorus lhuysii at each infrared camera site in the Wolong National Nature Reserve, Sichuan |
| |
经过10次重复,MaxEnt模型的平均训练AUC值和验证AUC值分别为0.954和0.897,表明模型预测结果优良(Swets,1988)。保护区内的绿尾虹雉生境总面积765.07 km2,占保护区总面积的38.25%。其中,高质量生境面积202.22 km2,集中于保护区西部和南部海拔4 000 m以上的区域,而低质量生境包裹在高质量生境的外围,总面积562.85 km2(图 2)。从保护区不同的功能区划来看,绿尾虹雉的高质量和低质量生境都集中分布于核心区,实验区和缓冲区几乎没有高质量生境,低质量生境的面积也较小(表 1)。
| 生境质量 Habitat quality |
面积Area/km2 | |||
| 实验区 Transition zone |
缓冲区 Buffer zone |
核心区 Core zone |
总面积 Total |
|
| 高质量 | 0.40 | 12.82 | 189.00 | 202.22 |
| 低质量 | 20.14 | 64.32 | 478.39 | 562.85 |
MaxEnt模型的变量贡献性分析显示,在所有的28个环境变量中,降水季节性(19.8%)、最干季均温(15.4%)、年均温(10.1%)、植被类型(7.1%)、距河流距离(6.5%)和距道路距离(5.8%)是对绿尾虹雉生境适宜性影响最大的6个变量。这些变量的响应曲线显示了各环境因子对绿尾虹雉生境质量的影响趋势。3个生物气候变量对绿尾虹雉生境质量的影响都呈现单峰曲线,分别在降水季节性82(图 3:A)、最干季均温-8 ℃(图 3:B)、年均温0 ℃(图 3:C)的区域达到生境适宜性的最高值。绿尾虹雉最偏好的植被类型是草甸,其次是灌丛(图 3:D)。此外,绿尾虹雉的生境质量随距河流和距道路距离的增大而上升(图 3:E、F)。
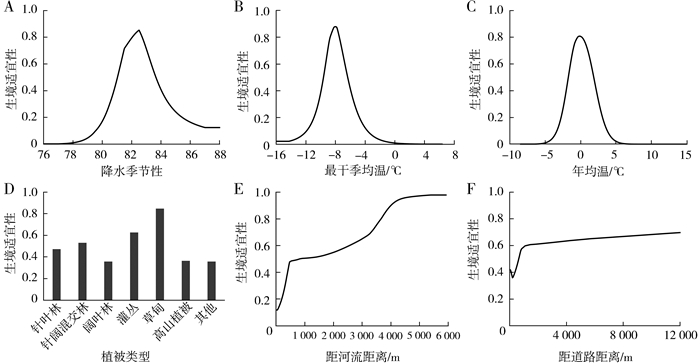
|
| 图 3 重要环境变量对绿尾虹雉生境适宜性的影响 Fig. 3 Effects of important environmental variables on the habitat quality of Lophophorus lhuysii |
| |
在山系尺度上的研究表明,邛崃山系所有自然保护区中,卧龙国家级自然保护区有面积最大的绿尾虹雉适宜生境,是该物种的重要分布区(Wang et al., 2017)。本研究通过大面积和长周期的红外相机调查在实地验证了这一结论,发现保护区内的大部分高海拔山区都有绿尾虹雉分布,并且在多个地区都有相对多度较高的种群,表明保护区的确分布着极为丰富的绿尾虹雉种群资源,对这一珍稀濒危物种的保护至关重要。
在众多环境因子中,气候变量对绿尾虹雉的生境质量具有最重要的影响,保护区的绿尾虹雉偏好在最干季均温和年均温都比较低的生境,表明了该物种对高海拔的寒冷低温环境的进化适应(Cui et al., 2019)。模型表明,绿尾虹雉对灌丛和草甸生境有明显偏好,这与以往的野外观测结果一致(刘梦瑶等,2013),也与其他地区的模型预测结果相似(余翔等,2017;钟雪等,2020),进一步反映了绿尾虹雉对高山、亚高山灌丛和草甸的依赖性。以往研究表明,水源是雉类生境选择的重要影响因素,很多物种都显著偏好选择靠近水源的生境(Brickle,2002;徐基良等,2002;李宏群等,2007)。但在本研究中,绿尾虹雉的生境质量在远离河流的地区更高,这可能是因为绿尾虹雉主要分布在高海拔区域,本就远离主要河流。因此,高山和亚高山区域的季节性溪流和高山"海子"可能对于绿尾虹雉的水源获取较为重要。此外,绿尾虹雉的生境质量还在远离公路的区域更高,这与此前的山系尺度研究结果一致,在一定程度上表明了绿尾虹雉对人为干扰的敏感性(Wang et al., 2017)。
总体来看,保护区内有面积较大、质量较高且连通性较好的绿尾虹雉生境,除北部白岩沟区域外的大部分生境斑块都相互连接。本研究的模型结果预测保护区北部的白岩沟区域具有面积较大但相对孤立的绿尾虹雉高质量生境,但是由于该区域受"5·12"汶川地震影响严重,可到达性差,本次红外相机调查未在该区域布设位点。因此,建议后续的研究工作通过实地调查对该区域的绿尾虹雉实际分布进行确认。保护区90%以上的绿尾虹雉生境都位于核心区,受到最严格的管理和保护。然而,以放牧牦牛为主要形式的人为干扰依然存在,一些有绿尾虹雉分布的高山草甸同时也是周边社区的牦牛牧场,自由放牧的牦牛在一定程度上会压缩绿尾虹雉的生境面积并且降低生境质量(Wang et al., 2017, 2021)。因此建议保护区进一步控制绿尾虹雉关键生境内的牦牛放牧面积和数量,以降低放牧带来的干扰和威胁。此外,由于公路的存在可能对于绿尾虹雉的生境质量有消极影响,翻越巴朗山的国道350长期以来都是绿尾虹雉生境中的干扰来源,降低了该区域绿尾虹雉的生境质量。2016年巴朗山隧道建成通车后,大部分车辆改由隧道穿越巴朗山,但隧道入口(海拔3 850 m)仍位于绿尾虹雉的生境之中,因此,在保护区未来的绿尾虹雉保护工作中,还需要关注公路带来的潜在消极影响,可在适当路段设计生态廊道供绿尾虹雉移动和扩散,以降低生境破碎化带来的种群隔离效应(Wang et al., 2017)。
陈立军, 肖文宏, 肖治术. 2019. 物种相对多度指数在红外相机数据分析中的应用及局限[J]. 生物多样性, 27(3): 243-248. |
何芬奇, 卢汰春, 芦春雷, 等. 1986. 绿尾虹雉的繁殖生态研究[J]. 生态学报, 6(2): 100-106. |
孔维尧, 李欣海, 邹红菲. 2019. 最大熵模型在物种分布预测中的优化[J]. 应用生态学报, 30(6): 2116-2128. |
李国庆, 刘长成, 刘玉国, 等. 2013. 物种分布模型理论研究进展[J]. 生态学报, 33(16): 4827-4835. |
李宏群, 廉振民, 陈存根, 等. 2007. 陕西黄龙山林区褐马鸡春季觅食地选择[J]. 动物学杂志, 42(3): 61-67. DOI:10.3969/j.issn.0250-3263.2007.03.010 |
刘梦瑶, 高依敏, 陈建宁, 等. 2013. 绿尾虹雉保护生物学研究现状[J]. 江西林业科技, 2: 36-39. |
唐书培, 穆丽光, 王晓玲, 等. 2019. 基于MaxEnt模型的赛罕乌拉国家级自然保护区斑羚生境适宜性评价[J]. 北京林业大学学报, 41(1): 106-112. |
徐基良, 张晓辉, 张正旺, 等. 2002. 白冠长尾雉育雏期的栖息地选择[J]. 动物学研究, 23(6): 471-476. DOI:10.3321/j.issn:0254-5853.2002.06.005 |
余翔, 陈俊橙, 王彬, 等. 2017. 四川小寨子沟国家级自然保护区绿尾虹雉种群密度调查与栖息地评价[J]. 四川动物, 36(4): 361-367. |
郑光美. 2015. 中国雉类[M]. 北京: 高等教育出版社.
|
钟雪, 杨炜蓉, 朱云东, 等. 2020. 基于MaxEnt模型的四川片口自然保护区绿尾虹雉栖息地评价[J]. 三峡生态环境监测, 5(4): 49-55. |
朱耿平, 刘国卿, 卜文俊, 等. 2013. 生态位模型的基本原理及其在生物多样性保护中的应用[J]. 生物多样性, 21(1): 90-98. |
BirdLife International. 2016. Lophophorus lhuysii. The IUCN Red List of Threatened Species 2016: e. T22679192A92806697[EB/OL]. (2021-01-01)[2021-05-10]. http://dx.doi.org/10.2305/IUCN.UK.2016-3.RLTS.T22679192A92806697.en.
|
Brickle NW. 2002. Habitat use, predicted distribution and conservation of green peafowl (Pavo muticus) in Dak Lak Province, Vietnam[J]. Biological Conservation, 105(2): 189-197. DOI:10.1016/S0006-3207(01)00182-3 |
Ceballos G, Ehrlich PR, Dirzo R. 2017. Biological annihilation via the ongoing sixth mass extinction signaled by vertebrate population losses and declines[J]. Proceedings of the National Academy of Sciences, 114(30): 6089-6096. DOI:10.1073/pnas.1704949114 |
CITES. 2016. Convention on international trade in endangered species of wild fauna and flora (CITES) appendices Ⅰ, Ⅱ and Ⅲ[EB/OL]. [2021-05-10]. https://cites.org.
|
Cui K, Li W, James JG, et al. 2019. The first draft genome of Lophophorus: a step forward for Phasianidae genomic diversity and conservation[J]. Genomics, 111(6): 1209-1215. DOI:10.1016/j.ygeno.2018.07.016 |
Evangelista PH, Kumar S, Stohlgren TJ, et al. 2008. Modelling invasion for a habitat generalist and a specialist plant species[J]. Diversity and Distributions, 14(5): 808-817. |
Fahrig L. 2003. Effects of habitat fragmentation on biodiversity[J]. Annual Review of Ecology Evolution & Systematics, 34: 487-515. |
Hijmans RJ, Cameron SE, Parra JL, et al. 2005. Very high resolution interpolated climate surfaces for global land areas[J]. International Journal of Climatology, 25(15): 1965-1978. |
O'Brien TG, Kinnaird MF, Wibisono HT. 2003. Crouching tigers, hidden prey: Sumatran tiger and prey populations in a tropical forest landscape[J]. Animal Conservation, 6: 131-139. |
Phillips SJ, Dudík M, Schapire RE. 2019. MaxEnt software for modeling species niches and distributions (Version 3.4.1)[EB/OL]. [2021-5-10]. https://biodiversityinformatics.amnh.org/open_source/maxent/.
|
Swets JA. 1988. Measuring the accuracy of diagnostic systems[J]. Science, 240(4857): 1285-1293. |
Wang B, Xu Y, Price M, et al. 2021. Niche partitioning among three montane ground-dwelling pheasant species along multiple ecological dimensions[J]. IBIS, 163(1): 171-182. |
Wang B, Xu Y, Ran J. 2017. Predicting suitable habitat of the Chinese monal (Lophophorus lhuysii) using ecological niche modeling in the Qionglai Mountains, China[J/OL]. PeerJ, 5(7): e3477[2021-03-10]. https://doi.org/10.7717/peerj.3477. eCollection 2017.
|
Xu Y, Wang B, Zhong X, et al. 2020. Predicting range shifts of the Chinese monal (Lophophorus lhuysii) under climate change: implications for long-term conservation[J/OL]. Global Ecology and Conservation, 22: e01018[2021-03-10]. https://doi.org/10.1016/j.gecco.2020.e01018.
|
 2021, Vol. 40
2021, Vol. 40




